Иммунологические эффекты применения ортодонтических микроимплантатов с модифицированной поверхностью в эксперименте на животных
Автор: Суетенков Дмитрий Евгеньевич, Терентюк Г.С., Карагайчев А.Л., Лясникова А.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: История медицины, юбилейные даты
Статья в выпуске: 1 т.7, 2011 года.
Бесплатный доступ
Оценены общие эффекты и динамика циркулирующих иммунных комплексов при использовании ортодонти-ческих микроимплантатов с наноструктурными покрытиями, содержащими серебро. Показана диагностическая значимость циркулирующих иммунных комплексов при воспалительных осложнениях. Обоснована безвредность применения подобных конструкций на животных
Ортодонтические микроимплантаты, перемещение зубов, серебро
Короткий адрес: https://sciup.org/14917260
IDR: 14917260
Текст научной статьи Иммунологические эффекты применения ортодонтических микроимплантатов с модифицированной поверхностью в эксперименте на животных
-
1Вв едение. Ортодонтические микроимплантаты (ОМИ) используются в клинической стоматологии для обеспечения стабильности точек приложения ортодонтических нагрузок к зубам и зубным рядам [1-3]. Применяемые при этом силы колеблются в широких пределах, обеспечивая перенесение нагрузки на скелетные структуры без задействования периодонтальной связки и клеточных механизмов тканевой перестройки [4-6]. Отрицательным моментом применения подобного подхода является наличие раны слизистой оболочки полости рта в области введения, а также травмирующее воздействие на минимальные по объему костные структуры альвеолярных и небных отростков челюстей [7-9]. Таким образом, достаточно ажурные костные структуры и слизистая оболочка полости рта находятся в состоянии хронического раздражения и необходимости реагировать на наличие микроимплантатов (раневой процесс, остеоинтеграция, погружной рост), что может отрицательно сказываться на организме пациента, динамике и выраженности ортодонтических эффектов [10, 11].
В своих работах одним из вариантов решения подобных проблем мы выбрали нанесение на поверхности микроимплантатов композитных покрытий, содержащих золото, серебро, хитозан и гидроксиапатит, которые позволяют модифицировать ответ макроорганизма на введение хирургических конструкций, а также оказывают антибактериальный и противовоспалительный эффекты [12-15]. Использование золота в покрытиях стоматологических имплантатов минимально изучено [16], а в отношении модификации поверхности ОМИ проводится впервые [17].
Реакция иммунной системы при применении ОМИ с модифицированной поверхностью нами выбрана как маркер важнейших механизмов обеспечивающих как поддержание гомеостаза, так и механизм блокады инфекционного процесса в тканях челюстей. Объектом изучения были выбраны крупные лабораторные животные (собаки), что определялось наличием достаточного объема костных тканей, возможностью соблюдения хирургического протокола установки ОМИ и рекомендациями ведущих разработчиков подобных конструкций [18-22].
Методы. В исследовании использовались титановые ОМИ производства «Плазма Поволжья» с покрытиями гидроксиапатитом, серебро-хитозан-пови-аргол содержащими композициями.
Нанесение ГАП-покрытий производилось плазменным напылением. Нанокомпозитные покрытия на основе низкомолекулярного водорастворимого хитозана и декстран-сульфата содержащие наночастицы серебра были получены методом полиионной самосборки. Толщину получившихся покрытий определяли при помощи атомно-силовой микроскопии, при этом она составляла от 10 до 40 нм. Полиэтилени-мин, хитозан, декстран-сульфат и серебросодержащий антисептик повиаргол были разведены в водном растворе 2 мг/мл. Хитозан и раствор металлических наночастиц наносились послойно. Подслоем использовался PEI для заряда поверхности стекла.
Адрес: г. Саратов, ул. Б.Казачья, 112.
Тел.: 8(8452)669734.
Отбор экспериментальных животных для проведения операций по введению имплантатов: 1 группа – контроль, 2 группа - опытная (имплантаты с модифицированной поверхностью), 3 группа - сравнение (титановые имплантаты).
Протокол введения имплантатов предусматривал общую анестезию с использованием 2 % ксилозина и золетила, формирование пилотного канала. Каждой собаке вводилось по 2 однотипных имплантата. Прочность фиксации определялась с помощью периотестометрии. Нагрузку микроимплантатов проводили никелидтитановыми пружинами с силой воздействия 100 мг. На каждую собаку оформлялся протокол наблюдения, в которых отражены все изменения в динамике наблюдения. Животные наблюдались в течение 21 дня.
В постоперационный период проводили ежедневный клинический осмотр, измерение температуры тела, орошение слизистой полости рта бидистили-рованной водой, фотографирование. В динамике исследования на 1, 3, 7, 14, 21 сутки наблюдения после операции определяли динамику изменения массы тела, проводили общий анализ крови, определение биохимических показателей сыворотки крови, уровней щелочной фосфатазы, лактатдегидрогеназы, общего белка, бикарбоната, кальция. Из иммунологических показателей собак: исследование антите-лообразования по содержанию в сыворотке крови циркулирующих иммунных комплексов (ЦИК); определение концентрации лизоцима в сыворотке крови.
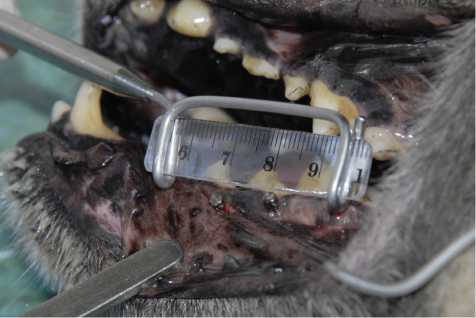
Фото 1 – имплантаты у собаки №428 в день операции (вид сверху)
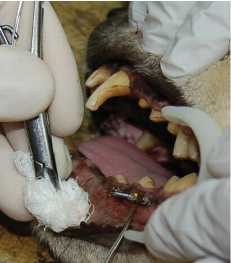
Фото 2 – нагрузка имплантатов у собаки №576 в день операции
Результаты. Функциональная полноценность конструкций на протяжении периода наблюдения по данным периотестометрии не страдала.
Анализируя данные протоколов наблюдения, следует отметить, что введение имплантатов во всех группах не сопровождалось выраженной реакцией слизистой в области их фиксации. Слизистая губы на месте соприкосновения с выступающей частью имплантатов была гиперемированной от 3 до 7 суток. Температура тела, общее состояние и поведение животного в норме. В группе №3 на 7 сутки слизистая оболочка вокруг 1 имплантата воспалена и кровоточит. На 14 сутки слизистая гиперемирована, на сли- зистой губы в точке соприкосновения с выступающей частью имплантата раневая поверхность. Такое же состояние сохраняется на 21 сутки, что может интерпретироваться как мукозит. После введения имплантатов в группе №2 с композицией «повиаргол + гидроксиапатит» изменения слизистой минимальны.
Масса тела (таблица № 1) и потребление пищи контрольными и опытными собаками особенностями не отличаются.
Анализируя данные общего анализа крови собак в динамике наблюдения (таблица 2), следует отметить увеличение количества сегментоядерных нейтрофилов и уменьшение лимфоцитов во 2 группе на
Таблица 1
Масса тела в динамике наблюдения
|
№ группы |
Масса тела в динамике наблюдения, кг |
||||
|
Исходная |
3 сутки |
7 сутки |
14 сутки |
21 сутки |
|
|
№ 1 |
13,7 |
13,5 |
13,5 |
12,2 |
13,2 |
|
№ 2 |
15,1 |
15,0 |
15,0 |
14,8 |
14,9 |
|
№ 3 |
17,0 |
17,0 |
18,5 |
18,3 |
17,5 |
Таблица 2
Общий анализ крови в динамике наблюдения
|
№ группы |
Показатели |
Значение показателей |
||||
|
Исходные показатели |
3 сутки |
7 сутки |
14 сутки |
21 сутки |
||
|
СОЭ, мм/ч |
5,0 |
6,0 |
5,0 |
3,0 |
3,0 |
|
|
Тромбоциты, тыс. в 1мм3 |
87,9 |
55,7 |
46,3 |
63,9 |
37,7 |
|
|
Нейтрофилы: юные, % |
0 |
0 |
0 |
0 |
0 |
|
|
палочкоядерные, % |
7 |
4 |
4 |
3 |
4 |
|
|
№ 1 |
сегментоядерные, % |
49 |
54 |
62 |
60 |
66 |
|
Лимфоциты, % |
41 |
36 |
22 |
23 |
20 |
|
|
Моноциты, % |
0 |
1 |
3 |
4 |
2 |
|
|
Эозинофилы, % |
3 |
3 |
8 |
7 |
8 |
|
|
Базофилы, % |
0 |
2 |
1 |
3 |
0 |
|
|
СОЭ, мм/ч |
2,0 |
2,0 |
3,0 |
3,0 |
2,0 |
|
|
Тромбоциты, тыс. в 1мм3 |
42,5 |
47,2 |
33,2 |
60,7 |
32,0 |
|
|
Нейтрофилы: юные, % |
0 |
2 |
2 |
0 |
0 |
|
|
палочкоядерные, % |
6 |
3 |
3 |
5 |
5 |
|
|
№3 |
сегментоядерные, % |
55 |
43 |
52 |
54 |
66 |
|
Лимфоциты, % |
31 |
42 |
31 |
28 |
23 |
|
|
Моноциты, % |
2 |
2 |
4 |
3 |
0 |
|
|
Эозинофилы, % |
5 |
6 |
5 |
4 |
6 |
|
|
Базофилы, % |
1 |
2 |
3 |
6 |
0 |
|
|
СОЭ, мм/ч |
2,0 |
4,0 |
7,0 |
5,0 |
2,0 |
|
|
Тромбоциты, тыс. в 1мм3 |
45,9 |
48,1 |
26,6 |
27,1 |
28,5 |
|
|
Нейтрофилы: юные, % |
0 |
1 |
0 |
0 |
0 |
|
|
палочкоядерные, % |
4 |
5 |
5 |
7 |
6 |
|
|
№ 2 |
сегментоядерные, % |
62 |
49 |
70 |
57 |
76 |
|
Лимфоциты, % |
22 |
36 |
15 |
28 |
11 |
|
|
Моноциты, % |
3 |
1 |
1 |
3 |
1 |
|
|
Эозинофилы, % |
8 |
6 |
6 |
2 |
6 |
|
|
Базофилы, % |
1 |
2 |
3 |
3 |
0 |
|
21 сутки наблюдения. В остальном различий между контрольными и опытными группами не наблюдается. Данные по оценке иммунологических показателей у обследуемых собак представлены в таблице 3
Данные таблицы свидетельствуют об отсутствии значимых отклонений уровня циркулирующих иммунных комплексов в сыворотке крови прооперированных собак по сравнению с интактными животными. Отмечается тенденция к уменьшению количества циркулирующих иммунных комплексов в сыворотке крови собак всех экспериментальных групп в динамике наблюдения. Статистически недостаточное количество животных в экспериментальных группах позволяет отметить только индивидуальные особенности в концентрации лизоцима в сыворотке крови обследуемых собак. Таким образом, значимого влияния введенных имплантатов на анализируемые иммунологические показатели в ходе настоящего эксперимента не установлено.
Данные анализа клинико-биохимических показателей у собак в динамике наблюдения представлены в таблице 4.
Обсуждение. Анализ данных таблицы свидетельствует об отсутствии достоверных различий клиникобиохимических показателей между контрольными и опытными животными в динамике наблюдения, а также об отсутствии достоверных изменений по отношению к исходным данным.
Анализируя данные протоколов наблюдения следует отметить, что введение собакам имплантатов с
Анализ иммунологических показателей различных групп в динамике наблюдения
Таблица 3
|
Экспериментальные группы |
Перечень показателей |
Исходные показатели |
Показатели в динамике наблюдения |
|||
|
3 сутки |
7 сутки |
14 сутки |
21 сутки |
|||
|
группа № 1 |
ЦИК, в 100 мл |
101,5 |
63,5 |
42 |
42 |
15 |
|
лизоцим, мг/кг |
4,8 |
3,6 |
1,9 |
2,6 |
1,0 |
|
|
группа №2 |
ЦИК, в 100 мл |
106 |
53 |
73 |
23 |
14 |
|
лизоцим, мг/кг |
2,4 |
1,6 |
1,3 |
2,1 |
1,1 |
|
|
группа № 3 |
ЦИК, в 100 мл |
43 |
30 |
13 |
22 |
16 |
|
лизоцим, мг/кг |
2,1 |
2,5 |
1,7 |
2,2 |
1,2 |
|
Таблица 4
Анализ клинико-биохимических показателей сыворотки крови в динамике наблюдения
При изучении гуморального звена иммунной системы биообъектов значимых отклонений уровня циркулирующих иммунных комплексов в сыворотке крови экспериментальных животных не выявлено, что свидетельствует об отсутствии нарушения антителообра-зования при введении собакам имплантатов.
Заключение. Резюмируя вышеизложенное, следует отметить, что введение собакам имплантатов не сопровождалось развитием у них выраженной общей реакции организма. Исключением является только активация механизмов неспецифической резистентности организма собак, которым вводились имплантаты без покрытия. На 3 и 7 сутки у них наблюдалось достоверное увеличение количества лизоцима. Именно на эти сроки у животных отмечались наиболее выраженные местные реакции слизистой и окружающих тканей на введение. Относительно имплантатов с модификацией поверхности уместно подчеркнуть, что их введение не вызывает у животных ни местных, ни общих реакций.
Список литературы Иммунологические эффекты применения ортодонтических микроимплантатов с модифицированной поверхностью в эксперименте на животных
- Оборотистое Н.Ю., Персии Л.С, Польма Л.В., Мураев А.А. Применение ортодонтических имплантатов при лечении зубочелюстных аномалий.//Ортодонтия. 2007. №3(39). С.71
- Польма Л.В., Персии Л.С, Ломакин М.В., Мураев А.А. Использование имплантатов при ортодонтическом лечении. Ортодент-инфо. №3, 2002
- Ludwig В., Glasl В., Litz Т., Lisson J.A. Мини-импланта-ты -в центре особого внимания. Части 1-6. Dental Tribune: Russian Ed. 2009. № 3-8(8). С 21-23. 4. Сунг Д.Х., Къюнг Х.М., Бай СМ., Парк О.В., Макнамара Д.А. Микроимплантаты в ортодонтии. Норта, СПб. 2006.174 с
- Reynders R., Ronchi L, Bipat S. Mini-implants in orthodontics: a systematic review of the literature. Am J Orthod Dentofacial Orthop. 2009. №135 (5). P.5641-5645.
- Wehrbein H., Merz B.R., Hammerle C.H., Lang N.P. Bone-to-implant contact of orthodontic implants in humans subjected to horizontal loading. Clin Oral Implants Res. 1998. №9(5). P.348-53
- Chen Y, Kyung H.-M., Zhao W.T., Yu W.J. Critical factors for the success of orthodontic mini-implants: a systematic review. Am J Orthod Dentofacial Orthop. 2009. №135(3). P.284-291
- Deguchi Т., Yabuuchi Т., Hasegawa M., Garetto L.P, Roberts W.E., Takano-Yamamoto T. Histomorphometric Evaluation of Cortical Bone Thickness Surrounding Miniscrew for Orthodontic Anchorage. Clinical Implant Dentistry and Related Research, Published Online: 12 May 2009
- Park H.S., Jeong S.H. et al. Factors affecting the clinical success of screw implants used as orthodontic anchorage. Am J Orthod Dentofacial Orthop. 2006. №130(1). P.18-25
- Serra G., Morais L.S., Elias ON., Meyers M.A., Andrade L, Muller O, Muller M. Sequential bone healing of immediately loaded mini-implants. Am J Orthod Dentofacial Orthop. 2008. №134(1). P.44-52
- Воложин A.M., Денисов-Никольский Ю.И., Докторов A.A., Мальгинов H.H., Лосев Ф.Ф., Татаренко-Козьмина Т.Ю., Жилкин Б.А. Тетюхин Д.В., Вольперт У.В., Янушевич О.О., Фролова Е.Н., Воложин ГА. Характеристика пролифератив-ных свойств стволовых клеток костного мозга на поверхности титана и золота. Материалы IX научного форума «Стоматология 2007», посвященного 45-летию ЦНИИС. М., 2007. С.226-229
- Абдулин И.Ш., Миронов М.М., Желтухин B.C. Бактерицидные и биологически стойкие покрытия для имплантатов//Новое в стоматологии. 1995. № 2. С.24-25
- Тумшевиц О.Н., Белоусова Ю.Б., Тумшевиц В.О. Исследование влияния хитозансодержащих композиций на ткани пародонта крыс с моделью сахарного диабета. Стоматология детского возраста и профилактика. 2007. №4. С.39-41.
- Bowman М.-О, Ballard Т.Е., Eckerson C.J., Feldheim D.L., Margolis D.M., Melander С. Inhibition of HIV Fusion with Multivalent Gold Nanoparticles. J Am Chem Soc. 2008, №130(22). P.6896-6897
- Воложин A.M., Денисов-Никольский Ю.И., Лосев Ф.Ф., Докторов A.A., Татаренко-Козьмина Т.Ю. Матвеева В.Н., Мальгинов Н.Н., Холодов СВ. Оптимизация костной регенерации с помощью стволовых клеток -предшественников остеобластов, фиксированных на композитных материалах (в эксперименте)//Кафедра. 2006. Т.5, №1. С.37-42.
- Juodzbalis G., Sapragoniene М., Wennerberg А., Baltrukonis Т. Titanum Dental Implant Surfase Micromorphology Optimization. Journal of Oral Implantology. 2007. -№4(33). P.177-185
- Abrahamsson I., Albouy J.P, Berglundh T. Healing at fluoride-modified implants placed in wide marginal defects: an experimental study in dogs. Clin Oral Implants Res. 2008. №19(2). P.153-159
- Berglundh T, Lindhe J., Marinello O, Ericsson I., Liljenberg B. Soft tissues reaction to de novo plaque formation on implants and teeth. An experimental study in the dog. Clin Oral Implants Res. 1992, №3. P.1-8
- Cornells, M.A., Scheffler N. R.etal. Systematic review of the experimental use of temporary skeletal anchorage devices in orthodontics. Am J Orthod Dentofacial Orthop. 2007. №131(4). P.52-58
- Deporter D.A., Watson PA., Pilliar R.M., Chipmani M.L., Valiquette N. A Histological Comparison in the Dog of Porous-coated vs. Threaded Dental Implants. J Dent Res. 1990. № 5(69). P.1138-1145
- Gotfredsen K., Berglundh T. et al. Anchorage of titanium implants with different surface characteristics: an experimental study in rabbits. Clin Implant Dent Relat Res. 2000. №2(3). P.120-128
- Maino B.G., Maino G. et al. Spider Screw: skeletal anchorage system. Prog Orthod. 2005. №6(1). P.70-81.


