Иммунолокализация цитокининов в клетках корней, формирующихся в каллусах пшеницы зародышевого происхождения
Автор: Зайцев Денис Юрьевич, Сельдимирова Оксана Александровна, Галин Ильшат Рафкатович, Круглова Наталья Николаевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
С помощью иммуногистохимического анализа выявлена локализация цитокининов в клетках разных зон корней, полученных в каллусах пшеницы зародышевого происхождения. Сопоставлены данные по распределению цитокининов в корнях in vivo и in vitro. Обсуждается влияние цитокининов на формирование и развитие корня.
Цитокинины, иммунолокализация, каллус, корни
Короткий адрес: https://sciup.org/148202054
IDR: 148202054 | УДК: 577.175.1:581.143.6
Текст научной статьи Иммунолокализация цитокининов в клетках корней, формирующихся в каллусах пшеницы зародышевого происхождения
Хорошо известно, что основными координаторами процессов органогенеза растений (в том числе и ризогенеза – формирования корня) как in vivo , так и in vitro являются фитогормоны – ауксины и цитокинины [1-4].
Результаты экспериментов Ф.Скуга и К.Миллера [5], а также других исследователей [610] свидетельствуют о том, что ауксины – ключевой фактор, обеспечивающий развитие корня. Цитокинины же рассматриваются как антагонисты ауксинов и отрицательные регуляторы роста корня [3, 11-13].
В то же время в литературе имеются данные, свидетельствующие о том, что для нормального роста корней наряду с ауксинами необходимы и цитокинины [14-17].
К настоящему времени получены данные о роли гормональных сигналов в регуляции экспрессии генов, от которых зависит как деление, так и дифференциация клеток корня [18-20]. Сформировалось представление о том, что характер деления и дифференциации клеток, определяющий формирование корней, зависит от концентрации фитогормонов в этих клетках [21-23]. Поэтому важно выявить распределение этих гормонов и их накопление в отдельных клетках развивающихся органов.
В литературе имеется достаточное количество работ по оценке содержания ауксинов в клетках разных зон корней in vivo (по [14]) и только единичные работы по анализу распределения цитокининов [14, 24]. Данные о содержании цитокининов в корнях, формирующихся в каллусах in vitro полностью отсутствуют
Цель работы состояла в иммунолокализации цитокининов в клетках разных зон корней, формирующихся в каллусах пшеницы зародышевого происхождения.
Объектом исследования послужил сорт яровой мягкой пшеницы Башкирская 26. Морфогенные каллусы из незрелых зародышей (15-17 сут после искусственного опыления, стадия органогенеза по периодизации [25]) получали и культивировали согласно [26]. Каллусы с формирующимися корнями фиксировали в растворе 4%-ного парафармальде-гида (Riedel-deHaen, Germany) и 0.1%-ного глутаральдегида (Panreac, Spain) под вакуумом, отмывали от фиксатора в фосфатном буфере (рН 7.3), обезвоживали в серии спиртов возрастающей концентрации и заключали в гидрофильную метакри-латную смолу JB-4 (Electron Microscopy Sciences, USA). Срезы каллусов получали с помощью ротационного микротома HM-325 (Microm, Germany). Иммунолокализацию цитокининов проводили согласно [27]. Препараты просматривали на микроскопе проходящего света Axio Imager A1 (Carl Zeiss, Germany) и фотографировали с помощью цифровой камеры Axio Cam MRc 5(Carl Zeiss, Germany).
При иммуногистохимическом анализе срезов апексов корней было выявлено интенсивное окрашивание клеток, что свидетельствовало о высоком содержании в них цитокининов (рис. 1 а ). Такие же результаты получены при анализе содержания и распределения цитокининов в клетках корней проростков пшеницы [14] и кукурузы [24] in vivo . Полученные данные вполне ожидаемы, поскольку хорошо известно, что апексы корней являются местом синтеза цитокининов [3, 4].
Иммунное окрашивание срезов нескольких слоев клеток корня в зоне деления, располагающихся сразу после апекса корня, также выявило высокое содержание цитокининов во всех клетках , кроме клеток цетральной метаксилемы (рис. 1б). Несмотря на то, что клетки центральной метаксилемы были отчетливо видны, заметного разделения клеток корня на зоны центрального цилиндра и коры не наблюдалось. Такое разделение наблюдалось при дальнейшем удалении от апекса корня (рис. 1в). В зоне деления не обнаруживались клетки формирующейся флоэмы, в отличие от данных, отраженных в работе [14], показывающих, что в зоне деления корней пшеницы in vivo происходило не только формирование, но и начиналось созревание ситовидных трубок, индикатором чего авторы считают исчезновение иммунного окрашивания.
Формирующиеся ситовидные трубки (клетки которых интенсивно окрашивались) обнаружива-
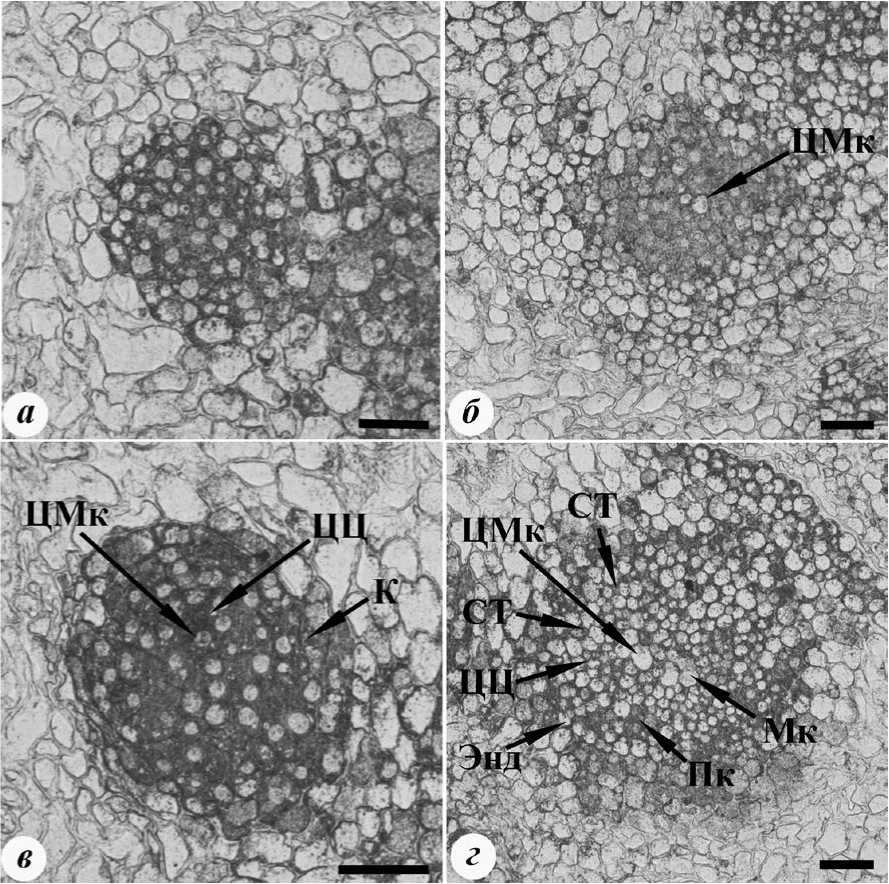
Рис. 1. Иммуногистохимическая локализация цитокининов на поперечных срезах разных зон корней. а - апекс корня, б,в - разные участки зоны деления, г -зона роста. Световая микроскопия, постоянные препараты. Масштаб - 50 мкм. Условные обозначения : К - кора корня, Мк - метаксилема, Пк - протоксилема, СТ - ситовидные трубки. ЦМк - центральная метаксилема, ЦЦ - центральный цилиндр, Энд - эндодерма
На срезах корня в зоне всасывания наблюдалось дальнейшее ослабевание иммунного окрашивания (рис. 2).
Именно в этой зоне обнаруживались созревающие ситовидные трубки и сосуды ксилемы. Клетки центрального цилиндра и корневых волосков окрашивались интенсивнее, чем клетки коры корня. Таким образом, полученные данные показали, что содержание цитокининов в клетках корней максимально в апексе корня и постепенно снижается при лись только в зоне роста корня (рис. 1 г). Иммунное окрашивание клеток центрального цилиндра и коры корня в этой зоне было слабее по сравнению с клетками зоны деления корня. Однако в сравнении с результатами, отраженными в работе [14], окрашивание клеток зоны роста корней, полученных в каллусах in vitro, было более интенсивным, чем окрашивание клеток аналогичной зоны корней пшеницы in vivo.
удалении от него. Такая же тенденция наблюдалась при изучении распределения цитокининов в корнях in vivo методами твердофазного иммунофермент-ного анализа и иммуногистохимии у кукурузы [24, 28] и пшеницы [14]. В работе Л.Б.Высоцкой с со-авт. [14] этот факт объясняется высокой активностью в корнях цитокининоксидазы, катализирующий распад цитокининов при передвижении их от апекса корня к его базальной части. В работах [14, 24] показано, что в зоне всасывания происходило небольшое повышение содержания цитокининов, что определялось как с помощью твердофазного иммуноферментного анализа, так и при иммуноги- стохимическом окрашивании. В наших же экспериментах снижение содержания цитокининов в корнях происходило постепенно.
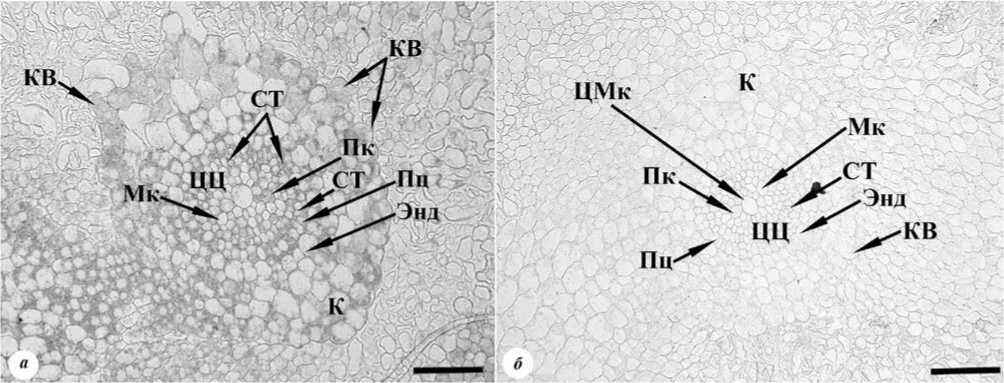
Рис. 2. Иммуногистохимическая локализация цитокининов на поперечном срезе зоны всасывания корня. а – срез, обработанный иммунной сывороткой, б – контрольный срез, обработанный неиммунной сывороткой. Световая микроскопия, постоянный препарат. Масштаб – 100 мкм. Условные обозначения : К – кора корня, КВ – корневой волосок, Мк – метаксилема, Пк – протоксилема, Пц – перицикл, СТ – ситовидные трубки. ЦМк – центральная метаксилема, ЦЦ – центральный цилиндр, Энд – эндодерма
Следует отметить, что, несмотря на значительное сходство распределения цитокининов в корнях in vivo и in vitro , имеются и некоторые различия. Так, дифференциация коры и центрального цилиндра в корнях, формирующихся в каллусах in vitro происходило позднее, чем in vivo . Возможно, это можно объяснить дополнительным воздействием экзогенного цитокинина, входящего в состав питательной среды.
В работе [29] приведены данные о накоплении экзогенных цитокининов в клетках паренхимы центральных цилиндров корней пшеницы и рассматривается возможный механизм транспорта экзогенных цитокининов в корни из окружающей среды. Также показано, что для тканей с высокой меристематической активностью характерно высокое содержание цитокининов [24]. Вполне вероятно, что избыточное содержание цитокининов (полученное в результате суммирования эндогенных и экзогенных цитокининов) поддерживает меристематический статус клеток корня и приводит к задержке их дифференциации.
В то же время формирование и созревание в корнях in vitro элементов ксилемы происходило раньше, а элементов флоэмы – позднее (в пространственном отношении ближе и дальше от апекса корня), чем в корнях in vivo .
Интенсивное иммунное окрашивание клеток корня в зоне деления свидетельствует о высоком содержании цитокининов в этих клетках, что согласуется с данными экспериментов [14, 24]. В работе [30] приводятся данные о преимущественной локализации цитокининов в клетках каллусов пшеницы, являющихся инициальными при реализации различных путей морфогенеза in vitro, в том числе и ризогенеза (формирования корня). Все эти данные подтверждают участие цитокининов в формировании и развитии корня.
В целом, совокупность полученных нами экспериментальных и литературных данных свидетельствуют о сходстве гормональных механизмов, регулирующих процессы органогенеза in vivo и in vitro , тем самым подтверждая концепцию об универсальности путей морфогенеза растений в различных системах размножения.
-
1. Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. М.: ФБК-ПРЕСС, 1999. 160 с.
-
2. Круглова Н.Н., Горбунова В.Ю., Куксо П.А. Морфогенез в культуре изолированных пыльников: роль фитогормонов // Успехи соврем. биологии. 1999. Т. 119. № 6. С. 567-577.
-
3. Медведев С.С., Шарова Е.И. Биология развития растений. Т. 1. Начала биологии развития растений. Фитогормоны. СПб., 2011. 253 с.
-
4. Plant hormones: biosynthesis, signal transduction, action / Ed. Davies P.J. Dordrecht, Heidelberg, London, New York: Springer, 2010. 802 p.
-
5. Skoog F., Miller C.O. Chemical regulation of growth and organ formation in plant tissues cultured in vitro // Sympos. Soc. Exp. Biol.: Proceed. 1957. V. 11. N 2. P. 118.
-
6. Brenner W.G., Schmulling T. Transcript profiling of cytokinin action in Arabidopsis roots and shoots discovers largely similar but also organ-specific responses // BMC Plant Biology. 2012. V. 12. N 1. P. 112-142.
-
7. Overvoorde P., Fukaki H., Beeckman T. Auxin control of root development // Cold Spring Harb. Perspect. Biol. 2010. V. 2. N 6. a001537.
-
8. Peret B., de Rybel B., Casimiro I. et al. Arabidopsis lateral root development: an emerging story // Trends Plant Sci. 2009. V. 14. N 7. P. 399-408.
-
9. Plant organogenesis: methods and protocols / Ed. De Smet I. New York, Heidelberg, Dordrecht, London: Humana Press, 2013. 356 p.
-
10. Yoshida S., Saiga S., Weijers D. Auxin regulation of embryonic root formation // Plant Cell Physiol. 2013. V. 54. N 3. P. 325-332.
-
11. Choi J., Hwang I. Cytokinin: perception, signal transduction, and role in plant growth and development // J. Plant Biol. 2007. V. 50. N 2. P. 98-108.
-
12. Laplaze L., Benkova E., Casimiro I. et al. Cytokinins act directly on lateral root founder cells to inhibit root initiation // The Plant Cell. 2007. V. 19. N 12. P. 3889-3900.
-
13. Li X., Mo X., Shou H., Wu P. Cytokinin-mediated cell cycling arrest of pericycle founder cells in lateral root initiation of Arabidopsis // Plant Cell Physiol. 2006. V. 47. N 8. P. 1112-1123.
-
14. Высоцкая Л.Б., Ахиярова Г.Р., Веселов С.Ю., Кудоярова Г.Р. Содержание цитокининов в клетках разных зон корней пшеницы // Цитология. 2011. Т. 53. № 11. С. 884890.
-
15. Gordon S.P., Chickarmane V.S., Ohno C., Meyerowitz E.M. Multiple feedback loops through cytokinin signaling control stem cell number within the Arabidopsis shoot meristem // PNAS. 2009. V. 106. N 38. P. 16529-16534.
-
16. Gupta S., Rashotte A.M. Down-stream components of cytokinin signaling and the role of cytokinin throughout the plant // Plant Cell Rep. 2012. V. 31. N 5. P. 801-812.
-
17. Zhao Y. The role of local biosynthesis of auxin and cytokinin in plant development // Curr. Opin. Plant Biol. 2008. V. 11. N 1. P. 16-22.
-
18. Dello Ioio R., Nakamura K., Moubayidin L. et al. Genetic framework for the control of cell division and differentiation in the root meristem // Science. 2008. V. 322. N 5906. P. 1380-1384.
-
19. Jenik P.D., Barton M.K. Surge and destroy: the role of auxin in plant embryogenesis // Development. 2005. V. 132. N 16. P. 3577-3585.
-
20. Muller B., Sheen J. Cytokinin and auxin interaction in root stem-cell specification during early embryogenesis // Nature. 2008. V. 453. N 7198. P. 1094-1097.
-
21. De Smet I., Tetsumura T., De Rybel B. et al. Auxindependent regulation of lateral root positioning in the basal meristem of Arabidopsis // Development. 2007. V. 134. N 4. P. 681-690.
-
22. Dubrovsky J.G., Napsucialy-Mendivil S., Duclercq J. et al. Auxin minimum defines a developmental window for lateral root initiation // New Phytologist. 2011.V. 191. N 4. P. 970983.
-
23. Kakani A., Li G., Peng Z. Role of AUX1 in the control of organ identity during in vitro organogenesis and in mediating tissue specific auxin and cytokinin interaction in Arabi-dopsis // Planta. 2009. V. 229. N 3. P. 645-657.
-
24. Полевой В.В., Полевой А.В. Эндогенные фитогормоны этиолированных проростков кукурузы // Физиология растений. 1999. Т. 39. № 6. С. 1165-1177.
-
25. Круглова Н.Н. Периодизация развития зародыша пшеницы для биотехнологических исследований // Аграрная Россия. 2008 № 3. С. 20-22.
-
26. Суханов В.М., Папазян Н.Д. Условия получения каллюса и регенерантов в культуре незрелых зародышей пшеницы // Апомиксис и цитоэмбриология растений. № 5. Саратов, 1983. С. 124-128.
-
27. Веселов С.Ю., Вальке Р.С., Ван Онкелен Х., Кудоярова Г.Р. Содержание и локализация цитокининов в листьях исходных и трансгенных растений табака // Физиология растений. 1999. Т. 46. № 1. С. 34-40.
-
28. Brovko F.A., Vasil'eva V.S., Nosov A.V. et al. Cytokininbinding protein (70 kDa): localization in tissues and cells of etiolated maize seedlings and its putative function // J. Exp. Bot. 2007. V. 58. N 10. P. 2479-2490.
-
29. Ахиярова Г.Р., Архипова Т.Н. Накопление экзогенного зеатина в клетках корней растений пшеницы и его значение в регуляции транспорта цитокининов // Цитология. 2010. Т. 52. № 12. С. 1024-1030.
-
30. Зайцев Д.Ю., Сельдимирова О.А., Круглова Н.Н. Морфогенез в культуре андроклинных каллусов пшеницы in vitro : начальный этап // Известия Уфимского научного центра РАН. 2011. № 2. С. 32-35.
IMMUNOLOCALIZATION OF CYTOKININS IN CELLS OF ROOTS, FORMING IN CALLI OF THE IMMATURE EMBRYO ORIGIN
Institute of Biology, Ufa Sci. Centre of RAS, Ufa
The localization of cytokinins in different zones of roots, obtained in calli of the immature embryo origin are revealed by the immunohistochemical analysis. Data on distribution of cytokinins in roots in vivo and in vitro are compared. Influence of cytokinins on root formation and development is discussed.
Список литературы Иммунолокализация цитокининов в клетках корней, формирующихся в каллусах пшеницы зародышевого происхождения
- Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. М.: ФБК-ПРЕСС, 1999. 160 с.
- Круглова Н.Н., Горбунова В.Ю., Куксо П.А. Морфогенез в культуре изолированных пыльников: роль фитогормонов//Успехи соврем. биологии. 1999. Т. 119. № 6. С. 567-577.
- Медведев С.С., Шарова Е.И. Биология развития растений. Т. 1. Начала биологии развития растений. Фитогормоны. СПб., 2011. 253 с.
- Plant hormones: biosynthesis, signal transduction, action/Ed. Davies P.J. Dordrecht, Heidelberg, London, New York: Springer, 2010. 802 p.
- Skoog F., Miller C.O. Chemical regulation of growth and organ formation in plant tissues cultured in vitro//Sympos. Soc. Exp. Biol.: Proceed. 1957. V. 11. N 2. P. 118.
- Brenner W.G., Schmulling T. Transcript profiling of cytokinin action in Arabidopsis roots and shoots discovers largely similar but also organ-specific responses//BMC Plant Biology. 2012. V. 12. N 1. P. 112-142.
- Overvoorde P., Fukaki H., Beeckman T. Auxin control of root development//Cold Spring Harb. Perspect. Biol. 2010. V. 2. N 6. a001537.
- Peret B., de Rybel B., Casimiro I. et al. Arabidopsis lateral root development: an emerging story//Trends Plant Sci. 2009. V. 14. N 7. P. 399-408.
- Plant organogenesis: methods and protocols/Ed. De Smet I. New York, Heidelberg, Dordrecht, London: Humana Press, 2013. 356 p.
- Yoshida S., Saiga S., Weijers D. Auxin regulation of embryonic root formation//Plant Cell Physiol. 2013. V. 54. N 3. P. 325-332.
- Choi J., Hwang I. Cytokinin: perception, signal transduction, and role in plant growth and development//J. Plant Biol. 2007. V. 50. N 2. P. 98-108.
- Laplaze L., Benkova E., Casimiro I. et al. Cytokinins act directly on lateral root founder cells to inhibit root initiation//The Plant Cell. 2007. V. 19. N 12. P. 3889-3900.
- Li X., Mo X., Shou H., Wu P. Cytokinin-mediated cell cycling arrest of pericycle founder cells in lateral root initiation of Arabidopsis//Plant Cell Physiol. 2006. V. 47. N 8. P. 1112-1123.
- Высоцкая Л.Б., Ахиярова Г.Р., Веселов С.Ю., Кудоярова Г.Р. Содержание цитокининов в клетках разных зон корней пшеницы//Цитология. 2011. Т. 53. № 11. С. 884-890.
- Gordon S.P., Chickarmane V.S., Ohno C., Meyerowitz E.M. Multiple feedback loops through cytokinin signaling control stem cell number within the Arabidopsis shoot meristem//PNAS. 2009. V. 106. N 38. P. 16529-16534.
- Gupta S., Rashotte A.M. Down-stream components of cytokinin signaling and the role of cytokinin throughout the plant//Plant Cell Rep. 2012. V. 31. N 5. P. 801-812.
- Zhao Y. The role of local biosynthesis of auxin and cytokinin in plant development//Curr. Opin. Plant Biol. 2008. V. 11. N 1. P. 16-22.
- Dello Ioio R., Nakamura K., Moubayidin L. et al. Genetic framework for the control of cell division and differentiation in the root meristem//Science. 2008. V. 322. N 5906. P. 1380-1384.
- Jenik P.D., Barton M.K. Surge and destroy: the role of auxin in plant embryogenesis//Development. 2005. V. 132. N 16. P. 3577-3585.
- Muller B., Sheen J. Cytokinin and auxin interaction in root stem-cell specification during early embryogenesis//Nature. 2008. V. 453. N 7198. P. 1094-1097.
- De Smet I., Tetsumura T., De Rybel B. et al. Auxindependent regulation of lateral root positioning in the basal meristem of Arabidopsis//Development. 2007. V. 134. N 4. P. 681-690.
- Dubrovsky J.G., Napsucialy-Mendivil S., Duclercq J. et al. Auxin minimum defines a developmental window for lateral root initiation//New Phytologist. 2011.V. 191. N 4. P. 970-983.
- Kakani A., Li G., Peng Z. Role of AUX1 in the control of organ identity during in vitro organogenesis and in mediating tissue specific auxin and cytokinin interaction in Arabidopsis//Planta. 2009. V. 229. N 3. P. 645-657.
- Полевой В.В., Полевой А.В. Эндогенные фитогормоны этиолированных проростков кукурузы//Физиология растений. 1992. Т. 39. № 6. С. 1165-1177.
- Круглова Н.Н. Периодизация развития зародыша пшеницы для биотехнологических исследований//Аграрная Россия. 2008 № 3. С. 20-22.
- Суханов В.М., Папазян Н.Д. Условия получения каллюса и регенерантов в культуре незрелых зародышей пшеницы//Апомиксис и цитоэмбриология растений. № 5. Саратов, 1983. С. 124-128.
- Веселов С.Ю., Вальке Р.С., Ван Онкелен Х., Кудоярова Г.Р. Содержание и локализация цитокининов в листьях исходных и трансгенных растений табака//Физиология растений. 1999. Т. 46. № 1. С. 34-40.
- Brovko F.A., Vasil'eva V.S., Nosov A.V. et al. Cytokininbinding protein (70 kDa): localization in tissues and cells of etiolated maize seedlings and its putative function//J. Exp. Bot. 2007. V. 58. N 10. P. 2479-2490.
- Ахиярова Г.Р., Архипова Т.Н. Накопление экзогенного зеатина в клетках корней растений пшеницы и его значение в регуляции транспорта цитокининов//Цитология. 2010. Т. 52. № 12. С. 1024-1030.
- Зайцев Д.Ю., Сельдимирова О.А., Круглова Н.Н. Морфогенез в культуре андроклинных каллусов пшеницы in vitro: начальный этап//Известия Уфимского научного центра РАН. 2011. № 2. С. 32-35.


