Иммуноопосредованные нежелательные явления, связанные с лечением препаратами, блокирующими контрольные точки Т-лимфоцитов
Автор: Реутова Елена Валерьевна, Лактионов Константин Павлович, Бредер Валерий Владимирович, Саранцева Ксения Андреевна, Окружнова Мария Александровна, Перегудова Марина Валерьевна
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 4 (20), 2016 года.
Бесплатный доступ
В последние годы основной акцент в лекарственном лечении злокачественных опухолей делается на иммунотерапию. Это обусловлено разработкой и регистрацией нового класса препаратов - блокаторов контрольных точек иммунного пути. Основанием для регистрации этого класса препаратов послужили результаты рандомизированных клинических исследований, показавших преимущество этих препаратов по сравнению со стандартной терапией в общей выживаемости [1-3]. Более благоприятным оказался их токсический профиль. Однако те осложнения, с которыми пришлось столкнуться клиницистам, имели принципиально новый, отличный от обусловленных стандартными цитостатиками характер. Многообразие побочных иммуноопосредованных реакций компенсируется стандартным алгоритмом их коррекции [4]. Раннее выявление и своевременное лечение необходимо для успешного купирования этих осложнений.
Иммунотерапия, ингибиторы контрольных точек, иммуноопосредованные нежелательные явления
Короткий адрес: https://sciup.org/140222671
IDR: 140222671 | DOI: 10.18027/2224-5057-2016-4-68-76
Текст научной статьи Иммуноопосредованные нежелательные явления, связанные с лечением препаратами, блокирующими контрольные точки Т-лимфоцитов
Традиционные подходы к лекарственному лечению больных злокачественными солидными опухолями, в первую очередь химиотерапия, демонстрируют весьма скромные результаты. Таргетная терапия на современном этапе весьма эффективна у ограниченной популяции больных, имеющих молекулярно-генетические нарушения в опухоли. Иммунотерапия давно признана перспективным направлением в лечении злокачественных опухолей. Недавнее ее возрождение в значительной степени связано с многочисленными исследованиями последних лет, которые улучшили наше понимание иммунологии опухоли и позволили разработать новые иммунотерапевтические подходы, нацеленные на специфические регуляторные контрольные точки. В отличие от химио- и лучевой терапии иммунотерапевтические препараты стимулируют собственные иммунные механизмы организма, усиливая его способность бороться с опухолями. Во избежание гиперактивации иммунной системы и повреждения здоровых тканей регуляторные Т-лимфоциты экспрессируют на своей поверхности ко-ингибирующие молекулы (белки-контролеры), которые действуют как негативные регуляторы их активации. Эти механизмы важны для защиты организма от развития аутоиммунных заболеваний, однако, они также эффективно используются опухолью для ускользания от иммунного контроля [5, 6]. Джеймс Эллисон разработал метод блокады белков-контролеров, открывающий иммунной системе доступ к опухоли. Этот терапевтический подход заключается в ингибировании иммунных контрольных точек на поверхности Т-лимфоцитов, таких как антиген-4 цитотоксических Т-лимфоцитов (СТLA-4) или рецептор программируемой гибели клеток –1 (PD-1), экспрессируемых на поверхности активированных Т-клеток и обычно сни- жающих активность иммунного ответа [5]. Использование моноклональных антител, которые блокируют рецепторы CTLA-4 и PD-1, усиливает Т-клеточный противоопухолевый иммунный ответ и позволяет достичь хороших результатов в лечении злокачественных опухолей [1–3, 7]. Тем не менее внешнее воздействие на иммунные контрольные точки может привести к дисбалансу в иммунологической толерантности и вызвать бесконтрольный иммунный ответ. Это может проявляться развитием аутоиммуноподобных/воспалитель-ных побочных реакций, которые вызывают повреждение нормальных тканей и органов, в том числе: кожи, желудочно-кишечного тракта, печени, легких, эндокринной системы и др. Такие неблагоприятные реакции называются иммуно-опосредованные нежелательные явления (иоНЯ). В настоящее время разработаны алгоритмы стандартного лечения иоНЯ с использованием иммуносупрессивной терапии, которая подавляет воспалительную реакцию, не устраняя противоопухолевый иммунный ответ [8]. Иммунотерапевтические препараты уверенно входят в клиническую практику – увеличивается количество получающих их пациентов, в случае контроля за болезнью им предполагается длительное лечение, таким образом, знание побочных реакций и способов их коррекции чрезвычайно важны.
ЧАСТОТА И ВРЕМЯ РАЗВИТИЯ ИММУНООПОСРЕДОВАННЫХ НЕЖЕЛАТЕЛЬНЫХ ЯВЛЕНИЙ
Препараты, блокирующие контрольные точки иммунного ответа, потенциально могут вызывать иоНЯ с поражением любых органов и систем (рис. 1). Они возникают
Любой орган – потенциальная мишень
Тиреодит
Гипофизит
Колиты
Гепатиты
Кожа:
сыпь, витилиго, зуд
Гематологические ПЭ

Увеиты
Пневмониты
Нефриты
Миокардит Перикардит
Надпочечниковая недостаточность
Рис. 1. Основные проявления иоНЯ
Нейротоксичность С-м Гийена-Барре у 90% пациентов, получающих лечение анти-CTLA-4 препаратами, и у 70% пациентов, получающих PD-1/PD-L1 антитела (рис. 2) [9, 10, 11]. Необходимо отметить, что осложнения 3–4 степени возникают не часто. Ан-ти-CTLA-4 чаще ассоциируются с выраженными осложнениями 3–4 степени – у 5–22% пациентов. Наиболее часто при терапии анти-CTLA-4 поражается кожа (сыпь, зуд) и желудочно-кишечный тракт (диарея, колит) [9]. При терапии анти-PD-1/PD-L1 препаратами тяжелые иоНЯ развиваются реже – у 7–12% пациентов, и проявляются усталостью, сыпью, зудом, диарей, тошнотой, снижением аппетита и артралгией [1–3]. Более редко встречаются иоНЯ со стороны следующих органов и систем: кожа (витилиго, псориаз, синдром Лайелла), желудочно-кишечный тракт (гастриты, панкреатиты), железы внутренней секреции (гипо/гипертиреоидиты, гипофизиты, надпочечниковая недостаточность, диабет), легкие (пульмониты, плевральный выпот, саркоидоз), нервная система (периферическая нейропатия, асептический менингит, синдром Гийена-Барре, энцефалопатия, миелит, менинго-радикуло-неврит, миастения), печень (гепатиты), почки (грануломатозный интерстициальный нефрит, волчанкоподобный гломерулонефрит), кроветворные органы (гемолитическая анемия, тромбоцитопения, нейтропения, панцитопения), мышечно-суставная система (артриты, миопатии), сердце (перикардит, кардиомиопатия), глаза (увеит, конъюнктивиты, блефариты, ретиниты, хореоидиты, орбитальный миозит) [1–3, 7, 9].
Такое многообразие клинических проявлений усложняет задачу клинициста, зачастую приходится проводить дифференциальный диагноз между прогрессированием опухолевого процесса, обострением сопутствующих заболеваний или осложнениями лечения.
Иммуноопосредованные реакции могут развиться на любом этапе иммунотерапии и даже после ее окончания. Однако большинство иоНЯ развивается в первые 6 месяцев терапии: кожная токсичность может развиться рано (на 2–3 неделе терапии), несколько позже развивается гастроинтестинальная токсичность (на 5–10 неделе), гепатотоксичность (на 6–14 неделе), эндокринопатии (с 7-й недели) [1–3]. Описаны случаи отсроченного развития нежелательных явлений, после окончания лечения, иногда до 1 года [7].
ОСНОВЫ КОРРЕКЦИИ ИММУНООПОСРЕДОВАННЫХ НЯ
Патофизиология иммуноопосредованной токсичности изучена не до конца. Считается, что основную роль в развитии иоНЯ играет гиперактивация Т-лимфоцитов. Однако возможно вовлечение других иммунных клеток и механизмов: секреция антител В-лимфоцитами, активация гранулоцитов и экспрессия цитокинов [12]. Помимо иммунотерапии существуют другие причины, маскирующие нарушение иммунитета, такие как опухолевая инфильтрация, оппортунистические патогены, сопутствующая медикаментозная терапия, профессиональные токсические воздействия. Дифференцировать истинное прогрессирование опухолевого процесса от токсического воздействия иногда можно только с помощью морфологической верификации. Возможно обострение хронических инфекций на фоне иммунотерапии, например вирусного гепатита с повышением печеночных ферментов, а появление легочных инфильтратов может быть проявлением пневмоцистной пневмонии. Эти состояния ошибочно могут быть расценены как проявления токсичности. Некоторые лекарственные препараты (антиаритмические, гипотензивные, антипсихотические, антиконвульсанты) потенциально могут способствовать развитию аутоиммунных реакций, а назначение иммуноонкологических препаратов увеличивает эти риски [13].
Учитывая всю сложность диагностики, пациент должен быть предупрежден о необходимости сообщать лечащему врачу о возникновении любых новых симптомов. Больного следует информировать о возможности развития осложнений иммунотерапии на любом этапе лечения – в начале, в процессе и после его окончания. Только своевременная диагностика и раннее лечение могут предотвратить развития тяжелых иоНЯ. Следует еще раз напомнить, что большинство иммуноопосредованных побочных явлений 1–2 степени выраженности обратимы при условии их правильной коррекции [11, 13].
Перед началом иммунотерапии необходимо убедиться, что все побочные реакции, связанные с предшествующим
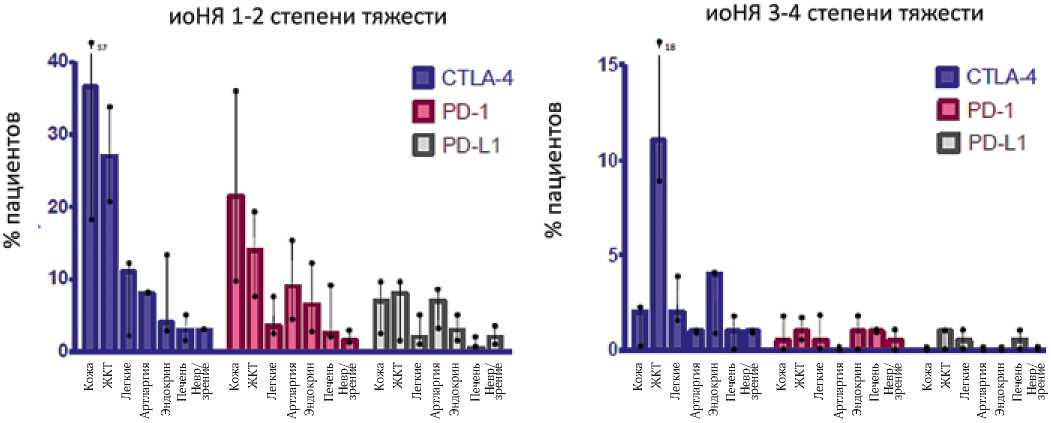
Рис. 2. Частота развития иоНЯ [4]
Если развилась иммуноопосредованная токсичность, необходимо установить тщательное наблюдение за больным, при необходимости в условиях стационара, и своевременно начать лечение – в зависимости от степени выраженности осложнений – это могут быть симптоматическая терапия, кортикостероиды и другие иммуносу-прессанты (таблица1) [11].
Многообразие проявлений иммуноопосредованной токсичности компенсируется единым алгоритмом лечения. Основой является кортикостероидная терапия. После купирования иоНЯ требуется постепенное снижение дозы кортикостероидов (в течение 1 месяца) из-за риска возврата осложнений. При отсутствии эффекта адекватной кортикостероидной терапии необходимо обсудить дополнительное назначение иммуносупрессантов – инфликсимаб, микофенолата мофетил, такролимус. Если диагноз иммуноопосредованных осложнений вызывает сложности, а также имеет место выраженная токсичность – показана консультация узкого специалиста, например пульмонолога, дерматолога, гастроэнтеролога, эндокринолога, хирурга [4, 8, 11].
Следует помнить, что нет четкой корреляции между дозой, длительностью лечения (интервалы между введениями) и эффективностью иммунотерапии. Например, бло- каторы CTLA-4 изучались в различных режимах – 10 мг/кг каждые 3 недели или каждые 3 месяца, а блокаторы PD-1 в исследованиях вводились в дозах от 1 до 10 мг/кг каждые 2 или 3 недели. Все режимы показали эквивалентную эффективность, у части больных, прекративших терапию из-за токсичности, сохранялся длительный эффект [3, 14, 15]. Таким образом, врач должен понимать, что предпочтительнее сделать отсрочку в введении препарата до купирования нежелательных реакций, без риска потерять дозовую интенсивность иммунотерапии.
Возобновление иммунотерапии возможно, если побочные эффекты полностью купированы или уменьшились до 1 степени, а доза кортикостероидов снижена до ≤10 мг/сут [4, 16]. Иммунотерапию необходимо полностью прекратить в случае тяжелых осложнений, а также при повторных осложнениях 2 степени, не купирующихся в течение 3 месяцев, несмотря на адекватную терапию. Для зарегистрированных на сегодняшний день трех препаратов, редукция дозы не предусмотрена [4, 7].
Как правило, гастроинтестинальная, печеночная и почечная токсичность купируются быстро, в то время как для разрешения эндокринопатии требуется длительное время. Гормональный дефицит может длительно сохраняться, и пациенты будут нуждаться в заместительной терапии. Имеющиеся данные не подтверждают негативного влияния иммуносупрессивной терапии, проводимой из-за токсичности, на эффективность лечения [15–17].
Длительная иммуносупрессивная терапия при рефрактерных иоНЯ увеличивает риск развития оппортунистических инфекций, включая аспергиллез легких, туберкулез, цитомегаловирусную инфекцию. Для профилактики предлагается использовать триметоприм/сульфаметоксазол, если суточная доза кортикостероидов равна или превышает 1 мг/кг. Также целесообразно провести тест на туберкулезную инфекцию [18].
Несомненно, что по мере накопления клинического опыта будут разработаны оптимальные режимы иммуносупрессивной терапии.
ОТДЕЛЬНЫЕ ВИДЫ ИММУНООПОСРЕДОВАННЫХ НЕЖЕЛАТЕЛЬНЫХ ЯВЛЕНИЙ
Гастроинтестинальная токсичность
– часто встречающееся иоНЯ при иммунотерапии.
Основными проявлениями являются диарея и колит, сообщалось о единичных случаях перфорации кишки на фоне терапии анти-CTLA-4. Диарея и колиты встречаются у 32,8% пациентов, а боли в животе у 15,3%, 3–4 степень токсичности развивается приблизительно в 5% случаев. У пациентов, получающих терапию анти-PD-1 препаратами, гастроинтестинальная токсичность развивается зна- чительно реже, чем при терапии анти-CTLA-4: диарея отмечена у 6.0–16.0% пациентов, а 3–4 степень у 2,2% [19, 20]. Незначительные проявления (1 степень) корригируются симптоматической терапией (лоперамид) и диетой. Необходимо исключить инфекционный характер диареи (Clostridium difficile). При диарее 2 степени (4–6 эпизодов в сутки) иммунотерапия откладывается до уменьшения симптоматики до 1 степени или полного восстановления и назначаются кортикостероиды. Выраженные симптомы – диарея 3–4 степени (более 7 эпизодов за сутки), подозрение на перфорацию кишки или непроходимость требуют незамедлительной полной отмены иммунотерапии, показана консультация хирурга, при исключении хирургической патологии – назначение высоких доз кортикостероидов (рис. 3). Диагноз колита ставится на основании клинических симптомов (боли в животе, часто диарея), рентгенологических данных (застой мезентериальных сосудов, утолщение кишечной стенки). В случае выраженных или персистирующих длительное время симптомах показана консультация гастроэнтеролога и колоноскопия с биопсией. В биоптатах при иммуноопосредованном колите определяется воспалительная клеточная инфильтрация. Дополнительно, при жизнеугрожающих симптомах и неэффективности адекватной кортикостероидной терапии при отсутствии противопоказаний (перфорация кишки, сепсис) может быть назначен инфликсимаб (5 мг/кг) – антитело TNF, применяемый для лечения аутоиммунных заболеваний [4, 21].
Кожная токсичность – наиболее частое проявление токсичности. Более чем у половины пациентов, получающих терапию анти-CTLA-4, развивается зуд и сыпь. При терапии анти-PD1 препаратами кожные реакции (сыпь и зуд) развиваются у 28–37% пациентов, витилиго у 9–11%. Необходимо отметить, что большинство кожных реакций 1–2 степени тяжести. Возможно развитие редких побочных реакций, таких как псориаз, эксфолиативный дерматит и эритема [14, 21, 22]. Сыпь (макулопапулезная или эритродермия) и зуд (на фоне сыпи или изолированно), как правило, клинически незначимы и легко контролируются пероральными антигистаминными препаратами и местными стероидами без прекращения иммунотерапии. При условии тщательного наблюдения за больным даже при 2 степени кожной токсичности иммунотерапия может быть продолжена. Системная стероидная терапия и отсрочка иммунотерапии показана при иоНЯ 3–4 степени. В биоптатах кожи определяется эозинофильная инфильтрация или лейкоцитокластический васкулит, могут преобладать CD8+ Т-лимфоциты с тропностью к меланинсодержащим клеткам. У больных с меланомой сыпь может быть предиктором иммунного ответа и в некоторых случаях приводить к витилиго [23]. Серьезные осложнения, такие как синдром Стивенса-Джонсона, токсический эпидермальный некролиз, язвенный, бул-
|
Степень тяжести (NCI СТСАЕ v4) |
Ведение |
Последующее наблюдение |
||
|
1 степень Дидрсястул < 4 раз в день Копит; бессимптомный |
4 |
|
4 |
Ухудшение:
|
|
2 степень Диарея; стул 4-6 раз в день . инфузионная терапия требуется <24 часов; не нарушена повседневная деятельность. Колик боль в животе; кровь в ступе |
4 |
|
Улучшение/разрешение: возобновление иммунотерапии Сохранение симптомов > 5-7 дней, ухудшение или рецидив : Глюкокортикоиды в таблетках (преднизолон в дозе 0,5-1 мг/кг/день) При достижении токсичности <1ст. медленно снижать дозу глюкокортикостероидов в течение, по меньшей мерс. 1 месяца, антибиотикотсрапия (профилактика оппортунистических инфекций), возобновление иммунотерапии Ухудшение, сохранение симптоматики >3-5 дней: лечить как 3/4 ст. токсичности |
|
|
3-4 степень Диарея Зет.: стул > 7 раз в день; недержание ступа; инфузионная терапия требуется £24 часов; нарушена повседневная деятельность. Копит 3d.: лихорадка; кишечная непроходимость; симптомы раздражения брюшины 4 степени: жизнеутрожакицее состояние, гюрс|х)рация |
Отмена иммунотерапии Метилпреднизолон в дозе 1-2 мг/кг/день в/а Антибиотикотерэпия при оппортунистических инфекциях Рассмотреть возможность гитдос ко<т ичес кого исследования |
Улучшение: Продолжить прием глюкокортикоидов до достижения 1 ст. токсичности, затем медленно снижать дозу в течение, по меньшей мере. 1 месяца Сохранение >3-6 дней или прогрессирование: Ввести инфликсимаб 5 мг/кг (при отсутствии перфорации ипи сепсиса) |
Рис. 3. Алгоритм ведения иммуноопосредованного колита [4]
|
Степень тяжести (NCI СТСАЕ v4) |
Ведение |
|
1 степень ACT или АЛТ 13.0 х ВГН и Общий билирубин 11,5 х ВГН
Продолжить иммунотерапию
2 степень ACT ил* АЛТ >30 X ВГН. но 15 х ВГН и/нли Общий билирубин > 1,5 но 13,0 х ВГН
3-4 степень ACT ил* АЛТ >5.0 X ВГН или
Общий билирубин >3.0 X ВГН

Отменить иммунотерапию Увеличить частоту мониторинга (каждые 1-2 дня) Высокие дозы глюкокортикоидов в/в (ме1и|е1реднизотюн 1-2 мг/кг/день) Профилактическая антибиотикотерания Консультация гопатолога
Последующее наблюдение
При остановить иммунотерапию Увеличить частоту мониторинга (каждые 3 дня)
Мониторинг печеночных проб перед введением каждой дозы
Ухудшение:
Лечить как 2 или 3-4 степень
Возвращение показателей к исходному уровню:
-
• Возобновить иммунотерапию
-
• Мониторинг печеночных проб
Сохранение токсичности 1 ст. >5-7 дней или ухудшение:
-
• гдкжокортикостероиды внутрь (преднизолон 0.5-1 мг/кг/день или эквивалент) При снижении до исходного уровня или1 ст: Медленно смокать дозу глюкокортикоидов в течение, по меньшей мере, 1 месяца
При возвращении ко 2 ст. токсичности:
Медлекю снижать дозу глюкокортикоидов в течение, по меньшей мере, 1 месяца

Отсутсвие улучшения >3-5 дней, ухудшение или возвращение:
-
• Добавить мофетил микофенолат в дозе 1 г два раза в день
-
• При отсутствии ответа в течение 3-5 дней следует рассмотреть возможность применения других иммумосупрсссантое. согласно локальным стаццаргам терапии
Рис. 4. Алгоритм ведения иммуноопосредованного гепатита [4]
|
Степень тяжести (NCI СТСАЕ v4) |
Ведение |
Последующее наблюдение |
|
1 степень Только ренгенологич ИЗМСНС»1ИЯ |
0 |
ДНЯ
|
|А |
• Rg контроль каждые 3 недели При ухудшении: Лечить как 2 или 3-4 ст. токсичности |
|
2 степень Усиление симптомов появление новых |
|
Улучшение/разрешение:
Нет улучшения через 2 нед/ухудшение:
|
||
|
3-4 степень Тяжелые новые симптомы; гигхжсия/ жизме'<рсжа#ощее состояние |
|
* |
Улучшение/разрешение:
Нет улучшения через 48 ч/ухудшение:
|
Рис. 5. Алгоритм ведения иммуноопосредованного пневмонита [4]
лезный, некротический или геморрагический дерматиты наблюдались менее чем в 1% случаев. Это однозначное показание к прекращению иммунотерапии, проведению высокодозной стероидной терапии и консультации дерматолога [22, 23].
Печеночная токсичность (гепатит) проявляется повышением печеночных ферментов (аланинаминотрансферазы или аспартатаминотрансферазы) и/или билирубина и развивается менее чем у 5% пациентов [11, 22]. Как правило, протекает бессимптомно, редко присоединяется лихорадка, слабость, тошнота, боли в животе. При развитии гепатита необходимо провести дифференциальный диагноз с прогрессированием болезни и инфекционным процессом. Полезными могут оказаться серологические пробы на вирусные гепатиты, цитомегаловирус, вирус Эпштейна-Барра. Ультразвуковое исследование печени может не выявить изменений или определить гомогенную гепатомегалию, отек, или увеличение периферических лимфоузлов. После консультации гепатолога может быть выполнена биопсия печени. В биоптатах при иммуноопосредованных реакциях описывается диффузная Т-клеточная инфильтрация, иногда фокусы воспаления вокруг желчных протоков. Повышение печеночных ферментов АСТ и/или АЛТ более 3 норм, а общего билирубина – более 1.5 норм, требует временного прекращения иммунотерапии и возобновле- ние ее, возможно, при снижении показателей до 1 степени тяжести (рис. 4). При пятикратном повышении ферментов и/или трехкратном повышении билирубина необходимо полностью отменить иммунотерапию из-за риска развития печеночной недостаточности (менее 1% случаев). Если, несмотря на адекватную стероидную терапию в течение 48–72 ч, симптомы выраженной печеночной токсичности сохраняются, показано назначение микофенолата мофети-ла в резистентных к нему случаях – такролимус [4, 22].
Легочная токсичность (пневмонит), пожалуй, самое грозное осложнение иммунотерапии, развивающееся примерно у 1% пациентов. Может быть выявлено случайно при контрольном рентгенологическом обследовании в виде диффузных инфильтратов и протекать бессимптомно. В отдельных случаях симптомы дыхательной недостаточности развиваются стремительно и могут приводить к летальному исходу [11]. Пульмонит, даже 1 степени (бессимптомные изменения, выявленные рентгенологически), может потребовать приостановки иммунотерапии и тщательного наблюдения за пациентом, с проведением контрольного ренгенологического исследования грудной клетки через 3 недели (рис. 5). Всем пациентам с легочными симптомами показана консультация пульмонолога, бронхоскопия с бронхоальвеолярным лаважом (для исключения инфекционной природы пульмонита), госпита- лизация (в отдельных случаях в отделение интенсивной терапии). В биоптате в легочной ткани выявляется диффузная лимфоцитарная инфильтрация. При постановке диагноза пульмонита сразу назначаются кортикостероиды, возможно эмпирическое назначение антибиотиков. При отсутствии эффекта в течение 48–72 ч рекомендована терапия инфликсимабом [4].
Выраженные пульмониты очень редко развиваются на фоне терапии анти-CTLA-4, для этого препарата более характерны бессимптомные рентгенологические находки, которые быстро купируются при временной отсрочке иммунотерапии. Симптомные пульмониты (с одышкой, увеличением мокроты, лихорадкой, болями в груди, кровохарканьем) более характерны для анти-PD-1 препаратов. Интересно, что частота пульмонитов 2–3 степени у больных меланомой развивается реже, чем у больных раком легкого (1–2% против 7%) [24, 25]. У больных с опухолевым поражением легких или сердечно-легочными заболеваниями симптомы дыхательной недостаточности также могут быть связаны с прогрессированием болезни, псевдопрогрессированием, обострением сопутствующих заболеваний, эмболией легочной артерии, однако, времени для дифференциального диагноза очень мало, поскольку симптомы быстро нарастают и могут привести к смертельному исходу при отсутствии адекватного лечения.
Эндокринопатии – самый сложный для диагностики вид иммуноопосредованной токсичности, развивающийся у 5–10% пациентов, получающих терапию ингибиторами контрольных точек [11]. Эти осложнения развиваются вследствие инфильтрации иммунными клетками щитовидной железы или гипофиза и могут приводить к развитию тиреоидита или гипофизита, что чаще проявляется гипотиреозом или гипопитуитаризмом, включая надпочечниковую недостаточность и гипогонадизм. Больным с сильными головными болями, особенно резистентными к НПВС и другим анальгетикам, показана МРТ головного мозга с детальным изучением гипофиза. Компрессия зрительного нерва может сопровождаться нарушениями зрения. Увеличение гипофиза подтверждает диагноз ги-пофизита. Последний может манифестировать не столь специфично в виде гипотензии, электролитных нарушений, болями в животе, слабостью, потерей либидо. На фоне иммунотерапии следует регулярно осуществлять контроль гормонов (ТТГ и свободного тироксина), по показаниям – УЗИ щитовидной железы. Всем больным с подозрением на эндокринопатию показана консультация эндокринолога, исследование гормонального профиля – пролактина, ФСГ, ЛГ, тестостерона/эстрадиола, биохимический анализ крови. При развитии симптомной эндокринопатии необходимо приостановить иммунотерапию и начать терапию высокими дозами кортикостероидов (1–2 мг/кг/сут) с проведением соответствующей заместительной гормональной терапии. Иммунотерапию возможно возобновить только после купирования симптомов и постепенной отмены кортикостероидов [4, 21]. Редко аутоиммунная эндокринопатия манифестирует адреналовыми кризами, в этих случаях показана стероидная терапия стрессовыми дозами (гидрокортизон 100 мг в/в немедленно, затем 50–100 мг каждые 8 ч), гидратация. Нейротоксичность – очень редкое осложнение иммунотерапии, как правило, проявляется в виде незначительной периферической сенсорной нейропатии или мышечной слабости. Симптомы выявляются при детальном расспросе пациента, осмотр позволяет выявить разнообразные нарушения – от снижения чувствительности до потери глубоких сухожильных рефлексов. Серьезные осложнения могут проявиться синдромом Гийена-Барре, поперечным миелитом, миастенией гравис [25, 26].
К редким иоНЯ также относятся гематологическая токсичность (анемия, тромбоцитопения), сердечно-сосудистая (миокардиты, перикардиты, васкулиты), зрительная (блефариты, конъюнктивиты, увеиты), почечная токсичность (нефриты), нарушение функции поджелудочной железы (эндокринной и экзокринной) [21, 25].
ЗАКЛЮЧЕНИЕ
Повышенный интерес к проблеме иммуноопосредованной токсичности объясняется тем, что это новое эффективное направление в лекарственной терапии онкологических больных, и механизм развития побочных реакций и способы их коррекции принципиально отличаются от цитостатиков и таргетных препаратов [1–4]. Активный поиск маркеров-предикторов токсичности пока не дал однозначных результатов, но исследования в этом направлении продолжаются. Ранняя диагностика и своевременное лечение осложнений – залог успешного проведения противоопухолевой терапии. Для достижения этой цели требуется тесное взаимодействие врачей разных специальностей, пациента и его близких.
Список литературы Иммуноопосредованные нежелательные явления, связанные с лечением препаратами, блокирующими контрольные точки Т-лимфоцитов
- Brahmer J., Reckamp K. L., Baas P. et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med. 2015; 373(2): 123-35
- Borghaei H., Paz-Ares L., Horn L. et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med. 2015; 373(17): 1627-39
- Herbst R. S., Baas P., Kim D. W. et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomized controlled trial. Lancet. 2016; 387(10027): 1540-50.
- Naidoo J., Page D. B., Li B. T. et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies. Ann Oncol. 2015 Dec;26(12):2375-91.
- Pardoll D. M. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012 Mar 22; 12(4):252-64.
- Sarantseva K. A., Laktionava L. V., Reutova E. V., Chernenko P. A., Breder V. V. Immunology: immune response as leading protectionfactor against cancer. Malignant Tumours 2016; 2: 5-14.
- Tarhini A. Immune-mediated adverse events associated with ipilimumab ctla-4 blockade therapy: the underlying mechanisms and clinical management. Scientifica (Cairo). 2013; 2013:857519.
- Horvat T. Z., Adel N. G., Dang T. O. et al. Immune-related adverse events, need for systemic immunosuppression, and effects on survival and time to treatment failure in patients with melanoma treated with ipilimumab at memorial sloan kettering cancer center. J Clin Oncol 2015; 33(28): 3193-8.
- Hodi F. S., O'Day S.J., McDermott D.F. et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363: 711e23.
- Topalian S. L., Hodi F. S., Brahmer J. R., Gettinger S. N. et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012; 366: 2443e54.
- Michot J. M., Bigenwald C., Champiat S. et al. Immune-related adverse events with immune checkpoint blockade: a comprehensive review. Eur J Cancer. 2016 Feb;54:1 39-48.
- Good-Jacobson K.L., Szumilas C. G., Chen L. et al. PD-1 regulates germinal center B cell survival and the formation and affinity of long-lived plasma cells. Nat Immunol 2010; 11: 535-542.
- Teply B. A., Lipson E. J. Identification and management of toxicities from immune checkpoint-blocking drugs. Oncology (Williston Park). 2014 Nov;28 Suppl 3:30-8.
- O'Day S.J., Maio M., Chiarion-Sileni V. et al. Efficacy and safety of ipilimumab monotherapy in patients with pretreated advanced melanoma: a multicentre single-arm phase II study. Ann. Oncol 2010; 21(8):1712-1717 2.
- Robert C., Ribas A., Wolchok J. D. et al. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet 2014; 384(9948): 1109-1117.
- European Medicines Agency: EMEA/H/C/002213-PSUSA/00009200/201409 -ipilimumab Product information 19/06/2015 Yervoy. http://www.ema.europa.eu/docs/en_GB/document_library/ERAP_-_Product information/human002213/WC500109299.pdf (8 November 2015, data last accessed), August 2015.
- Weber J. S., Antonia S. J., Topalian S. L. et al. Safety profile of nivolumab (NIVO) in patients with advanced melanoma (MEL): a pooled analysis. J Clin Oncol 2015; 33 (suppl).
- Kyi C., Hellmann M. D., Wolchok J. D. Opportunistic infections in patients treated with immunotherapy for cancer. J Immunother Cancer 2014; 2(1):19.
- Robert C., Long G. V., Brady B. et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015 Jan 22; 372(4).
- Wolchok J. D., Neyns B., Linette G. et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study. Lancet Oncol 2010 Feb; 11(2):155e64.
- Hofmann L., Forschner A., Loquai C. et al. Cutaneous, gastrointestinal, hepatic, endocrine, and renal side-effects of anti-PD-1 therapy. Eur J Cancer. 2016 Jun; 60: 190-209.
- Belum V. R., Benhuri B., Postow M. A. et al. Characterisation and management of dermatologic adverse events to agents targeting the PD-1 receptor. Eur J Cancer. 2016 Jun; 60: 12-25.
- Lacouture M. E., Wolchok J. D., Yosipovitch G. et al. Ipilimumab in patients with cancer and the management of dermatologic adverse events. J Am Acad Drematol. 2014; 71:161-9.
- Langer C. J. Emerging immunotherapies in the treatment of non-small cell lung cancer (NSCLC): The role of immune checkpoint inhibitors. Am. J Clin Oncol.
- Zimmer L., Goldinger S. M., Hofmann L. et al. Neurological, respiratory, musculoskeletal, cardiac and ocular side-effects of anti-PD-1 therapy. Eur J Cancer. 2016 Jun;60:210-25. Epub 2016 Apr 13 DOI: 10.1016/j.ejca.2016.02.024
- Wilgenhof S., Neyns B. Anti-CTLA-4 antibody Guillain-Barre syndrome in a melanoma patient. Ann. Oncol.2011; 22: 991-993.


