Иммунорегуляторные функции ингибиторов PD-1/PD-L1 и развитие к ним резистентности
Автор: Саяпина Мария С.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 2 (23), 2017 года.
Бесплатный доступ
Данный обзор представляет современное понимание об ингибиторах PD-1/PD-L1. Несмотря на выраженный ответ на иммунотерапию ингибиторами чекпоинтов в ряде нозологий, в 60% случаев отмечается либо первичная, либо приобретенная резистентность. Механизмы, лежащие в основе резистентности, также освещены в данной статье.
Ингибиторы чекпоинтов, первичная/приобретенная резистентность
Короткий адрес: https://sciup.org/140223045
IDR: 140223045 | DOI: 10.18027/2224-5057-2017-2-94-99
Текст научной статьи Иммунорегуляторные функции ингибиторов PD-1/PD-L1 и развитие к ним резистентности
С внедрением в клиническую практику ингибитора CTLA-4 при метастатической меланоме проведен ряд исследований по изучению ингибиторов других контрольных точек, таких как PD-1/PD-L1, продемонстрировавших еще большую эффективность и более благоприятный токсический профиль [1, 2, 3]. В частности, ингибиторы чекпоинтов продемонстрировали высокую эффективность в более чем 15 видах рака, включая меланому, немелкоклеточный рак легкого, почечно-клеточный рак, рак мочевого пузыря, лимфома Ходжкина [4]. FDA были одобрены ингибиторы: PD-1 ниволумаб – для лечения немелкоклеточного рака легкого, метастатической меланомы, почечно-клеточного рака; PD-1 пембролизумаб – немелкоклеточного рака легкого, метастатической меланомы; PD-L1 атезолизумаб – в терапии больных метастатическим уротелиальным раком [3].
В то время как CTLA-4 регулирует активацию наивных Т-клеток и клеток памяти путем вовлечения TCR ( T-cell receptor ) , PD-1 ограничивает активность эффекторных Т-клеток в тканях на периферии во время воспалительного ответа на инфекцию или рак, тем самым ограничивая аутоиммунитет [5].
Programmed cell death-1 (PD-1) – ко-стимуляторный рецептор семейства CD28, играющий ключевую роль в толерантности к опухолевым клеткам [6, 7]. Взаимодействие PD-1/PD-L1 ингибирует пролиферацию Т-лимфоцитов, выживаемость и эффекторные функции (цитотоксичность, секреция цитокинов), индуцирует апоптоз антиген-презентирующих Т-клеток, способствует дифференцировке CD4+Т-клеток в FOXP3+ регуляторные клетки, обеспечивает резистентность опухолевых клеток к цитотоксическому ответу [8, 9, 10, 11]. Все это находит свое отражение в механизмах резистентности в опухолевом микроокружении. Экспрессия PD-1 индуцируется, когда Т-клетки становятся активированными [12]. Связываясь с одним из лигандов, PD-1 ингибирует киназы, которые вовлечены в активацию Т-клеток, через фосфотазы (SHP-1 и SHP-2), тем самым ингибируя сигнальный путь
T-клеточного рецептора (TCR) PI3K/Akt [13, 14]. При сравнении профиля экспрессии гена Т-клеток, подвергнутых антителам к PD-1 и CTLA4, было выявлено, что PD-1 обладает гораздо более выраженной ингибирующей способностью. Более того, CTLA-4 не контролирует ген выживания Bcl-XL, то есть только PD-1 потенциально индуцирует апоптоз Т-клеток [15].
Существуют также альтернативные сигнальные пути, определяющие врожденную и приобретенную иммунную резистентность (рис. 1). Конститутивная экспрессия лиганда PD-1 может определяться онкогенами EGFR и ALK при немелкоклеточном раке легкого и делецией или потерей супрессорного гена PTEN при некоторых видах глиобластом. Повышенная экспрессия PTEN и/или блокирование Akt/mTOR пути приводят к поддержанию и промоции индуцируемых Т-регуляторных клеток. Потеря гена PTEN способствует увеличению экспрессии PD-L1, PD-1 путь может активировать отрицательную обратную связь для сдерживания собственной функции [16, 17, 18]. В свою очередь, большинство опухолей экспрессирует PD-L1 в ответ на провоспалительные цитокины (такие, как интерферон гамма, TNF) для предотвращения иммунного ответа, что называется приобретенной иммунной резистентностью [19, 20, 21, 22].
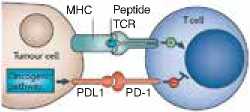
PDL1 PD-1
МНС Peptide \ I TCR
А. Первичная резистентность
Конститутивный онкогенный сигналинг индуцирует экспрессию PD-L1опухолевыми клетками
Ругуляция экспрессии
PD-L1, индуцированная Т-клеткой
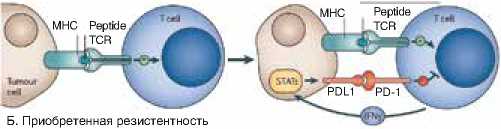
Рисунок 1. Первичная и приобретенная резистентность [22]
PD-1/PD-L1 путь регулирует как периферическую, так и центральную толерантность. В тимусе PD-L1 экспрессируется на тимоцитах, в корковом и мозговом веществе тимуса [23]. Толерогенные дендритные клетки экспрессируют PD-L1 и PD-L2, редуцируют начальную фазу активации и экспансии самореактивных Т-клеток [24]. PD-1 путь также модулирует реактивность, экспансию и эффекторные функции Т-клеток [25]. Наравне с CTLA4 на Т-регуляторных клетках экспрессируются PD-1 и PD-L1. Более того, PD-L1 способствует дифференцировке наивных CD4+Т-лимфоцитов в индуцируемые CD4+FOXP3+Т-регуляторные клетки [26].
PD-1 имеет 2 потенциальных лиганда – PD-L1 (B7H1 и CD274) и PDL2 (B7DC и CD273), которые демонстрируют различный спектр экспрессии и регуляции и в равной степени могут связываться с рецептором PD-1 [27, 28, 29]. Похожие комплексы на лиганды CD80 и CD86 связываются с рецептором CD28, экспрессируемом на покоящихся Т-клетках, и с CTLA4 – на активированных Т-клетках. Как было ранее упомянуто, PD-1 в большей мере регулирует активность эффекторных Т-клеток в ткани и опухоли, а CTLA4 – активацию Т-клеток. При этом CD80 также может экспрессироваться на Т-клетках/антигенпрезентиру-ющих клетках и быть рецептором для PD-L1 [22, 30, 31].
Отмечено, что PD-L1 экспрессируется как опухолевыми клетками, так и конститутивно большинством гемопоэтических клеток, паренхиматозными клетками (поджелудочной железы, эндотелиально-сосудистых), миелоидными клетками в опухолевом микроокружении, опухоль-инфильтрирующими лимфоцитами [32, 33]. В то время как экспрессия PD-L2 ограничена макрофагами, дендритными клетками, опухолевыми клетками первичной медиастинальной лимфомы, фолликулярной лимфомы, лимфомы Ходжкина [34]. Регуляция PD-L2 на клетках лимфом обычно ассоциирована с амплификацией гена или реаранжировкой трансактиваторного локуса CIITA главного комплекса гистосовместимости – MHC II (major histocompatibility complex), который обладает высокой транскрипционной активностью при В-клеточ-ных лимфомах [35].
PD-1, по сравнению с CTLA4, в большей степени представлен на клетках. Так, PD-1 индуцируется на поверхности не только Т-клеточных субпопуляций, но и В-клетками, а также натуральными киллерами (NK-клетками). Поэтому блокада пути PD-1 приводит к активации не только эффекторных Т-клеток, но и NK-клеток, а также продукции антител B+Т-лимфоцитами как напрямую, так и опосредованно [36, 37, 38]. PD-1 экспрессируется большой когортой опухоль-инфильтрирующих лимфоцитов (TILs) при различных видах опухолей. Повышенная экспрессия PD-1 среди CD4+ТILs обычно отражает высокий уровень PD1 на Т-регуляторных клетках. Повышенная экспрессия PD1 среди CD8+TILs указывает на анергию или истощение этих клеток, что подтверждается сниженной секрецией цитокинов PD1+ по сравнению с PD1-TILs меланомы [39].
Следует отметить, что явление истощения или анергии Т-клеток наблюдается при персистирующей экспрессии PD1 опухолевыми клетками или в условиях хронической инфекции, что может являться причиной развития резистентности к ингибиторам чекпоинтов.
Механизмы резистентности к ингибиторам чекпоинтов
Несмотря на выраженный ответ на иммунотерапию ингибиторами чекпоинтов в ряде нозологий, в 60% случаев отмечается либо первичная, либо приобретенная резистентность. Механизмы, лежащие в основе резистентности, обусловлены следующими параметрами: опухолевая иммуногенность; презентация антигена и генерация эффекторных Т-клеток; вовлечение антигена и PD-L1 опу-холь-специфическими Т-лимфоцитами; активность и эффективность опухоль-специфического иммунного ответа; индукция иммунологической памяти [40].
Меланома у человека, почечно-клеточный рак и немелкоклеточный рак легкого – высокоиммуногенные опухоли, несущие от 5 до 10 соматических мутаций ДНК, что обуславливает высокую чувствительность этих опухолей к ингибиторам чекпоинтов PD-1. В свою очередь, низкоиммуногенные опухоли, такие, как опухоли поджелудочной железы и простаты, несущие от 0,1 до 1 соматической мутации ДНК, в большей степени резистентны к анти-PD-1 терапии [3, 41, 42].
Также было показано, что мутации человеческой меланомы, которые увеличивают стабильность и сигналинг р-катенина, могут уменьшать экспрессию лиганда хемо-кина CCL4, значимого для миграции дендритных клеток. Сниженная экспрессия CCL4 ассоциируется с отсутствием TILs и резистентностью к анти-PD1 терапии. Таким образом, сниженную инфильтрацию дендритных клеток в опухолевом микроокружении связывают с резистентностью к анти-PD1 терапии [43]. Повышенное значение VEGF, TGFр и IL10 в опухолевом микроокружении также способствует развитию резистентности к анти-PD1 терапии, предотвращая активацию опухоль-специфи-ческих Т-лимфоцитов [44, 45, 46]. Более того, на ксе-нографтах мышей было продемонстрировано, что TGFр модулирует экспрессию PD-1 и PD-L1 [47]. Ко-экспрессия других ингибиторных рецепторов в дополнение к PD-1, таких, как TIM3 (T-cell immunoglobulin mucin 3), LAG3 (lymphocyte activation gene 3), CTLA4 и BTLA (B and T lymphocyte attenuator), ассоциируется с развитием резистентности к анти-PD1 терапии, что было продемонстрировано при немелкоклеточном раке легкого [48]. Резистентность к анти-PD1 терапии может быть обусловлена секрецией иммуносупрессорных метаболитов. IDO (индол-амин-2,3-диоксигеназа) и IDO2, стимулируя катаболизм триптофана, супрессируют
Т-клеточный иммунитет. Для многих опухолей человека характерен повышенный синтез IDO и IDO2, в частности, вследствие инактивации опухолевого супрессора Bin1 (транскрипционный репрессор). Было продемонстрировано, что экспрессия IDO опухолевыми клетками меланомы способствует резистентности к анти-PD1 терапии [49, 50, 51]. Другим иммуносупрессорным метаболитом является аденозин. A2aR, лигандом которого является аденозин, ингибирует Т-клеточный ответ, способствуя экспрессии CD4+Т-клетками FOXP3, то есть дифференцировке в Т-регуляторные клетки. После гибели клетки секретируют аденозин. В дополнение на Т-регуля-торных клетках высокоэкспрессирован CD39, который конвертирует экстрацеллюлярный АТФ в АМФ, и CD73, конвертирующий АМФ в аденозин. Таким образом, взаимодействие A2aR с аденозином способствует дифференцировке Т-клеток в Т-регуляторные клетки, которые, в свою очередь, образуют самоамплифицирующую нишу в опухоли [52, 53]. Повышенная экспрессия PD-1, ко-экспрессия множественных ингибиторных рецепторов и продукция иммуносупрессивных метаболитов оказывают влияние на чувствительность опухоли к анти-PD1 терапии. А также гетерогенность, присущая большинству опухолей, позволяет одновременно реализовываться множественным механизмам резистентности (рис. 2).
В то время как эффекторные CD8+Т-клетки продемонстрировали свою необходимость для эффективности анти-PD1 терапии, на основе результатов последних исследований можно сделать предположение, что Т-клетки памяти также важны для чувствительности опухоли к ингибиторам чекпоинтов. При сравнении опухоль-инфиль-трирующих лимфоцитов до и после анти-PD1 терапии было выявлено, что у чувствительных пациентов большую
Резистентность к анти-PD-1/PD-LI
Чувствительность Анергия/истощение к анти-PD-1/PD-LI вследствие персистирующей экспрессии PD-1
Ко-экспрессия Экспрессия PD-1- других ингибиторных независимых рецепторов ингибиторных путей
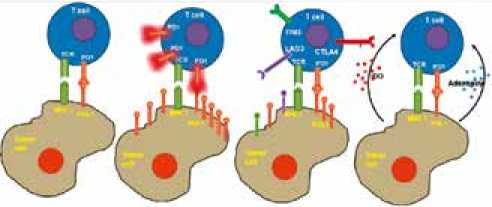
Рисунок 2. Механизмы резистентности к анти-PD-1/PD-L1 терапии [40]
часть популяции Т-лимфоцитов занимала субпопуляция эффекторных клеток памяти CD8+Tem; в свою очередь, TILs резистентных пациентов содержали значительно меньшее количество Tem. Следовательно, индукция Т-клеток с фенотипом эффекторной памяти имеет важное значение для эффективности анти-PD1 терапии, а резистентность к анти-PD1 терапии ограничивает индукцию T-клеток памяти [54].
Дальнейшее изучение механизмов резистентности, комбинированных режимов с включением ингибиторов иммуносупрессорных рецепторов (анти-CTLA, анти-PD1 или PD-L1/L2, анти-LAG3, анти-TIM3 и других) с целью повышения эффективности за счет синергизма (принимая во внимание более высокий риск аутоиммунных осложнений), изучение вакцин и/или адаптивной Т-клеточной терапии в комбинации с ингибиторами чекпоинтов, а также поиск предикторных биомаркеров позволит повысить чувствительность пациентов к данному виду терапии.
Список литературы Иммунорегуляторные функции ингибиторов PD-1/PD-L1 и развитие к ним резистентности
- Blank C. et al. Blockade of PD-L1 (B7-H1) augments human tumor-specific T cell responses in vitro, Int. J. Cancer, 2006, Vol. 119, No. 2, pp. 317-327.
- Brahmer J. R., Tykodi S. S., Cho L. Q., Hwu W. J., Topalian S. L., Hwu P. et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer, N. Engl. J. Med. 2012. Vol. 366, pp. 2455-2465.
- Topalian S. L., Hodi F. S., Brahmer J. R., Gettinger S. N., Smith D. C., McDermott D. F. et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer, N. Engl. J. Med. 2012. Vol. 366, pp. 2443-2454.
- Sharma P., Allison J. P., The future of immune checkpoint therapy, Science, 2015, Vol. 348, No. 6230, pp. 56-61.
- Okazaki T., Honjo T., PD-1 and PD-1 ligands: from discovery to clinical application, Int. Immunol., 2007, Vol. 19, No. 813-824.
- Keir M. E., Liang S. C., Guleria I., Latchman Y. E., Qipo A., Albacker L. A. et al. Tissue expression of PD-L1mediates peripheral T cell tolerance, J. Exp. Med., 2006, Vol. 203, No. 4, pp. 883-895.
- Tseng S. Y., Otsuji M., Gorski K., Huang X., Slansky J. E., Pai S. I. et al. B7-DC, a new dendritic cell molecule with potent costimulatory properties for T cells, J. Exp. Med., 2001, Vol. 193, pp. 839-846.
- Dong H., Strome S. E., Salomao D. R., Tamura H., Hirano F., Flies D. B. et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion, Nat. Med., 2002, Vol. 8, pp. 793-800.
- Wang L., Pino-Lagos K., de Vries V. C., Guleria I., Sayegh M. H., Noelle R. J., Programmed death 1 ligand signaling regulates the generation of adaptive Foxp3+CD4+ regulatory T cells, Proc. Natl. Acad. Sci. USA, 2008, Vol. 105, pp. 9331-9336
- Iwai Y., Ishida M., Tanaka Y., Okazaki T., Honjo T., Minato N. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade, Proc. Natl. Acad. Sci. USA, 2002, Vol. 99, pp. 12293-12297.
- Tsushima F., Yao S., Shin T., Flies A., Flies S., Xu H. et al. Interaction between B7-H1 and PD-1 determines initiation and reversal of T-cell anergy, Blood, 2007, Vol. 110, pp. 180-185.
- Ishida Y., Agata Y., Shibahara K., Honjo T. Induced expression of PD1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death, EMBO J., 1992, Vol. 11, pp. 3887-3895.
- Freeman G. J. et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation, J. Exp. Med., 2000, Vol. 192, pp. 1027-1034.
- Zitvogel L., Kroemer G., Targeting PD-1/PD-L1 interactions for cancer immunotherapy, OncoImmunology, 2012, Vol. 1: 8, pp. 1223-1225.
- Parry R. V., Chemnitz J. M., Frauwirth K. A., Lanfranco A. R., Braunstein I., Kobayashi S. V. et al. CTLA-4 and PD-1 receptors inhibit T-cell activation by distinct mechanisms, Mol. Cell. Biol., 2005, Vol. 25, pp. 9543-9553.
- Marzec M. et al. Oncogenic kinase NPM/ALK induces through STAT3 expression of 573 immunosuppressive protein CD274 (PD-L1, B7-H1), Proc. Natl. Acad. Sci. USA, 2008, Vol. 105, No. 52, pp. 20852-20857.
- Parsa A. T. et al. Loss of tumor suppressor PTEN function increases B7-H1 expression and immunoresistance in glioma, Nat. Med., 2007, Vol. 13, No. 1, pp. 84-88.
- Mittendorf E. A. et al. PD-L1 expression in triple-negative breast cancer, Cancer Immunol. Res., 2014, Vol. 2, No. 4, pp. 361-370.
- Ribas A. Adaptive Immune Resistance: How Cancer Protects from Immune Attack, Cancer Discov., 2015, Vol. 5, No. 9, pp. 915-919.
- Chen L., Han X., Anti-PD-1/PD-L1 therapy of human cancer: past, present, and future, J. Clin. Invest., 2015, Vol. 125, No. 9, pp. 3384-91.
- Mittal D. et al. New insights into cancer immunoediting and its three component phases elimination, equilibrium and escape, Curr. Opin. Immunol., 2014, Vol. 27, pp. 16-25.
- Pardoll D. M. The blockade of immune checkpoints in cancer immunotherapy, Nat. Rev. Cancer, 2012, Vol. 12, No. 4, pp. 252-264.
- Nishimura H., Honjo T., Minato N. Facilitation of beta selection and modification of positive selection in the thymus of PD-1-deficient mice, J. Exp. Med., 2000, Vol. 191, pp. 891-898.
- Probst H. C., McCoy K., Okazaki T., Honjo T., van den Broek M. Resting dendritic cells induce peripheral CD8+ T cell tolerance through PD-1 and CTLA-4, Nat. Immunol., 2005, Vol. 6, pp. 280-286.
- Ansari M. J., Salama A. D., Chitnis T., Smith R. N., Yagita H., Akiba H. et al. The programmed death-1 (PD-1) pathway regulates autoimmune diabetes in nonobese diabetic (NOD) mice, J. Exp. Med., 2003, Vol. 198, pp. 63-69.
- Francisco L. M., Salinas V. H., Brown K. E., Vanguri V. K., Freeman G. J., Kuchroo V. K. et al. PD-L1 regulates the development, maintenance, and function of induced regulatory T cells, J. Exp. Med., 2009, Vol. 206, pp. 3015-3029.
- Dong H., Zhu G., Tamada K., Chen L. B7H1, a third member of the B7 family, co-stimulates Tcell proliferation and interleukin 10 secretion, Nature Med., 1999, Vol. 5, pp. 1365-1369.
- Latchman Y. et al. PDL2 is a second ligand for PD1 and inhibits T cell activation, Nature Immunol., 2001, Vol. 2, pp. 261-268.
- Shin T. et al. In vivo costimulatory role of B7DC in tuning T helper cell 1 and cytotoxic T lymphocyte responses, J. Exp. Med., 2005, Vol. 201, pp. 1531-1541.
- Paterson A. M. et al. The programmed death1 ligand 1: B7-1 pathway restrains diabetogenic effector T cells in vivo, J. Immunol., 2011, Vol. 187, pp. 1097-1105.
- Park J. J. et al. B7-H1/CD80 interaction is required for the induction and maintenance of peripheral T-cell tolerance, Blood, 2010, Vol. 116, pp. 1291-1298.
- Kuang D. M. et al. Activated monocytes in peritumoral stroma of hepatocellular carcinoma foster immune privilege and disease progression through PDL1, J. Exp. Med., 2009, Vol. 206, pp. 1327-1337.
- Liu Y., Zeng B., Zhang Z., Zhang Y., Yang R. B7H1 on myeloid-derived suppressor cells in immune suppression by a mouse model of ovarian cancer, Clin. Immunol., 2008, Vol. 129, pp. 471-481.
- Rosenwald A. et al. Molecular diagnosis of primary mediastinal B cell lymphoma identifies a clinically favorable subgroup of diffuse large B cell lymphoma related to Hodgkin lymphoma, J. Exp. Med., 2003, Vol. 198, pp. 851-862.
- Steidl C. et al. MHC class II transactivator CIITA is a recurrent gene fusion partner in lymphoid cancers, Nature, 2011, Vol. 471, pp. 377-381.
- Terme M. et al. IL18 induces PD-1 -dependent immunosuppression in cancer, Cancer Res., 2011, Vol. 71, pp. 5393-5399.
- Fanoni D. et al. New monoclonal antibodies against Bcell antigens: possible new strategies for diagnosis of primary cutaneous Bcell lymphomas, Immunol. Lett., 2011, Vol. 134, pp. 157-160.
- Velu V. et al. Enhancing SIV-specific immunity in vivo by PD1 blockade, Nature, 2009, Vol. 458, pp. 206-210.
- Ahmadzadeh M. et al. T cells infiltrating the tumor express high levels of PD1 and are functionally impaired, Blood, 2009, Vol. 114, No. 8, pp. 1537-1544.
- O'Donnell J. S., Long G. V., Scolyer R. A. et al. Resistance to PD1/PDL1 checkpoint inhibition, Cancer Treatment Reviews, 2017, Vol. 52, pp. 71-81.
- Schumacher T. N., Schreiber R. D., Neoantigens in cancer immunotherapy, Science, 2015, Vol. 348, No. 6230, pp. 69-74.
- Martin A. M. et al., Paucity of PD-L1 expression in prostate cancer: innate and adaptive immune resistance, Prostate Cancer Prostatic Dis., 2015, Vol. 18, No. 4, pp. 325-332.
- Spranger S., Bao R., Gajewski T. F., Melanoma-intrinsic ß-catenin signaling prevents anti-tumor immunity, Nature, 2015, Vol. 523, No. 7559, pp. 231-235.
- Ellis L. M., Hicklin D. J. VEGF-targeted therapy: mechanisms of anti-tumor activity, Nat. Rev. Cancer, 2008, Vol. 8, No. 8, pp. 579-591.
- Young M. R. et al., Tumor-derived cytokines induce bone marrow suppressor cells that mediate immunosuppression through transforming growth factor beta, Cancer Immunol. Immunother., 1992, Vol. 35, No. 1, pp. 14-18.
- Commeren D. L. et al. Paradoxical effects of interleukin-10 on the maturation of murine myeloid dendritic cells, Immunology, 2003, Vol. 110, No. 2, pp. 188-196.
- Baas M., Besancon A., Goncalves T. et al. TGFb-dependent expression of PD-1 and PD-L1 controls CD8+ T cell anergy in transplant tolerance eLife 2016; 5: e08133.
- Thommen D. S. et al., Progression of Lung Cancer Is Associated with Increased Dysfunction of T Cells Defined by Coexpression of Multiple Inhibitory Receptors, Cancer Immunol. Res., 2015, Vol. 3, No. 12, pp. 344-355.
- Prendergast G. C. Immune escape as a fundamental trait of cancer: focus on IDO, Oncogene, 2008, Vol. 27, pp. 3889-3900.
- Holmgaard R. B. et al., Indoleamine 2,3-dioxygenase is a critical resistance mechanism in antitumor T cell immunotherapy targeting CTLA-4, J. Exp. Med., 2013, Vol. 210, No. 7, pp. 1389-1402.
- Spranger S. et al., Mechanism of tumor rejection with doublets of CTLA-4, PD-1/PD-L1, or IDO blockade involves restored IL-2 production and proliferation of CD8 (+) T cells 700 directly within the tumor microenvironment, J. Immunother. Cancer, 2014, Vol. 2, p. 3.
- Zarek P. E. et al. A2A receptor signaling promotes peripheral tolerance by inducing Tcell anergy and the generation of adaptive regulatory T cells, Blood, 2008, Vol. 111, pp. 251-259.
- Deaglio S. et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression, J. Exp. Med., 2007, Vol. 204, pp. 1257-1265.
- Ribas A. et al. PD-1 Blockade Expands Intratumoral Memory T Cells, Cancer Immunol. Res., 2016, Vol. 4, No. 3, pp. 194-203.


