Иммунотерапия ингибиторами контрольных точек перед высокодозной химиотерапией с аутологичной трансплантацией кроветворных стволовых клеток у больных с рецидивами и рефрактерными формами классической лимфомы Ходжкина
Автор: Мочкин Н.Е., Мельниченко В.Я., Протопопова Ю.В.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Обзоры литературы
Статья в выпуске: 2 т.19, 2024 года.
Бесплатный доступ
Классическая лимфома Ходжкина считается потенциально излечимым онкологическим заболеванием, однако после окончания первой линии лечения рецидивы и рефрактерное течение болезни констатируются примерно у 10–30% больных. Актуальным и сложным вопросом является выбор дальнейшей терапии для таких пациентов. Существующие режимы химиотерапии второй линии имеют ограниченную эффективность. В настоящее время ингибиторы иммунных контрольных точек (PD-1-ингибиторы) стали новой высокоэффективной опцией для лечения рецидивов и резистентном течении классической лимфомы Ходжкина. Представлен комплексный обзор исследований, демонстрирующих эффективность и безопасность использования PD-1-ингибиторов в качестве подготовки к аутологичной трансплантации гемопоэтических стволовых клеток, позволяющей достичь длительный ответ на лечение.
Классическая лимфома Ходжкина, ингибиторы иммунных контрольных точек, аутологичная трансплантация гемопоэтических стволовых клеток
Короткий адрес: https://sciup.org/140307046
IDR: 140307046 | DOI: 10.25881/20728255_2024_19_2_115
Текст научной статьи Иммунотерапия ингибиторами контрольных точек перед высокодозной химиотерапией с аутологичной трансплантацией кроветворных стволовых клеток у больных с рецидивами и рефрактерными формами классической лимфомы Ходжкина
Большинство пациентов с классической лимфомой Ходжкина (кЛХ) могут быть излечены с помощью стандартной химиотерапии первой линии [1]. Однако у 10–30% пациентов после завершения данного лечения диагностируют рефрактерность (отсутствие полной ремиссии после окончания химиотерапии первой линии или прогрессирование во время ее проведения) или рецидив заболевания [2; 3].
Такие пациенты получают химиотерапию по схемам второй линии, эффективность которой повышается после консолидации ремиссии с помощью высокодозной химиотерапии с трансплантацией аутологичных гемопоэтических стволовых клеток (ВДХТ+аутоТГСК) [4]. Важным условием эффективности и целесообразности проведения аутоТГСК считается химиочувствительность опухоли, то есть достижение как минимум частичного ответа на химиотерапию рецидива [5].
Режимы химиотерапии второй линии позволяют получить полный ответ лишь в 21–73% случаев (Табл. 1). В качестве терапии второй линии могут применяться комбинации ICE, DHAP, IGEV, GDP, ESHAP, GemOx и др. Все эти режимы имеют сопоставимую эффективность и токсичность. Оптимальным считается проведение 2 циклов противорецидивной терапии. Увеличение количества циклов химиотерапии перед аутоТГСК с целью достижения ответа сопровождается увеличением токсичности и представляется бесперспективным. При отсутствии как минимум частичного ответа на 2 цикла терапии второй линии целесообразен переход на другой режим лечения, ранее не применявшийся.
Повышения эффективности химиотерапии второй линии с целью последующего выполнения ВДХТ+ау-тоТГСК является чрезвычайно важным и актуальным вопросом лечения кЛХ.
Использование PD-1-ингибиторов в качестве терапевтической опции для лечения рецидивирующих и рефрактерных форм кЛХ
Данные о генетике и опухолевом микроокружении кЛХ, а именно обнаружение высокого уровня экспрессии PD-L1 и PD-L2 — лиганда программируемой клеточной гибели-1 и 2 на поверхности клеток Рид-Штернберга, открыли новые возможности для лечения кЛХ (Рис. 1).
Высокий уровень экспрессии PD-L1 при кЛХ возникает вследствие амплификации локуса 9p24.1 или EBV инфекции [14]. Классическая лимфома Ходжкина содержит генетические изменения, которые могут активировать передачу сигналов JAK/STAT, наиболее распростра-

Мочкин Н.Е., Мельниченко В.Я., Протопопова Ю.В.
ИММУНОТЕРАПИЯ ИНГИБИТОРАМИ КОНТРОЛЬНЫХ ТОЧЕК ПЕРЕД ВЫСОКОДОЗНОЙ ХИМИОТЕРАПИЕЙ С АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИЕЙ КРОВЕТВОРНЫХ СТВОЛОВЫХ КЛЕТОК У БОЛЬНЫХ С РЕЦИДИВАМИ И РЕФРАКТЕРНЫМИ ФОРМАМИ КЛАССИЧЕСКОЙ ЛИМФОМЫ ХОДЖКИНА
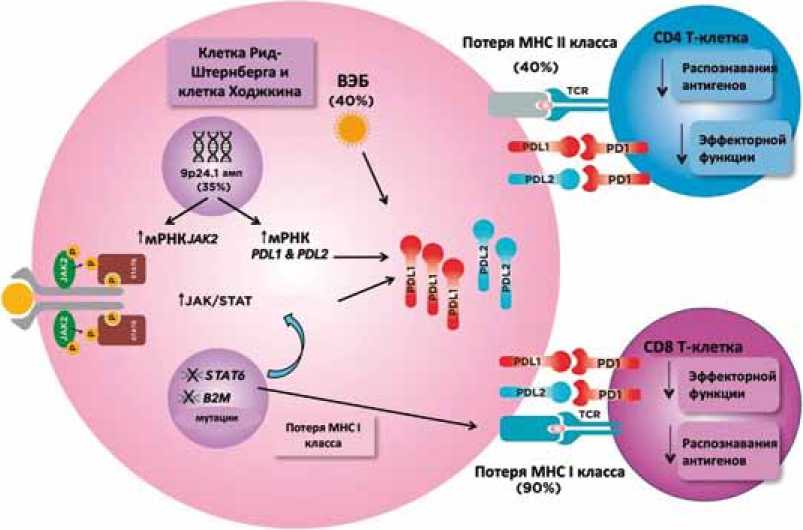
Табл. 1. Эффективность различных режимов химиотерапии второй линии. Использование PD-1-ингибиторов в качестве терапевтической опции для лечения рецидивирующих и рефрактерных форм кЛХ
|
Автор |
Протокол |
Число пациентов (n) |
Рефрактерность (%) |
Метод оценки эффективности |
Частота объективных ответов (%) |
Частота полных ответов (%) |
|
J. Rodriguez и соавт., 1999 [6] |
ASHAP |
56 |
12% |
КТ+галлий |
70% |
34% |
|
J. Aparicio и соавт., 1999 [7] |
ESHAP |
22 |
22% |
КТ |
73% |
41% |
|
С.Н. Moskowitz и соавт., 2001 [8] |
ICE |
65 |
34% |
КТ |
88% |
26% |
|
A. Josting и соавт., 2002 [9] |
DHAP |
102 |
16% |
КТ |
89% |
21% |
|
T. Baetz и соавт., 2003 [10] |
GDP |
23 |
9% |
КТ |
69% |
17% |
|
A. Josting и соавт., 2010 [11] |
DHAP |
279 |
– |
КТ |
70% |
24% |
|
J. Labrador и соавт., 2014 [12] |
ESHAP |
82 |
50% |
КТ |
67% |
50% |
|
A. Santoro и соавт., 2016 [13] |
BeGEV |
59 |
46% |
ПЭТ-КТ |
83% |
73% |
Рис. 1. Биологические эффекты гиперэкспрессии PD-L1 и PD-L2. PD-L1 — лиганд программируемой клеточной гибели-1, PD-L2 — лиганд программируемой клеточной гибели-1, MHC I — основной комплекс гистосовместимости I класса, MHC II — основной комплекс гистосовместимости II класса (адаптировано и переведено из статьи N. Meti и соавт. [15]).
ненными из которых являются JAK2 и STAT6, что в конечном итоге также может увеличить экспрессию PD-L1 [15]. Молекулы PD-L1 передают сигнал через PD-1 рецептор, экспрессированный на интратуморальных Т-клетках, что приводит к подавлению эффекторной функции Т-клеток и неэффективному противоопухолевому иммунному ответу [16]. Дополнительный механизм ускользания опухолевых клеток от иммунного надзора заключается в подавлении экспрессии основного комплекса гистосовместимости (major histocompatibility complex — MHC) I и II класса, который является ключевым звеном для презентации опухолевых антигенов и активации CD8 и CD4 Т-клеток [15]. Блокада PD-1 сигнала предотвращает угнетение функции и истощение Т-клеток.
Ингибиторы иммунных контрольных точек (PD-1-ингибиторы), пембролизумаб и ниволумаб, были одобрены FDA при рецидивах и рефрактерном течении кЛХ (р/р кЛХ) в 2017 и 2016 гг. на основании результатов исследований второй фазы KEYNOTE-087 и CheckMate 205 [17-19]. Первоначально зарегистрированные FDA показания к применению пемброли-зумаба: лечение больных с рефрактерным течением кЛХ или рецидивами после трех и более линий системной терапии; показания к применению ниволу-маба: прогрессирование или рецидив кЛХ после ау-тоТГСК и брентуксимаба ведотина. В РФ пемброли-зумаб и ниволумаб были зарегистрированы по аналогичным показаниям.

Обновленные данные 5-летнего наблюдения в рамках исследований KEYNOTE-087 и CheckMate 205 свидетельствуют о том, что частота объективных ответов (ЧОО) (определяется как сумма всех полных и частичных ответов) на иммунотерапию достигает 71,4%, из которых частота полных ответов варьирует от 21,4% до 27,6% [20; 21]. Медиана продолжительности ответа составила 18,2 месяца по данным CheckMate 205, 16,6 месяцев — по данным KEYNOTE-087, при этом только половина пациентов, достигших полный ответ, сохраняет его более 4 лет. Медиана выживаемости без прогрессирования (ВБП) составила 15,1 месяцев в CheckMate 205 и 17,2 месяцев в KEYNOTE-087. Медиана общей выживаемости (ОВ) не была достигнута в обоих исследованиях: 5-летняя ОВ составила 70,7% и 71,4% в исследовании CheckMate 205 и KEYNOTE-087, соответственно.
Таким образом, PD-1-ингибиторы высокоэффективны при р/р кЛХ, однако длительность ответов и долгосрочные результаты без прогрессирования остаются неудовлетворительными.
Иммунотерапия и повышение чувствительности опухоли к последующей химиотерапии
Последние исследования показывают, что PD-1-ингибиторы могут повысить чувствительность (сенсибилизировать) р/р кЛХ к последующей цитотоксической химиотерапии (Табл. 2) [22–25]. В исследовании Е. Calabretta и соавт. продемонстрировано, что при рецидиве после терапии PD-1-ингибиторами 82% больных с резистентным течением и множественными рецидивами кЛХ достигли полный ответ на противорецидивную химиотерапию [26].
Хорошо изучен потенциальный синергетический эффект иммунотерапии и химиотерапии: ингибиторы иммунных контрольных точек изменяют микроокру- жение опухоли, делая опухолевые клетки более восприимчивыми к повреждению ДНК и таким образом усиливая действие химиотерапевтических агентов [27]. В свою очередь химиотерапия также влияет на микроокружение опухоли и активирует противоопухолевый иммунный ответ: снижается экспрессии PD-L1, уменьшается количество регуляторных Т-клеток и миелоидных супрессорных клеток [28–30]. Индуцированное химиотерапевтическими агентами разрушение опухолевых клеток усиливает воздействие опухолевых антигенов на иммунную систему, это активирует функцию цитотоксических Т-лимфоцитов и стимулирует их проникновение в паренхиму опухоли [31].
Способность PD-1-ингибиторов повышать чувствительность кЛХ к последующей цитотоксической химиотерапии делает биологически обоснованным их более ранее применение в лечение кЛХ, в том числе использование в качестве бридж-терапии к аутоТГСК. В РФ в 2022 г. было одобрено новое показание для применения пембролизу-маба у взрослых и детей от 3-х лет и старше с р/р кЛХ: после одной и более предшествующей линий терапии при наличии противопоказаний к выполнению аутоТГСК.
Применение PD-1-ингибиторов в качестве «bridge»-терапии к ВДХТ+аутоТГСК
Использование иммунотерапии в монорежиме или в комбинации с химиотерапией для достижения ответа перед ВДХТ+аутоТГСК получило название подготовительной или «bridge»-терапии. В США в многоцентровое ретроспективное исследование были включены 78 пациентов с р/р кЛХ, которым проведена ВДХТ+аутоТГСК после предшествующего лечения PD-1-ингибиторами [32]. Большинство пациентов имели множественные рецидивы кЛХ: медиана линий системной терапии до получения PD-1-ингибитора — 3. Ингибиторы им-
Табл. 2. Сводная таблица результатов исследований, оценивающих чувствительность к химиотерапии после предшествующего лечение PD-1-ингибиторами при р/р кЛХ
|
С. Rossi и соавт., 2018 год [24] |
N.A. Carreau и соавт., 2020 год [22] |
B. Casadei и соавт., 2020 год [25] |
E. Calabretta и соавт., 2022 год [26] |
|
|
Количество пациентов, n |
19 |
81 |
25 |
28 |
|
Медиана возраста, года |
44 |
39 |
32 |
29 |
|
Медиана линий предшествующей терапии (число, диапазон) |
6 (2–14) |
4 (1–11) |
4 (1–10) |
4 (2–11) |
|
Предшествующая аутоТГСК (n, %) |
10 (53%) |
34 (42%) |
11 (44%) |
18 (64%) |
|
Статус болезни после окончания терапии PD-1-ингибиторами (n, %) |
||||
|
Стабилизация/ прогрессирование |
17 (89%) |
55 (68%) |
17 (68%) |
28 (100%) |
|
Частичный ответ |
2 (11%) |
– |
6 (16%) |
– |
|
Полный ответ |
– |
1 (1%) |
2(8%) |
– |
|
Нет данных о статусе |
– |
25 (31%) |
– |
– |
|
Частота объективных ответов на терапию (Полный ответ), % |
59 (41%) |
62 (42%) |
60 (32%) |
93 (82%) |
|
Получили консолидацию алло-ТГСК (n %) |
3 (16%) |
22 (27%) |
4 (16%) |
25 (89%) |
|
Получили консолидацию ауто-ТГСК (n, %) |
– |
16 (20%) |
4 (16%) |
1 (4%) |
|
Медиана наблюдения, мес. |
12,1 |
18 |
32,4 |
21 |
|
Медиана выживаемости без прогрессирования, мес. |
11 |
6.3 |
19.1 |
Не достигнута |
|
Медиана общей выживаемости, мес. |
Не достигнута |
21 |
Не достигнута |
Не достигнута |

Мочкин Н.Е., Мельниченко В.Я., Протопопова Ю.В.
ИММУНОТЕРАПИЯ ИНГИБИТОРАМИ КОНТРОЛЬНЫХ ТОЧЕК ПЕРЕД ВЫСОКОДОЗНОЙ ХИМИОТЕРАПИЕЙ С АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИЕЙ КРОВЕТВОРНЫХ СТВОЛОВЫХ КЛЕТОК У БОЛЬНЫХ С РЕЦИДИВАМИ И РЕФРАКТЕРНЫМИ ФОРМАМИ КЛАССИЧЕСКОЙ ЛИМФОМЫ ХОДЖКИНА мунных контрольных точек применялась в качестве «бридж-терапии» к ВДХТ+аутоТГСК как в монорежиме, так и в составе комбинированной иммунохимиотерапии. При анализе выживаемости были получены впечатляющие результаты: 18-месячная ВБП и ОВ для всей когорты пациентов составила 81 и 96%, соответственно. Обнадеживающие результаты также были получены в группе пациентов, рефрактерных к 2 последовательным линиям терапии, предшествующим лечению PD-1-ингибитором (18-месячная ВБП — 78%), а также в группе пациентов, получивших 3 и более линий терапий (18-месячная ВБП — 73%). ПЭТ-положительный статус перед ВДХТ+аутоТГСК не ухудшал результаты выживаемости: 18-месячная ВБП составила 75%, что ставит под сомнения парадигму о необходимости достижения полного ответа перед ВДХТ+аутоТГСК (Рис. 2). Ключевым прогностическим фактором для положительных исходов после ВДХТ+аутоТГСК являлся ответ на терапию PD-1-ингибиторами: пациенты, которые не достигли общего объективного ответа на терапию PD-1-ингибиторами, имели наихудшие исходы (18-месячная ВБП — 51%). Таким образом, результаты исследования демонстрируют высокую эффективность ингибиторов иммунных контрольных точек в качестве «bridge»-терапии к ВДХТ+аутоТГСК вне зависимости от состава и длительности предшествующего противоопухолевого лечения у пациентов с р/р кЛХ.
В попытке увеличить частоту полного ответа у пациентов с р/р кЛХ были инициированы проспективные исследования II фазы, изучающие комбинации PD1-ингибиторов с различными режимами химиотерапии (Табл. 3).
Так, в исследовании L.J. Brayan и соавт. оценивалась эффективность пембролизумаба в комбинации с химиотерапией по схеме ICE (ифосфамид, карбоплатин и этопозид) у пациентов с р/р кЛХ после 1 или 2 предшествующих линий химиотерапии [35]. ЧОО составила 97,3%, частота полных ответов — 87,2%. По протоколу исследования, все пациенты, достигшие полный ответ, получали консолидацию ремиссии с помощью ВДХ+аутоТГСК. 2летняя ОВ составила 95,1%, ВБП — 87,2%.
В исследовании А.А. Мамедовой и соавт. была продемонстрирована высокая эффективность комбинации ни-волумаба и DHAP (дексаметазон, цитарабин, цисплатин)
Все пациенты
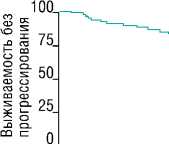
Кол-во 0 $ '2 18
пациентов Месяцы после аутоТГСК
Всего-78 69 53 35
ПЭТ-положительный статус (ПЭТ*) перед аутоТГСК в сравнении с ПЗТ-негативным статусом (ПЭТ-)
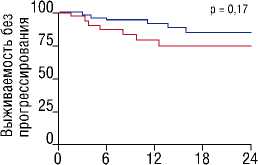
Количество Месяцы после аутоТГСК
ПЭТ-статус - 47 43 34 22 15
ПЭТ+статус - 31 26 19 13 8
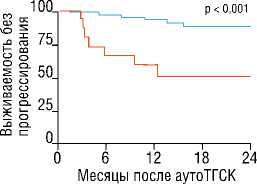
Достижение ответа 63 59 45 29 18
Отсутствие ответа — 15 10 8 6 5
Достижение ответа но терапию PD-1-ингибиторами в сравнении с отсутствием ответа
А
БВ
Рис. 2. Выживаемость без прогрессирования. (A) В общей группе пациентов. (Б) При достижении ответа на терапию PD-1-ингибиторами в сравнении с отсутствием ответа. (В) При ПЭТ-положительном статусе перед аутоТГСК в сравнении с ПЭТ-негативным статусом (адаптировано и переведено из статьи R.W. Merryman и соавт. [32]).
Табл. 3. Сводная таблица эффективности комбинации PD1-ингибиторов с различными режимами химиотерапии
|
Режим |
Тип исследования |
Фаза |
Пациенты, n |
Частота полных ответов (%) |
Частота объективных ответов (%) |
ВБП (%) (среди всех пациентов) |
ВБП (%) (группа пациентов, получивших ВДХТ+ ауто-ТГСК) |
Медиана наблюдения, месяцы |
Автор |
|
Ниволумаб ±ICE |
Проспективное |
II |
42 |
91% |
95% |
72% (2 года) |
94% (2 года) |
31 |
M. Mei и соавт., 2022 [33] |
|
Ниволумаб+DHAP |
Проспективное |
II |
32 |
75% |
95% (3 года) |
74% (3 года) |
87% (3 года) |
24 (после аутоТГСК) |
А.К. Мамедова и соавт., 2022 [34] |
|
Ниволумаб+BeGEV |
Проспективное |
II |
51 |
100% |
100% |
Нет данных |
93% |
12 |
Я.К Мангасарова и соавт., 2023 [21] |
|
Пембролизумаб+ICE |
Проспективное |
II |
37 |
86,5% |
95% (2 года) |
87% (2 года) |
Нет данных |
24 |
J.L. Bryan и соавт., 2023 [35] |
|
Пембролизумаб+GVD |
Проспективное |
II |
39 |
95% |
100% |
100% (1 год) |
100% (1 год) |
13,5 |
A.J. Moskowitz и соавт., 2023 [36] |
у пациентов с рефрактерной и рецидивирующей кЛХ. Показатель общего объективного ответа достиг 100% после заверения всей программы лечения (больные получали 2 введения ниволумаба и 4 цикла Nivo-DHAP), ВБП для всей когорты пациентов через 12, 24 и 36 месяцев составила 81%, 78% и 74%, ОВ при тех же сроках наблюдения была 95%. Предварительные данные по использованию ингибиторов PD-1 в комбинации с химиотерапией пока не позволяют обсуждать вопрос о возможности отказа от ВДХТ с последующей аутоТГСК в качестве оптимального метода консолидации ремиссии [38].
A.J. Moskowitz и соавт. изучали эффективность комбинации пембролизума и протокола GVD (гемцитабин, винорелбин и пегелированный липосомальный доксорубицин) в качестве терапии второй линии при р/р кЛХ[36]. ЧОО составила 100%, а частота полных ответов — 95%. 95% пациентов получили консолидацию ремиссии с помощью ВДХТ+аутоТГСК. При медиане наблюдения после аутоТГСК 13,5 месяцев все пациенты, перенесшие трансплантацию, находятся в ремиссии.
М. Мei и соавт. изучали ПЭТ-адаптированную терапию второй линии р/р кЛХ с применением ниволумаба (Рис. 3) [33]. Результаты исследования демонстрируют, что применение PD-1-ингибитора в монорежиме является высоко эффективной опцией, позволившей большинству пациентов перейти к этапу высокодозной консолидации без включения химиотерапии в состав проти-ворецидного лечения: ЧОО составляет 81%, а ПР — 71%. В группе пациентов, не достигших полный или частичный ответ на монотерапию ниволумабом и получивших дополнительное комбинирование лечение по схеме NICE (ниволумаб в комбинации ифосфамидом, кар-боплатином и этопозидом), ЧОО — 100%, полных ответов — 89%. Авторы подчеркивают необходимость проведения дальнейших исследований и поиска факторов для идентифицикации пациентов, которым достаточно применение PD-1-ингибитора в монорежиме, и тех, для которых комбинированная химиоиммунотерапия станет более эффективной опцией в качестве противорецидивной терапии второй линии р/р кЛХ. Также в исследовании демонстрируется важность консолидации достигнутого ответа: 2-летняя ВБП и ОВ у пациентов, получивших ВДХТ+аутоТГСК, составили 94% и 97%, соответственно. Отказ от трансплантации у 4 из 5 пациентов, достигших ПР на терапию рецидива, привел к прогрессированию заболевания, медиана ВБП в этой группе составила 7,5 месяцев.
Безопасность и токсические эффекты ВДХТ+аутоТГСК после применения иммунотерапии
Комбинированная иммунохимиотерапия не снижает эффективность мобилизации и сбора стволовых кроветворных клеток для проведения аутоТГСК [34; 35]. Также показано, что терапия PD-1-ингибиторами перед ау-тоТГСК не увеличивает длительность агранулоцитоза и продолжительность пребывания пациентов в стационаре [34; 39; 40].
В ретроспективном исследовании R.W. Merrymen и соавт. не было зафиксировано связанных с аутоТГСК летальных исходов и неожиданных осложнений аутоТГСК у больных с р/р кЛХ после предшествующего лечения PD-1-ингибиторами [32].
В исследовании М. Мei и соавт. синдром приживления развился у 12% пациентов, терапия кортикостероидами потребовалась только в 1 случае [33]. У 1 пациента (3%) после аутоТГСК развился гепатит, колит и зуд III степени тяжести, которые были расценены, как иммуноопосредованные нежелательные явление (иНЯ), связанные с приемом ниволумаба до аутоТГСК. У другого пациента (3%) развился пневмонит II степени тяжести во время поддерживающей терапии пембролизумабом после аутоТГСК.
M ■ 25 <00% IWVMMI «toITOQ
N * 4 OtIUllAKb 01 аутоТГСХ В ПР
По ммриению лечения Ww: 400 81% (34/42 rw*exm| ПО 71% (30/42 пациентов)
N • 11 (7714 получим» •утоТГОС после маерме*«и кето лротомма лесами»
После 3 циклов Маю
ЧОО 88% (37/42 пациентов) ПО 62% 126/42 пациентов)
По моершению всего протокола лечения.
400 93% 139/4 2 пациентов)
ПО 91% (38/42 пациентов)
После 6 циклов Юмос 400 89% (33/37 пациентов] ЛО 78% (29/37 пациентов)
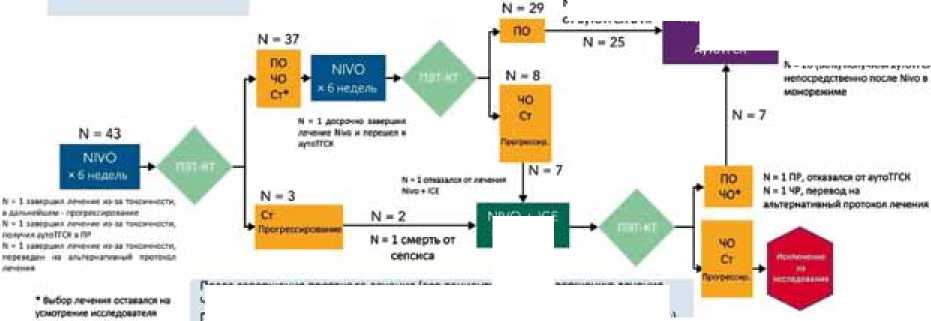
NIVO ♦ КЛ ■ Б недель
Посла мвершемия протокола лечения (все пациенты) По м вершению лечения
ЧОО 91% (39/43 пациентов) Nko ♦ ICE :
ПО 88* (88/43 паижиго.) ЧОО 100» (9/9 пит»"»)
ПО 89% <8/9 гиииенго*)
Рис. 3. Протокол исследования и данные о частоте ответов на лечение. ПО — полный ответ, ЧО — частичный ответ, Ст — стабилизация болезни, ЧОО — частота объективных ответов (адаптировано и переведено из статьи M. Mei и соавт. [33]).
Мобилизация ПСКН АутоТГСК
Мочкин Н.Е., Мельниченко В.Я., Протопопова Ю.В.
ИММУНОТЕРАПИЯ ИНГИБИТОРАМИ КОНТРОЛЬНЫХ ТОЧЕК ПЕРЕД ВЫСОКОДОЗНОЙ ХИМИОТЕРАПИЕЙ С АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИЕЙ КРОВЕТВОРНЫХ СТВОЛОВЫХ КЛЕТОК У БОЛЬНЫХ С РЕЦИДИВАМИ И РЕФРАКТЕРНЫМИ ФОРМАМИ КЛАССИЧЕСКОЙ ЛИМФОМЫ ХОДЖКИНА
|
Показатель |
Результат |
|
Медиана содержания CD34+ в трансплантате, х10 6 /кг (интервал) |
2,7 (1,7–95) |
|
Медиана времени до достижения уровня тромбоцитов > 20х10 9 /л, дни (интервал) |
10,5 (9–26) |
|
Медиана времени до достижения уровня нейтрофилов > 0,5х10 9 /л, дни (интервал) |
13,5 (7–43) |
|
Анемия 2 степени по СТСАЕ 5.0, число пациентов (%) |
18 (41,9) |
|
Анемия 3 степени по СТСАЕ 5.0, число пациентов (%) |
19 (44,2) |
|
Медиана времени применения Г-КСФ, дни (интервал) |
9 (0–26) |
|
ПЭГ-Г-КСФ, число пациентов (%) |
10 (23,3) |
|
Медиана трансфузий тромбоконцентрата, число доз (интервал) |
2 (1–31) |
|
Медиана трансфузий эритроцитной взвеси, число доз (интервал) |
1 (0–15) |
|
Мукозит 3-4 степени по СТСАЕ 5.0, число пациентов (%) |
2 (4,6) |
|
Энтеропатия 3-4 степени по СТСАЕ 5.0, число пациентов (%) |
6 (14) |
|
Нейтропеническая лихорадка, число пациентов (%) |
32 (74,4) |
|
Документированная инфекция, число пациентов (%) Клостридиальный колит, число пациентов (%) |
19 (44,2) 5 (11,6) |
|
Негематологическая токсичность, число пациентов (%)
|
10 (23,4) 8 (18,6) 2 (4,6) 1 (2,3) |
|
Медиана времени применения в/в антибиотиков, дни (интервал) |
8 (0–23) |
|
Медиана длительности госпитализации, дни (интервал) |
25 (14–72) |
|
Смертность в течение 100 дней после ТГСК, число пациентов (%) |
2 (4,6) |
Рис. 4. Характеристики приживления аутотрансплантата и осложнений ВДХТ+аутоТГСК после терапии PD-1-ингибиторами (адаптировано и переведено из тезисов Н.Е. Мочкина и соавт., представленных на EHA2022 [39]).
В работе Н.Е. Мочкина и соавт., представленной на EHA2022, профиль токсичности также соответствовал ранее опубликованным данным о безопасности ВДХТ+аутоТГСК без предшествующего лечения PD-1-ингибиторами, в том числе в отношении смертности в течение 100 дней после аутоТГСК (было зафиксировано 2 случая — 4,6%) [39]. Авторы отмечают более высокую частоту развития синдрома приживления (18,6% случаев), а также 1 летальный исход (1,3% случаев) как следствие фульминантного течения иммуноопос-редованных нежелательных явлений (миокардит и пневмонит) (Рис. 4).
При лечении комбинацией пембролизумаба и GVD синдром приживления развился у 68% пациентов, получивших аутоТГСК [36]. При лечении комбинацией пембролизумабом и ICE сообщалось об одном случае острой дыхательной недостаточности со смертельным исходом, вызванной респираторным дистресс-синдромом на фоне синдрома приживления [35]. В ретроспективном исследовании B. Bai и соавт. частота синдрома приживления после лечения PD-1-ингибиторами достигала 77% [41].
Возникновение иммуноопосредованных нежелательных явлений у пациентов, перенесших ау-тоТГСК после предшествующего лечения иммунотерапией, обусловлено периодом полувыведения PD-1-ингибиторов — 15–25 дней и сохранением системной активности в течение этого периода. Поэтому клиницистам следует обратить особое внимание на определение оптимального интервала между последней дозой PD-1-ингибитора и аутоТГСК и на развитие возможных угрожающих жизни иммуноопосредованных нежелательных явлений.
Заключение
Ингибиторы иммунных контрольных точек стали новой эффективной опцией для лечения р/р кЛХ. Последние исследования демонстрируют их высокую эффективность в качестве «bridge»-терапии к аутологичной трансплантации у пациентов с химиорефрактерно-стью и длительной историей предшествующего противоопухолевого лечения.
Использование иммунотерапии на более ранних этапах лечения р/р кЛХ, например, во второй линии, представляется перспективным. Это обусловлено тем, что традиционный подход, основанный на применении полихимиотерапии, приводит к достижению полных ответов приблизительно только у половины больных. PD-1-ингибиторы продемонстрировали высокую эффективность как в монорежиме, так и в комбинации с классическими химиотерапевтическими режимами во второй линии лечения р/р кЛХ. Применение ингибиторов иммунных контрольных точек в сочетании с полихимиотерапией привело к увеличению эффективности традиционных химиотерапевтических схем. Важным направлением для дальнейших исследований остается определение характеристик пациентов и заболевания, которые позволят выявить, кто из пациентов может быть успешно пролечен только ингибиторами иммунных контрольных точек, а кому потребуется комбинированная химиоиммунотерапия.
Безусловно, для определения оптимальной схемы лечения второй линии при р/р кЛХ необходимо проведение проспективных рандомизированных исследований. В исследование III фазы ECOG-ACRIN 4211 (EA4211) планируется включение более 300 пациентов после неудач индукционного лечения кЛХ и их последующая рандомизация для лечения полихимиотерапией (ICE, GVD или брентуксимаб ведотин + бендамустин) с или без пембро-лизумаба (NCT05711628). Пациентам, достигших полный или частичный ответ по ПЭТ-КТ, будет проведена высо-кодозная консолидация [42].
Для пациентов с р/р кЛХ важным фактором долговременной консолидации достигнутого эффекта остается ВДХТ+аутоТГСК, поэтому может быть рекомендована всем пациентам с достигнутым эффектом (полный ответ или частичный ответ) на терапию PD-1-ингибиторами. В исследовании R.W. Merrymen показано, что ПЭТ-положительный статус перед трансплантацией не ухудшал результаты ВДХТ+аутоТГСК при применении ингибиторов иммунных контрольных точек в качестве бридж-терапии к аутологичной трансплантации.
При выполнении ВДХТ+аутоТГСК после лечения ингибиторами иммунных контрольных точек в монорежиме или в качестве комбинированной химиоиммунотерапии важно помнить о рисках возникновения иммуно-опосредованных нежелательных явлений. Следует обращать особое внимание на соблюдение оптимального интервала между последней дозой PD-1-ингибитора и ау-тоТГСК с целью снижения риска тяжелых иммуноопос-редованных нежелательных явлений.
Список литературы Иммунотерапия ингибиторами контрольных точек перед высокодозной химиотерапией с аутологичной трансплантацией кроветворных стволовых клеток у больных с рецидивами и рефрактерными формами классической лимфомы Ходжкина
- Connors JM. Hodgkin’s Lymphoma: The Hazards of Success. J Clin Oncol. 2003; 21(18): 3388-90. doi: 10.1200/JCO.2003.07.001.
- Engert A, Diehl V, Franklin J, Lohri A, Dörken B, Ludwig WD, et al. Escalated-dose BEACOPP in the treatment of patients with advanced-stage Hodgkin’s lymphoma: 10 years of follow-up of the GHSG HD9 study. J Clin Oncol. 2009; 27(27): 4548-54. doi: 10.1200/JCO.2008.19.8820.
- Radford J, Illidge T, Counsell N, Hancock B, Pettengell R, Johnson P, et al. Results of a Trial of PET-Directed Therapy for Early-Stage Hodgkin’s Lymphoma. N Engl J Med. 2015; 372(17): 1598-607. doi: 10.1056/ NEJMoa1408648.
- Montanari F, Diefenbach C. Relapsed Hodgkin lymphoma: management strategies. Curr Hematol Malig Rep. 2014; 9(3): 284-93. doi: 10.1007/ s11899-014-0220-7.
- Moskowitz AJ, Yahalom J, Kewalramani T, Maragulia JC, Vanak JM, Zelenetz AD, et al. Pretransplantation functional imaging predicts outcome following autologous stem cell transplantation for relapsed and refractory Hodgkin lymphoma. Blood. 2010; 116(23): 4934-7. doi: 10.1182/blood-2010-05-282756.
- Rodriguez J, Rodriguez MA, Fayad L, McLaughlin P, Swan F, Sarris A, et al. ASHAP: A Regimen for Cytoreduction of Refractory or Recurrent Hodgkin’s Disease. Blood. 1999; 93(11): 3632-6. doi: 10.1182/blood.V93.11.3632.
- Aparicio J, Segura A, Garcerá S, Oltra A, Santaballa A, Yuste A, et al. ESHAP is an active regimen for relapsing Hodgkin’s disease. Ann Oncol. 1999; 10(5): 593-5. doi: 10.1023/a:1026454831340.
- Moskowitz CH, Nimer SD, Zelenetz AD, Trippett T, Hedrick EE, Filippa DA, et al. A 2-step comprehensive high-dose chemoradiotherapy second-line program for relapsed and refractory Hodgkin disease: analysis by intent to treat and development of a prognostic model. Blood. 2001; 97(3): 616-23. doi: 10.1182/blood.V97.3.616.
- Josting A, Rudolph C, Reiser M, Mapara M, Sieber M, Kirchner HH, et al. Time-intensified dexamethasone/cisplatin/cytarabine:an effective salvage therapy with low toxicity in patients with relapsed and refractory Hodgkin’s disease. Ann Oncol. 2002; 13(10): 1628-35. doi: 10.1093/annonc/mdf221.
- Baetz T, Belch A, Couban S, Imrie K, Yau J, Myers R, et al. Gemcitabine, dexamethasone and cisplatin is an active andnon-toxic chemotherapy regimen in relapsed or refractory Hodgkin’s disease: a phase II study by the National Cancer Institute of Canada Clinical Trials Group. Ann Oncol. 2003; 14(12): 1762-7. doi: 10.1093/annonc/mdg496.
- Josting A, Müller H, Borchmann P, Baars JW, Metzner B, Döhner H, et al. Dose Intensity of Chemotherapy in Patients With Relapsed Hodgkin’s Lymphoma. J Clin Oncol. 2010; 28(34): 5074-80. doi: 10.1200/JCO. 2010.30.5771.
- Labrador J, Cabrero-Calvo M, Pérez-López E, Mateos MV, Vázquez L, Caballero MD, et al. ESHAP as salvage therapy for relapsed or refractory Hodgkin’s lymphoma. Ann Hematol. 2014; 93(10): 1745-53. doi: 10.1007/s00277-014-2114-0.
- Santoro A, Mazza R, Pulsoni A, Re A, Bonfichi M, Zilioli VR, et al. Bendamustine in Combination With Gemcitabine and Vinorelbine Is an Effective Regimen As Induction Chemotherapy Before Autologous Stem-Cell Transplantation for Relapsed or Refractory Hodgkin Lymphoma: Final Results of a Multicenter Phase II Study. J Clin Oncol. 2016; 34(27): 3293-9. doi: 10.1200/JCO.2016.66.4466.
- Roemer MGM, Advani RH, Ligon AH, Natkunam Y, Redd RA, Homer H, et al. PD-L1 and PD-L2 Genetic Alterations Define Classical Hodgkin Lymphoma and Predict Outcome. J Clin Oncol. 2016; 34(23): 2690-7. doi: 10.1200/JCO.2016.66.4482.
- Meti N, Esfahani K, Johnson N. The Role of Immune Checkpoint Inhibitors in Classical Hodgkin Lymphoma. Cancers. 2018; 10(6): 204. doi: 10.3390/cancers10060204.
- Keir ME, Butte MJ, Freeman GJ, Sharpe AH. PD-1 and Its Ligands in Tolerance and Immunity. Annu Rev Immunol. 2008; 26(1): 677-704. doi: 10.1146/annurev.immunol.26.021607.090331.
- Armand P, Engert A, Younes A, Fanale M, Santoro A, Zinzani PL, et al. Nivolumab for Relapsed/Refractory Classic Hodgkin Lymphoma After Failure of Autologous Hematopoietic Cell Transplantation: Extended Follow-Up of the Multicohort Single-Arm Phase II CheckMate 205 Trial. J Clin Oncol. 2018; 36(14): 1428-39. doi: 10.1200/JCO.2017.76.0793.
- Ansell SM, Lesokhin AM, Borrello I, Halwani A, Scott EC, Gutierrez M, et al. PD-1 Blockade with Nivolumab in Relapsed or Refractory Hodgkin’s Lymphoma. N Engl J Med. 2015; 372(4): 311-9. doi: 10.1056/NEJMoa1411087.
- Chen R, Zinzani PL, Lee HJ, Armand P, Johnson NA, Brice P, et al. Pembrolizumab in relapsed or refractory Hodgkin lymphoma: 2-year follow-up of KEYNOTE-087. Blood. 2019; 134(14): 1144–53. doi: 10.1182/blood. 2019000324.
- Armand P, Zinzani PL, Lee HJ, Johnson NA, Brice P, Radford J, et al. Five-year follow-up of KEYNOTE-087: pembrolizumab monotherapy for relapsed/refractory classical Hodgkin lymphoma. Blood. 2023; 142(10): 878-86. doi: 10.1182/blood.2022019386.
- Ansell SM, Bröckelmann PJ, von Keudell G, Lee HJ, Santoro A, Zinzani PL, et al. Nivolumab for relapsed/refractory classical Hodgkin lymphoma: 5-year survival from the pivotal phase 2 CheckMate 205 study. Blood Adv. 2023; 7(20): 6266-74. doi: 10.1182/bloodadvances.2023010334.
- Carreau NA, Pail O, Armand P, Merryman R, Advani RH, Spinner MA, et al. Checkpoint Blockade Treatment May Sensitize Hodgkin Lymphoma to Subsequent Therapy. The Oncologist. 2020; 25(10): 878-85. doi: 10.1634/theoncologist.2020-0167.
- Calabretta E, Guidetti A, Ricci F, Di Trani M, Monfrini C, Magagnoli M, et al. Chemotherapy after PD- 1 inhibitors in relapsed/refractory Hodgkin lymphoma: Outcomes and clonal evolution dynamics. Br J Haematol. 2022; 198(1): 82-92. doi: 10.1111/bjh.18183.
- Rossi C, Gilhodes J, Maerevoet M, Herbaux C, Morschhauser F, Brice P, et al. Efficacy of chemotherapy or chemo- anti- PD- 1 combination after failed anti- PD- 1 therapy for relapsed and refractory hodgkin lymphoma: A series from lysa centers. Am J Hematol. 2018; 93(8): 1042-9. doi: 10.1002/ajh.25154.
- Casadei B, Argnani L, Morigi A, Lolli G, Broccoli A, Pellegrini C, et al. Effectiveness of chemotherapy after anti- PD- 1 blockade failure for relapsed and refractory Hodgkin lymphoma. Cancer Med. 2020; 9(21): 7830-6. doi: 10.1002/cam4.3262.
- Calabretta E, Guidetti A, Ricci F, Di Trani M, Monfrini C, Magagnoli M, et al. Chemotherapy after PD-1 inhibitors in relapsed/refractory Hodgkin lymphoma: Outcomes and clonal evolution dynamics. Br J Haematol. 2022; 198(1): 82-92. doi: 10.1111/bjh.18183.
- Carreau NA, Pail O, Armand P, Merryman R, Advani RH, Spinner MA, et al. Checkpoint Blockade Treatment May Sensitize Hodgkin Lymphoma to Subsequent Therapy. The Oncologist. 2020; 25(10): 878-85. doi: 10.1634/theoncologist.2020-0167.
- Suzuki E, Kapoor V, Jassar AS, Kaiser LR, Albelda SM. Gemcitabine Selectively Eliminates Splenic Gr-1+/CD11b+ Myeloid Suppressor Cells in Tumor-Bearing Animals and Enhances Antitumor Immune Activity. Clin Cancer Res. 2005; 11(18): 6713-21. doi: 10.1158/1078-0432.CCR-05-0883.
- Ghiringhelli F, Larmonier N, Schmitt E, Parcellier A, Cathelin D, Garrido C, et al. CD4+CD25+ regulatory T cells suppress tumor immunity but are sensitive to cyclophosphamide which allows immunotherapy of established tumors to be curative. Eur J Immunol. 2004; 34(2): 336-44. doi: 10.1002/eji.200324181.
- Chen G, Emens LA. Chemoimmunotherapy: reengineering tumor immunity. Cancer Immunol Immunother. 2013; 62(2): 203-16. doi: 10.1007/ s00262-012-1388-0.
- Ramakrishnan R, Gabrilovich DI. Novel mechanism of synergistic effects of conventional chemotherapy and immune therapy of cancer. Cancer Immunol Immunother. 2013; 62(3): 405-10. doi: 10.1007/s00262-012-1390-6.
- Merryman RW, Redd RA, Nishihori T, Chavez J, Nieto Y, Darrah JM, et al. Autologous stem cell transplantation after anti-PD-1 therapy for multiply relapsed or refractory Hodgkin lymphoma. Blood Adv. 2021; 5(6): 1648-59. doi: 10.1182/bloodadvances.2020003556.
- Mei MG, Lee HJ, Palmer JM, Chen R, Tsai NC, Chen L, et al. Response-adapted anti-PD-1–based salvage therapy for Hodgkin lymphoma with nivolumab alone or in combination with ICE. Blood. 2022; 139(25): 3605-16. doi: 10.1182/blood.2022015423.
- Мамедова А.А, Мочкин Н.Е, Саржевский В.О, Демина Е.А, Богатырев В.С, Спорник А.А. и соавт. Комбинированная иммунохимиотерапия у больных рефрактерной/рецидивирующей классической лимфомой Ходжкина как лечение 2-й линии перед аутологичной трансплантацией кроветворных стволовых клеток (предварительные результаты) // Онкогематология. — 2022. — №17(3). — С.91-97. doi: 10.17650/1818-8346-2022-17-3-40-47.
- Bryan LJ, Casulo C, Allen PB, Smith SE, Savas H, Dillehay GL, et al. Pembrolizumab Added to Ifosfamide, Carboplatin, and Etoposide Chemotherapy for Relapsed or Refractory Classic Hodgkin Lymphoma: A Multi-institutional Phase 2 Investigator-Initiated Nonrandomized Clinical Trial. JAMA Oncol. 2023; 9(5): 683-91. doi: 10.1001/jamaoncol.2022.7975.
- Moskowitz AJ, Shah G, Schöder H, Ganesan N, Drill E, Hancock H, et al. Phase II Trial of Pembrolizumab Plus Gemcitabine, Vinorelbine, and Liposomal Doxorubicin as Second-Line Therapy for Relapsed or Refractory Classical Hodgkin Lymphoma. J Clin Oncol. 2021; 39(28): 3109-17. doi: 10.1200/JCO.21.01056.
- Мангасарова Я.К., Моисеева Т.Н., Марголин О.В., Горенкова Л.Г. и др. Nivo-BeGEV как подготовка к трансплантации аутологичных гемопоэтических стволовых клеток при рецидивах и рефрактерном течении классической лимфомы Ходжкина: результаты многоцентрового проспективного клинического исследования // Клиническая Онкогематология. — 2023. — №16(3). — С.280-286. doi: 10.21320/2500-2139-2023-16-3-280-286.
- Саржевский В.О., Мамедова А.А., Мочкин Н.Е., Демина Е.А. и др. Комбинация Nivo-DHAP с последующей высокодозной химиотерапией и трансплантацией аутологичных гемопоэтических стволовых клеток у пациентов с рецидивами и рефрактерным течением классической лимфомы Ходжкина: результаты многоцентрового проспективного клинического исследования (ClinicalTrials.gov, NCT04091490) // Клиническая Онкогематология. — 2024. — №17(1). — С.1-10. doi: 10.21320/2500-2139-2024-17-1-1-10.
- Mochkin N, Sarzhevskiy V, Protopopova Y, Demina E, et al. P1091: Feasibility of ASCT after ANTI-PD-1 therapy for R/R classical Hodgkin lymphoma. HemaSphere [Internet]. 2022; 6. [URL].
- Park JJ, Lin J, Huang E, Schaar DG. The Impact of Prior Salvage Treatment With Immune Checkpoint Inhibitors on Hodgkin Lymphoma Patients Undergoing Autologous Hematopoietic Stem Cell Transplantation: A Single-Center Experience. Clin Lymphoma Myeloma Leuk. 2021; 21(9): e726-30. doi: 10.1016/j.clml.2021.05.006.
- Bai B, Wang XX, Gao Y, Li PF, He HX, Ping LQ, et al. Prior anti-PD-1 therapy as a risk factor for life-threatening peri-engraftment respiratory distress syndrome in patients undergoing autologous stem cell transplantation. Bone Marrow Transplant. 2021; 56(5): 1151-8. doi: 10.1038/ s41409-020-01164-y.
- Samara Y, Mei M. Autologous Stem Cell Transplantation in Hodgkin Lymphoma—Latest Advances in the Era of Novel Therapies. Cancers. 2022; 14(7): 1738. doi: 10.3390/cancers14071738.


