Иммунотерапия в комплексном лечении опухолевых заболеваний
Автор: Селедцов В.И., Селедцова Г.В., Доржиева А.Б., Иванова И.П.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 2 т.21, 2022 года.
Бесплатный доступ
Цель исследования - проанализировать базу научной литературы с целью выявления и анализа возможностей противоопухолевой иммунотерапии, направленной на усиление способности иммунной системы противостоять развитию опухоли и(или) ослабление способности опухоли поддерживать свой рост. Материал и методы. Проведен поиск доступных литературных источников, опубликованных в базе данных Medline, Pubmed и др. Было найдено 215 источников, посвященных изучению формирования противоопухолевых механизмов и возможности их модуляции, из которых 57 были включены в данный обзор. Результаты. Обзор посвящен анализу литературы по супрессии опухолевого роста путем модуляции воспаления, коррекции концентрации факторов и ферментов, ингибирования формирования иммуносупрессорных клеток, усиления антительной цитотоксичности, стимуляции клеточной цитотоксичности. Оценены возможности противоопухолевой вакцинации. Заключение. Установлено, что разные иммунотерапевтические агенты могут усиливать противоопухолевое действие друг друга. На ранних стадиях болезни иммунотерапия может элиминировать опухолевые клетки, оставшиеся в организме после хирургического удаления первичной опухоли. На поздних стадиях заболевания комбинированное лечение, включающее в себя традиционное циторедуктивное и иммунотерапевтическое лечение, должно быть направлено на остановку или торможение развития болезни. Прогноз течения заболевания можно оценивать по воспалительной шкале, основанной на определении 3 параметров крови: содержания С-реактивного белка, лактат-дегидрогеназы и нейтрофил-лимфоцитарного соотношения.
Опухоль, воспаление, противоопухолевая иммунотерапия, радиохимиотерапия, прогноз заболевания
Короткий адрес: https://sciup.org/140293892
IDR: 140293892 | УДК: 616-006-08:615.37:612.017
Текст научной статьи Иммунотерапия в комплексном лечении опухолевых заболеваний
Внутриклеточные биохимические и сигнальные процессы в опухолевых и нормальных клетках сходные. Поэтому разработка химиопрепаратов с селективным противоопухолевым действием представляется весьма проблематичной. Вместе с тем, опухолевые клетки отличаются от нормальных клеток по экспрессии иммуногенных молекул маркеров (антигенов). Точно установлено, что иммунная система способна распознавать эти антигены и контролировать развитие опухоли. В зависимости от воспалительной активности опухоль можно рассматривать как «холодную», «теплую», «горячую» или «перегретую» (рис. 1). «Холодная» опухоль характеризуется слабой иммуногенностью и низкой инфильтрацией иммунными клетками. В этом случае иммунная система как бы «не видит» опухоль. В строме «теплой» опухоли обнаруживается большое количество иммунных клеток, которые, однако, не проникают в опухолевую массу. Миграционная и функциональная активность иммунных клеток в окружении «теплой» опухоли эффективно контролируется локальными иммуносупрессорными механизмами. В «горячей» опухоли имеет место активное проникновение иммунных клеток в толщу опухоли. «Горячая»
опухоль характеризуется высокой экспрессией иммуностимулирующих и костимулирующих молекул; наличием активированных иммунных клеток с высокой цитостатической и цитолитической активностью и повышенной транскрипцией интерфероновых генов [1]. Конверсия «холодной» или «теплой» опухоли в «горячую» указывает на развитие противоопухолевых иммунных реакций, способных контролировать опухолевый рост. Вместе с тем, опухоль способна активно защищать себя от иммунного отторжения посредством генерации избыточного воспаления, которое оказывает негативное влияние на противоопухолевый иммуногенез. «Перегревание» опухоли обычно развивается на поздних стадиях заболевания за счет высвобождения из поврежденных опухолевых и нормальных клеток иммуноактивных молекул (DAMPs, damage-associated molecular pattern molecules), взаимодействие которых со своими рецепторами (PAMPs, pathogen-associated molecular patterns) стимулирует асептическое воспаление, усиливающее регенеративные процессы. Цель иммунотерапии заключается в снижении негативного влияния опухоли на иммунитет и усилении эффективности иммунологического контроля над опухолевым ростом.
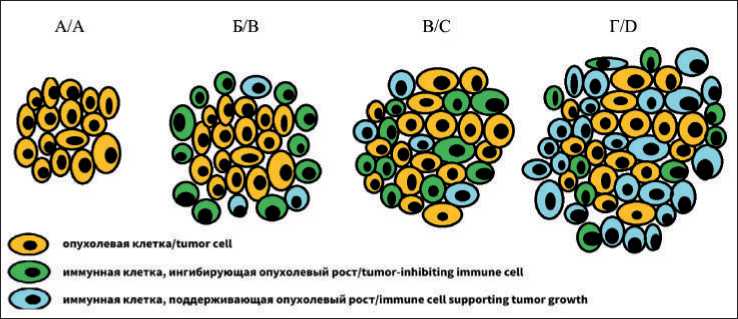
Рис. 1. Уровни опухолевого воспаления. «Холодная» (а), «теплая» (б), «горячая» (в) и «перегретая» опухоль (г).
(Пояснения в тексте)
Fig. 1. Types of cancer from the immunological and immunotherapeutic perspective.
Tumors (yellow cells) are considered as immunologically cold (a), warm (b) or hot (c), and overheated (d) based on immune cell (green cells) infiltration. The description is in the text
Иммунологическая регуляция опухолевого роста
Дендритные клетки являются профессиональными антиген-презентирующими клетками, которые запускают первичные иммунные реакции и поддерживают вторичные иммунные процессы. Эти клетки процессируют эндогенные и экзогенные антигены (АГ) до небольших пептидов и презентируют их в комплексе с продуктами главного комплекса гистосовместимости (ГКГ) I или II класса антиген-специфичным Т-лимфоцитам. Дендритные клетки синтезируют полный набор растворимых и мембранных костимуляторных молекул, необходимых для дифференцировки нативных Т-лимфоцитов в эффекторные Т-клетки и Т-клетки памяти [2]. По сравнению с нативными Т-клетками клетки памяти более чувствительны к антигенной стимуляции и менее зависимы от влияния костимуляторных сигналов [3, 4], поэтому они могут быть активированы не только дендритными клетками, но и другими АГ-презентирующими клетками, такими как В-лимфоциты, макрофаги и гранулоциты. Активированные Т-клетки привлекают в опухолевое микроокружение другие иммунные клетки, которые способны контролировать опухолевый рост посредством как АГ-зависимых, так и АГ-независимых механизмов [5]. Роль дирижеров иммунных процессов, регулирующих опухолевый рост, выполняют СD4+ T-хелперные лимфоциты: Th1, Th2, Th17 и др. Th1 продуцируют интерферон-гамма (ИФ-ɣ) и другие цитокины, необходимые для классической активации N1-нейтрофилов и M1-макрофагов и генерации CD8+ цитотоксических лимфоцитов
(ЦТЛ), а также для усиления цитотоксической активности натуральных НK-клеток, натуральных киллерных Т-клеток (НKT) и Тγδ-клеток. НK-клетки экспрессируют активационные и ингибиторные рецепторы, вовлекаемые в распознавание стресс-лигандов опухолевых клеток. НKT-клетка экспрессирует как рецептор НK-клеток, так и инвариантный CD1d-рестриктированный T-клеточный рецептор. Тγδ-клетки несут на своей поверхности полиинвариантные γ/δ Т-клеточные рецепторы, которые распознают опухолевые фосфоантигены и стресс-лиганды [6, 7]. В отличие от Th1-клеток, Th2-клетки продуцируют интерлейкин 4 (ИЛ-4) и другие цитокины, необходимые для альтернативной активации N2-нейтрофилов и М2-макрофагов, а также для генерации регуляторных Т-клеток (Tрег) и миелоидных супрессорных клеток (MСК), обладающих выраженной иммуносупрессорной активностью. Важно, что активированные Th1- и Th2-лимфоциты могут непосредственно и опосредованно супрессировать функциональную активность друг друга и, таким образом, поддерживать поляризацию адаптивной иммунной реактивности [8]. Роль в противоопухолевом иммунитете Th17-клеток, секретирующих ИЛ-17, пока остается до конца не выясненной [9]. Функциональная активность B-лимфоцитов в иммунологических механизмах, регулирующих опухолевый рост, может быть разнонаправленной. В качестве антиген-презентирующих клеток они играют ключевую роль в поддержании адаптивного иммуногенеза [10]. Плазматические клетки, секретирующие цитотоксические антитела (АТ), – важный элемент противоопухолевой иммунной
Таблица 1/table 1
Клетки иммунной системы и растворимые факторы, вовлекаемые в иммунную регуляцию опухолевого роста cells of the immune system and soluble factors involved in the immune regulation of tumor growth
Ингибиция опухолевого роста/Tumor growth inhibition
Усиление опухолевого роста/Increased tumor growth
Клетки/Cells
N1-нейтрофилы, M1-макрофаги, НK-клетки, НKT-клетки, Тγδ-клетки, классические зрелые дендритные клетки, ЦТЛ, Th1, Th17, В-клетки/
N1-neutrophils, M1-macrophages, NK cells, NKT cells, Tγδ – cells, classical mature dendritic cells, CTL, Th1, Th17, B cells
N2-нейтрофилы, M2-макрофаги, МСК, незрелые толерогенные дендритные клетки, Th2, Th17, регуляторные Т- и В-клетки/
N2 neutrophils, M2 macrophages, MSCs, immature tolerogenic dendritic cells, Th2, Th17, regulatory T and B cells
Растворимые факторы/Soluble Factors
Активные формы кислорода (АФК), протеазы, фосфолипазы, фактор некроза опухоли (ФНО), ИФ-ɣ, ИФ 1-го типа, ИЛ-2, ИЛ-7, ИЛ-15, ИЛ-18, гранулоцит-макрофагальный колониестимулирующий фактор (ГМ-КСФ) внеклеточный аденозин-трифосфат (АТФ)/
Reactive oxygen species (ROS), proteases, phospholipases, tumor necrosis factor (TNF), IF-ɣ, type 1 IF, IL-2, IL-7, IL-15, IL-18, granulocyte-macrophage colony-stimulating factor (GM-CSF) extracellular adenosine triphosphate (ATP)
АФК, протеазы, фосфолипазы, ФНО, ТГФ-бета, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, эндотелиальный ростовой фактор (ЭРФ), простагландин Е (ПГЕ), гистамин, гранулоцитарный колониестимулирующий фактор(Г-КСФ), ГМ-КСФ, аденозин (АД)/ ROS, proteases, phospholipases, TNF, THF-beta, IL-2, IL-4, IL-6, IL-10, endothelial growth factor (ERF), prostaglandin E (PGE), histamine, granulocyte colony-stimulating factor (G -CSF), GM-CSF, adenosine (AD)
Примечание: дальнейшие исследования, несомненно, будут вносить изменения и дополнения в иммунные механизмы регуляции опухолевого роста.
Note: further research will undoubtedly introduce changes and additions to the immune mechanisms of tumor growth regulation.
защиты. Но, с другой стороны, регуляторные В-лимфоциты способны ингибировать иммунные, в т. ч. и противоопухолевые, реакции, продуцируя иммуносупрессорные цитокины, такие как трансформирующий ростовой фактор-бета (ТРФ-бета) и ИЛ-10. В табл. 1 представлены элементы разнонаправленной иммунной регуляции опухолевого роста.
Как можно заметить, некоторые виды клеток, например нейтрофилы и макрофаги, могут быть вовлечены как в негативную, так и в позитивную регуляцию опухолевого роста. Это же можно утверждать и в отношении растворимых факторов. В частности, реактивные формы кислорода (АФК) опосредуют цитотоксическую активность гранулоцитов и макрофагов, но, с другой стороны, АФК ингибируют адаптивную Т-клеточную реактивность [11]. Еще пример – фосфолипазы, которые могут участвовать в разрушении опухолевой клетки, а также вносить определенный вклад в разрушение внутритканевых барьеров, тем самым способствуют опухолевой инвазии. ИФ-ɣ также может играть двоякую ключевую роль как в генерации, так и в поддержании противоопухолевой иммунореактивности. Вместе с тем, он способен усиливать в опухолевом микроокружении мембранную экспрессию иммуносупрессорных контрольных молекул и стимулировать иммуносупрессорную активность индоламин 2, 3,-диоксигеназы-1 (IDO-1) [12–14], регулируя иммунореактивность по механизму обратной связи. В этой связи заслуживает упоминания ИЛ-2, который является основным ростовым и костимуляторным фактором для Т-клеток, включая Th1 и ЦТЛ, и одновременно ключевым индуктором иммуносупрессорных Трег.
Противоопухолевый иммунный механизм чрезвычайно уязвим к действию повреждающих факторов. Дефект даже одного элемента этого механизма может самым неблагоприятным образом сказаться на эффективности всей работы. Так, иммунные элементы, поддерживающие опухолевый рост, являются одновременно составными частями врожденного регенеративного механизма, ответственного за целостность организма. Элементы этого механизма многократно дублируют друг друга, и поломка одного или нескольких из них обычно не оказывает серьезного влияния на его работу. Как замечено ранее, воспаление, с одной стороны, стимулирует приток иммунных клеток в опухолевое микроокружение и играет важную роль в обеспечении иммунологического контроля над ростом опухоли, что указывает на благоприятный прогноз течения заболевания. С другой стороны, на поздних стадиях опухоль через усиление воспаления стимулирует активность иммуносупрессорных механизмов. Поэтому противоспалительная терапия должна быть включена в схему лечения любого опухолевого заболевания, особенно при распространенном процессе. Действительно, на разных экспериментальных моделях показано, что препараты с противовоспалительной активностью, такие как нестероидные противовоспалительные средства, блокаторы Н2-рецепторов, ингибиторы фосфодиэстеразы 5, статины, β-адреноблокаторы, холиномиметики и глюкокортикоиды, способны тормозить развитие опухоли и препятствовать метастазированию [1].
Ингибирование иммуносупрессорных механизмов
При физиологических условиях контрольные молекулы обеспечивают обратную связь между уровнем воспаления и иммунологической реактивностью, предотвращая развитие аутоиммунных реакций. Посредством как конститутивной, так и индуцированной в результате воспаления экспрессии этих молекул опухоль может подавлять развитие противоопухолевых иммунных реакций и, таким образом, избегать иммунологического отторжения. Противоопухолевые стратегии, основанные на функциональном ингибировании молекул Programmed Death (PD-1) и Сytotoxic T-lymphocyte-associated protein-4 (CTLA-4), получили широкое применение. Иммунотерапевтические возможности ингибирования других контрольных молекул, таких как T-cell immunoglobulin-3 (TIM-3), lymphocyte activation gene 3 ( LAG-3), V-domain Ig suppressor of T-cell activation (VISTA) и tyrosinebased inhibitory motif domain (TIGIT), активно исследуются.
IDO-1 – иммуносупрессивный фермент, который высоко экспрессируется в микроокружение многих опухолей. Ингибиторы IDO-1 (1- Methyl-tryptophan и INCB024360) в настоящее время позиционируются как противоопухолевые иммунотерапевтические средства. Показано, что ингибиторы IDO-1 способны вызывать супрессию опухолевого роста у мышей дикого типа, но не у иммунодефицитных животных и что блокировка активности IDO-1 может индуцировать апоптоз опухолевых клеток [15].
На экспериментальных моделях показано, что истощение регуляторных Трег посредством использования анти-CD25 АT или конъюгата ИЛ-2 с дифтерийным токсином может усилить развитие противоопухолевых иммунных реакций [16, 17]. Трег высоко экспрессируют контрольные молекулы, включая CTLA-4 и PD-1 [18]. Поэтому эти клетки являются важными мишенями для терапевтических АT, блокирующих активность контрольных молекул. Анти PD-1 АT (Nivolumab) способны снижать иммуносупрессивную активность Трег [19]. Аналогичный эффект обнаружен у агониста TLR7/8 (Resiquimod) [20]. Активно разрабатываются стратегии трансформации Трег в клетки, продуцирующие ИФ-гамма.
Миелоидные супрессорные клетки (МСК) – еще одна мишень для противоопухолевой иммунотерапии. Показано, что ретиноевая кислота (ATRA, all-trans-retinoic acid) способна индуцировать дифференцировку МСК в зрелые макрофаги и дендритные клетки. Иммуносупрессорная активность МСК может быть снижена под действием синтетического производного олеаноловой кислоты (2-cyano-3,12-dioxooleana-1,9(11)-dien-28-oic acid, CDDO-IM) или ее метилового эфира, через активацию Nrf2 гена. [21]. Существует целый ряд фармакологических агентов: ингибиторы PDE5, ингибиторы COX-2, ингибиторы аргиназы 1 (ARG1), бифосфонаты, Entinostat, Gemcitabine, Paclitaxel, которые в преклинических исследованиях показали способность ингибировать функциональную активность МСК [22].
Частым серьезным побочным эффектом снижения функциональной эффективности иммуносупрессорных механизмов является развитие аутоиммунных воспалительных реакций. Достижение компромисса между продвижением противоопухолевых иммунных процессов и сдерживанием патологических аутоиммунных реакций является основной целью всех иммунотерапевтических стратегий, основанных на ослаблении природных иммуносупрессорных механизмов.
Усиление противоопухолевых иммунных механизмов
Современные биоинженерные технологии позволяют получать гуманизированные низкоиммуногенные цитотоксические IgG-АТ любой специфичности. В настоящее время антительные препараты, такие как Rituximab, Trastuzumab, Cetuximab, Panitumumab и др., нашли широкое применение в онкологической практике [23]. Связываясь с АГ, АТ индуцируют опосредуемую Fc-рецепторами иммунную цитотоксичность. Моноклональные АТ могут быть конъюгированы с химио- или радиопрепаратом. В этом случае АТ осуществляют прицельную доставку цитотоксического агента к опухолевой клетке. Однако следует иметь в виду, что большинство опухолеассоциированных АГ экспрессируются не только опухолевыми, но и нормальными клетками. Недавно мы предложили новую теоретическую концепцию одновременного применения в субоптимальных концентрациях нескольких АТ разной антигенной специфичности для достижения пороговой цитотоксической концентрации иммунных комплексов на опухолевых, но не на нормальных клетках [24]. На наш взгляд, такой подход позволит расширить возможность использования цитотоксических АТ в лечении разных опухолей, включая те, которые, строго говоря, не экспрессируют опухолеспецифичные АГ.
В качестве противоопухолевой вакцины могут быть использованы антигенные протеины/ пептиды, аутологичные или аллогенные клетки опухоли (или их лизаты), а также нагруженные опухолеассоциированные антигены (ОАГ)
дендритные клетки (пример Sipuleucel-T) [25]. Активно разрабатываются РНК и ДНК-вакцины на основе генномодифицированных структур, кодирующих ОАГ [26]. Однако иммунизация одним или несколькими вакцинальными АГ может создать условия для селективного ускоренного роста опухолевых клонов, не экспрессирующих вакцинальных АГ. Следовательно, противоопухолевая вакцина должна быть полиантигенной для того, чтобы индуцировать широкий поликлональный иммунный ответ, способный подавить рост если не всех, то большинства опухолевых клеток. Следует также иметь в виду, что дифференцировочные ОАГ низкоиммуногенны, поскольку к ним исходно сформирована иммунологическая толерантность. Противоопухолевая вакцинотерапия должна быть нацелена на прерывание этой толерантности. Поэтому гомологичные клеточные и пептидные вакцины обычно комбинируют с иммуностимулирующими адъювантами (например, БЦЖ). Наиболее эффективными в прерывании иммунной толерантности являются, на наш взгляд, вакцины, содержащие ксеногенные дифференцировочные антигены. Небольшие структурные отличия ксеногенных антигенов от их человеческих аналогов делают их высокоиммуногенными для человека и способными индуцировать противоопухолевые иммунные реакции в отсутствие иммуноадъювантов [26, 27].
Среди дифференцировочных ОАГ тестикулярные (cancer/testis) антигены представляют наибольший интерес в качестве потенциальных вакцинальных антигенов. Продукты тестикулярных генов непосредственно вовлечены в разные этапы туморогенеза и являются обязательным элементом опухолевого фенотипа. Высокая экспрессия тестикулярных генов выявлена почти во всех типах опухолей, тогда как в нормальных тканях эти гены не экспрессируются или экспрессируются очень слабо (исключение клетки яичка и плаценты) [28].
Как известно, иммунная система распознает общие патоген-ассоциированные структуры (PAMPs, pathogen-associated molecular pattern), экспрессированные на разных микроорганизмах, посредством патоген-распознающих рецепторов (pattern recognition receptors, PRRs). PRRs включают в себя ТЛР-подобные (Toll-like), НОД-подобные (NOD-like) рецепторы, а также RLRs (retinoic acid inducible gene 1-like receptors). Показано, что лиганды PRRs способны усиливать как врожденные, так и адаптивные противоопухолевые иммунные реакции. В частности, стимуляция внутриклеточных ТЛР 3, 7, 8 или 9 индуцирует секрецию ИФ-α, ИЛ-6, ИЛ-8, ИЛ-12 и ФНО-α дендритными клетками и макрофагами и стимулирует Th1-опосредуемые иммунные ответы [29, 30].
В позитивную регуляцию противоопухолевых иммунных реакций могут быть также вовлечены агонисты Т-клеточной активации. К этой группе молекул, в частности, относятся члены рецепторного семейства фактора некроза опухоли (tumour necrosis factor receptor superfamily, TNFRSF) [31]. Стимуляция специфическими АТ этих молекул обеспечивает многокомпонентную активацию иммунной системы, которая реализует вовлечение в противоопухолевый процесс как врожденных, так и адаптивных иммунных реакций. Другой агонист Т-клеточной активации, индуцибельный Т-клеточный стимулятор (inducible T-cell co-stim-ulator, ICOS), экспрессируется преимущественно на активированных CD4+ клетках. Cвязывание его со своим лигандом (ICOSL) способствует развитию противоопухолевых Т-клеточных реакций [31]. Экспрессия трансмембранного фосфогликопротеина CD27 также практически ограничена иммунными клетками. При связывании CD27 с его естественным лигандом СD70 происходит усиление пролиферации Т-клеток и их дифференцировки в эффекторные клетки и клетки памяти. Антительный препарат Varlilumab (агонист CD27) продемонстрировал многообещающие эффекты в лечении гематологических и солидных опухолей [32].
Определенную нишу в лечении опухолевых заболеваний заняли цитокины. Интерфероны (ИФ) I и II типа играют индуктивную роль в противоопухолевой поляризации нейтрофилов и макрофагов, а также усиливают цитотоксическую активность НК клеток. ИФ способствуют развитию адаптивных иммунных ответов, опосредуемых Th1-клетками. Использование цитокинов позволяет ставить разные задачи, решение которых может повышать эффективность противоопухолевого иммунитета. Так, ГМ-КСФ может быть использован для стимуляции дифференцировки дендритных клеток, ИЛ-12/ИЛ-18 – для Th1 поляризации иммунных реакций, комплекс ИЛ-2, ИЛ-7, ИЛ-12,ИЛ-15 и ИЛ-21 – для экспансии АГ-активированных лимфоцитов [1]. В настоящее время цитокины применяются при лечении меланомы, рака почки и некоторых других опухолей.
Определенные надежды в лечении опухолевых заболеваний возлагаются на онколитические вирусы (ОВ). Долгое время прямой цитотоксический механизм считался основным в терапевтическом действии этих вирусов. Однако в настоящее время иммунологическим механизмам, включающим в себя иммуногенную клеточную смерть, иммуногенный апоптоз, некроз/некробиоз, пироптоз и аутофагию, отдают приоритетную роль в противоопухолевом действии ОВ [33]. Первый OB Т-VEC одобрен FDA для лечения метастатической меланомы в 2015 г. Т-VEC – генетически модифицированный вирус семейства герпеса I типа, экспрессирующий ГМ-КСФ [34]. Терапия, основанная на использовании разных ОВ, демонстрирует обнадеживающие результаты в лечении ряда опухолей: Pexa-Vec для рака печени, CG0070 для рака мочевого пузыря, G471 для глиобластомы и рака простаты. Несмотря на определенный успех, клиническое применение ОВ ограничено формированием иммунного ответа к ОВ, который делает малоэффективным их повторное использование [35].
Известно, что экзовезикулы (ЕВ), секретируемые активированными иммунокомпетентными клетками, могут воспроизводить функциональные эффекты этих клеток. Так, EВ, полученные из АГ-презентирующих М1 (но не М-2) макрофагов, способны индуцировать сильный антиген-специфичный Т-клеточный ответ [36]. ЕВ из НК-клеток обладают цитотоксической активностью против клеток различных человеческих опухолевых линий [37], EВ из активированных CD8+ клеток могут оказывать цитотоксический эффект на мезенхимальные стромальные опухолевые клетки [38]. Мы предполагаем, что EВ, полученные из клеток иммунной системы, могут, по крайней мере частично, заменить эти клетки при проведении адоптивной терапии уже в ближайшем будущем.
В обычном состоянии опухолевые клетки превращают 60–80% глюкозы в лактат, при гипоксии – до 90 %. Секретируемый опухолевыми клетками лактат, наряду с воспалением, формирует в опухолевом микроокружении ацидоз, который самым негативным образом воздействует на функциональную активность клеточного иммунитета. Для снижения ацидоза рационально включать в лечение онкологических пациентов подщелачивающие буферные реагенты, такие, например, как бикарбонат натрия или калия, а также рекомендовать им щелочное питание [39].
Аминокислоты L-цистеин, L-аргинин и L-триптофан необходимы для Т-клеточной активации и пролиферации. Опухолевое микроокружение, как правило, характеризуется дефицитом содержания этих аминокислот. Восполнение этого дефицита должно быть важным элементом иммунотерапевтического лечения [21].
Онкологические пациенты часто принимают витамины для снижения риска рецидива заболевания и поддержания качества жизни. В экспериментальных моделях показана противоопухолевая активность у витаминов A, C, D и E [40]. Их противоопухолевые свойства, возможно, объясняются наличием антиоксидантной активности и умеренной противовоспалительной активности. В дополнение к витаминам для усиления иммунитета часто используются минеральные добавки, включающие селен и цинк. Однако их клиническая эффективность пока не доказана. По нашему мнению, микроэлементы, как и витамины, могут быть эффективными не столько сами по себе, сколько из-за их способности усиливать действие других иммунотерапевтических препаратов. В свете этого мы рекомендуем любую схему иммунотерапевтического лечения дополнять приемом подщелачивающих агентов, незаменимых аминокислот, витаминов и микроэлементов. Такая метаболическая поддержка призвана оказывать благотворное влияние не только на иммунитет, но и на другие органы и ткани организма, повышая общую сопротивляемость организма.
Нейрогормональные механизмы играют важную роль в регуляции иммуногенеза. С возрастом их эффективность падает. В частности, возрастное снижение уровня циркулирующего мелатонина совпадает с возрастным снижением противоинфек-ционной иммунной защиты. Показана способность мелатонина стимулировать иммунные реакции, опосредуемые Th1-клетками. Антиоксидантные и иммуностимулирующие эффекты мелатонина являются обоснованием его применения в качестве «заместительной терапии» у онкологических больных [6].
Тимус – основное место формирования Т-клеток. С возрастом его способность генерировать Т-клетки неуклонно падает. Поэтому в лечении пожилых пациентов представляется целесообразным использовать тимические пептиды для того, чтобы частично компенсировать снижение тимусной активности. Показано, что натуральный тимический пептид тимозина α1 (Tα1) способен усиливать противоопухолевую активность не только Т-клеток, но и макрофагов [41]. Теоретически по сравнению с одним пептидом комплекс разных тимических пептидов должен быть более эффективным в поддержании иммунной реактивности. В эксперименте показано, что препарат ТИМАЛИН, представляющий собой смесь низкомолекулярных тимусных пептидов, обладает способностью ингибировать опухолевый рост в более низких дозах, чем рекомендуемые в инструкции [42]. Блокирование половых гормонов может приводить к «омоложению» тимуса, увеличению экспорта из тимуса наивных Т-клеток и снижению прививаемости опухолей у старых мышей. Эти данные указывают на возможность использования антигормональ-ной терапии в качестве иммунотерапевтического средства. У пожилых пациентов часто понижен уровень тиреоидных гормонов, вовлеченных в позитивную регуляцию как врожденных, так и адаптивных иммунных реакций [43]. Включение в лечение таких пациентов тиреоидных гормонов заслуживает тщательного рассмотрения.
Многочисленные данные указывают на важность в иммунорегуляции нейроэндокринных гормонов, таких как пролактин, гормон роста и инсулин-подобный ростовой фактор-1 [44]. К сожалению, влияние этих гормонов на противоопухолевые иммунные реакции и возможность их использования в иммунотерапии остаются пока малоисследованными.
Микробиота кишечника участвует не только в патогенезе желудочно-кишечных заболеваний, но также играет значимую роль в канцерогенезе [45]. У мышей, получавших Bifidobacterium, обнаружено торможение опухолевого роста, ассоциированное с проникновением CD8 + Т-клеток внутрь опухоли. Такие пробиотики, как Lactobacillus rhamnosus GG, Bifidobacterium longum, Enterococcus faecium и Collinsella aerofaciens, могут способствовать нормализации иммунных процессов у пациентов. Модуляция микробиоты кишечника с помощью трансплантации фекальных микробов может повышать чувствительность к иммунотерапии (ИТ), тогда как антибиотикотерапия, по-видимому, снижает эффективность ИТ [46].
Адоптивная клеточная иммунотерапия позволяет в течение относительно короткого времени мобилизовать разные типы иммунных клеток на борьбу с опухолью. Эта технология включает в себя получение иммунных клеток из крови или опухолевого микроокружения, их in vitro активацию и размножение с последующим их возвратом пациенту. Следует, однако, заметить, что размножение клеток в искусственных условиях в присутствии высоких концентраций ростовых факторов может приводить к культуральной селекции клеток, не приспособленных к выживанию и функционированию в условиях in vivo . Имея это в виду, мы разработали технологию адоптивной лейкоцитарной иммунотерапии, которая включает в себя кратковременную инкубацию (до 18 ч) лейкоцитов крови ex vivo с активирующими стимулами с последующим возвратом активированных лейкоцитов пациенту. Разработанная технология не использует наращивание клеток вне организма. Ее назначение – одновременная стимуляция всех типов иммунных клеток, обладающих противоопухолевым потенциалом.
Комбинированная иммунотерапия
Опухоли характеризуются генетической лабильностью: различные опухолевые клоны могут отличаться по мембранной экспрессии иммуногенных и иммунорегуляторных молекул, а также по способности мигрировать и образовывать метастатические очаги. Эффективное противодействие опухолевой экспансии требует от иммунной системы слаженной работы всех ее элементов. Поэтому эффективная ИТ должна строиться на комплексе воздействий, затрагивающих разные элементы противоопухолевой защиты. Комбинация различных иммунотерапевтических подходов оказалась более эффективной и обеспечивала более высокую общую выживаемость по сравнению с монотерапией при различных опухолях [47, 48]. Комплексная ИТ может одновременно включать воздействия, направленные на ингибирование иммуносупрессорных механизмов и усиление противоопухолевой иммунореактивности. Определение оптимального баланса между разными иммунотерапевтическими воздействиями позволяет получать максимальный противоопухолевый эффект как на ранних, так и на поздних стадиях заболевания. По сравнению с монотерапией комбинированная ИТ может строиться на использовании гораздо более низких доз провоспалительных иммуномодуляторов и поэтому может ассоциироваться со сниженным риском развития тяжелых иммуноопосредованных расстройств.
Комбинирование противоопухолевой иммунотерапии с традиционными методами лечения
Хирургическое удаление первичной опухоли является радикальным методом лечения, особенно на ранних стадиях опухолевого процесса. Следует иметь в виду, что появление опухоли указывает на сбой в работе противоопухолевого иммунитета. Кроме того, хирургическое вмешательство приводит к возникновению временной иммуносупрессии, которая может спровоцировать развитие рецидива заболевания. Отсюда имеются четкие показания к проведению ИТ в предоперационном и/или в послеоперационном периоде. Эта терапия должна стимулировать иммунную систему к распознаванию и уничтожению опухолевых клеток, оставшихся после удаления первичного очага. Для этого могут быть использованы стимуляция опухолеспецифической иммунной реактивности, а также воздействия, направленные на нейрогормональную иммунореабилитацию и коррекцию возрастных иммунологических отклонений. Для усиления иммунных процессов в зоне оперативного вмешательства может применяться локальная термотерапия. Показано, что умеренная гипертермия (39–41 °С) способна усиливать клеточную иммунореактивность, в т. ч. и противоопухолевую [49].
Химиотерапия (ХТ) приводит к избирательному росту опухолевых клеток, резистентных к действию цитостатиков. Поэтому преждевременное применение ХТ может приводить к раннему ростовому доминированию таких клеток и, в ко- нечном итоге, к неэффективности химиотерапии на поздних стадиях заболевания, когда лекарственная циторедукция могла бы продлить жизнь пациента. По нашему мнению, ИТ должна занять ведущее место в протоколах лечения опухолей на ранних стадиях заболевания, отодвигая на второй план применение химиопрепаратов (табл. 1).
Уничтожить все опухолевые клетки на поздних стадиях заболевания в большинстве случаев невозможно. Под влиянием цитодеструктивных агентов опухоль с течением времени становится малочувствительной к цитотоксическим воздействиям. Вместе с тем, такая опухоль в значительной степени сохраняет чувствительность к биологическим воздействиям, контролирующим ее рост [50, 51].
Опухоль наделена патологической регенеративной активностью. Поэтому разрушение части опухолевых клеток стимулирует появление гораздо большего их количества. Системное противоопухолевое лечение на поздних стадиях заболевания должно быть направлено не столько на прямое уничтожение опухоли, сколько на усиление в опухолевом микроокружении иммунных процессов, препятствующих реализации регенеративного потенциала опухоли и торможению ростовой активности стволовых опухолевых клеток. Другими словами, стратегия лечения должна быть нацелена на достижение состояния опухолевого покоя (dormant state) (рис. 2).
Результаты экспериментальных и клинических исследований свидетельствуют, что опухоль может находиться в таком состоянии в течение длительного времени и что именно иммунная система играет ключевую роль в его поддержании [52]. Важно заметить, что низкодозовая (метрономная) радиохимиотерапия может повышать чувствительность опухоли к иммунотерапевтическим воздействиям [26]. По нашему мнению, стратегия, основанная на комбинировании традиционных циторедуктивных и иммунотерапевтических методов и нацеленная на поддержание долговременного контроля над опухолевым ростом, могла бы быть наиболее це-
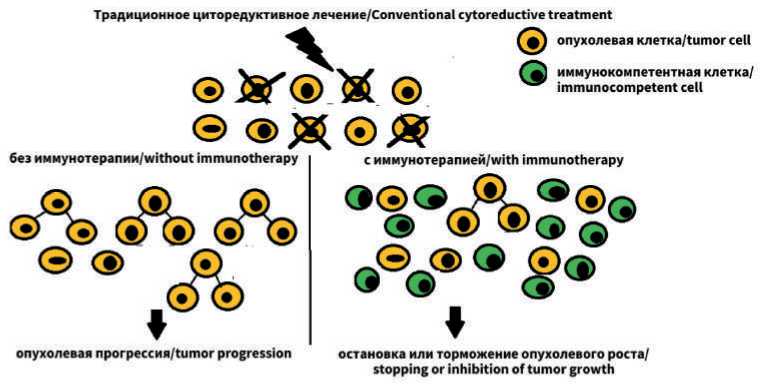
Рис. 2. Восстановление иммунологического контроля над опухолевым ростом. (Пояснения в тексте) Fig. 2. Tumor growth-controlling effects of immunotherapy in advanced cancer patients. The description is in the text
лесообразной и эффективной на поздних стадиях болезни (рис. 2). Такая стратегия могла бы обеспечить продление жизни пациента с максимально возможным сохранением ее качества. Необходимо формировать взгляд на диссеминированный опухолевый процесс как на хроническую болезнь, которую невозможно излечить, но с которой можно длительно сосуществовать. Аналогию здесь можно провести с сердечно-сосудистыми заболеваниями и неврологическими расстройствами.
Прогностическая оценка эффективности комплексной противоопухолевой терапии
Объективный мониторинг противоопухолевой терапии имеет важное значение, поскольку позволяет своевременно вносить необходимые изменения в протоколы лечения. Воспаление может сделать опухолевые очаги более заметными при инструментальных исследованиях. Часто это воспринимается как прогрессирование заболевания. Однако у части пациентов такая воспалительная реакция может сопровождаться последующим уменьшением размеров опухоли. Псевдопрогрессирование определяется как увеличение размера первичной опухоли или появление нового очага поражения с последующей регрессией опухоли или остановкой ее роста. Это явление доказано гистологической биопсией, которая обнаружила выраженную воспалительную инфильтрацию опухоли Т- или В-лимфоцитами [53]. С другой стороны, иммуносупрессивная химиорадиотерапия может сделать опухолевые очаги менее замет- ными за счет снижения воспаления, и это явление можно рассматривать как псевдорегрессирование. Поэтому необходимо проявлять осторожность при интерпретации данных инструментальной визуализации и обращать больше внимания на результаты лабораторных исследований.
Умеренное локальное воспаление может быть положительным прогностическим фактором течения опухолевого заболевания. Однако неспецифическое системное воспаление, вызванное опухолевой прогрессией, несомненно, ассоциируется с отрицательным прогнозом. Через усиление воспаления опухоль дезориентирует и ослабляет противоопухолевую защиту и создает благоприятные условия для опухолевой инвазии. Принимая во внимание все вышесказанное, мы разработали новую прогностическую воспалительную шкалу (ПШВ), основанную на определении 3 параметров крови: С-реактивного белка (СРБ), лактатдегидрогеназы ЛДГ и соотношение нейтрофилов к лимфоцитам (НЛС). CРБ – белок острой фазы печеночного происхождения, который используется для оценки системного воспаления. Повышенный уровень CРБ идентифицирован как негативный прогностический фактор при многих формах рака [47]. ЛДГ катализирует превращение лактата в пируват. Фермент считается маркером повреждения тканей, а также маркером опухолевой нагрузки. Уровень ЛДГ обратно коррелирует с эффективностью иммунотерапии [39]. НЛС в крови повышены при запущенных или высокоагрессивных формах опухолей. Высокие значения НЛС коррелируют
Таблица 2/table 2
Лечение рака на ранних и поздних стадиях заболевания treatment of cancer in early and advanced stages
Стадия заболевания/ Stage of the disease
Лечение/Treatment
Хирургическое лечение; вакцинация; локальная гипертермия; нейрогормональная
Локальная опухоль (I–II стадии)/ иммунореабилитация; метаболическая терапия; лекарственная иммунотерапия/ Local tumor (stages I–II) Surgery; vaccination; local hyperthermia; neurohormonal immunorehabilitation; meta bolic therapy; drug immunotherapy
Хирургическое лечение; радиотерапия; химиотерапия; антигормональная терапия; противовоспалительная терапия; гипертермия; вакцинация; нейрогормональная
Распространенная опухоль (III–IV иммунореабилитация; метаболическая терапия; лекарственная иммунотерапия; стадии)/ адоптивная клеточная терапия/
Advanced tumor (stage III–IV ) Surgery; radiotherapy; chemotherapy; antihormonal therapy; anti-inflammatory therapy; hyperthermia; vaccination; neurohormonal immunorehabilitation; metabolic therapy;
drug immunotherapy; adoptive cell therapy
Прогностическая оценка воспаления prognostic assessment of inflammation
Таблица 3/table 3
|
Параметр/Parameter |
Норма/Norm |
Превышение/Excess |
|
СРБ/SRP |
0 |
1 |
|
ЛДГ/LDH |
0 |
1 |
|
НЛС/NLS |
0 |
1 |
Примечание: прогноз хороший – 0; сомнительный – 1; умеренно плохой – 2; плохой – 3.
Note: prognosis good – 0; doubtful – 1; moderately – 2; bad – 3.
В клинике традиционно используется прогностическая шкала Глазго (GPS), которая основана на
Список литературы Иммунотерапия в комплексном лечении опухолевых заболеваний
- Seledtsov V.I., von Delwig A. Clinically feasible and prospective immunotherapeutic interventions in multidirectional comprehensive treatment of cancer. Expert Opin Biol Ther. 2021; 21(3): 323-42. doi: 10.1080/14712598.2021.1828338.
- SantosP.M., ButterfieldL.H. Dendritic Cell-Based Cancer Vaccines. J Immunol. 2018; 200(2): 443-9. doi: 10.4049/jimmunol.1701024.
- Tanel A., Fonseca S.G., Yassine-Diab B., Bordi R., Zeidan J., Shi Y., Benne C., Sekaly R.P. Cellular and molecular mechanisms of memory T-cell survival. Expert Rev Vaccines. 2009; 8(3): 299-312. doi: 10.1586/14760584.8.3.299.
- Seledtsov V.I., von Delwig A.A. Immune memory limits human longevity: the role of memory CD4+ T cells in age-related immune abnormalities. Expert Rev Vaccines. 2020; 19(3): 209-15. doi: 10.1080/14760584.2020.1745638.
- Ayers M., Lunceford J., Nebozhyn M., Murphy E., Loboda A., Kaufman D.R., Albright A., Cheng J.D., Kang S.P., Shankaran V., Piha-PaulS.A., Yearley J., Seiwert T.Y., RibasA., McClanahan T.K. IFN-y-related mRNA profile predicts clinical response to PD-1 blockade. J Clin Invest. 2017; 127(8): 2930-40. doi: 10.1172/JCI91190.
- Seledtsov V.I., GoncharovA.G., Seledtsova G.V. Clinically feasible approaches to potentiating cancer cell-based immunotherapies. Hum Vaccin Immunother. 2015; 11(4): 851-69. doi:10.1080/21645515.2015 .1009814.
- AndzinskiL., KasnitzN., Stahnke S., Wu C.F., GerekeM., vonKockritz-BlickwedeM., SchillingB., Brandau S., Weiss S., Jablonska J. Type I IFNs induce anti-tumor polarization of tumor associated neutrophils in mice and human. Int J Cancer. 2016; 138(8): 1982-93. doi: 10.1002/ijc.29945.
- Seledtsov V.I., Seledtsova G.V. A balance between tissue-destructive and tissue-protective immunities: a role of toll-like receptors in regulation of adaptive immunity. Immunobiology. 2012; 217(4): 430-5. doi:10.1016/j. imbio.2011.10.011.
- Darcy P.K., Neeson P., Yong C.S., Kershaw M.H. Manipulating immune cells for adoptive immunotherapy of cancer. Curr Opin Immunol. 2014; 27: 46-52. doi: 10.1016/j.coi.2014.01.008.
- Seledtsov V.I., Seledtsova G.V. A Possible Role for Idiotype/Anti-idiotype B-T Cell Interactions in Maintaining Immune Memory. Front Immunol. 2017; 8: 409. doi: 10.3389/fimmu.2017.00409.
- Zhang Z., Liu S., Zhang B., Qiao L., Zhang Y., Zhang Y. T Cell Dysfunction and Exhaustion in Cancer. Front Cell Dev Biol. 2020; 8: 17. doi: 10.3389/fcell.2020.00017.
- Qian J., Wang C., Wang B., Yang J., Wang Y., Luo F., Xu J., Zhao C., Liu R., Chu Y. The IFN-y/PD-L1 axis between T cells and tumor microenvironment: hints for glioma anti-PD-1/PD-L1 therapy. J Neuroinflammation. 2018; 15(1): 290. doi: 10.1186/s12974-018-1330-2.
- Tran L., Theodorescu D. Determinants of Resistance to Checkpoint Inhibitors. Int J Mol Sci. 2020; 21(5): 1594. doi: 10.3390/ ijms21051594.
- Liang C., Jiang E., Yao J., Wang M., Chen S., Zhou Z., Zhai W., Ma Q., Feng S., Han M. Interferon-y mediates the immunosuppression of bone marrow mesenchymal stem cells on T-lymphocytes in vitro. Hematology. 2018; 23(1): 44-9. doi: 10.1080/10245332.2017.1333245.
- Liu Y., Liang X., Yin X., Lv J., Tang K., Ma J., Ji T., Zhang H., Dong W., Jin X., Chen D., Li Y., Zhang S., Xie H.Q., Zhao B., Zhao T., Lu J., Hu Z.W., Cao X., Qin F.X., Huang B. Blockade of IDO-kynurenine-AhR metabolic circuitry abrogates IFN-y-induced immunologic dormancy of tumor-repopulating cells. Nat Commun. 2017; 8: 15207. doi: 10.1038/ ncomms15207.
- Onizuka S., Tawara I., Shimizu J., Sakaguchi S., Fujita T., Nakayama E. Tumor rejection by in vivo administration of anti-CD25 (interleukin-2 receptor alpha) monoclonal antibody. Cancer Res. 1999; 59(13): 3128-33.
- Palena C., Schlom J. Vaccines against human carcinomas: strategies to improve antitumor immune responses. J Biomed Biotechnol. 2010. doi: 10.1155/2010/380697.
- Kim J.H., Kim B.S., Lee S.K. Regulatory T Cells in Tumor Microenvironment and Approach for Anticancer Immunotherapy. Immune Netw. 2020; 20(1). doi: 10.4110/in.2020.20.e4.
- GianchecchiE., FierabracciA. Inhibitory Receptors and Pathways of Lymphocytes: The Role of PD-1 in Treg Development and Their Involvement in Autoimmunity Onset and Cancer Progression. Front Immunol. 2018; 9: 2374. doi: 10.3389/fimmu.2018.02374.
- DunneA, MarshallN.A., MillsK.H. TLR based therapeutics. Curr Opin Pharmacol. 2011; 11(4): 404-11. doi: 10.1016/j.coph.2011.03.004.
- LawA.M.K., Valdes-MoraF., Gallego-OrtegaD. Myeloid-Derived Suppressor Cells as a Therapeutic Target for Cancer. Cells. 2020; 9(3): 561. doi: 10.3390/cells9030561.
- Orillion A., Hashimoto A., Damayanti N., Shen L., Adelaiye-OgalaR, ArisaS., ChintalaS., OrdentlichP., KaoC, ElzeyB., GabrilovichD., Pili R. Entinostat Neutralizes Myeloid-Derived Suppressor Cells and Enhances the Antitumor Effect of PD-1 Inhibition in Murine Models of Lung and Renal Cell Carcinoma. Clin Cancer Res. 2017; 23(17): 5187-5201. doi: 10.1158/1078-0432.CCR-17-0741.
- Singh S., Kumar N.K., Dwiwedi P., Charan J., Kaur R., Sidhu P., Chugh V.K. Monoclonal Antibodies: A Review. Curr Clin Pharmacol. 2018; 13(2): 85-99. doi: 10.2174/1574884712666170809124728.
- Seledtsov V.l., Seledtsova G.V. Attaining threshold antibody cytotoxicity for selective tumor cell destruction: an opinion article. Oncotarget. 2018; 9(87): 35790-4. doi:10.18632/oncotarget.26271.
- Kantoff P.W., Higano C.S., Shore N.D., Berger E.R., Small E.J., Penson D.F., Redfern C.H., Ferrari A.C., Dreicer R., Sims R.B., Xu Y., Frohlich M.W., Schellhammer P.F; IMPACT Study Investigators. Sipuleuc-el-T immunotherapy for castration-resistant prostate cancer. N Engl J Med. 2010; 363(5): 411-22. doi: 10.1056/NEJMoa1001294.
- Lopes A., Vandermeulen G., Preat V. Cancer DNA vaccines: current preclinical and clinical developments and future perspectives. J Exp Clin Cancer Res. 2019; 38(1): 146. doi: 10.1186/s13046-019-1154-7.
- Seledtsova G.V., Shishkov A.A., Kaschenko E.A., Seledtsov V.I. Xenogeneic cell-based vaccine therapy for colorectal cancer: Safety, association of clinical effects with vaccine-induced immune responses. Biomed Pharmacother. 2016; 83: 1247-52. doi: 10.1016/j.biopha.2016.08.050.
- Seledtsova G. V., Shishkov A.A., Kaschenko E.A., Goncharov A.G., Gazatova N.D., Seledtsov V.I. Xenogeneic cell-based vaccine therapy for stage III melanoma: safety, immune-mediated responses and survival benefits. Eur J Dermatol. 2016; 26(2): 138-43. doi: 10.1684/ejd.2016.2733.
- Gordeeva O. Cancer-testis antigens: Unique cancer stem cell biomarkers and targets for cancer therapy. Semin Cancer Biol. 2018; 53: 75-89. doi: 10.1016/j.semcancer.2018.08.006.
- Chiang C.L., Kandalaft L.E., Coukos G. Adjuvants for enhancing the immunogenicity of whole tumor cell vaccines. Int Rev Immunol. 2011; 30(2-3): 150-82. doi: 10.3109/08830185.2011.572210.
- Müller E., Speth M., Christopoulos P.F., Lunde A., Avdagic A., 0ynebratenI., Corthay A. Both Type I and Type II Interferons Can Activate Antitumor M1 Macrophages When Combined With TLR Stimulation. Front Immunol. 2018; 9: 2520. doi: 10.3389/fimmu.2018.02520.
- Sanmamed M.F., Pastor F., Rodriguez A., Perez-Gracia J.L., Rodriguez-Ruiz M.E., Jure-Kunkel M., Melero I. Agonists of Co-stimulation in Cancer Immunotherapy Directed Against CD137, 0X40, GITR, CD27, CD28, and ICOS. Semin Oncol. 2015; 42(4): 640-55. doi: 10.1053/j. seminoncol.2015.05.014.
- Starzer A.M., Berghoff A.S. New emerging targets in cancer immunotherapy: CD27 (TNFRSF7). ESMO Open. 2020; 4(3). doi: 10.1136/ esmoopen-2019-000629.
- Schirrmacher V. Cancer vaccines and oncolytic viruses exert profoundly lower side effects in cancer patients than other systemic therapies: a comparative analysis. Biomedicines. 2020; 8(3): 61. doi:10.3390/ biomedicines8030061.
- Dobosz P., Dzieciqtkowski T. The intriguing history of cancer immunotherapy. Front Immunol. 2019; 10: 2965. doi:10.3389/ fimmu.2019.02965.
- Hamid O., Ismail R., Puzanov I. Intratumoral Immunotherapy-Update 2019. Oncologist. 2020; 25(3): 423-38. doi: 10.1634/theoncolo-gist.2019-0438.
- ChengL., Wang Y., HuangL. Exosomes from M1-Polarized Macrophages Potentiate the Cancer Vaccine by Creating a Pro-inflammatory Microenvironment in the Lymph Node. Mol Ther. 2017; 25(7): 1665-75. doi: 10.1016/j.ymthe.2017.02.007.
- LuginiL., Cecchetti S., Huber V., LucianiF., Macchia G., SpadaroF., Paris L., Abalsamo L., Colone M., Molinari A., Podo F., Rivoltini L., Ramoni C., Fais S. Immune surveillance properties of human NK cell-derived exosomes. J Immunol. 2012; 189(6): 2833-42. doi: 10.4049/ jimmunol.1101988.
- Im H., Lee K., Weissleder R., Lee H., Castro C.M. Novel nanosens-ing technologies for exosome detection and profiling. Lab Chip. 2017; 17(17): 2892-8. doi:10.1039/c7lc00247e.
- Van Wilpe S., KoornstraR., DenBrokM., De Groot J. W., BlankC., De Vries J., Gerritsen W., Mehra N. Lactate dehydrogenase: a marker of diminished antitumor immunity. Oncoimmunology. 2020; 9(1): 1731942. doi: 10.1080/2162402X.2020.1731942.
- Davis-YadleyA.H., Malafa M.P. Vitamins in pancreatic cancer: a review of underlying mechanisms and future applications. Adv Nutr. 2015; 6(6): 774-802. doi: 10.3945/an.115.009456.
- Shrivastava P., Singh S.M., Singh N. Activation of tumor-associated macrophages by thymosin alpha 1. Int J Immunopathol Pharmacol. 2004; 17(1): 39-47. doi: 10.1177/039463200401700106.
- Zhukova G. V., SchikhlyarovaA.I., Barteneva T.A., ShevchenkoA.N., Zakharyuta F.M. Effect of Thymalin on the Tumor and Thymus under Conditions of Activation Therapy In Vivo. Bull Exp Biol Med. 2018; 165(1): 80-3. doi: 10.1007/s10517-018-4104-z.
- Mascanfroni I., Montesinos Mdel M., Susperreguy S., Cervi L., Ilarregui J.M., Ramseyer V.D., Masini-Repiso A.M., Targovnik H.M., Rabinovich G.A., Pellizas C.G. Control of dendritic cell maturation and function by triiodothyronine. FASEB J. 2008; 22(4): 1032-42. doi: 10.1096/fj.07-8652com.
- Kelley K.W., Weigent D.A., Kooijman R. Protein hormones and immunity. Brain Behav Immun. 2007; 21(4): 384-92. doi: 10.1016/j. bbi.2006.11.010.
- SekirovI., Russell S.L., AntunesL.C., Finlay B.B. Gut microbiota in health and disease. Physiol Rev. 2010; 90(3): 859-904. doi: 10.1152/ physrev.00045.2009.
- Christofi T., Baritaki S., FalzoneL., LibraM., ZaravinosA. Current Perspectives in Cancer Immunotherapy. Cancers (Basel). 2019; 11(10): 1472. doi: 10.3390/cancers11101472.
- Spranger S., Gajewski T. Rational combinations of immunothera-peutics that target discrete pathways. J Immunother Cancer. 2013; 1: 16. doi: 10.1186/2051-1426-1-16.
- Bashraheel S.S., Domling A., Goda S.K. Update on targeted cancer therapies, single or in combination, and their fine tuning for precision medicine. Biomed Pharmacother. 2020; 125: 110009. doi: 10.1016/j. biopha.2020.110009.
- Cheng Y, Weng S., Yu L, Zhu N., Yang M., Yuan Y. The Role of Hyperthermia in the Multidisciplinary Treatment of Malignant Tumors. Integr Cancer Ther. 2019; 18. doi: 10.1177/1534735419876345.
- Quail D.F., Joyce J.A. Microenvironmental regulation of tumor progression and metastasis. Nat Med. 2013; 19(11): 1423-37. doi: 10.1038/ nm.3394.
- Jahanban-EsfahlanR., Seidi K., ManjiliM.H., Jahanban-EsfahlanA., Javaheri T., Zare P. Tumor Cell Dormancy: Threat or Opportunity in the Fight against Cancer. Cancers (Basel). 2019; 11(8): 1207. doi: 10.3390/ cancers11081207.
- Wang H.F., Wang S.S., Huang M.C., Liang X.H., Tang Y.J., Tang Y.L. Targeting Immune-Mediated Dormancy: A Promising Treatment of Cancer. Front Oncol. 2019; 9: 498. doi: 10.3389/fonc.2019.00498.
- Ma Y., Wang Q., Dong Q., Zhan L., Zhang J. How to differentiate pseudoprogression from true progression in cancer patients treated with immunotherapy. Am J Cancer Res. 2019; 9(8): 1546-53.
- Uribe-QuerolE., Rosales C. Neutrophils in Cancer: Two Sides of the Same Coin. J Immunol Res. 2015. doi: 10.1155/2015/983698.
- CarusoR.A., BelloccoR., PaganoM., Bertoli G., RigoliL., Inferrera C. Prognostic value of intratumoral neutrophils in advanced gastric carcinoma in a high-risk area in northern Italy. Mod Pathol. 2002; 15(8): 831-7. doi: 10.1097/01.MP.0000020391.98998.6B


