Имплантации электрода в наиболее позднюю зону левого желудочка, определенную с помощью неинвазивного картирования до операции, для повышения эффективности сердечной ресинхронизирующей терапии
Автор: Степанова В. В., Зубарев С. В., Маринин В. А., Савельева М. А., Лебедев Д. С.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Цель. В проспективном исследовании определить, позволяет ли имплантация левожелудочкового электрода (ЛЖЭ) в зону поздней электрической активации левого желудочка, определенную до операции с помощью неинвазивного электрофизиологического картирования, увеличить количество отвечающих на сердечную ресинхронизирующую терапию (СРТ), в сравнении со стандартной методикой операции. Оценить зависимость ответа на СРТ от положения стимулирующего полюса ЛЖЭ по отношению к исходной зоне поздней активации.Материалы и методы. В исследование включено две группы пациентов с показаниями к СРТ I и II a классов согласно рекомендациям Европейского общества кардиологов по электрокардиостимуляции и ресинхронизирующей терапии 2021 г. В основной группе (n=60) перед имплантацией выполнялось неинвазивное электрофизиологическое картирование (НЭФК) с целью определения зоны поздней электрической активации левого желудочка (ЛЖ). В контрольной группе (n=60) проводилась стандартная имплантация ЛЖЭ без предварительного НЭФК. Сравнивался ответ на СРТ в обеих группах. Анализировалось влияние расстояния от стимулирующего полюса ЛЖЭ до поздней зоны активации ЛЖ при исходном ритме (дистанция ЛЖЭ-поздняя зона) на формирование ответа на СРТ.Результаты. Анализ сопряженности ответа на СРТ в зависимости от группы показал статистически значимые различия между количеством ответивших/не ответивших на СРТ в основной и контрольной группе (51/9 против 38/22, соответственно, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Сердечная ресинхронизирующая терапия, целевая имплантация левожелудочкового электрода, неинвазивное электрофизиологическое картирование, компьютерная томография сердца с контрастированием лучено письменное информированное согласие
Короткий адрес: https://sciup.org/143183527
IDR: 143183527 | УДК: 616.12-008.1 | DOI: 10.38109/2225-1685-2024-4-82-89
Текст научной статьи Имплантации электрода в наиболее позднюю зону левого желудочка, определенную с помощью неинвазивного картирования до операции, для повышения эффективности сердечной ресинхронизирующей терапии
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike»/ «Атрибуция-Не-коммерчески-СохранениеУсловий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: by-nc-sa/4.0/
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Сердечная ресинхронизирующая терапия (СРТ) является рекомендованным методом интервенционного лечения хронической сердечной недостаточности (ХСН) у больных с блокадой левой ножки пучка Гиса (БЛНПГ) или неспецифическими нарушениями внутрижелудочковой проводимости, сопровождающимися значимым расширением комплекса QRS. Тем не менее, 30-50% пациентов не отвечают на СРТ [1].
По данным исследований, имплантация левожелудочкового электрода (ЛЖЭ) в область поздней активации на исходном ритме может улучшить результаты СРТ [2]. Известно, что расположение поздней зоны может отличаться даже у пациентов с классической БЛНПГ [3]. У кандидатов на имплантацию СРТ с другими нарушениями внутрижелудочковой проводимости, а также в зависимости от наличия рубцовых зон той или иной локализации, вариабельность расположения поздней зоны может быть еще более значительной [4].
Оценка зоны поздней активации возможна с помощью тканевой эхокардиографии (ЭХОКГ). Ряд исследований показали преимущества целевой имплантации ЛЖЭ, в сравнении со стандартной [5,6]. Однако эхокардиографические методики нацелены на детекцию поздней зоны путем оценки механической диссинхронии левого желудочка (ЛЖ), которая, как известно, присоединяется значительно позже электрической [7]. Дополнительно стоит отметить, что ЭХОКГ методики являются крайне исследователь-зависимыми, как показало исследование PROSPECT [8]. В связи с этим, именно определение электрической диссинхронии и попытка ее коррекции путем СРТ представляется более обоснованной.
Для определения электрической диссинхронии предложены инвазивные и неинвазивные методики. Одним из применяемых инвазивных методов является определение интервала Q-LV [9]. Измеряется интервал между началом комплекса QRS и пиком эндограммы с ЛЖЭ. Максимально возможный интервал свидетельствует о том, что ЛЖЭ находится максимально близко к исходной поздней зоне. Недостатком этой методики является то, что необходимо заведение ЛЖЭ в каждую доступную вену коронарного синуса (КС) для измерения интервала Q-LV в ней. Такой поиск максимального значения показателя Q-LV трудоемок, так как значимо удлиняет время имплантации, увеличивает риски, связанные с манипуляциями в притоках КС, увеличивает время рентгеноскопии.
Другим инвазивным методом определения поздней зоны является электроанатомическое картирование эндокардиальной поверхности ЛЖ [10,11] или даже самих вен коронарного синуса (КС) (система EnSite NavX, St. Jude Medical, St. Paul, MN, USA) [12]. Данный подход несет в себе минусы, связанные с его инвазивным характером, а также с удлинением процедуры имплантации и увеличением времени рентгеноскопии.
Говоря о неинвазивных методиках определения электрической диссинхронии можно сказать, что уже существует целый ряд систем, направленных на детекцию зон поздней активации [13-16]. В настоящее время в России зарегистрирована одна из этих систем, позволяющая проводить неинвазивное электрофизиологическое картирование (НЭФК) [15]. Стоит отметить, что в настоящее время актуальным видится не просто визуализировать зону поздней электрической активации, но также одновременно понять, насколько близко от нее можно имплантировать ЛЖЭ и как положение ЛЖЭ влияет на формирование конечного ответа на СРТ.
Целью данного проспективного исследования было определить, позволяет ли имплантация ЛЖЭ в зону поздней электрической активации, определенную неинвазивно, увеличить количество ответивших на СРТ в сравнении со стандартной методикой операции, а также оценить зависимость ответа на СРТ от положения стимулирующего полюса ЛЖЭ по отношению к исходной зоне поздней активации.
МЕТОДЫ ИССЛЕДОВАНИЯ
В проспективное исследование включено 120 пациентов с показаниями к СРТ I и II a классов согласно рекомендациям Европейского общества кардиологов по электрокардиостимуляции и ресинхронизирующей терапии 2021 г. [17], на фоне оптимальной медикаментозной терапии. Методом случайной рандомизации пациенты были разделены на две группы – основная (n=60) и контрольная (n=60). До включения в исследование у всех участников было получено письменное информированное согласие. В исследование не включались пациенты с противопоказаниями к выполнению мультиспиральной компьютерной томографии (МСКТ) сердца с контрастированием. Применялись стандарты надлежащей клинической практики (Good Clinical Practice). Исследование выполнялось в соответствии с принципами Хельсинской Декларации.
В основной группе (n=60) на дооперационном этапе выполнялось НЭФК в сочетании с МСКТ сердца с контрастированием в венозную фазу. Определялась зона поздней активации ЛЖ на исходном ритме и вена КС, наиболее приближенная к этой зоне. В ходе имплантации ЛЖЭ позиционировали в отдел вены, который был максимально приближен к зоне поздней активации ЛЖ.
Процедура НЭФК в основной группе включала несколько этапов.
Первоначально с помощью аппарата Амикард 01C (Россия) проводилась многоканальная регистрация электрокардиографических (ЭКГ) сигналов от униполярных отведений (до 240) на исходном ритме. Для этого использовались полоски с 8-ю рент-ген-непрозрачными электродами ЭКГ, которые наклеивались равномерно продольно по всей окружности грудной клетки. Наряду с этим проводилась запись стандартной 12-канальной ЭКГ.
На втором этапе выполнялась МСКТ сердца с записью серий «торс» (для визуализации всех электродов) и «сердце». Серия «торс» записывалась с использованием низкодозового протокола Lung Low Dose без ЭКГ синхронизации, без введения контрастирующего препарата с захватом всех электродных полосок. Запись серии «сердце» на МСКТ осуществлялась с ЭКГ-синхронизацией на задержке дыхания с предварительным тест-болюсом. На основании полученных данных тест-болюса рассчитывалось индивидуальное время начала сканирования сердца для получения качественного контрастирования КС и его притоков. Лучевая нагрузка контрастной МСКТ составляла от 1,36 до 3 миллизиверт в зависимости от антропометрических данных пациента. Количество использованного йодсодержащего контрастирующего вещества (Оптирей или Ультравист 300) составляло до 100 мл на исследование.
Далее полученные данные ЭКГ и МСКТ импортировались в программное обеспечение системы Амикард 01C. На основании реконструкций строилась изохронная карта для визуализации зоны поздней активации (рис. 1).
Затем переходили к воксельной модели ЛЖ, на которой выполнялось измерение расстояния от центра поздней зоны до той или иной вены КС (рис. 2).
Целевым считался венозный приток, максимально близко расположенный к поздней зоне, не имеющий выраженных угловых деформаций в устье, с остиальным углом больше 45 градусов и диаметром проксимального отдела ≥ 2 мм.
Пациентам с ишемической болезнью сердца выполнялась магнитно-резонансная томография сердца (МРТ) с контрастировани- ем для исключения фиброза в целевом сегменте. При поражении ≥50% толщины стенки или трансмурально сегмент считался непригодным для имплантации. В таком случае оценивались близлежащие сегменты (например, переднелатеральный срединный сегмент непригоден, а переднелатеральный базальный пригоден). В случае отсутствия данных МРТ у пациентов с ишемической болезнью наличие трансмурального рубца в зоне предполагаемой имплантации исключалось на отсроченной фазе МСКТ.
В конечном итоге вся информация предоставлялась в виде заключений пациенту и оперирующему хирургу для планирования имплантации. В ходе операции ограничением для имплантации ЛЖЭ в требуемый сегмент целевой вены КС было наличие стимуляции диафрагмального нерва, порог выше 5 Вольт при длительности 1 миллисекунда, технические трудности, связанные с заведением и/или стабилизацией электрода в вене.
Пациентам из группы контроля (n=60) не проводилась НЭФК и МСКТ перед операцией. Имплантация ЛЖЭ выполнялась по стандартной методике. Стандартная методика включала проведение интраоперационной окклюзионной баллонной венографии и имплантацию ЛЖЭ в одну из вен на боковой стенке (наиболее предпочтительной считалась боковая или заднебоко- вая вены, наименее предпочтительной считалась передняя вена, неприемлемой – задняя межжелудочковая вена) [18]. При невозможности завести электрод в одну из вен на боковой стенке, неприемлемом пороге стимуляции и/или наличии диафрагмальной стимуляции имплантировали электрод в другую доступную вену.
В послеоперационном периоде через 1 месяц после имплантации всем пациентам обеих групп выполнялось НЭФК и МСКТ без контрастирования. Записывался собственный ритм при временном отключении имплантированного устройства. На изохронной карте оценивалась зона поздней активации. Далее выбирался полюс ЛЖЭ, максимально близко расположенный к ней, и измерялась дистанция ЛЖЭ-поздняя зона (рис. 3).
Оптимизация СРТ осуществлялась стандартным способом, подбиралась оптимальная атриовентрикулярная (АВ) задержка с помощью автоматизированного алгоритма, после чего контролировалось, чтоб при данной АВ задержке успевала завершиться деполяризация предсердий (завершенный зубец P на ЭКГ). Межжелудочковая задержка подбиралась таким образом, чтобы получить минимальную продолжительность комплекса QRS и максимально скорректировать электрическую ось стимулированного сокращения по сравнению с исходным комплексом.
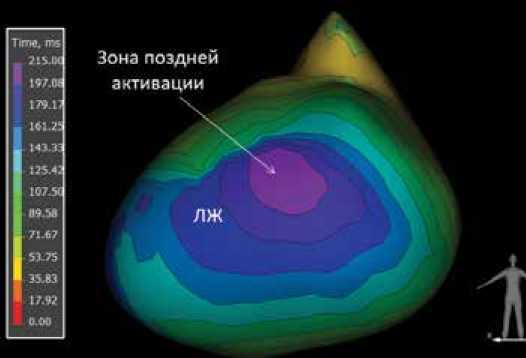
Рисунок 1. Изохронная карта левого желудочка. Зона поздней активации [выполнено авторами]
Picture 1. Isochronal map of left ventricle. Late activation zone [performed by the authors]
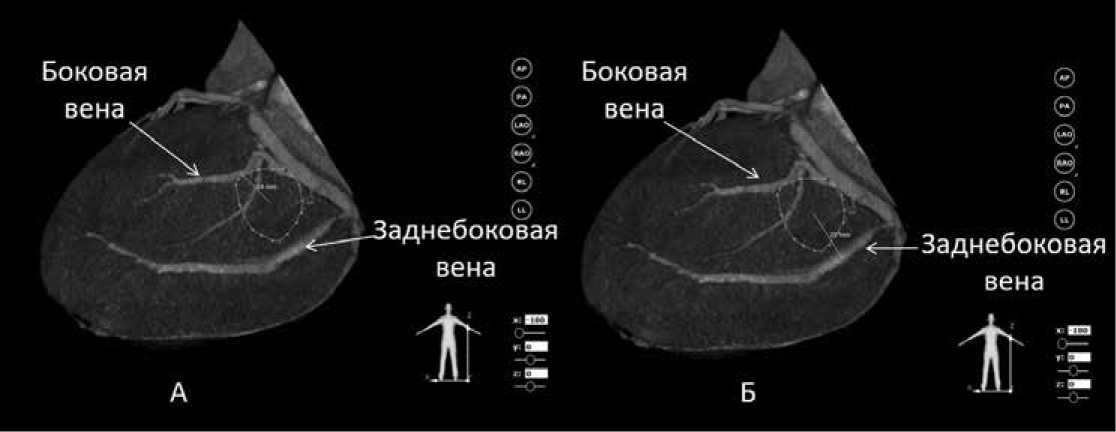
Рисунок 2. Воксельная модель левого желудочка. Определение целевого притока коронарного синуса путем измерения расстояния от поздней зоны до вены: А – расстояние до боковой вены 19 мм, Б – расстояние до заднебоковой вены 25 мм. Целевой является боковая вена [выполнено авторами]
Picture 2. Voxel model of left ventricle. Revealing target vein of coronary sinus by measuring distance from latest electrical activation site to vein: A – distance to lateral vein is 19 mm, B – distance to posterolateral vein is 25 m. Lateral vein is a target one [performed by the authors]
Ответ на СРТ оценивался через 12 месяцев после операции как совокупность показателей: уменьшение функционального класса ХСН на один и более, повышение фракции выброса ЛЖ на 5% и более, уменьшение конечно-систолического объема (КСО) ЛЖ на 15% и более.
СТАТИСТИЧЕСКИЙ АНАЛИЗ
Для анализа результатов применялся набор инструментов описательной и аналитической статистики, реализованный в программе Statistica v. 13.0 (StatSoft Inc., США). Статистическая однородность групп анализировалась с применением знакового теста и однофакторного дисперсионного анализа (критерий Фишера). Данные показателей проверялись на соответствие нормальному распределению: центральные значения представлены в виде медиан (Me) и значений 25 и 75 квартилей. Для выявления неоднородности групп использовался анализ сопряженности (критерий Пирсона Хи-квадрат) и двухфакторный дисперсионный анализ factorial ANOVA (критерий Фишера F). Применялась логистическая регрессия для оценки вероятности отсутствия ответа на СРТ в зависимости от показателя дистанции ЛЖЭ-поздняя зона. Статистические гипотезы подтверждались р-значениями и 95% доверительными интервалами, рассчитанными по методу Клоппера-Пирсона.
РЕЗУЛЬТАТЫ
В процессе проверки однородности установлено, что группы статистически значимо не различаются по основным клиническим и эхокардиографическим параметрам (табл. 1).
Анализ сопряженности ответа на СРТ в зависимости от группы показал статистически значимые различия между количеством
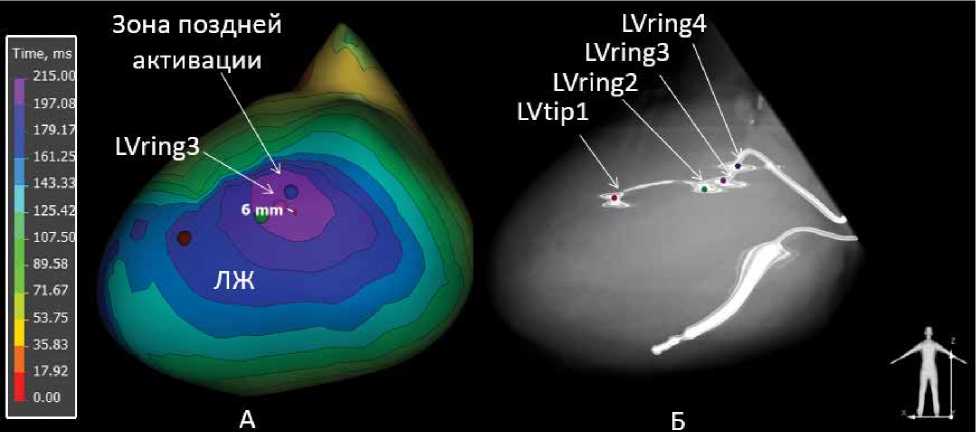
Рисунок 3. Изохронная карта на собственном ритме при временном отключении устройства. Выбор полюса левожелудочкового электрода, максимально близко расположенного к центру поздней зоны [выполнено авторами]
Picture 3. Isochronal map during own rhythm when the device is temporarily turned off. Selection of pole of left ventricular lead, which is the closest to center of latest activation site [performed by the authors]
Таблица 1. Результаты проверки однородности групп [составлено авторами]
Table 1. Results of homogeneity of variance test [compiled by the authors]
|
Показатель |
Основная группа |
Контрольная группа |
Использованный статистический метод |
Р |
|
Возраст, лет |
65 (58; 69) * |
62,5 (58; 66,5) * |
Критерий Манна-Уитни |
0,2 |
|
Пол Женщины, n (%) |
11 (18%) |
17 (28%) |
Критерий Пирсона Хи-квадрат |
0,6 |
|
ол Мужчины, n (%) |
49 (82%) |
43 (72%) |
||
|
Индекс массы тела |
28 (25,55; 31,5) * |
28 (25,75; 31,2) * |
Критерий Манна-Уитни |
0,5 |
|
Неишемическая Генез КМП Ишемическая |
22 (37%) |
33 (55%) |
Критерий Пирсона Хи-квадрат |
0,4 |
|
38 (63%) |
27 (45%) |
|||
|
Синусовый ритм/ ФП, n (%) |
50(83%)/10(17%) |
51(85%)/9 (15%) |
Критерий Пирсона Хи-квадрат |
0,5 |
|
Длительность QRS, мс |
190 (177,5; 203) * |
190(176,5; 205) * |
Критерий Манна-Уитни |
0,2 |
|
Инфаркт миокарда в анамнезе |
34 (57%) |
26 (43%) |
Критерий Пирсона Хи-квадрат |
0,5 |
|
II |
27 (45%) |
11 (18%) |
Критерий Пирсона Хи-квадрат |
0,5 |
|
ФК ХСН III |
33 (55%) |
48 (80%) |
Критерий Пирсона Хи-квадрат |
0,7 |
|
IV |
0 |
1 (2%) |
Критерий Пирсона Хи-квадрат |
1 |
|
ФВ ЛЖ, % |
27 (24;31) * |
25 (21;32) * |
Критерий Манна-Уитни |
0,3 |
Примечание: * – медиана (значения 25-ого квартиля; 75-ого квартиля)
Note: * – median (25th quartile, 75th quartile)
Сокращения: КМП – кардиомиопатия; ФВ ЛЖ – фракция выброса левого желудочка по Симпсону; ФК ХСН – функциональный класс хронической сердечной недостаточности; ФП – фибрилляция предсердий.
86 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 4, 2024
ответивших/не ответивших на СРТ в основной и контрольной группе (51/9 против 38/22 соответственно, p<0,01) (рис. 4).
Применение двухфакторного дисперсионного анализа зависимости расстояния ЛЖЭ-поздняя зона и ответа на СРТ в обеих группах показало значимую зависимость между этими характеристиками (рис. 5).
Анализ зависимости ответа на СРТ от дистанции ЛЖЭ-поздняя зона в обеих группах выявил статистически значимое влияние данного показателя: критерий Пирсона Хи-квадрат = 50,27, p<0,01. Согласно уравнению логистической регрессии значимое увеличение вероятности отсутствия ответа на СРТ от 0 баллов до 1 балла происходило в диапазоне значений дистанции ЛЖЭ-поздняя зона 46-57 мм. При значении показателя свыше 57 мм вероятность ответа была минимальной (рис. 6).
Критерий Пирсона Хи-квадат, p=0,0067
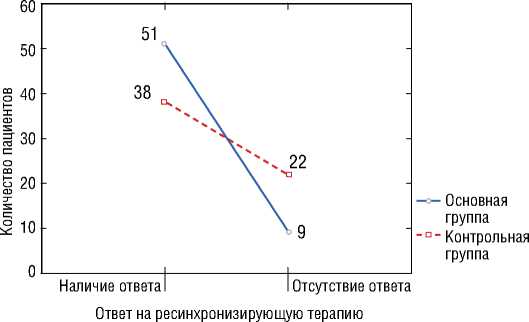
Рисунок 4. Результаты анализа сопряженности ответа на ресинхронизирующую терапию в зависимости от группы. Выявлена статистически значимая зависимость в виде преобладания ответивших и меньшего количества не ответивших в основной группе в сравнении с контрольной группой, p<0,01 [выполнено авторами]
Picture 4. Results of analysis of conjugacy of response to cardiac resynchronization therapy in each group. There revealed statistically evident difference in more responders and less nonresponders in the main group in comparison to the control group, p<0,01 [performed by the authors]
Был проведен анализ позиции активного полюса ЛЖЭ и других возможных причин отсутствия ответа в основной группе. По данным послеоперационного НЭФК из 9 не ответивших на СРТ основной группы только у 2 пациентов электрод располагался в целевой вене (при этом не в целевом сегменте, электрод был имплантирован дистальнее). У остальных 7 пациентов имплантация ЛЖЭ в целевую вену оказалась неудачной по разным причинам: анатомическая трудность (1), неприемлемо высокий порог стимуляции в целевой вене (2), диафрагмальная стимуляция в целевой вене (4).
ОБСУЖДЕНИЕ
В нашей работе выявлено большее количество ответивших на СРТ в группе целевой имплантации ЛЖЭ в сравнении с группой контроля, где применялась стандартная методика, что сви-
Критерий Фишера F, p=0,00477 Вертикальные скобки содержат 95% доверительные интервалы
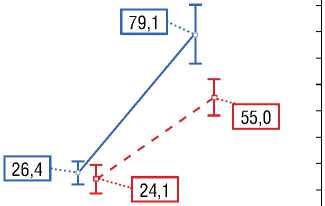
Наличие ответа
Отсутствие ответа
Ответ на ресинхронизирующую терапию
ЕЕ Основная ^ Контрольная группа группа
Рисунок 5. Результаты двухфакторного дисперсионного анализа зависимости ответа на ресинхронизирующую терапию от расстояния от стимулирующего полюса электрода до поздней зоны в левом желудочке, p<0,01 [выполнено авторами]
Picture 5. Results of bivariate analysis of variance of response to cardiac resynchronization therapy and distance left ventricular electrode – the latest site in left ventricle dependence, p<0,01 [performed by the authors]
Логистическая регрессия описывается уравнением y=exp(-34,866+(0,681443)*x/(1+exp(-34,866+(0,681443)*x)) Критерий Пирсона Хи-квадат: 50,27; p=0,0000001
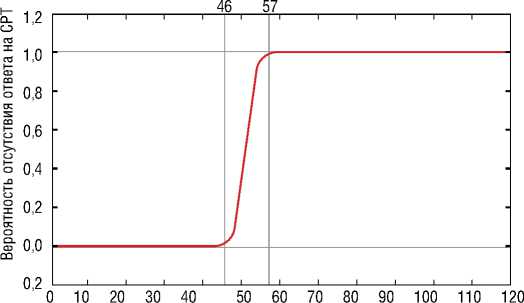
Расстояние от стимулирующего полюса электрода до центра поздней зоны, мм
Рисунок 6. Функция логистического отклика. Вероятность наличия или отсутствия ответа на сердечную ресинхронизирующую терапию (СРТ) в зависимости от показателя расстояния от стимулирующего полюса левожелудочкового электрода до центра поздней зоны в левом желудочке [выполнено авторами]
Picture 6. Logistic response function. Probability of presence or absence of response to cardiac resynchronization therapy (CRT) as a function of distance from the stimulating pole of the left ventricular electrode to the center of the late zone in the left ventricle [performed by the authors]
детельствует об оправданности дооперационной оценки с помощью методики НЭФК.
Полученные нами результаты согласуются с данными проведенного ранее многоцентрового исследования MАP-CRT Parreira et al. [19]. Пациентам после имплантации СРТ выполнялось НЭФК с помощью комплекса Амикард 01С. На исходном ритме при выключенной стимуляции измерялось расстояние от активного полюса ЛЖЭ до поздней зоны. Примечательно, что у 35% пациентов поздняя зона располагалась не в базальных или срединных отделах боковой стенки, а в других областях ЛЖ, что подтверждало ранее полученные данные о возможной гетерогенности ее локализации [4]. По результатам работы Parreira et al. было установлено, что расстояние от ЛЖЭ до поздней зоны < 47 мм значимо ассоциировалось с получением ответа на СРТ.
Данные нашего исследования на другой выборке пациентов показали схожие результаты: расстояние от ЛЖЭ до поздней зоны < 46 мм значимо ассоциировано с ответом на СРТ. В отличие от MАP-CRT работы, наше исследование было проспективным, кроме того, помимо поздней зоны определялась венозная анатомия КС до операции в основной группе. Дооперационное изучение анатомии коронарного синуса представляется важным, так как в поздней зоне может не быть вен, доступных для имплантации ЛЖЭ, а, с другой стороны, может быть несколько вен, приемлемых для трансвенозной имплантации электрода и, в таком случае, необходимо определить ближайший к поздней зоне приток.
В работе Nguyen et al. на малой выборке (n=16) применялся подход, схожий с нашим для предоперационной подготовки больных перед СРТ [20]. Оценка зон фиброза осуществлялась с помощью МРТ сердца с контрастированием (Philips Ingenia1,5 Тл, The Netherlands). Анализ данных МРТ производился с помощью программного обеспечения CAAS MRV 3.4 (Pie Medical Imaging, the Netherlands). Для оценки венозной анатомии применялась МСКТ с контрастированием (Somatom Definition Force, Siemens Germany). НЭФК выполнялось с помощью Active Two system (BioSemi, Amsterdam, The Netherlands). Данные НЭФК обрабатывались в программе MATLAB R201613(MathWorks, Natick, MA, USA) и PreView (SCI, University of Utah, USA). Все полученные общие данные в виде STL или VTK файлов загружались в Parawiew 5.1.0 (Kitware Inc., Clifton Park, NY, USA). Далее результаты представлялись хирургу в виде 3D модели сердца с венами КС, на которой цветом отражалась зона поздней активации, и были промаркированы сегменты с фиброзными полями. С учетом вышесказанного становится ясным, что в нашей работе были ограничения со стороны МРТ. Так, мы имели только описание МРТ без отражения зон фиброза на модели желудочков. Это затрудняло четкое понимание расположения фиброза на 3D изображении. В настоящее время трудно переоценить роль МРТ сердца с контрастированием как в рамках диагностики у пациентов с ХСН и/или желудочковыми нарушениями ритма, так и непосредственно для предоперационной подготовки перед СРТ, в связи с чем выполнение МРТ имеет II A класс показаний [21]. Методика позволяет определить общий объем рубцовой ткани относительно здоровой, определить толщину рубца, если речь идет о плотном рубце, уточнить топографию фиброзной ткани [22]. По данным Стукаловой О. В. И соавторов, 2019 г., из 14 пациентов с ишемической кардиопатией и рубцовыми изменениями латеральной стенки, ответ на СРТ был получен только у 2. Знать топографию рубцовой ткани до операции крайне важно, так как стимуляция рубцовой ткани как минимум менее эффективна, чем стимуляция участков, непораженных фиброзом, а кроме того она сопрово- ждается расширением и фрагментацией QRS, а, следовательно, ведет к электрической и механической диссинхронии [23]. Также мы анализировали фиброз с помощью МРТ сердца или на отсроченной фазе МСКТ только у пациентов с ишемической болезнью. В то время как, несмотря на отсутствие классического постинфарктного рубца, по данным исследований [23], у пациентов с неишемической кардиопатией существует некая критическая величина объема фиброзной ткани (более 7% от массы миокарда или более 12,5 г.), при которой СРТ может оказаться неэффективной. С другой стороны, наша выборка основной группы, в которой выполнялась целевая имплантация ЛЖЭ была больше (n=60) и имелась группа контроля, что делает результаты более значимыми.
ЗАКЛЮЧЕНИЕ
Целевая имплантация ЛЖЭ в область наиболее поздней электрической активации ЛЖ, определенную с помощью методики НЭФК, статистически значимо увеличивает количество отвечающих на СРТ в сравнении со стандартной методикой имплантации. При значении дистанции ЛЖЭ-поздняя зона > 57 мм вероятность ответа на СРТ минимальна.
Список литературы Имплантации электрода в наиболее позднюю зону левого желудочка, определенную с помощью неинвазивного картирования до операции, для повышения эффективности сердечной ресинхронизирующей терапии
- Varma N., Boehmer J., Bhargava K. et al. Evaluation, management, and outcomes of patients poorly responsive to cardiac resynchronization device therapy. J Am Coll Cardiol. 2019;74: 2588-2603. https://doi.org/10.1016/j.jacc.2019.09.043
- Kandala J., Upadhyay G.A., Altman R.K. et al. QRS morphology, left ventricular lead location, and clinical outcome in patients receiving cardiac resynchronization therapy. Eur Heart J. 2013;34(29):2252-2262. https://doi.org/10.1093/eurheartj/eht123
- Fung JW, Chan JY, Yip GW, et al. Effect of left ventricular endocardial activation pattern on echocardiographic and clinical response to cardiac resynchronization therapy. Heart. 2007;93(4):432-437. https://doi.org/10.1136/hrt.2007.115295
- Zubarev S., Chmelevsky M., Potyagaylo D. et al. Noninvasive electrocardiographic imaging with magnetic resonance tomography in candidates for cardiac resynchronization therapy. Computing in Cardiology Conference 2019, Cin C. 2019;46:1-4. https://doi.org/s://doi:10.22489/CinC.2019.397
- Khan F.Z., Virdee M.S., Palmer C.R. et al. Targeted left ventricular lead placement to guide cardiac resynchronization therapy: the TARGET study: a randomized, controlled trial. J Am Coll Cardiol. 2012;59(17):1509-1518. https://doi.org/10.1016/j.jacc.2011.12.030
- Saba S., Marek J., Schwartzman D. et al. Echocardiography-guided left ventricular lead placement for cardiac resynchronization therapy: results of the Speckle Tracking Assisted Resynchronization Therapy for Electrode Region trial. Circ Heart Fail. 2013;6(3):427-434. https://doi.org/10.1161/CIRCHEARTFAILURE.112.000078
- Kirk J.A., Kass D.A. Electromechanical dyssynchrony and resynchronization of the failing heart. Circ Res. 2013;113(6):765-76. https://doi.org/10.1161/CIRCRESAHA.113.300270
- Chung E.S., Leon A.R., Tavazzi L. et al. Results of the Predictors of Response to CRT (PROSPECT) trial. Circulation. 2008;117(20):2608-2616. https://doi.org/10.1161/CIRCULATIONAHA.107.743120
- Singh J.P., Fan D., Heist E.K. et al. Left ventricular lead electrical delay predicts response to cardiac resynchronization therapy. Heart Rhythm 2006;3(11):1285-92. https://doi.org/10.1016/j.hrthm.2006.07.034
- Auricchio A., Fantoni C., Regoli F. Characterization of left ventricular activation in patients with heart failure and left bundlebranch block. Circulation. 2004;109(9):1133-1139. https://doi.org/10.1161/01.CIR.0000118502.91105.F6
- Rodriguez L.M., Timmermans C., Nabar A., Beatty G., Wellens H.J. Variable patterns of septal activation in patients with left bundle branch block and heart failure. J Cardiovasc Electrophysiol. 2003;14(2):135-141. https://doi.org/10.1046/j.1540-8167.2003.02421.x
- Rad M.M, Blaauw Y., Dinh T., et al. Left ventricular lead placement in the latest activated region guided by coronary venous electroanatomic mapping. Europace. 2015;17(1):84-93. https://doi.org/10.1093/europace/euu221
- Jia P., Ramanathan C., Ghanem R.N. Electrocardiographic imaging of cardiac resynchronization therapy in heart failure: observation of variable electrophysiologic responses. Heart Rhythm. 2006;3(3):296-310. https://doi.org/10.1016/j.hrthm.2005.11.025
- Berger T., Pfeifer B., Hanser F.F. Single-beat noninvasive imaging of ventricular endocardial and epicardial activation in patients undergoing CRT. PLoS One. 2011;6(1):e16255. https://doi.org/10.1371/journal.pone.0016255
- Revishvili A., Lebedev D., Wissner E. et al. Validation of the mapping accuracy of a novel non-invasive epicardial and endocardial electrophysiology system. Europace. 2015;17(8):1282-8. https://doi.org/10.1093/europace/euu339
- Rickard J., Jackson K., Gold M., et al. Electrocardiogram Belt guidance for left ventricular lead placement and biventricular pacing optimization. Heart Rhythm. 2023;20(4):537-544. https://doi.org/10.1016/j.hrthm.2022.11.015
- Glikson M., Nielsen J.C., Kronborg M.B. et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC) With the special contribution of the European Heart Rhythm Association (EHRA). European Heart Journal. 2021;42(35):3427-3520. https://doi.org/10.1093/eurheartj/ehab364
- Ellenbogen K.A., Wilkoff B.L., Kay G.N. Device therapy for congenial heart failure. SAUNDERS: An Imprint of Elsevier, 2004, p.311. ISBN 0-7216-0279-7
- Parreira L., Tsyganov A., Artyukhina E. et al. Non-invasive threedimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 2023;25(4):1458-1466. https://doi.org/10.1093/europace/euad041
- Nguyên U.C., Cluitmans M.J.M., Strik M., et al. Integration of cardiac magnetic resonance imaging, electrocardiographic imaging, and coronary venous computed tomography angiography for guidance of left ventricular lead positioning. Europace. 2019;21(4):626-635. https://doi.org/10.1093/europace/euy292
- Голицын С.П., Костюкевич М.В., Лайович Л.Ю. и соавт. Евразийские клинические рекомендации по диагностике и лечению желудочковых нарушений ритма сердца и профилактике внезапной сердечной смерти (2022). Евразийский Кардиологический Журнал. 2022;(4):6-67. https://doi.org/10.38109/2225-1685-2022-4-6-67
- Уцумуева М.Д., Миронова Н.А., Каштанова С.Ю., Стукалова О.В. Возможности магнитно-резонансной томографии сердца при отборе кандидатов на ресинхронизирующую терапию. Медицинская визуализация. 2018;(4):20-31 https://doi.org/10.24835/1607-0763-2018-4-20-31
- Стукалова О.В., Миронова Н.А., Уцумуева М.Д. и др. Эффективность сердечной ресинхронизирующей терапии у пациентов с хронической сердечной недостаточностью различной этиологии в зависимости от структурного поражения миокарда по данным магнитно-резонансной томографии сердца с контрастированием. Российский кардиологический журнал. 2019; 24 (12), 22-32. https://doi.org/10.15829/1560-4071-2019-12-22-32


