Имплантируемый аппарат длительного мониторирования ЭКГ для выявления фибрилляции предсердий после аблации кавотрикуспидального перешейка у пациентов с трепетанием предсердий
Автор: Байрамова Севда Афгановна, Романов Александр Борисович, Миттель С., Муссат Д., Стейнберг Д., Покушалов Евгений Анатольевич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 3 т.19, 2015 года.
Бесплатный доступ
Введение Применение непрерывного длительного электрокардиографического мониторинга у пациентов с трепетанием предсердий, подвергающихся радиочастотной аблации кавотрикуспидального перешейка (КТП), может выявить новые эпизоды фибрилляции предсердий (ФП). Цель Выявление частоты и продолжительности вновь возникшей ФП у пациентов с трепетанием предсердий, подвергающихся радиочастотной аблации, с помощью имплантируемых петлевых регистраторов со специальным алгоритмом детекции фибрилляции предсердий. Материал и методы В исследование включено 20 пациентов с трепетанием предсердий и показателем 2-3 балла по шкале CHADS 2, без документированной ФП в анамнезе. После аблации кавотрикуспидального перешейка имплантировали аппараты длительного подкожного ЭКГ-мониторинга для оценки ритма и анализа всех записанных регистратором электрограмм. Результаты Средняя продолжительность динамического наблюдения составила 328±218 дней. У 11 пациентов (55%) записанные ЭКГ подтвердили наличие ФП на 62±38 день после аблации КТП. У 4 пациентов (20%) детектированные подкожным монитором эпизоды ФП были представлены синусовым ритмом с предсердной экстрасистолией предсердий и/или связанной повышенной чувствительностью. У 5 пациентов (25%) не выявлено ФП за исследуемый период. Зарегистрированные подкожным монитором эпизоды менее 4 ч ассоциированы с незначительным временем нахождения пациента в состоянии ФП (AF burden
Фибрилляция предсердий, трепетание предсердий, катетерная аблация, кавотрикуспидальный перешеек, имплантируемый петлевой регистратор
Короткий адрес: https://sciup.org/142140675
IDR: 142140675 | УДК: 616.12-008.313.2-089:612.014.421
Текст научной статьи Имплантируемый аппарат длительного мониторирования ЭКГ для выявления фибрилляции предсердий после аблации кавотрикуспидального перешейка у пациентов с трепетанием предсердий
|
A |
В |
|||||||
|
Episodes (20?) |
Since: IO-Dec-2012 |
Arrhythmia Episode Utt: Ю-Оее-2012 15 48 18I0 21-JM*2O13 13 52 51 |
||||||
|
Symptom |
0 |
All ccPeded epnodes |
||||||
|
FVT |
0 |
Time |
Duration |
|||||
|
VI |
o |
Ю* |
Tim. |
Dew |
hh:mm |
hh: ллт:** |
Max V. Raw |
Median V. Raw |
|
Asystole Brady |
949 |
19*n-2OI3 |
0543 |
02-00 |
95 bpm (630 mt) |
75 bpm (800 mt) |
||
|
64» |
AF |
16-Jan-2013 |
03 19 |
0600 |
3166pm (190 *m> |
I25bpm(4»o mt) |
||
|
947 |
Al" |
1б*г*2О13 |
0253 |
0290 |
98 bpm (6Ю ms) |
65 bpm <930 me) |
||
|
946 |
Asystole |
iS*r*20l3 |
0043 |
03 |
57 bpm (1050 ms) |
|||
|
AT |
0 |
645 |
AF |
I3*n-2O13 |
0949 |
1400 |
111 bpm (540 m*) |
76 bpm <790 me) |
|
AF |
190 |
944 |
AF |
l3*r*20i3 |
09 37 |
1000 |
80 bpm (750 ms} |
76 bpm (790 rm) |
|
%ol TimeAT/AF |
2.3S |
943 |
AF |
i3*r*20l3 |
0927 |
0290 |
81 bpm (680 ms) |
83 bpm <720 rm) |
|
942 |
AF |
I3*n-2O13 |
08 29 |
06 00 |
107 bpm (560 ms} |
68 bpm <880 rm) |
||
|
941 |
де |
13*n-2013 |
0913 |
0290 |
85bpm(7l0ms> |
7$ bpm <790 ms) |
||
|
940 |
AF |
!3*r*20l3 |
0709 |
0200 |
120 6pm (500 ms} |
73 bpm <820 rm) |
||
|
939 |
AF |
13*1*2013 |
0703 |
0400 |
103 6pm (580 ms> |
75 bpm <800 rm) |
||
|
93» |
AF |
13*п-2013 |
09 51 |
0490 |
92 bpm 1650 ms) |
64 bpm <940 ms) |
||
|
АТ – предсердная тахикардия |
937 |
AF |
I2*rv-2O13 |
18:51 |
0290 |
75 bpm (800 ms) |
65 bpm <920 rm) |
|
|
FVT – быстрая желудочковая тахикардия |
936 |
AF |
12*1*2013 |
1839 |
0490 |
73 bpm (820 ms) |
67 bpm <890 m*) |
|
|
Symptom – симптом |
935 |
AF |
I2-Jei-2O13 |
16 55 |
0490 |
286 bpm (2 Ю m*} |
92 bpm <650 mt) |
|
|
VT – желудочковая тахикардия |
934 933 |
Atyswe AF |
12*1*2013 11*1*2013 |
08 51 1959 |
03 02 00 |
200 bpm (300 m*} |
62 6pm <970 me) 91 bpm <660 mt) |
|
|
Asystole – асистолия |
932 |
AtytlC* |
11*r*2OI3 |
1809 |
03 |
43 bpm <1380 m*> |
||
|
Brady – брадикардия |
931 |
AF |
10*1*2013 |
0315 |
02 00 |
115 bpm (520 m*} |
67 bpm <900 me) |
|
|
AT/AF – ПТ/ФП |
930 |
AF |
10*«*2013 |
0305 |
0200 |
140 bpm (430 m*} |
66 bpm (TOO mej |
|
|
AF – ФП |
929 |
Asystole |
10*1*2013 |
02 35 |
03 |
63 bpm (950 mil |
||
|
% of Time AT/AF – время, |
ПТ/ФП |
92$ 927 |
AF AF |
10*«*2013 1O*t*2O13 |
02 29 0217 |
02 00 02 00 |
71 bpm (840 ms) 75 bpm 1800 mt) |
62 bpm <970 m*) 75 bpm <800 rm) |
|
проведенное в состоянии |
92$ |
AF |
10*1*2013 |
02 09 |
02 00 |
85 bpm «710 ms) |
63 bpm <950 me) |
|
|
Duration – продолжительность |
925 |
AF |
10*1*2013 |
0121 |
0200 |
7$ bpm |790m*) |
54 bpm (1110 m*> |
|
|
924 |
AF |
06*n-20l3 |
03 31 |
0290 |
83 bpm 1720 ms) |
66 Ьрт<9Ю rm) |
||
|
923 |
AF |
09*1*2013 |
0117 |
0200 |
85 bpm (710 ms) |
65 bpm <920 ms I |
||
|
922 |
Asystole |
07*1*2013 |
16.19 |
03 |
63 bpm i960 rm) |
|||
|
921 |
Asystole |
07*f*2013 |
1501 |
03 |
55 bpm <1100 m*> |
|||
|
920 |
AF |
06*r*20l3 |
1055 |
0200 |
78 bpm 1770 ms) |
78 bpm <770 me) |
||
|
C |
919 |
Asystole |
03*1*2013 |
01?0* |
03 |
64 bpm <940 me) |
||
|
91» |
AF |
02*0-2013 |
1915 |
08 00 |
300 bpm (200 ms) |
52 bpm<1150ms) |
||
|
Since Last Session W-Dec-2012 to 21Jan-2013 |
917 |
AF |
01*1*2013 |
07 45 |
0290 |
109 bpm <550 m*> |
69 bpm <870 me) |
|
|
AT/AF Durations |
91» |
AF |
31-Dec-2012 |
0621 |
0290 |
68 bpm i860 rm) |
63 bpm <980 rm) |
|
|
915 |
AF |
30-0^2012 |
0149 |
02 00 |
63 bpm 1950 ms) |
63 bpm <960 rm) |
||
|
Duration Episodes |
914 |
AF |
29-0^-2012 |
05 03 |
0290 |
75 bpm i800m*) |
67 bpm <890 me) |
|
|
>72 hr |
0 |
913 |
AF |
29-0^-2012 |
04 43 |
0290 |
83 bpm (720 ms) |
65 bpm <920 me) |
|
48 hr to 72 hr |
o |
899 |
Asystole |
26-Dec-20l2 |
07 16 |
93 |
56 bpm <1070 ms) |
|
|
88» |
Brady |
25 0*6-2012 |
1709 |
96 |
Mn ■ 43 bpm |
43 bpm <1410 rm) |
||
|
24 hr to 48 hr |
0 |
875 |
Atysioie |
23-0*4-2012 |
0024 |
03 |
59 bpm < 1020 ms > |
|
|
12 hr to 24 hr |
0 |
870 |
Asystole |
22-0^2012 |
1957 |
03 |
63 bpm <960 me) |
|
|
4 hr to 12 hi |
0 |
851 |
Asystole |
18-0*9-2012 |
1990 |
03 |
55 bpm <1090 mt) |
|
|
1 hr to 4 hr |
2 |
849 |
Asystole |
18-0^-2012 |
12:19 |
03 |
4$ bpm <1300 mt) |
|
|
84» |
AtyttoK |
18OC-2012 |
12:01 |
03 |
44 bpm <13Ю m*> |
|||
|
10 min to 1 hr |
33 |
82$ |
Asystole |
150*6-2012 |
23 57 |
03 |
48 bpm <1250 mt) |
|
|
2 min to 10 min |
155 |
— |
||||||
Рис. 1. Опрос устройства пациента с ИПР (21 января 2013)
Мужчине 72 лет с артериальной гипертензией и сахарным диабетом (2 балла по шкале CHADS2) выполнены аблация КТП и имплантация аппарата подкожного мониторирования ЭКГ 21 июня 2011 г.: a – с момента предыдущего опроса (10 декабря 2012) зарегистрировано 190 эпизодов ФП, AF burden 2,3%; b – 30 последних зафиксированных эпизодов ФП длительностью не менее 2 мин; c – 190 эпизодов ФП распределены в «промежутки» от 1 до 8. Наибольшая продолжительность эпизода с момента последнего опроса составила 1–4 ч. Записанные данные ЭКГ доступны только для событий, показанных в числе эпизодов аритмии.
ляторами и дефибрилляторами, показал, что скрытые эпизоды ФП могут значительно увеличивать риск тромбоэмболии [3, 4]. Однако у большинства пациентов, имеющих факторы риска, нет имплантированного водителя ритма или дефибриллятора, а зарегистрированные эпизоды ФП часто носят асимптомный характер, в связи с чем появляется большой интерес к альтернатив- ным методикам, которые могут произвести запись ЭКГ в момент эпизодов.
В настоящее время разработано большое количество амбулаторных наружных систем мониторинга и записи ЭКГ. В их число входят 24–48-часовой Холтеровский мониторинг, 7–14-дневный Холтеровский мониторинг, активируемые пациентами устройства записи ритма серд-
|
Pnrametore |
Detection |
EGG Recording |
Interval i Retel |
Duration |
|
FVT |
On |
On |
280 me (231 bpm) |
30,40 boats |
|
VT |
On |
Oh |
30 me (176 bpm) |
16 beats |
|
Aeyetoie |
On |
Oh |
3eoc |
|
|
Brady |
On |
On |
2000 me (30 bpm) |
4 beats |
|
Symptom |
On |
Three 7 5 mn Epeodeo |
б
Detection ECG Fteccxdino Record ECG ol
AT/AF
AF Only On Epreodee >■ в mn
Dec 2011 Feb 2012 Apr 2012 Jun 2012 Aug 2012 Oct 2012 Dec 2012
_1_________l________ 1 1________1__1________1________1________1_________ 1 1________L________1____
111 II 1 I 1 1 1 1 1
P ■ Ргодтлт
I - Inlerrogete _ = Remote t ■ Symptom

Рис. 2. Опрос ИПР (12 января 2013): а – петлевой регистратор запрограммирован для записи данных ЭКГ-эпизодов ФП более 6 мин; б – графическое представление суммарного времени ПТ/ФП за последние 13 мес. Почти ежемесячно пациентам выполнялся удаленный мониторинг (I) петлевого регистратора с помощью системы Carelink
FVT – быстрая желудочковая тахикардия
Symptom – симптом
VT – желудочковая тахикардия
Asystole – асистолия
Brady – брадикардия
Parameters – параметры
Detection – выявление
ECG Recording – запись ЭКГ
Interval (Rate) – интервал (частота)
Duration – продолжительность
AT/AF total hours/day – общая продолжительность ПТ/ФП ч/день
ца, автоматические петлевые регистраторы и мобильные устройства телеметрии сердечно-сосудистой системы. Тем не менее для этих устройств записи ЭКГ ограничена продолжительность мониторинга, что препятствует их долгосрочному использованию у пациентов с высоким риском, у которых ФП может иметь разную продолжительность и частоту [5]. Лучшей альтернативой может быть имплантируемый петлевой регистратор (ИПР) со специальным алгоритмом детекции ФП, записывающий ЭКГ длительно (около 3 лет). Эксперты подтверждают высокую точность записи данной методики [6].
Особый интерес представляет когорта пациентов с типичным трепетанием предсердий без документированных ранее эпизодов ФП. Ввиду высокой частоты рецидивов трепетания предсердий катетерная аблация кавотрикуспидального перешейка (КТП) стала терапией выбора [7, 8]. Накоплено достаточно данных о развитии у таких пациентов фибрилляции предсердий при долгосрочном наблюдении [9, 10]. Фибрилляция предсердий не связана с вмешательством, а отражает, что в основе трепетания и фибрилляции предсердий лежит общий субстрат. Достоверную частоту ФП у та- а
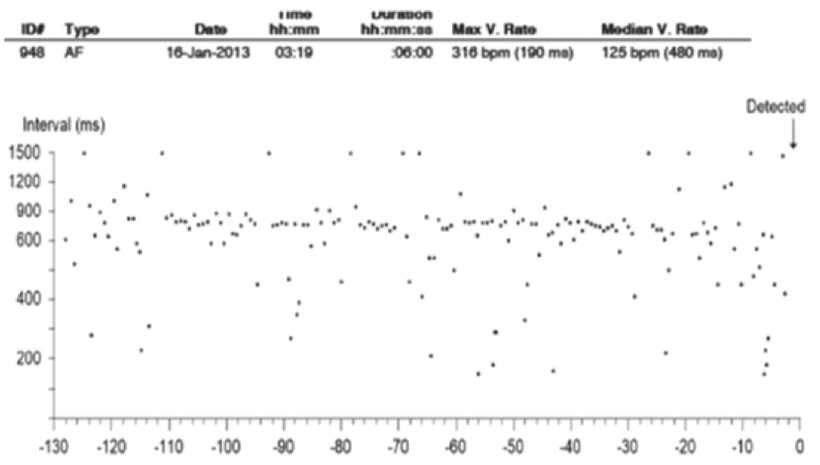
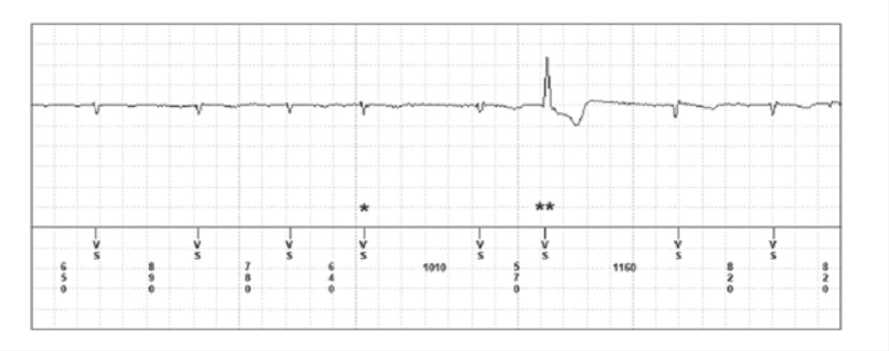
Рис. 3. Опрос ИПР (21 января 2013): а – данные для эпизода 948 продолжительностью 6 мин; б – синусовый ритм с частыми преждевременными сокращениями предсердий, желудочковой аберрацией (*) и без нее (**). Все доступные ЭКГ пациентов показали аналогичный результат. Для двух эпизодов ФП продолжительностью 1–4 ч ЭКГ была недоступна, поэтому невозможно определить ФП после аблации по поводу трепетания
ких пациентов оценить сложно, так как большинство эпизодов асимптомны, продолжительность динамического наблюдения варьирует, и имеющиеся методы динамического контроля ЭКГ не стандартизированы. Согласно данным метаанализа, ФП регистрируется приблизительно у одной трети пациентов во время динамического наблюдения на протяжении 2 лет после катетерной аблации КТП [11]. В клинической практике стратегия мониторинга ЭКГ после аблации отсутствует, так же как достоверно не изучена оптимальная продолжительность приема антикоагулянтов после аблации. Большинство докторов предпочитают поддерживать режим антикоагуляции в течение 1 мес. после аблации: по истечении этого периода при отсутствии ФП прием
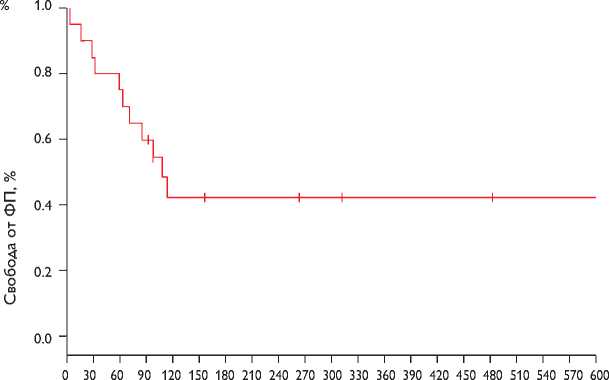
Рис. 4. Свобода от подтвержденного эпизода фибрилляции предсердий после аблации кавотрикуспидального перешейка
Время с момента аблации, дни антикоагулянтов прекращают. В то же время существует мнение о пожизненном приеме антикоагулянтов, так как у большинства пациентов после аблации КТП развивается фибрилляция предсердий.
После катетерной аблации КТП мы имплантировали ИПР со специальным алгоритмом детекции ФП. Цель исследования – определение достоверной частоты ФП у данных пациентов, посредством чего мы могли охарактеризовать время, проведенное в состоянии ФП (AF burden), и продолжительность ФП и установить, может ли эта информация использоваться для разработки оптимальных стратегий мониторинга ЭКГ после аблации трепетания предсердий.
Материал и методы
В пилотное исследование мы включили 20 пациентов с типичным пароксизмальным или персистирующим трепетанием предсердий, которые были направлены на катетерную аблацию КТП. Возраст пациентов не менее 18 лет, у всех пациентов, по данным ЭКГ, зафиксировано пароксизмальное или персистирующее типичное трепетание предсердий, ранее документированные эпизоды ФП отсутствовали. В исследовании участвовали пациенты с показателем CHADS2 ≥ 2, находящиеся в зоне повышенного риска инсульта. Достоверная информация о развитии у таких пациентов ФП после аблации КТП могла влиять на решение об антикоагуляции.
Пациенты не имели показаний к антикоагулянтной терапии за исключением трепетания предсердий. У исследуемых не было необходимости в имплантации постоянного электрокардиостимулятора, дефибриллятора или устройства ресинхронизирующей терапии сердца. Все пациенты подписали информированное согласие. Протокол исследования одобрен экспертными советами Госпиталя Святого Луки – Рузвельта, Нью-Йорк, США; Госпиталя Вэлли, Риджвуд, США; Новосибирского научно-исследовательского института патологи кровообращения имени академика Е.Н. Мешалкина Министерства здравоохранения РФ, Новосибирск, Россия.
Катетерная аблация
Для оценки размера левого предсердия и функции левого желудочка анализировали эхокардиографические данные. Катетерная аблация выполнялась с помощью системы электроанатомической навигации CARTO (Biosense Webster, Diamond Bar, CA) в сочетании с орошаемым аблационным катетером (интегрированная система орошения кончика катетера и аблации ThermoCool, Biosense Webster). Конечной точкой аблации было подтверждение двухстороннего блока проведения через КТП с помощью стимуляции. Ни у одного пациента не было необходимости в назначении антиаритмических препаратов после аблации.
Имплантируемый петлевой регистратор
Непосредственно после аблации пациентам был имплантирован петлевой регистратор (Reveal XT, Model 9529, Medtronic Inc., Minneapolis, MN). Устройство, емкость батареи которого составляет около 3 лет, обладает алгоритмом детекции ФП, который позволяет зафиксировать эпизоды ФП (продолжительностью более 2 мин) и оценить общее время нахождения пациента в состоянии ФП (AF burden). В памяти устройства сохраняются 49,5 мин данных ЭКГ; 27 мин автоматически активирующихся событий и 22,5 мин возникающих событий (активируются пациентом). Показания для удаления ИПР: брадиаритмия, потребовавшая имплантации ЭКС; решение о пожизненной антикоагуляции на основании документированной ФП; отсутствие подтвержденных эпизодов ФП в течение 2 лет после имплантации устройства.
Имплантируемый петлевой регистратор фиксирует информацию о зарегистрированных эпизодах ФП различными путями. Во-первых, сообщает количество эпизодов ФП с момента последнего подключения к нему, наряду с процентом времени, в течение которого пациент находился в состоянии ФП (рис. 1, а ). ЭКГ доступна для каждого эпизода, также определяется процент времени, занятого ФП, сообщенный устройством, и это является «наихудшим сценарием развития» по данным регистратора. Другими словами, это тот процент, при котором устройство обладает 100% специфичностью (учитывая высокую чувствительность устройства, представляется маловероятным, что оно не сможет выявить эпизоды истинной ФП [6]). Во-вторых, устройство ведет список эпизодов аритмии, который включает информацию о дате, времени, продолжительности, средней и максимальной частоте сокращения желудочков за последние 30 эпизодов ФП (рис. 1, б ). Данный список включает все эпизоды, выявленные ИПР, длительностью более 2 мин. Изменить этот параметр выявления невозможно. В-третьих, устройство «сортирует» все отдельные эпизоды ФП в 1 из 8 отдельных временных рамок: 2–10 мин, 10 мин – 1 ч, 1–4, 4–12, 12–24, 24– 48, 48–72 и более 72 ч (рис. 1, в )
Запись и доступность данных ЭКГ зависят от программирования устройства. Во время имплантации специалист должен установить параметр «Запись ЭКГ» во время выявленного периода. Стандартная опция – «Все эпизоды»; в качестве альтернативы можно ограничить запись ЭКГ событиями «≥6 минут», «≥10 минут», «≥20 минут», «≥30 минут», «≥60 минут» (рис. 2). ИПР затем сохраняет данные ЭКГ для двух первых минут послед- них 13 эпизодов, которые соответствуют критериям «Запись ЭКГ» (рис. 3). Тем не менее эти 13 эпизодов должны находиться в числе последних 30 выявленных эпизодов ФП; в противном случае при добавлении новых эпизодов старые удаляются, даже если они были связаны с данными ЭКГ.
У пациентов, которым имплантировался ИПР в США, ежемесячно выполнялся удаленный мониторинг с помощью системы Carelink. Пациенты в России ежеквартально выполняли контрольные визиты; мониторинг Carelink был недоступен. При каждом подключении к устройству (удаленно или непосредственно в клинике) мы определяли количество эпизодов ФП, зафиксированных устройством, процент времени аритмии (AF burden), дату и продолжительность самого длительного эпизода ФП из списка при условии наличия ЭКГ для оценки самого длительного эпизода и количества эпизодов ФП в каждой из 8 категорий продолжительности. Мы также определяли продолжительность самого длительного эпизода ФП с подтвержденной записью ЭКГ-аппаратом подкожного мониторирования.
Статистический анализ
Все непрерывные переменные выражены как средние ± SD. Статистическую оценку функции выживаемости по Каплану – Майеру использовали, чтобы определить свободу от любой подтвержденной ФП, любую подтвержденную и возможную ФП, любой эпизод ФП более 4 и 12 ч во время динамического наблюдения. Все анализы были основаны на конечных точках, полученных 12 апреля 2013 г. Статистически значимым считалось р<0,05.
Результаты
Средний возраст составил 71±10 лет; средний балл по шкале тромбоэмболий CHADS2 – 2. У двух пациентов в анамнезе был перенесенный инсульт; ни одному из пациентов ранее не рекомендовалась антикоагулянтная терапия. Трепетание предсердий носило персистирующий характер у 16 пациентов (80%). Размер левого предсердия у 18 пациентов (90%) составил более 40 мм; фракция выброса миокарда левого желудочка у всех пациентов была более 40%. Амиодарон применен у одного пациента перед аблацией и прекращен после нее. Другие пациенты в исследуемой когорте антиаритми-ческие препараты ранее не получали. Катетерная аблация была успешно выполнена у всех пациентов. После окончания процедуры все пациенты имели синусовый ритм и двухсторонний блок проведения по КТП. Осложнений у данных пациентов не зарегистрировано. Приводим демографические данные пациентов.
|
Пациенты, n |
20 |
|
Место включения |
|
|
Нью-Джерси |
10 |
|
Нью-Йорк |
3 |
|
Россия |
7 |
|
Пол, мужской, n (%) |
16 (80) |
|
Возраст (годы), среднее ± SD |
71±10 |
|
Показатель по CHADS2, n (%) |
|
|
2 |
15 (75) |
|
3 |
5 (25) |
|
Факторы риска инсульта, n (%) |
|
|
Застойная сердечная недостаточность |
6 (30) |
|
Гипертензия |
19 (25) |
|
Сахарный диабет |
7 (35) |
|
Возраст ≥ 75 лет |
7 (35) |
|
Перенесенный ранее инсульт |
2 (10) |
|
Форма трепетания предсердий, n (%) |
|
|
Пароксизмальная |
4 (20) |
|
Персистирующая |
16 (80) |
|
Эхокардиографические данные |
|
|
Дней между проведением ЭхоКГ |
7 |
|
и аблацией, медиана |
|
|
Размер левого предсердия >40 мм, n (%) |
18 (90) |
|
Фракция выброса >40%, n (%) |
20 (100) |
В течение периода наблюдения, средняя продолжительность которого составила 382±218 дней, при опросе и анализе данных, зарегистрированных ИПР, мы выявили 3 различные особенности. Первая – из всех проанализированных пациентов, имеющих эпизоды ФП по данным ИПР, лишь у 11 (55%) при анализе электрограмм подтвердилось наличие истинной ФП. Только у 1 из этих пациентов проявились симптомы, связанные с ФП, остальные пациенты имели асимптомный характер ФП. Диагноз ФП, по данным ЭКГ, был поставлен через 62±38 дней после катетерной аблации КТП (в диапазоне 3–114 дней). Из 11 пациентов с документированной ФП 3 пациента (27%) имели ФП длительностью 1–4 часа, суммарное время, проведенное в состоянии ФП, менее 1%. Пациентов с ФП продолжительностью 2–10 мин или 10 мин – 1 ч не было; у всех 11 пациентов с документированной и подтвержденной ФП эпизод продолжался более 1 ч. Первые эпизоды ФП регистрировались вплоть до 120 дней после аблации КТП. 12-месячная свобода от любой подтвержденной ФП (независимо от продолжительности) составила 42% (рис. 4). 12-месячная свобода от любого одного эпизода ФП составила 52% для эпизодов длительностью более 4 ч и 83% для эпизодов длительностью более 12 ч.
У 4 пациентов (20%), по данным ИПР, имелась ложная детекция ФП, при анализе доступных электрограмм достоверно наличие ФП не подтвердилось, ложно-детектированные эпизоды в действительности представляли собой синусовый ритм с частыми предсердными экстрасистолами, ложная детекция ФП обусловлена гиперчувствительностью устройства (см. рис. 3). Заметим, что данные эпизоды ложной детекции были краткосрочны и никогда не продолжались более 4 ч. У 5 пациентов (25%) в течение средней продолжительности наблюдения 388±247 дней ФП не наблюдалось.
На сегодняшний день ИПР удалены у 6 пациентов (30%). У 2 пациентов впоследствии развились выраженная синусовая брадикардия и признаки синдрома слабости синусового узла, потребовавшие имплантации двухкамерного кардиостимулятора, ИПР был эксплан-тирован. Отметим, что у обоих пациентов ИПР уже документировал множество эпизодов ФП. 3 пациентам назначена пожизненная антикоагулянтная терапия на основании данных ИПР о вновь возникшей пароксизмальной (n = 1) или персистирующей (n = 2) ФП. У 1 пациента ИПР удален после более 2-летнего периода наблюдения, не зарегистрировавшего ни одного эпизода ФП после аблации кавотрикуспидального перешейка.
Обсуждение
По результатам анализа данных пациентов с типичным трепетанием предсердий, отсутствием ранее документированной ФП и повышенным риском инсульта (показатель CHADS2 2 или 3) мы выявили достаточно большой процент появления ФП после аблации КТП, зарегистрированной с помощью ИПР. По нашим данным, у 55% пациентов вновь возникшая ФП подтвердилась. У 20% достоверно доказать наличие ФП при анализе данных ИПР не удалось, у этой группы пациентов зарегистрированное явление аритмии ограничивалось длительностью менее 4 ч. Первый подтвержденный эпизод ФП произошел в среднем через 62 дня (и вплоть до 4 мес.) после аблации КТП, и AF burden варьировало, поэтому, маловероятно, что способы поверхностной записи ЭКГ могли бы зафиксировать данные эпизоды. В связи с чем этот вид регистрации ФП не может заменять ИПР в качестве инструмента длительного мониторинга ФП ввиду низкой специфичности. Время выявления ФП также подчеркивает потенциальный риск произвольной отмены антикоагулянтной терапии у пациентов с высоким риском через 1 мес. после аблации кавотрикуспидального перешейка.
Результаты ретроспективного исследования около 650 000 пациентов популяции Medicare показали, что как ФП, так и трепетание предсердий увеличивает долгосрочный риск инсульта [12]. Пациенты с трепетанием предсердий и ФП имеют аналогичный повышенный риск инсульта, как и пациенты с изолированной ФП. Проведенные ранее исследования уже предполагали высокую частоту ФП у пациентов после аблации КТП [9, 10], по-видимому, эти пациенты имеют общий триггер, который запускает и ФП, и трепетание, но после аблации КТП триггер способен запускать только ФП. Это может подтвердить гипотезу, что изоляция легочных вен, выполненная в сочетании с аблацией КТП у пациентов с анамнезом изолированного трепетания предсердий, является лучшей возможностью долгосрочной свободы от рецидива предсердных аритмий [13]. Однако ни одно из проведенных ранее исследований не предоставляло достоверной информации о продолжительности ФП и точного времени нахождения пациента в состоянии аритмии (AF burden).
В настоящее время стандартного подхода к мониторингу ритма после аблации КТП не существует. В клинической практике, если после аблации кавотрикуспидального перешейка восстанавливается синусовый ритм, антикоагулянтная терапия прекращается. На основании ограничений Холтеровского мониторирования и систем длительной телеметрии (лимитированная продолжительность записи) и доступности систем ИПР мы назначали имплантацию ИПР, используя устройство со специальным алгоритмом детекции ФП, пациентам с изолированным трепетанием предсердий, которым выполнялась аблация КТП и которые имели повышенный риск инсульта. В настоящее время существуют предпосылки связи количества и длительности эпизодов фибрилляции предсердий для определения потребности в антикоагулянтной терапии и стратификации рисков тромбоэмболий для пациентов после аблации КТП, на чем и была основана наша стратегия имплантации аппарата подкожного мониторирования ЭКГ для точной детекции ФП.
Характеристики использовавшихся ИПР были официально тестированы в исследовании XPECT [6], где золотым стандартом был Холтеровский мониторинг, выполненный в когорте из 206 пациентов с фибрилляцией предсердий в анамнезе. Чувствительность, специфичность, положительная (ППЗ) и отрицательная прогностическая значимость выявления пациентов с
ФП составили 96,1, 85,4, 79,3, и 97,4% соответственно. ППЗ увеличивалась пропорционально повышению продолжительности любого отдельного эпизода с 2 до 20 мин; о влиянии на ППЗ большей продолжительности эпизодов не сообщалось. Так как чувствительность и специфичность являются функцией периода мониторинга, и мониторинг был ограничен 46-часовой продолжительностью Холтеровского исследования, авторы выявили, что при большей продолжительности мониторинга специфичность могла бы снизиться. Действительно, это было показано в результатах недавнего исследования, в котором 22% классифицированных ИПР эпизодов ФП были в конечном счете при более тщательном анализе сочтены синусовым ритмом [14]. Тем не менее высокая чувствительность и отрицательная прогностическая значимость системы гарантируют, что пациенты с отсутствием доказательств ФП действительно свободны от нее. При поверхностном мониторинге ЭКГ, напротив, на отсутствие ФП могут повлиять приверженность пациента к осмотру и сама продолжительность мониторинга. Необходимо проведение более крупных исследований для установления связи между продолжительностью ФП и риском инсульта. Мы выявили, что ИПР – эффективный метод детекции ФП при рассмотрении эпизодов длительностью более 4 ч. Некоторые доступные данные предполагают, что риск тромбоэмболии не увеличивается кроме случаев, в которых наибольшая продолжительность ФП превышает 5,5 ч. Однако данный риск может оставаться прежним даже при продолжительности эпизода более 17,72 ч [3, 4]. В нашем исследовании 83% пациентов были свободны от ФП, если рассматривались эпизоды более 12 ч. С другой стороны, данные обнаруживают, что даже эпизоды более 5 мин у пациентов с показателем CHADS2 не менее 2 имеют прогностическую значимость [15]. В соответствии с тем что достоверное выявление более коротких эпизодов ФП остается сложной задачей [16], наши данные показывают, что нынешнее поколение ИПР обладает техническими ограничениями, и поэтому не влияют на клинические решения, если продолжительность эпизодов менее 4 ч считается прогностически значимой. Дальнейшие исследования, по нашему мнению, должны быть направлены на точную классификацию достоверных эпизодов ФП, которая в свою очередь могла бы предоставить более точную информацию о времени нахождения в состоянии ФП, сохранении данных ЭКГ, связанных с наиболее длительным эпизодом, и мгновенную (беспроводную) передачу критических данных для предотвращения их перезаписи и помощи для принятия клинических решений у пациентов с высоким риском инсульта [17].
Ограничения исследования
В проведенном исследовании, во-первых, отсутствовал достоверный способ определения свободы от ФП до аблации КТП, так как мы не имплантировали ИПР до аблации. Ввиду того что у большинства пациентов форма трепетания предсердий была персистирующей, было невозможно оценить асимптомные эпизоды ФП. Во-вторых, мы не проводили одновременное Холтеровское исследование у пациентов, которые считались свободными от ФП по данным ИПР, тем не менее было показано, что использованная система ИПР фиксирует все эпизоды ФП [6]. В-третьих, мы отметили низкую чувствительность устройства в дифференцировке предсердной экстрасистолии, которая чаще всего ложно детектировалась устройством как ФП. Эффект от недавно улучшенного программного обеспечения на это явление у наших пациентов не оценивался [14]. Наконец, наше исследование было пилотным и не обладало достаточной мощностью для верификации клинических характеристик, которые могут быть предикторами развития ФП после аблации кавотрикуспидального перешейка.
Заключение
Фибрилляция предсердий после катетерной аблации КТП выявляется у многих пациентов, что позволяет предположить наличие одного триггера для этих двух нарушений ритма, вероятнее всего запускающего трепетание предсердий до аблации КТП, а фибрилляцию предсердий – после вмешательства. Несмотря на то что выявленная ФП носила пароксизмальный характер и у большинства пациентов длилась менее 24 ч, ее продолжительность была достаточной для повышения риска тромбоэмболии [4]. Таким образом, имплантируемые подкожные мониторы ЭКГ могут влиять на контроль ФП и принятие клинических решений у пациентов с высоким риском.
Список литературы Имплантируемый аппарат длительного мониторирования ЭКГ для выявления фибрилляции предсердий после аблации кавотрикуспидального перешейка у пациентов с трепетанием предсердий
- Fuster V., Ryden L.E., Cannom D.S., et al. 2011ACCF/AHA/HRS focused updates incorporated into the ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines//Circulation. 2011. Vol. 123. P. 269-367.
- Gage B.F., Waterman A.D., Shannon W., Boechler M., Rich M.W., Radford M.J. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation//JAMA. 2001. Vol. 285. P. 2864-2890.
- Glotzer T.V., Daoud E.G., Wyse D.G., et al. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk: the TRENDS study//Circ. Arrhythm. Electrophysiol. 2009. Vol. 2. P. 474-480.
- Healey J.S., Connolly S.J., Gold M.R., et al. for the ASSERT Investigators. Subclinical atrial fibrillation and the risk of stroke//N. Engl. J. Med. 2012. Vol. 366. P. 120-129.
- Mittal S., Movsovitz C., Steinberg J.S. Ambulatory external electrocardiographic monitoring: focus on atrial fibrillation//J. Am. Coll. Cardiol. 2011. Vol. 58. P. 1741-1749.
- Hindricks G., Pokushalov E., Urban L., et al. on behalf of the XPECT Trial Investigators. Performance of a new leadless implantable cardiac monitorin detecting and quantifying atrial fibrillation: results of the xPECT trial. Circ Arrhythm Electrophysiol. 2010; 3: 141-147.
- Babaev A., Suma V., Tita C., Steinberg J.S. Recurrence rate of atrial flutter after initial presentation in patients on drug treatment//Am. J. Cardiol. 2003. Vol. 92. P. 1122-1124.
- Natale A., Newby K.H., Pisano E., et al. Prospective randomized comparison of antiarrhythmic therapy versus first-line radiofrequency ablation in patients with atrial flutter//J. Am. Coll. Cardiol. 2000. Vol. 35. P. 1898-1904.
- Ellis K., Wazni O., Marrouche N., et al. Incidence of atrial fibrillation post-cavotricuspid isthmus ablation in patients with typical atrial flutter: left-atrialsize as an independent predictor of atrial fibrillation recurrence//J. Cardiovasc. Electrophysiol. 2007. Vol. 18. P. 799-802.
- Luria D.M., Hodge D.O., Monahan K.H., et al. Effect of radiofrequency ablation of atrial flutter on the natural history of subsequent atrial arrhythmias//J. Cardiovasc. Electrophysiol. 2008. Vol. 19. P. 1145-1150.
- Perez F.J., Schubert C.M., Parvez B., Pathak V., Ellenbogen K.A., Wood M.A. Long-term outcomes after catheter ablation of cavotricuspid isthmus dependent atrial flutter: a metaanalysis//Circ. Arrhythm. Electrophysiol. 2009. Vol. 2. P. 393-401.
- Biblo L.A., Yuan Z., Quan K.J., Mackell J.A., Rimm A.A. Risk of stroke in patients with atrial flutter//Am. J. Cardiol. 2001. Vol. 87. P. 346-349.
- Navarrette A., Conte F., Moran M., Ali I., Milikan N. Ablation of atrial fibrillation at the time of cavotricuspid isthmus ablation in patients with atrial flutter without documented atrial fibrillation derives a better long-term benefit//J. Cardiovasc. Electrophysiol. 2011. Vol. 22. P. 34-38.
- Eitel C., Husser D., Hindricks G., et al. Performance of an implantable automatic atrial fibrillation detection device: impact of software adjustments and relevance of manual episode analysis//Europace. 2011. Vol. 12. P. 480-485.
- Botto G.L., Padeletti L., Santini M., et al. Presence and duration of atrial fibrillation detected by continuous monitoring: crucial implications for the risk of thromboembolic events//J. Cardiovasc. Electrophysiol. 2009. Vol. 20. P. 241-248.
- Kapa S., Epstein A.E., Callans D.J., et al. Assessing arrhythmia burden using an implantable loop recorder: the ABACUS study//J. Cardiovasc. Electrophysiol. 2013. Vol. 24. P. 875-881.
- Paruchuri V., Adhaduk M., Garikipati N.V., Steinberg J.S., Mittal S. Clinical utility of a novel wireless implantable loop recorder in the evaluation of patients with unexplained syncope//Heart Rhythm. 2011. Vol. 8. P. 858-863.


