In vitro биохимические особенности применения холодной плазмы в клетках экспериментального рака молочной железы MCF-7
Автор: Зиннурова А.Б., Воробьев К.П., Бакина О.В., Сенькина Е.И., Спирина Л.В., Носарева О.Л., Жаворонок Т.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.23, 2024 года.
Бесплатный доступ
Введение. Низкотемпературная плазма в настоящее время находит применение в медицине, в том числе в терапии опухолей. Активированные плазмой биологические растворы предложены в качестве потенциальных реагентов для лечения рака. Однако биологические эффекты в клетках, вызываемые воздействием холодной плазмы, остаются неизученными. Исследование молекулярных механизмов воздействия холодной плазмы на клетки имеет важное значение для ее клинического применения. Целью исследования явилась оценка влияния воздействия холодной плазмы на особенности изменения жизнеспособности, активности каталазы, содержания малонового диальдегида в культурах клеток рака молочной железы MCF-7 по сравнению с нормальными клетками фибробластов подкожно-соединительной ткани мыши 3T3. Материал и методы. В качестве объектов исследования использовали клетки эпителия молочной железы млекопитающих MCF-7, в качестве сравнения - клетки эмбриональных фибробластов мыши NIH/3T3. Обработку клеточных суспензий проводили при помощи низкотемпературной плазмы атмосферного разряда с убегающими электронами. Для количественной оценки жизнеспособности клеточных линий использовали аннексин V и пропидия йодид. Содержание малонового диальдегида определяли по развивающейся окраске его раствора с 2-тиобарбитуровой кислотой при высокой температуре в кислой среде. Активность каталазы оценивали по скорости разложения перекиси водорода за определенное время инкубации смеси.
Холодная плазма, клетки рака молочной железы mcf-7, перекисное окисление липидов, каталаза, малоновый диальдегид
Короткий адрес: https://sciup.org/140308742
IDR: 140308742 | УДК: 618.19-006.6:575.853:533.9]-092.4 | DOI: 10.21294/1814-4861-2024-23-6-89-96
Текст научной статьи In vitro биохимические особенности применения холодной плазмы в клетках экспериментального рака молочной железы MCF-7
В настоящее время технология холодной плазмы (ХП) представляет собой перспективный подход воздействия на клетки человека [1] и находит применение для дезинфекции и заживления ран, стерилизации медицинских изделий и в противоопухолевой терапии [2]. В последние годы все больше исследователей обращают внимание на влияние ХП на опухолевые культуры клеток человека. Полагают, что данный подход может быть перспективным для лечения злокачественных новообразований [3, 4]. Ранее сообщалось, что активируемая ХП среда оказывала in vitro противоопухолевое воздействие на клетки глиобластомы головного мозга [5], карциномы яичников [6], раковые клетки поджелудочной железы [7] и др. Однако биологические эффекты, вызываемые данным воздействием, остаются неизученными.
Взаимодействия ХП с биологическими жидкостями широко изучались рядом авторов [8, 9]. Поток ионизованного газа, имеющий относительно низкую температуру, способен активировать раз- личные молекулы и частицы [10]. Поскольку воздух содержит азот, кислород и воду, в нем генерируются короткоживущие радикалы - активные формы кислорода (АФК), модель генерации которых в результате взаимодействия плазменной струи с воздухом и растворами впервые исследована A.M. Hirst et al. [11]. Холодная плазма способна взаимодействовать с питательной средой для культур клеток, содержащей большое количество компонентов, включая неорганические соли, витамины и аминокислоты [12-14]. Полученные данные свидетельствовали о потере функций аминокислот как питательных веществ и об увеличении содержания перекисных радикалов в присутствии лактата. Кроме того, генерация АФК являлась ключевым звеном в развитии окислительного стресса (ОС), приводящего к гибели клетки [15] за счет окислительной модификации макромолекул (ОММ), в частности полипептидов [16]. В недавних исследованиях было показано, что пьезоэлектрическая ХП индуцирует апоптоз и аутофагию в клетках гепатоцеллюлярной карциномы человека путем блокирования гликолиза и пути AKT/mTOR/HIF-1α [17, 18]. Таким образом, понимание молекулярных механизмов воздействия ХП на клетки имеет важное клиническое значение для ее клинического применения.
Целью исследования явилось изучение влияния ХП на особенности апоптоза, активности каталазы, содержания малонового диальдегида (МДА) в культурах клеток рака молочной железы MCF-7 и нормальных клеток - 3T3 фибробластов подкожно-соединительной ткани мыши.
Материал и методы
Клетки эпителия молочной железы млекопитающих (MCF-7) и клетки эмбриональных фибробластов мыши (NIH/3T3) инкубировали в питательной среде ДМЕМ/F-12 с L-глутамином (Биолот, Россия), с добавлением 10 % сыворотки крупного рогатого скота (HiClone, США) и 1 % пенициллин/стрептомицина (Биолот, Россия) при 37 °C в атмосфере 5 % CO2 (MCO-5AC Sanyo, Япония). После образования монослоя со 100 % конфлюентностью на дне культуральной чашки Петри клетки снимали раствором Трипсина-Версена (Биолот, Россия). Количество живых клеток определяли окрашиванием витальным красителем трипановым синим (Биолот, Россия). Клетки высевали в 24-луночные планшеты (Costar, США) с питательной средой по 1,8×105 клеток в каждую лунку и культивировали в течение 30 мин при температуре 37 °C и 5 % CO2.
Обработку ХП проводили при помощи низкотемпературной плазмы атмосферного разряда с убегающими электронами (Atmospheric Discharge with Runaway Electrons – DRE) на установке «Артемида» [19]. Планшет с клеточной культурой помещали между электродами установки на расстоянии 30 мм от верхнего электрода. Обработку ХП проводили в режиме непрерывной генерации импульсов при амплитуде импульсов выходного напряжения - 56 кВ, длительности фронта импульса - 10 нс, длительности импульса на полувысоте -40 нс. Применяемая в установке конструкция электрода позволяет эффективно и равномерно обрабатывать убегающими электронами полимерные волокнистые материалы по всей внешней и внутренней поверхности [20].
Для количественной оценки жизнеспособности клеточных линий использовали аннексин V (FITC) и пропидия йодид (PI). Аннексин-V является типичным маркером гибели клеток, который широко используется при оценке жизнеспособности клеток при химическом или физическом воздействии [21]. Комбинированная окраска аннексином-V и красителем PI позволяет идентифицировать живые клетки как отрицательные по аннексину V и отрицательные по пропидий йодиду (Аннексин V–/ PI–), клетки не будут окрашены. На ранней стадии апоптоза клетки связывают аннексин V, но будут отрицательны по пропидий йодиду (Аннексин
V+/PI–). Апоптотические клетки с нарушенной в результате вторичного некроза целостностью мембраны будут окрашены PI и иметь ореол зеленого/ дальне-красного окрашивания на плазматической мембране (Аннексин V+/PI+). Некротические клетки в результате проникновения йодистого про-пидия внутрь будут окрашены красным (PI+).
Клеточную суспензию переносили из лунок планшета в пробирки Эппендорфа объемом 1,5 мл, центрифугировали, дважды промывали натрийфосфатным буфером (PBS) и ресуспендировали в буфере, связывающем аннексин V с метили аннек-сином V-FITC и пропидий йодидом в соответствии с инструкциями производителя (BD Pharmingen, США). Для каждого измерения было проанализировано не менее 10 000 клеток методом проточной цитометрии (Beckman Coulter CytoFLEX, США).
МДА определяли по развивающейся окраске при взаимодействии МДА и 2-тиобарбитуровой кислоты (ТБК) при высокой температуре в кислой среде. Клетки дважды промывали PBS, лизировали ультразвуком и центрифугировали. К 1 мл надосадочной жидкости добавляли 1 мл 10 % трихлоруксусной кислоты (ТХУ) и 0,5 мл 0,75 % тиобарбитуровой кислоты (ТБК). Далее пробы помещали в кипящую водяную баню на 15 мин. Пробы охлаждали, центрифугировали при 3 000 об/мин в течение 10 мин. Оптическую плотность надосадочной жидкости измеряли при длине волны 532 нм.
Активность каталазы оценивали по скорости разложения перекиси водорода за определенное время инкубации смеси при температуре 37 °С. Метод является быстрым, точным и соответствует принципам зеленой химии. Химические вещества, используемые в этом методе, более безопасны для окружающей среды, чем те, которые использовались ранее, например в ферритиоцианатном методе [22]. Количественное определение перекиси водорода проводили с помощью цветной реакции с молибденовокислым аммонием при длине волны 410 нм. К 0,1 мл промытых и лизированных клеток добавляли 2,0 мл 0,03 % раствора перекиси водорода и инкубировали 10 мин при 37 °С. Реакцию останавливали добавлением 1,0 мл 4 % раствора молибдата аммония. Пробы центрифугировали 10 мин при 4 000 об/мин, интенсивность развивающейся окраски измеряли на спектрофотометре при длине волны 410 нм.
Статистическую обработку результатов проводили с применением пакета статистических программ STATISTICA 10.0. Проверка предположения о нормальности распределения признаков выполнялась с использованием критерия Колмогорова–Смирнова. Значимость различий оценивали по критерию Манна–Уитни. Данные представлены как Me (Q1;Q3). Корреляционный анализ был проведен с помощью непараметрического критерия Спирмена.
Результаты и обсуждение
При исследовании апоптоза клеточных линий методом проточной цитометрии (рис. 1) отмечено, что в культуре клеток MCF-7 количество клеток в стадии некроза составляло 21 %, в стадии раннего апоптоза - 3 %, в стадии позднего апоптоза - 13 %.
После 1-й мин облучения ХП были отмечены следующие изменения (таблица): количество живых клеток снижалось до 43,81 %, количество клеток в стадии некроза снижалось незначительно (14,73 %). Вместе с этим, значительно увеличивалось количество клеток в стадии раннего (34,74 %) и позднего (6,72 %) апоптоза. Увеличение количества апоптических клеток MCF-7 одновременно со снижением их жизнеспособности свидетельствовало о повреждающем действии ХП уже в течение 1 мин экспозиции.
Дальнейшее увеличение длительности воздействия ХП до 2 мин привело к снижению количества живых клеток в клеточной культуре MCF-7 до 34,05 % и увеличению клеток в стадии раннего апоптоза до 38,47 % и в стадии позднего апоптоза до 16,88 %. Таким образом, количество жизнеспособных клеток при воздействии ХП снизилось в 1,8 раза по сравнению с контролем, также увеличился процент раннего и позднего апоптоза при снижении доли клеток, находящихся в некрозе.
Для оценки токсического воздействия ХП на нормальные клетки исследовали изменение жизнеспособности клеточной линии 3Т3, обладающей высокой чувствительностью и рекомендованной ГОСТ Р ИСО 10993.5 [23] . В контроле клеток 3T3 количество клеток в стадии некроза составляло 18,53 %, в стадии раннего апоптоза - 28,03 %, в стадии позднего апоптоза - 3,09 %. После первой минуты обработки ХП не наблюдалось изменения количества жизнеспособных клеток по сравнению с контролем. После 2 мин облучения ХП количество
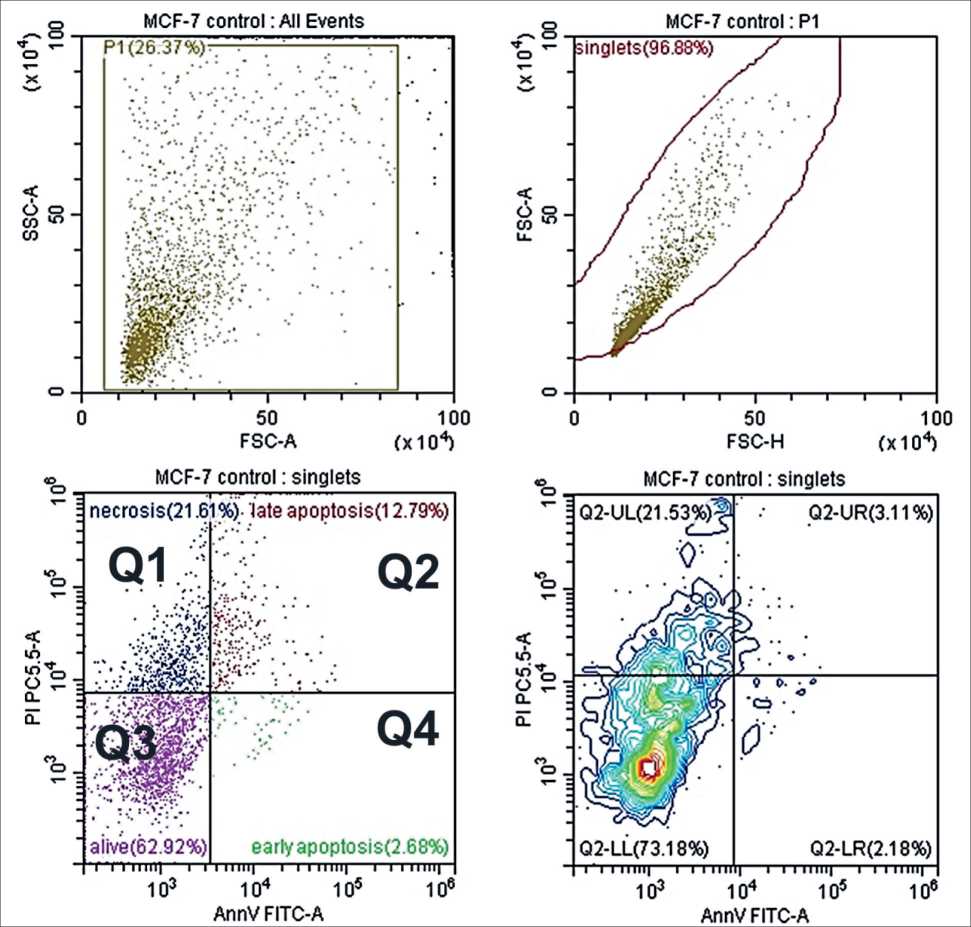
Рис. 1. Анализ жизнеспособности клеточной линии MCF-7 двойным окрашиванием аннексином V (FIТC) и PI до обработки ХП. Примечания: Q1 - некротические клетки; Q2 - поздние апоптотические клетки; Q4 - ранние апоптотические клетки и
Q3 - жизнеспособные клетки; рисунок выполнен авторами
Fig. 1. Features of viability in MCF-7 cell culture by annexin V (FIТC) and propidium iodide-doubled staining before cold plasma treatment. Notes: Q1- shows necrotic cells; Q2 - shows late apoptotic cells; Q4- shows early apoptotic cells, and Q3 - shows the viable cells; created by the authors
Таблица/table
Особенности апоптоза, активности каталазы, содержания МДА в культурах клеток рака молочной железы MCF-7, 3t3 фибробластов мыши под влиянием холодной плазмы the influence of cold plasma on apoptosis, catalase activity and Mda content in MCF-7 and 3t3 cells
|
Показатели/ Parameters |
Контроль/ Control |
MCF-7 1 мин/1 min |
Q25 |
3T3 1 мин/1 min |
2 мин/2 min |
|
|
2 мин/2 min |
Контроль/ Control |
|||||
|
МДА, мкмоль/л / MDA, μM/L (×10-5) |
0,0128 (0,0064;0,018) |
0,019 (0,019; 0,00212) |
0,021 (0,00897; 0,030)* |
0,018 (0,00577; 0,019) |
0,021 (0,020; 0,0288) |
0,022 (0,022; 0,0314) |
|
Каталаза, мкмоль/мин×л/ Catalase, μmol/min×L (×10-3) |
0,428 (0,261; 0,610) |
0,451 (0,216; 0,622) |
0,380 (0,229; 0,532) |
0,495 (0,272; 0,648) |
0,423 (0,356; 0,666) |
0,288 (0,144; 0,514)* ** |
|
Апоптоз/Apoptosis |
26,09 % (15,47; 34,95) |
29,28 % (23,29; 41,46) |
25,48 % (19,70; 55,35) |
35,38 % (31,12; 44,13) |
35,73 % (24,42; 44,70) |
32,94 % (24,81; 37,80) |
|
Некроз/Necrosis |
26,54 % (13,84; 28,55) |
23,44 % (14,73;30,11) |
23,55 % (10,61; 19,70) |
18,75 % (13,40; 21,09) |
19,09 % (15,13; 22,89) |
19,05 % (15,75; 21,86) |
Список литературы In vitro биохимические особенности применения холодной плазмы в клетках экспериментального рака молочной железы MCF-7
- Bernhardt T., Semmler M.L., Schäfer M., Bekeschus S., Emmert S., Boeckmann L. Plasma Medicine: Applications of Cold Atmospheric Pressure Plasma in Dermatology. Oxid Med Cell Longev. 2019. https://doi.org/10.1155/2019/3873928.
- Gao L., Shi X., Wu X. Applications and challenges of low temperature plasma in pharmaceutical field. J Pharm Anal. 2021; 11(1): 28-36. https://doi.org/10.1016/j.jpha.2020.05.001.
- Babington P., Rajjoub K., Canady J., Siu A., Keidar M., Sherman J.H. Use of cold atmospheric plasma in the treatment of cancer. Biointerphases. 2015; 10(2). https://doi.org/10.1116/1.4915264.
- Yan D., Cui H., Zhu W., Nourmohammadi N., Milberg J., Zhang L.G., Sherman J.H., Keidar M. The Specific Vulnerabilities of Cancer Cells to the Cold Atmospheric Plasma-Stimulated Solutions. Sci Rep. 2017; 7(1): 4479. https://doi.org/10.1038/s41598-017-04770-x.
- Tanaka H., Mizuno M., Ishikawa K., Nakamura K., Kajiyama H., Kano H., Kikkawa F., Hori M. Plasma-activated medium selectively kills glioblastoma brain tumor cells by down-regulating a survival signaling molecule, AKT kinase. Plasma Med. 2011; 1(3-4): 265-77. https://doi.org/10.1615/PlasmaMed.2012006275.
- Utsumi F., Kajiyama H., Nakamura K., Tanaka H., Mizuno M., Ishikawa K., Kondo H., Kano H., Hori M., Kikkawa F. Effect of indirect nonequilibrium atmospheric pressure plasma on anti-proliferative activity against chronic chemo-resistant ovarian cancer cells in vitro and in vivo. PLoS One. 2013; 8(12). https://doi.org/10.1371/journal.pone.0081576.
- Hattori N., Yamada S., Torii K., Takeda S., Nakamura K., Tanaka H., Kajiyama H., Kanda M., Fujii T., Nakayama G., Sugimoto H., Koike M., Nomoto S., Fujiwara M., Mizuno M., Hori M., Kodera Y. Effectiveness of plasma treatment on pancreatic cancer cells. Int J Oncol. 2015; 47(5): 1655-62. https://doi.org/10.3892/ijo.2015.3149.
- Jablonowski H., Schmidt-Bleker A., Weltmann K.D., von Woedtke T., Wende K. Non-touching plasma-liquid interaction - where is aqueous nitric oxide generated? Phys Chem Chem Phys. 2018; 20(39): 25387-98. https://doi.org/10.1039/c8cp02412j.
- Takeda K., Ishikawa K., Tanaka H., Sekine M., Hori M. Spatial distributions of O, N, NO, OH and vacuum ultraviolet light along gas flow direction in an AC-excited atmospheric pressure Ar plasma jet generated in open air. J Physics D: Appl Physics. 2017; 50(19). https://doi.org/10.1088/1361-6463/aa6555.
- Lim K., Hieltjes M., van Eyssen A., Smits P. Cold plasma treatment. J Wound Care. 2021; 30(9): 680-3. https://doi.org/10.12968/jowc.2021.30.9.680.
- Hirst A.M., Frame F.M., Arya M., Maitland N.J., O’Connell D. Low temperature plasmas as emerging cancer therapeutics: the state of play and thoughts for the future. Tumour Biol. 2016; 37(6): 7021-31. https://doi.org/10.1007/s13277-016-4911-7.
- Ishikawa K., Hosoi Y., Tanaka H., Jiang L., Toyokuni S., Nakamura K., Kajiyama H., Kikkawa F., Mizuno M., Hori M. Non-thermal plasma-activated lactate solution kills U251SP glioblastoma cells in an innate reductive manner with altered metabolism. Arch Biochem Biophys. 2020; 688. https://doi.org/10.1016/j.abb.2020.108414.
- Takahashi Yo., Taki Yu., Takeda K., Hashizume H., Tanaka H., Ishikawa K., Hori M. Reduced HeLa cell viability in methionine‐containing cell culture medium irradiated with microwave‐excited atmospheric-pressure plasma. Plasma Processes and Polymers. 2018; 15(3). https://doi.org/10.1002/ppap.201700200.
- Liu Ya., Ishikawa K., Miron C., Hashizume H. Hydrogen peroxide in lactate solutions irradiated by non-equilibrium atmospheric pressure plasma. Plasma Sources Sci Technol. 2021; 30(4). https://doi.org/10.1088/1361-6595/abbbd4.
- Al Mamun A., Wu Y., Monalisa I., Jia C., Zhou K., Munir F., Xiao J. Role of pyroptosis in spinal cord injury and its therapeutic implications. J Adv Res. 2020; 28: 97-109. https://doi.org/10.1016/j.jare.2020.08.004.
- Dubey S.K., Dabholkar N., Pal U.N., Singhvi G., Sharma N.K., Puri A., Kesharwani P. Emerging innovations in cold plasma therapy against cancer: A paradigm shift. Drug Discov Today. 2022; 27(9): 2425-39. https://doi.org/10.1016/j.drudis.2022.05.014.
- Wang Y., Mang X., Li X., Cai Z., Tan F. Cold atmospheric plasma induces apoptosis in human colon and lung cancer cells through modulating mitochondrial pathway. Front Cell Dev Biol. 2022; 10. https://doi.org/10.3389/fcell.2022.915785.
- Wang Y., Mang X., Li D., Chen Y., Cai Z., Tan F. Piezoeletric cold atmospheric plasma induces apoptosis and autophagy in human hepatocellular carcinoma cells through blocking glycolysis and AKT/mTOR/ HIF-1α pathway. Free Radic Biol Med. 2023; 208: 134-52. https://doi.org/10.1016/j.freeradbiomed.2023.07.036.
- Maltsev A.N. Dense gas discharge with runaway electrons as a new plasma source for surface modification and treatment. IEEE transactions on plasma science. 2006; 34(4): 1166-74.
- Lozhkomoev A.S., Glazkova E.A., Khorobraya E.G., Lerner M.I., Mal'tsev A.N., Podkovyrov V.G. Modifikatsiya poverkhnosti polimernykh volokon DRE-plazmoi dlya adgezii chastits oksigidroksida alyuminiya. Izvestiya vysshikh uchebnykh zavedenii. 2013; 56(4): 22-6.
- Kumar V., Sharma N., Maitra S.S. In vitro and in vivo toxicity assessment of nanoparticles. Int Nano Lett. 2017; 7(4): 243-56. https://doi.org/10.1007/s40089-017-0221-3.
- Hadwan M.H., Abed H.N. Data supporting the spectrophotometric method for the estimation of catalase activity. Data Brief. 2015; 6: 194-99. https://doi.org/10.1016/j.dib.2015.12.012.
- GOST R ISO 10993.5. Izdeliya meditsinskie. Otsenka biologicheskogo deistviya meditsinskikh izdelii. Ch. 5. Issledovanie na tsitotoksichnost': metody in vitro
- Shan K., Feng N., Zhu D., Qu H., Fu G., Li J., Cui J., Chen H., Wang R., Qi Y., Chen Y.Q. Free docosahexaenoic acid promotes ferroptotic cell death via lipoxygenase dependent and independent pathways in cancer cells. Eur J Nutr. 2022; 61(8): 4059-75. https://doi.org/10.1007/s00394-022-02940-w.
- Wang Y., Mang X., Li D., Wang Z., Chen Y., Cai Z., Tan F. Cold atmospheric plasma sensitizes head and neck cancer to chemotherapy and immune checkpoint blockade therapy. Redox Biol. 2024; 69. https://doi.org/10.1016/j.redox.2023.102991.
- Dai X., Wu J., Lu L., Chen Y. Current Status and Future Trends of Cold Atmospheric Plasma as an Oncotherapy. Biomol Ther (Seoul). 2023; 31(5): 496-514. https://doi.org/10.4062/biomolther.2023.027.
- Gay-Mimbrera J., García M.C., Isla-Tejera B., Rodero-Serrano A., García-Nieto A.V., Ruano J. Clinical and Biological Principles of Cold Atmospheric Plasma Application in Skin Cancer. Adv Ther. 2016; 33(6): 894-909. https://doi.org/10.1007/s12325-016-0338-1. Erratum in: Adv Ther. 2016.


