Ин виво дозиметрия люминесцентными микродозиметрами при брахитерапии рака молочной железы источником 192Ir: разработка технологии и клиническая апробация
Автор: Жарова Е.П., Степаненко В.Ф., Киселва М.В., Богачва В.В., Аминов Г.Г., Колыженков Т.В., Петухов А.Д., Жарикова И.А., Демьянович А.В., Борышева Н.Б., Иванов С.А., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 2 т.29, 2020 года.
Бесплатный доступ
Необходимость ин виво дозиметрии, как существенной части программы обеспечения качества радиотерапии, подчёркивается в рекомендациях ВОЗ, МАГАТЭ и МКРЗ. Это особенно актуально при брахитерапии (БТ) с использованием таких источников как 192Ir, когда имеет место большой градиент поглощённой дозы на малых расстояниях от излучателя. Мультифракционная адъювантная брахитерапия рака молочной железы (РМЖ) может сопровождаться существенными вариациями распределения реально отпущенных поглощённых доз по сравнению с расчётным дозиметрическим планом - из-за подвижности тканей и изменения формы молочной железы (МЖ) в процессе радиотерапии. В данной публикации представлены результаты разработки технологии ин виво дозиметрии с применением термолюминесцентных микродозиметров LiF:Mg,Ti применительно к высокомощностной БТ РМЖ с целью верификации расчётных доз. Технология апробирована в клинических условиях при проведении мультифракционной (десять фракций, по две фракции в день) адъювантной БТ РМЖ с использованием 192Ir. Миниатюрность размеров люминесцентных дозиметров (около 100 мкм) позволила размещать их в виде сборок в намеченных положениях на неповреждённых кожных участках МЖ - вблизи мест входа и выхода интродьюсеров для источника 192Ir. В данном случае локальные участки кожи МЖ вблизи мест входа и выхода интродьюсеров с 192Ir рассматривались как потенциально наиболее облучаемые, то есть, как критические. Измерения локальных поглощённых доз в кожных участках МЖ были проведены в 100 точках (суммарно) у 12 пациенток. По полученным результатам установлено: в 34% измерений (от их общего числа) результаты ин виво дозиметрии и расчётные локальные дозы согласуются между собой в пределах погрешностей измерений; в 21% измеренные локальные дозы достоверно превышают расчётные (превышение величин измеренных доз над расчётными дозами находится в пределах от 15 до 58%); в 45% измеренные локальные дозы достоверно меньше расчётных (разница в величинах измеренных и расчётных локальных доз находится в пределах от 26 до 58% по отношению к расчётным дозам). У 8 пациенток максимальные величины суммарных измеренных локальных поглощённых доз в коже МЖ превышали 10 Гр (от 10,1 до 27,0 Гр). Полученные результаты показывают необходимость и полезность инструментальной верификации расчётных доз при БТ РМЖ источником 192Ir. Выявленные случаи больших величин измеренных локальных поглощённых доз (более 10 Гр) являются основанием для динамического наблюдения за состоянием кожи молочной железы пациенток после брахитерапии - с целью принятия необходимых мер в отношении возможных лучевых осложнений.
Ин виво дозиметрия, термолюминесцентные дозиметры, тл-микродозиметры, мультифракционная адъювантная брахитерапия, рак молочной железы
Короткий адрес: https://sciup.org/170171532
IDR: 170171532 | УДК: 618.19-006.6-085.849.5:546.93.02.192 | DOI: 10.21870/0131-3878-2020-29-2-67-77
Текст научной статьи Ин виво дозиметрия люминесцентными микродозиметрами при брахитерапии рака молочной железы источником 192Ir: разработка технологии и клиническая апробация
Ин виво дозиметрия пациентов (ИВД) рекомендуется ВОЗ, МАГАТЭ и МКРЗ как существенный элемент гарантий качества при радиотерапии злокачественных новообразований [1-3]. При проведении брахитерапии (БТ) [4-10], когда имеет место большой градиент поглощённой дозы в облучаемых тканях на малых расстояниях от источника излучения (например, при БТ источником 192Ir с высокой мощностью дозы), применение ИВД особенно необходимо, так как даже небольшие различия между планируемыми и реальными расстояниями «источник – облу-
чаемая ткань» из-за подвижности тканей и изменения формы молочной железы (МЖ) в процессе БТ рака молочной железы (РМЖ) могут привести к существенной разнице между величинами планируемых и реальных поглощённых доз в областях интереса.
Отмечено [11], что после комплексного лечения РМЖ с использованием мультифракци-онной высокомощностной БТ кожные реакции в виде пигментации и эритемы первой степени выраженности наблюдались у 21 и 15% пациенток соответственно (период наблюдения – 18 месяцев после терапии); при более длительном сроке наблюдения (60 месяцев) после высокомощностной мультифракционной адъювантной БТ РМЖ и локальных суммарных дозах облучения кожи МЖ, равным 10 Гр и более, отмечены кожная реакция в виде телангиэктазии, а также фиброз кожи.
В данной публикации представлены результаты разработки и клинической апробации технологии ин виво дозиметрии с применением термолюминесцентных микродозиметров LiF:Mg,Ti, располагаемых на участках кожи МЖ при мультифракционной адъювантной брахитерапии рака молочной железы источником 192Ir. Технология люминесцентной ин виво дозиметрии применялась с целью верификации расчётных (планируемых) доз и для принятия необходимых мер по купированию возможных лучевых осложнений.
Материалы и методы
Тканеэквивалентные синтетические термолюминесцентные дозиметры в виде микрокристаллов LiF:Mg,Ti размерами около 100 мкм (см. наши предыдущие публикации [12-15]) формировали в виде сборок, герметично упакованных внутри гибких оболочек из тканеэквивалентного материала. В каждой из таких сборок, размещаемой на кожных участках МЖ вблизи мест входа и выхода интродьюсеров, для ввода используемых при БТ РМЖ источников 192Ir, содержались микрокристаллы LiF:Mg,Ti с общей массой 30 мг. В соответствии с условиями НРБ-99/2009 [16] толщина покровного слоя сборки дозиметров равна 40 мг/см2. Измерения интенсивности радиационно-обусловленной термостимулированной люминесценции (ТЛ) выполняли на установке «Harshow 3500». При измерениях использовали по 3 аликвоты микрокристаллов LiF:Mg,Ti от каждой сборки микродозиметров. Масса каждой аликвоты составляла 10 мг. Для построения калибровочных дозовых зависимостей микродозиметров LiF:Mg,Ti применяли паспортизированные источники 90Sr/90Y, поверенные вторичным образцовым источником МРНЦ (60Co). Процедуры калибровки микродозиметров LiF:Mg,Ti представлены в наших предыдущих публикациях [10-13]. Расчёт поглощённых доз в коже МЖ проводили с использованием программы BrachyVision [17].
Результаты
Разработанный протокол измерений интенсивности термостимулированной люминесценции после облучения синтетических микрокристаллов LiF:Mg,Ti приведён в табл. 1.
Таблица 1
Параметры измерений интенсивности термостимулированной люминесценции после облучения микрокристаллов LiF:Mg,Ti (измерения на установке «Harshow 3500»)
Температура предварительного отжига: 400 °С
Длительность предварительного отжига: 1 ч
Скорость нагрева при измерениях: 5°С/с
Температурный диапазон считывания площади пика радиационно-обусловленного термостимулированного люминесцентного свечения: от 100 до 330 °С
Температурный диапазон интегрирования пика интенсивности радиационно-обусловленного термостимулированного люминесцентного свечения: ± 30 °С от максимальной величины пика ТЛ
Установлена линейная зависимость интенсивности радиационно-обусловленной термостимулированной люминесценции от дозы облучения (дозовая калибровочная зависимость) микрокристаллов LiF:Mg,Ti в терапевтическом диапазоне доз (см. также нашу работу [15]):
I = KxD , (1)
где I – интенсивности радиационно-обусловленной термостимулированной люминесценции, измеренной в соответствии с разработанным Протоколом (табл. 1), нКл; K – коэффициент пропорциональности, равный 1710±62 нКл/Гр (погрешность соответствует 1SD).
При этом коэффициент линейной корреляции равен 0,9955 при p<0,0001 и количестве точек измерений n=7 в диапазоне доз от 1 до 20 Гр.
Метод ИВД люминесцентными микродозиметрами LiF:Mg,Ti апробирован в клинических условиях (12 пациенток) при проведении мультифракционной адъювантной БТ РМЖ с использованием 192Ir: десять фракций облучения, по две фракции в день, с планируемыми очаговыми дозами на фракцию 3,4 Гр и, соответственно, с планируемой суммарной очаговой дозой 34 Гр. Малость размеров люминесцентных дозиметров позволила размещать их в виде сборок в намеченных положениях на неповреждённых участках кожи МЖ – на фиксированных расстояниях (от 0,5 до 2 см) по отношению к областям входа и выхода в ткань МЖ интродьюсеров с источниками 192Ir. Локальные участки кожи МЖ, вблизи мест входа и выхода интродьюсеров с 192Ir, рассматривались как потенциально наиболее облучаемые, то есть, как критические. Были проведены измерения локальных доз в 100 точках (суммарно) на кожных участках МЖ у 12 пациенток. На рис. 1 схематично указаны точки расположения сборок люминесцентных дозиметров на участках кожи МЖ пациентки.
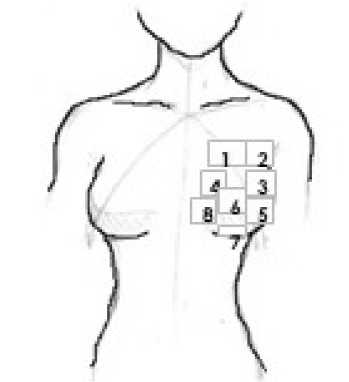
Рис. 1. Схематическое расположение сборок люминесцентных микродозиметров на участках кожи молочной железы пациентки.
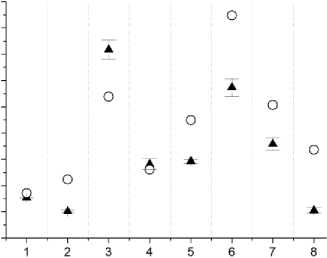
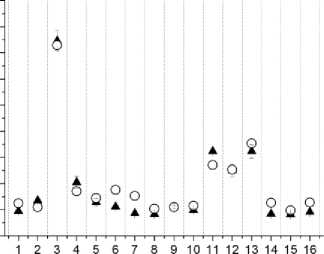
Результаты измерений локальных доз облучения кожи МЖ по сравнению с расчётными дозами в точках расположения микродозиметров приведены на рис. 2-13 (на этих рисунках указаны величины суммарных поглощённых доз для 10 фракций облучения).
Номера точек с микродозиметрами на коже МЖ
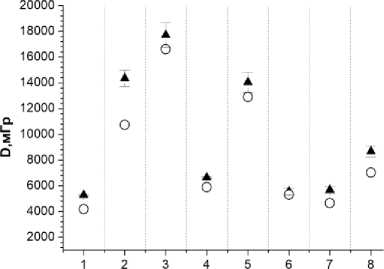
Рис. 2. Пациентка З. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже МЖ (8 точек вблизи мест входа и выхода интродью-серов с 192 Ir). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы. Указанные погрешности соответствуют 1 SD.
Номера точек с микродозиметрами на коже МЖ
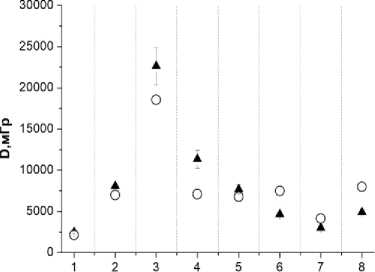
Рис. 3. Пациентка A. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже МЖ (8 точек вблизи мест входа и выхода интродью-серов с 192 Ir). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы. Указанные погрешности соответствуют 1 SD.
20000 q
18000 -
16000 -
12000 -
£■ юооо -
О 8000 -
6000 -
4000 -
2000 - оJ—।--------1--------1--------1--------1--------1--------1--------1--------1--------1--------1--------■--------1--------1--------1—
1 2 3 4 5 6 7 8
Номера точек с микродозиметрами на коже МЖ
Рис. 4. Пациентка Т. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже МЖ (8 точек вблизи мест входа и выхода интродью-серов с 192 Ir). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы. Указанные погрешности соответствуют 1 SD.
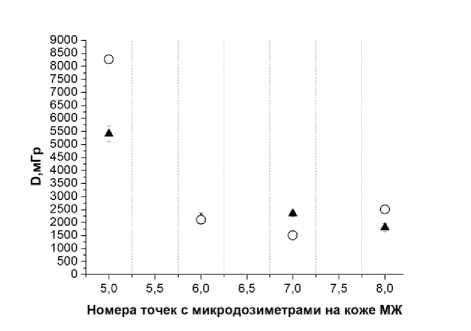
Рис. 5. Пациентка В. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже нижней части МЖ (4 точки вблизи места входа ин-тродьюсеров с 192 Ir). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы.
Указанные погрешности соответствуют 1 SD.
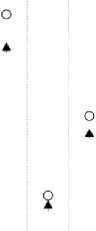

34000q 32000 -30000 -28000 -26000 -2400022000 -20000-Q. 18000 2 16000- q 14000120001000080006000 -40002000- оJ—। 1 ' 1 1 1 1--'—।—।—।—।—।—
1 2 3 4 5 6 7 8
Номера точек с миеродози метрам и на коже МЖ
Рис. 6. Пациентка К. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже МЖ (8 точек вблизи мест входа и выхода интродью-серов с 192 Ir). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы. Указанные погрешности соответствуют 1 SD.
11000 -| 10000
7000- о. 6000 -5 5000 -
°" 4000- °
3000- ▲
1000-
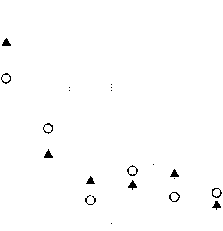
0 J—।------------- 1------1------1------1------1------1------1------ 1------ 1------ 1------1------ 1------1—
1 2 3 4 5 6 7 8
Номера точек с микродозиметрами на коже МЖ
Рис. 7. Пациентка Ц. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже МЖ (8 точек вблизи мест входа и выхода интродью-серов с 192 Ir). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы. Указанные погрешности соответствуют 1 SD.
22000 -|
20000 -
16000-
14000-о. 120005 10000° 8000 -

4000-

2000- ф

22000 -] 20000 - о
1600014000 - а 120005 10000° 8000 -
6000 -4000- О 2000- *
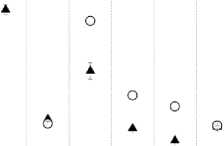
Номера точек с микродозиметрами на коже МЖ
оJ—। 1 1 1 1--------1 1--------1 1 1 1 ■ 1 1--------1—
1 2 3 4 5 6 7 8
Номера точек с микродозиметрами на коже МЖ
Рис. 8. Пациентка П. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже МЖ (8 точек вблизи мест входа и выхода интродью-серов с 19 2Ir). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы. Указанные погрешности соответствуют 1 SD.
Рис. 9. Пациентка О. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже МЖ (8 точек вблизи мест входа и выхода интродью-серов с 192 Ir). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы. Указанные погрешности соответствуют 1 SD.
и 8000
° 6000
о

▲ а о
1 ' 3 ' 4 ' Г
о
5 5000
Q
Номера точек с микродозиметрами на коже МЖ
Номера точек с микродозиметрами на коже МЖ
Рис. 10. Пациентка М. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже МЖ (8 точек вблизи мест входа и выхода интродью-серов с 192I r). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы. Указанные погрешности соответствуют 1 SD.
Рис. 11. Пациентка Н. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже МЖ (8 точек вблизи мест входа и выхода интродью-серов с 192I r). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы. Указанные погрешности соответствуют 1 SD.
5 8000 Q
Номера точек с микродозиметрами на коже МЖ
Рис. 12. Пациентка Д. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже двух МЖ (16 точек вблизи мест входа и выхода ин-тродьюсеров с 192 Ir). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы.
Указанные погрешности соответствуют 1 SD.
4500 -]
3000 -
2500 -
5 2000- О - 1500
1000 -
500 - оJ—।------'------1------1------1------1------1------1------1------•------1------"------1-------------1—
1 2 3 4 5 6 7 8
Номера точек с микродозиметрами на коже МЖ
Рис. 13. Пациентка Ш. Сравнение измеренных и расчётных доз в точках расположения микродозиметров на коже МЖ (8 точек вблизи мест входа и выхода интродью-серов с 192 Ir). Заполненные треугольники – результаты измерений. Окружности – расчётные дозы. Указанные погрешности соответствуют 1 SD.
Заключение
Были проведены измерения локальных доз в 100 точках (суммарно) на кожных участках МЖ у 12 пациенток. Локальные участки кожи МЖ вблизи мест входа и выхода интродьюсеров с 192Ir рассматривались как потенциально наиболее облучаемые, то есть, как критические.
Анализ данных, представленных на рис. 2-13, показывает существенную вариабельность как абсолютных величин локальных суммарных поглощённых доз (измеренных и расчётных), так и большую вариабельность различий между измеренными и поглощёнными дозами в участках кожи МЖ, расположенных вблизи мест расположения интродьюсеров с 192Ir.
Различия в абсолютных величинах локальных поглощённых доз в коже МЖ отдельных пациенток находятся в пределах от 3 до 17 раз для измеренных доз и в пределах от 3 до 16 раз для расчётных доз.
По полученным результатам установлено: в 34% измерений (от общего числа измерений, равном 100) результаты ин виво дозиметрии и расчётные локальные дозы согласуются между собой в пределах погрешностей измерений; в 21% измеренные локальные дозы достоверно превышают расчётные (превышение величин измеренных доз над расчётными дозами находится в пределах от 15 до 58%); в 45% измеренные локальные дозы достоверно меньше расчётных (разница в величинах измеренных и расчётных локальных доз находится в пределах от 26 до 58% по отношению к расчётным дозам).
У восьми пациенток максимальные величины суммарных измеренных локальных поглощённых доз в коже МЖ превышали 10 Гр (от 10,1 до 27,0 Гр).
Причиной установленных расхождений между расчётными и измеренными дозами могут быть различия между планируемыми и реальными расстояниями «источник – облучаемая ткань» из-за подвижности тканей и изменения формы МЖ в процессе высокомощностной брахитерапии РМЖ, когда имеет место большой пространственный градиент поглощённых доз. Кроме того, необходимо иметь в виду, что при планировании лучевой терапии расчёт доз в поверхностных слоях кожи может быть неточным, так как для точных расчётов необходимо учитывать разницу в плотности биологической ткани и окружающей воздушной среды (отсутствие условий электронного равновесия). Детальный анализ причин различий в значениях локальных расчётных и измеренных поглощённых доз планируется в дальнейших исследованиях.
Полученные результаты показывают необходимость и полезность инструментальной верификации величин локальных расчётных доз при БТ РМЖ источником 192Ir. Выявленные случаи больших величин измеренных локальных суммарных доз в коже МЖ (более 10 Гр) являются основанием для динамического наблюдения состояния кожи молочной железы пациенток после брахитерапии – для принятия необходимых мер в отношении возможных лучевых осложнений.
Данная работа выполнена на базе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России, на протяжении многих лет сочетающего в своей работе экспериментальные исследования и их клиническое применение [18-20].
Список литературы Ин виво дозиметрия люминесцентными микродозиметрами при брахитерапии рака молочной железы источником 192Ir: разработка технологии и клиническая апробация
- Radiotherapy Risk Profile. Technical Manual. WHO/IER/PSP/2008.12. Geneva: WHO, 2008. 51 p. URL: https://www.who.int/patientsafety/activities/technical/radiotherapy_risk_profile.pdf (дата обращения: 21.01.2020).
- Lessons learned from accidental exposures in radiotherapy. IAEA Safety Report Series No. 17. Vienna: IAEA, 2000. 96 p. URL: https: //www-pub.iaea.org/MTCD/Publications/PDF/Pub1084_web.pdf (дата обращения 21.01.2020).
- ICRP, 2005. Prevention of high-dose-rate brachytherapy accidents. ICRP Publication 97 //Ann. ICRP. 2005. V. 35, N 2, P. 1-52. URL: https://www-pub.iaea.org/MTCD/Publications/PDF/Pub1606_web.pdf (дата обращения 21.01.2020).
- Каприн А.Д., Галкин В.Н., Иванов С.А. Роль брахитерапии в лечении локализованных форм рака предстательной железы //Biomedical Photonics. 2015. Т. 4, № 4. С. 21-26.
- Иванов С.А. Брахитерапия как метод радикального лечения при раке предстательной железы: дис. … докт. мед. наук. М., 2011. 265 с.
- Иванов С.А., Каприн А.Д., Миленин К.Н., Альбицкий И.А., Иваненко К.В. Результаты применения низкодозной брахитерапии в качестве радикального лечения при раке предстательной железы //Диагностическая и интервенционная радиология. 2015. Т. 5, № 1. С. 73-76.
- Каприн А.Д., Паньшин Г.А., Альбицкий И.А., Миленин К.Н., Цыбульский А.Д. Брахитерапия локализованного рака предстательной железы (медицинская технология). М., 2009. URL: https://www.rncrr.ru/upload/Doc/fs2009218.pdf (дата обращения: 21.01.2020).
- Брахитерапия /Под общ. ред. акад. РАН А.Д. Каприна, чл.-корр. РАН Ю.С. Мардынского. Обнинск. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2017. 245 с.
- Каприн А.Д., Киселёва М.В., Аминов Г.Г., Гулидов И.А., Жарикова И.А. Высокомощностная брахитерапия в комплексном лечении рака молочной железы //Вопросы урологии и андрологии. 2019. Т. 7. № 2, C. 54-55.
- Киселёва М.В., Аминов Г.Г., Гулидов И.А., Жарикова И.А. Комплексное лечение раннего рака молочной железы с использованием высокомощностной брахитерапии //Исследования и практика в медицине. 2019. Т. 6. № 1S. С. 146.
- Perera F., Chisela F., Stitt L., Engel L., Venkatesan V. TLD skin dose measurements and acute and late effects after lumpectomy and high-dose-rate brachytherapy only for early breast cancer //Int. J. Radiat. Oncol. Biol. Phys. 2005. V. 62, N 5. P. 1283-1290.
- Степаненко В.Ф., Бирюков В.А, Карякин О.Б., Каприн А.Д., Галкин В.Н., Иванов С.А., Мардынский Ю.С., Колыженков Т.В., Петухов А.Д., Богачева В.В., Ахмедова У.А., Яськова Е.К., Лепилина О.Г., Санин Д.Б., Скворцов В.Г., Иванников А.И., Хайлов А.М., Анохин Ю.Н. Локальные поглощённые дозы облучения медицинского персонала при брахитерапии рака предстательной железы микроисточниками 125I российского производства //Радиация и риск 2017. T. 26, № 1. С. 44-59.
- Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Иванников А.И., Борышева Н.Б., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков В.А., Обухов А.А., Анохин Ю.Н. Внутриполостная автономная «ин виво» дозиметрия при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: разработка технологии и первые результаты //Радиация и риск 2017. T. 26, № 2. С. 72-82.
- Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Борышева Н.Б., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Обухов А.А., Иванников А.И., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков В.А., Анохин Ю.Н. «Ин виво» дозиметрия при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: сравнение распределения планируемых и измеренных доз при внутриполостном размещении автономных люминесцентных микродозиметров //Радиация и риск. 2018. T. 27, № 1. С. 77-87.
- Коротков В.А., Бирюков В.А, Каприн А.Д., Иванов С.А., Степаненко В.Ф., Борышева Н.Б., Обухов А.А., Колыженков Т.В., Ахмедова У.А., Богачева В.В., Петухов А.Д., Жарова Е.П. Проявления позднего лучевого уретрита в сравнении с инструментальными оценками пространственного внутриполостного распределения доз в органе при выскомощностной брахитерапии рака предстательной железы с применением 192Ir: предварительные результаты //Радиация и риск. 2019. Т. 28, № 1. С. 110-123.
- Нормы радиационной безопасности (НРБ-99/2009). СанПин 2.6.1.2523-09. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009. 100 с.
- BrachyVision Treatment Planning System. Feature Sheet. RAD 4241A A4. Varian Medical Systems International AG. Cham, Switzerland, 2014. URL: https://embed.widencdn.net/pdf/view/varian/ zg8mrymbds/BrachyVision_FeatureSheet_A4_RAD4241A_Mar2014.pdf?u=wefire (дата обращения: 21.01.2020).
- Каприн А.Д., Галкин В.Н., Жаворонков Л.П., Иванов В.К., Иванов С.А., Романко Ю.С. Синтез фундаментальных и прикладных исследований – основа обеспечения высокого уровня научных результатов и внедрения их в медицинскую практику //Радиация и риск. 2017. Т. 26, № 2. С. 26-40.
- Каприн А.Д., Мардынский Ю.С., Смирнов В.П., Иванов С.А., Костин А.А., Полихов С.А., Решетов И.В., Фатьянова А.С., Денисенко М.В., Эпатова Т.В., Коренев С.В., Терещенко А.В., Филоненко Е.В., Гафаров М.М., Романко Ю.С. К истории развития лучевой терапии (часть I) //Biomedical Photonics. 2019. Т. 8, № 1. С. 52-62.
- Каприн А.Д., Смирнов В.П., Иванов С.А., Полихов С.А., Решетов И.В., Фатьянова А.С., Бабаева Ю.В, Денисенко М.В., Семенова Н.М., Коренев С.В., Терещенко А.В., Филоненко Е.В., Южаков В.В., Корякин С.Н., Сухова Т.Е., Гафаров М.М., Огданская К.В., Романко Ю.С. К 115-летию отечественной радиологии. История развития лучевой терапии: лучевая диагностика в МРНЦ им. А.Ф. Цыба //Biomedical Photonics. 2019. Т. 8, № 2. С. 47-50.


