Индивидуализация выбора декомрессионных стом и места их формирования у больных раком толстой кишки, осложненным острой непроходимостью как метод профилактики послеоперацинных осложнений на всех этапах лечения
Автор: Тотиков З.В., Тотиков В.З., Гадаев Ш.Ш., Магомадов Э.А., Тарамов У.У., Абдурзаков а-С. м-С., Ибрагимов Л.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 4 (74), 2020 года.
Бесплатный доступ
Цель исследования: уменьшить количество ранних послеоперационных воспалительных осложнений и летальных исходов у больных раком толстой кишки, осложненным острой кишечной непроходимостью, путем индивидуализации показаний к выбору вида декомпрессионных стом, места их локализации, а также усовершенствования существующих способов.Материал и методы: в статье представлены результаты применения у 259 больных раком толстой кишки, осложненным острой кишечной непроходимостью, различных декомпрессионных стом. В основную группу были включены 183 больных, у которых при выборе вида стомы был использован новый индивидуализированный подход и способы лечения. Во вторую, контрольную группу, вошли 76 пациентов, которым разгрузочные стомы накладывались без учета локализации опухоли, антропометрических и топографо-анатомических особенностей, а также степени и вида ожирения.Результаты: как показали результаты исследования после наложения двуствольных разгрузочных трансверзостом через мини-доступ достоверно реже, чем при наложении илеостом развиваются воспалительные осложнения, летальные исходы, реже вероятность отказа от их выполнения.Заключение: выбор вида илеостом, так же, как и трансверзостом, должен быть индивидуализирован с учетом антропометрических, анатомо-топографических особенностей брюшной стенки и кишечника, степени толщины передней брюшной стенки и вида ожирения, и с применением разработанных в клинике новых способов и технологий.
Кишечная непроходимость, рак толстой кишки, илеостома, трансверзостома
Короткий адрес: https://sciup.org/142229616
IDR: 142229616 | УДК: 616.345-006.6, | DOI: 10.17238/issn2072-3180.2020.4.21-26
Текст научной статьи Индивидуализация выбора декомрессионных стом и места их формирования у больных раком толстой кишки, осложненным острой непроходимостью как метод профилактики послеоперацинных осложнений на всех этапах лечения
Одним из путей улучшения ближайших и отдаленных результатов лечения больных раком толстой кишки (РТК), осложненным острой обтурационной толстокишечной непроходимостью (ОТКН), является формирование на первом этапе декомпрессионных стом через мини-доступ и выполнение радикального этапа после разрешения непроходимости и проведения в предоперационном периоде терапии, направленной на снижение интоксикационного синдрома, коррекцию сердечно-сосудистых нарушений, сопутствующих заболеваний, а также проведения лучевой или химио-лучевой терапии [1, 2, 3, 4, 5]. Однако у части больных выполнение этого оперативного вмешательства из-за антропометрических и анатомо-топографических особенностей бывает невозможным, у других — приводит к большому количеству осложнений в виде инфицирования, некрозов и ретракций стом [1, 4, 5, 6]. Причинами столь частых неудач и осложнений, на наш взгляд, являются отсутствие опыта выполнения этих оперативных вмешательств и использование шаблонных подходов, без учета антропометрических и топографо-анатомических особенностей, при формировании разгрузочных илео- или колостом через мини-доступ у больных РТК, осложненным ОТКН.
Цель исследования. Уменьшить количество ранних послеоперационных воспалительных осложнений и летальных исходов у больных РТК, осложненным ОТКН, путем индивидуализации показаний к выбору вида декомпрессионных стом, места их локализации, а также усовершенствования существующих способов.
Материалы и методы
Представленное проспективное исследование основано на анализе результатов применения в лечении 259 больных РТК, осложненным ОТКН, различных декомпрессионных стом. Условием включения в исследование было наличие у больного клинической и рентгенологической картины ОТКН. Из исследования были исключены больные, госпитализированные в стационар с 5 степенью операционно-анестезиологического риска по ASA, с неоперабельными формами рака, с планируемой экстирпацией прямой кишки, а также с 1 и 4 стадией нарушения проходимости толстой кишки (по классификации В.З. Тотикова 1993 г.). Все пациенты были госпитализированы и оперированы в экстренном порядке в хирургических отделениях РКБСМП г. Владикавказ, БСМП г. Грозного, РОД Чеченской республики в период с 2015 по 2020 гг. В зависимости от тактики больные были разделены на две группы. В первую, основную группу, были включены 183 больных, у которых при выборе вида стомы был использован новый индивидуализированный подход и способы лечения. Во вторую, контрольную группу, вошли 76 пациентов, которым разгрузочные стомы накладывались без учета локализации опухоли, антропометрических и топографо-анатомических особенностей, а также степени и вида ожирения. В обеих группах были выделены 2 подгруппы. В первую подгруппу в обеих группах включали больных с разгрузочными трансверзостомами, наложенными через минидоступ в правом подреберье. В основной группе таких больных было 146 (79,8%), в контрольной — 41 (53,9%) пациент. Во вторую подгруппу были включены больные с илеостомами, в том числе 37 (20,2%) больных основной и 35 (46,1%) пациентов контрольной группы. По таким основным показателям, как пол и возраст, сроки госпитализации с момента начала заболевания, сопутствующие заболевания, тяжесть физического состояния на момент поступления, по количеству больных с нормальной или избыточной массой тела, локализации опухоли и ее распространенности, общеклиническим и лабораторным показателям основная и контрольная группы, также подгруппы были сопоставимы.
Толщина передней брюшной стенки и степень пролапса кожи в месте наложения стом были определены у 183 больных основной группы. Замеры толщины производили с помощью УЗИ в правом подреберье по параректальной линии и в точке Ланца в положении лежа и стоя. Ультразвуковое исследование производили на аппарате LOGIQTMα200 General Electric Co с использованием видеопринтера SONY UP-895 MOW и линейного датчика с частотой 7,5 МГц и конвексного датчика с частотой 3,5 МГц.
В процессе исследования было выявлено, что толщина передней брюшной стенки в правом подреберье и подвздошной области не всегда коррелируют со степенью индекса массы тала. В связи с этим, мы в своей работе использовали метрические показатели, взяв за норму среднестатистическую толщину передней брюшной стенки при нормальной массе тела, которая составила 3±1,1 см. Этот же показатель оказался значимым при техническом выполнении оперативного вмешательства. В результате нами условно выделены 5 степеней толщины передней брюшной стенки. 1 степень — до 3 см, 2 степень — 4-6 см, 3 степень — 7-9 см, 4 степень —10-12 и 5 степень — 13 см и более. Мобильность предполагаемого для наложения стомы участка поперечно-ободочной и подвздошной кишки была изучена у дополнительной группы, состоящей из 87 больных, оперированных по поводу РТК в плановом порядке. Она определялась путем измерения расстояния смещения петли кишки от исходной точки.
Результаты
В контрольной группе результаты лечения были изучены у 35 (46,1%) больных с илеостомами и у 41 (53,9%) пациента с трансверзостомами. У 5 (6,6%) больных с абдоминальным типом ожирения или малоподвижной петлей ободочной или подвздошной кишки наложение стомы через мини-доступ оказалось невозможным. В том числе у 2 (5,7%) больных, которым предполагалось формирование илеостомы, и у 3 (7,3%) паци- ентов—трансверзостомы. Остальным больным разгрузочные стомы были выполнены, в том числе 33 больным илео- и 38 пациентам трансверзостомы. Однако, при наложении илеостом у 9 (25,7%) больных, и у 6 (14,6%) пациентов при наложении трансверзостом, из-за возникших технических трудностей были увеличены размеры ран на 3–5 см. У 5 (14,3%) пациентов с илеостомами и у 3 (7,3%) больных с двуствольными трансверзостомами в послеоперационном периоде произошла ретракция стомы. У всех 8 пациентов имела место избыточная масса тела. В двух случаях причиной ретракции при илеостомии был некроз кишки, у других—прорезывание швов. Нагноение операционной раны и мацерации кожи выявлены у 9 (25,7%) больных с илеостомами и у 4 (9,7%) — с трансверзостомами. В послеоперационном периоде в течение 4 суток умерло 3 (3,9%) больных, в том числе 1 (2,8%) больной с илеостомой и 2 (4,9%) пациента с двуствольными петлевыми трансверзостомами. Причиной летального исхода в одном случае была ретракция стомы и перитонит, у остальных больных — острая сердечнососудистая и печеночно-клеточная недостаточность.
Для уточнения технических возможностей выполнения оперативного вмешательства — наложения стом, мы у 183 больных основной группы в предполагаемых местах их формирования определяли толщину передней брюшной стенки, ее мобильность, а также мобильность кишечной петли.
По данным УЗИ, выполненном в положении лежа, толщина передней брюшной стенки в правом подреберье по параректальной линии у 98 (53,5%) больных не превышала 3 см. У 62 (33,8%) пациентов этот показатель составил от 4 до 6 см; у 19 (10,4%) больных — от 7 до 9 см; у 3 (1,6%) — от 10 до 12 см и более 12 см — у 1 (0,5%) пациента. В правой подвздошной области (в точке Ланца) толщина передней брюшной стенки не превышала 3 см у 60 (32,8%) больных, у 66 (36,1%) больных она составила 4-6 см, у 41 (17,9%) — 7-9 см, у 32 (17,5%) — 10-12 см и 8 (4,3%) пациентов — более 12 см.
При определении подвижности кожи в правом подреберье в вертикальном положении у 11 пациентов с 3 и 4 степенью толщины передней брюшной стенки отмечено смещение до 2–3 см, у остальных 218 пациентов заметного пролапса кожи в правом подреберье не выявлено.
Значительная подвижность передней брюшной стенки в положении стоя выявлена в правой подвздошной области. Только у 89 (48,6%) больных провисание передней брюшной стенки не превышало 3 см. У 39 (21,3%) оно достигало 4-6 см, у 19 (10,4%) пациентов — 7-9 см, у 18 (9,8%) больных —10-12 см и более 12 см — еще у 18 (9,8%) пациентов. Чаще провисание передней брюшной стенки имело место у больных с гиноидной формой ожирения и у лиц пожилого и старческого возраста (Рис. 1, 2).
При измерении толщины передней брюшной стенки в правом подреберье в вертикальном положении, этот показатель ни у одного больного с 1 и 2 степенью толщины передней брюшной стенки (98 и 78 пациентов соответственно) не изменился.
Уменьшение на 3–6 см отмечено у 2 ,7 и у 1 больного с 3, 4 и 5 степенью соответственно (Рис. 3, 4).
Рис. 1. Измерение подвижности передней брюшной стенки лежа
При измерении толщины передней брюшной стенки в положении стоя в точке Ланца у 126 пациентов с 1 и 2 степенью, размеры практически не менялись. У 22 (68,7%) из 32 больных с 3 степенью этот показатель уменьшился на 3 см. На 3 и более см отмечено уменьшение в этой области и у всех 17 пациентов с 4 степенью, и у 8 больных с 5 степенью. У последних 15 больных этот показатель достигал 7 см.
У больных с пониженной и нормальной массой тела маркированный участок ободочной кишки можно было свободно (без натяжения) сдвинуть влево до 7–16 см (11±4 см), вправо на 8–23 см (14±7 см). У больных с предо-жирением влево на 5–14 см (9±5 см), вправо на 6–13 см (9±3 см). При ожирении 1 степени на 5–12 см (8±3 см). При ожирении 2 степени на 5–12 см (8±4 см) и при ожирении 3 степени на 4–9 см (6±2 см).
Более подвижная поперечная ободочная кишка выявлена у больных с гиноидным типом ожирения. Несколько меньшая амплитуда выявлена у больных со смешанным типом и наиболее ограниченная подвижность отмечалась у пациентов с абдоминальным типом ожирения.
Рис. 2. Измерение подвижности передней брюшной стенки стоя
ожирении 1 степени—от 9 до 19 см (14±5 см), при ожирении 2 степени — от 8 до 17 см (13±5 см) и при ожирении 3 степени — от 7 см до 15 см (11±4 см).
У больных с гиноидной формой ожирения подвздошная кишка была более подвижная. Несколько меньше сдвигалась к передней брюшной стенке петля кишки у больных со смешанным типом. И наименьшую амплитуду мы выявили у больных с абдоминальной формой ожирения.
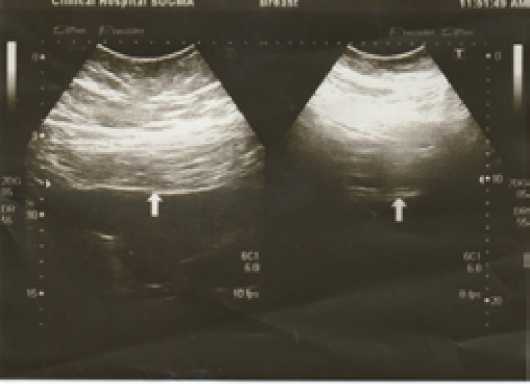
Рис. 4. Толщина передней брюшной стенки по данным УЗИ в горизонтальном положении (слева – правое подреберье – 10 см, справа – правая подвздошная область – 14 см)
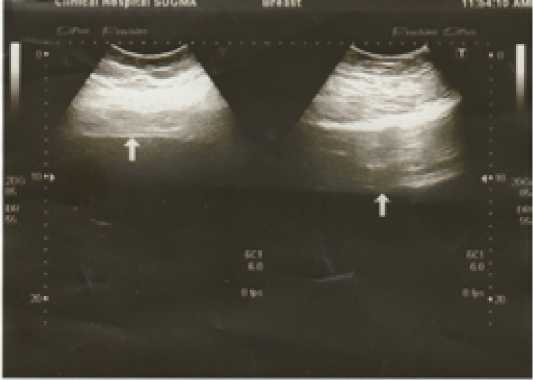
Рис. 3. Толщина передней брюшной стенки по данным УЗИ в вертикальном положении (слева – правое подреберье – 8 см, справа – правая подвздошная область – 10 см)
У этих же больных мы протестировали мобильность подвздошной кишки. У больных с пониженной и нормальной массой тела эта амплитуда составляла от 12 до 26 см (18±7 см), при предожирении—колебалась от 9 до 21 см (15±6 см), при
Одним из факторов, ограничивающих использование транс-верзостом у больных с РТК, осложненным ОКТН, мы сочли локализацию опухоли проксимальнее средней трети нисходящей кишки или наличие единичных метастазов в печени. В первом случае оставшуюся после радикального этапа культю поперечной ободочной кишки невозможно было бы анастомозировать, во втором—доступ к печени был бы закрыт стомой.
С учетом полученных результатов проведенного исследования, в основной группе у 146 (79,8%) больных были сформированы двуствольные трансверзостомы, у 37 (20,2%) больных — илеостомы.
Для формирования двуствольных трансверзостом у 103 (56,3%) пациентов с толщиной передней брюшной стенки не более 6 см и подвижной петлей поперечной ободочной кишки и ИМТ не более 30% были использованы стандартные технологии. Еще у 35 (19,1%) больных с 1 или 2 степенью абдоминального ожирения или 3 степенью гиноидного типа ожирения для декомпрессии был применен усовершенствованный способ наложения двуствольной трансверзостомы, позволивший путем мобилизации приводящей и отводящей петель ободочной кишки и использования специального ранорасширителя выводить петлю кишки на уровень кожи и фиксировать ее. После чего опорожнять содержимое с помощью специального троакара, вскрывать просвет, накладывать на брыжеечную полуокружность лигатуры и с их помощью подвешивать кишку к специальному устройству.
В тех случаях (8 больных), когда вышеописанный способ не позволял вывести заднюю полуокружность на уровень кожи, лигатуры, расположенные по брыжеечной окружности, подвешивали на перекладину специального турника с умеренным натяжением. В просвет дистальной культи вводили 2-просветный зонд и накладывали калоприемник, через который выводили установленный зонд.
У 9 (4,9%) больных с локализацией рака ниже средней трети нисходящей кишки, но толщиной передней брюшной стенки более 6 см и любым видом ожирения, были наложены илеостомы по разработанному в клинике способу, который выполнялся следующим образом: в положении стоя в проекции точки Ланца наносили метку маркером. Затем больного укладывали на операционный стол, совмещали линию bispinalis с меткой. От точки Ланца и выше выполняли разрез до 3–4 см и в рану устанавливали специальный ранорасширитель, с помощью которого максимально увеличивали диаметр и уменьшали толщину раны. Через рану определяли илеоцекальный угол, затем, отступя на 5–7 см от него, подвздошную кишку пересекали продольным сшивающим аппаратом. В дальнейшем с помощью аппарата LigaSure , с сохранением сосудистой аркады, мобилизовывали участок приводящей подвздошной кишки необходимого размера. И выводили ее на переднюю брюшную стенку с формированием одноствольной илеостомы.
Еще у 4 (2,2%) больных с менее выраженными признаками ожирения и малоподвижной петлей подвздошной кишки был применен другой способ оперативного вмешательства, заключающийся в пересечении петли подвздошной кишки на расстоянии 20–25 см от илеоцекального угла и мобилизации приводящей и отводящей петли на сосудистой ножке и свободном выведении их на кожу.
Остальным 23 (2,5%) пациентам с пониженной, нормальной и избыточной массой тела, в том числе у 5 (2,7%) больных с опухолями средней и дистальной трети нисходящей кишки, но с единичными метастазами в печении, были наложены типичные двуствольные илеостомы.
В послеоперационном периоде в основной группе умерло 6 (3,3%) больных, в том числе после илеостом—2 (5,7%) и транс-верзостом—4 (2,7%) пациентов. Воспалительные осложнения в виде инфицирования раны вокруг стомы выявлены у 12 (6,6%) больных, в том числе у 9 (6,2%) пациентов с трансверзостома-ми и у 3 (8,1%) больных с илеостомами. Все 6 больных умерли на фоне выраженной интоксикации, сердечно-сосудистой и печеночно-клеточной недостаточности.
Заключение
Таким образом, после наложения 2-ствольных разгрузочных трансверзостом через мини-доступ достоверно реже, чем при наложении илеостом, развиваются воспалительные осложнения, летальные исходы, реже вероятность отказа от их выполнения. В то же время отсутствие возможности использования с целью декомпрессии двуствольной трансверзостомы при опухолях левых отделов ободочной кишки, а также учитывая возникновение технических трудностей на радикальном этапе при расположении опухоли проксимальнее средней трети нисходящей кишки, наложение илеостом у этих больных более рационально.
Однозначно показано наложение илеостом при раках правых отделов ободочной кишки. В то же время выбор вида илеостом, так же как и трансверзостом, должен быть индивидуализирован с учетом антропометрических, анатомо-топографических особенностей брюшной стенки и кишечника, степени толщины передней брюшной стенки и вида ожирения, и с применением разработанных в клинике новых способов и технологий. Что позволяет снизить количество неудачных попыток наложения стом с 6,6% до 0%, ретракций стом — с 10,5% до 0%, неоправданных расширенных операций на втором этапе — с 1,7% до 0%, некрозов пристомальных участков кишки — с 2,6% до 0%, летальных исходов — с 6,7% до 3,8%, воспалительных осложнении на первом этапе лечения — с 17,1% до 6,6%, на 2 этапе — с 10,3% до 5,6%, на 3 этапе — с 16,4% до 6,3%.
Список литературы Индивидуализация выбора декомрессионных стом и места их формирования у больных раком толстой кишки, осложненным острой непроходимостью как метод профилактики послеоперацинных осложнений на всех этапах лечения
- Kasten K.R., Midura E.F., Davis B., Rafferty J., Paquette I. Blowhole colostomy for the urgent management of distal large bowel obstruction. J. Surg. Res., 2014, May, No. 1, 188(1), рр. 53-57. DOI: 10.1016/j.jss.2014.01.007
- Шелыгин, Ю.А. Клинические рекомендации. Колопроктология. М.: ГЭОТАР-Медиа, 2015. 528 с.
- Тотиков З.В., Тотиков В.З. Лечение больных раком толстой кишки, осложненным острой кишечной непроходимостью. Хирургия, 2017. № 3. C. 17-23.
- Пугаев А.В., Ачкасов Е.Е. Обтурационная опухолевая толстокишечная непроходимость. М.: Профиль, 2005. 223 с.
- Тотиков З.В., Тотиков В.З., Талапова И.М., Тотиков М.З., Асланов А.Д. Способ формирования двуствольной петлевой колостомы при толстокишечной непроходимости опухолевого генеза. Колопроктология, 2013. № 1. С. 39-43.
- Amelung F.J., Mulder C.L., Verheijen P.M., Draaisma W.A., Siersema P.D., Consten E.C. Acute resection versus bridge to surgery with diverting colostomy for patients with acute malignant left sided colonic obstruction: Systematic review and meta-analysis. Surg. Oncol., 2015, Dec.; No. 24(4), рр. 313-321. Epub. 2015 Oct 20 DOI: 10.1016/j.suronc.2015.10.003


