Индуцирование апоптоза в проростках гороха
Автор: Павловская Н.Е., Гагарина А.Ю.
Журнал: Вестник аграрной науки @vestnikogau
Рубрика: Научное обеспечение развития растениеводства
Статья в выпуске: 6 (27), 2010 года.
Бесплатный доступ
Показано проявление индуцированного апоптоза в проростках гороха. Апоптоз выявляется по фрагментации ДНК и снижению активности ферментов: супероксиддисмутазы, каталазы и пероксидазы.
Апоптоз, активность каталазы, супероксиддисмутазы, перокидазы, антиоксидантная система
Короткий адрес: https://sciup.org/147123589
IDR: 147123589 | УДК: 635.656:576.367
Текст научной статьи Индуцирование апоптоза в проростках гороха
защищающие аэробную клетку от « самозагрязнения » потоками О 2 - и Н 2 О 2 , действуют как синергисты . Активность СОД резко снижается при апоптозе ( в клетках колеоптиля пшеницы ). Заражение растений возбудителем фузариозного увядания подобных проявлений не вызывает , однако проявляется реакция сверхчувствительности ( некроз ).
Факторами клеточной системы , вызывающей апоптоз , могут быть как внешние , так и внутренние [4]. Так , цитокинины , подавляющие пролиферацию клеток , индуцируют апоптоз . Цитокинин 6- бензиламинопурин вызывает программируемую гибель клеток моркови и A. thaliana , детектируемую по конденсации хроматина . Ауксин стимулирует ЗКГ в проростках табака . Предполагается , что баланс между абсцизовой кислотой и этиленом регулирует инициацию программируемой гибели клеток в эндосперме .
Несмотря на широкий интерес , проявляемый исследователями , к проблеме программируемой смерти клеток , пусковые механизмы еще не изучены и не ясно , являются ли факторы , вызывающие апоптоз , общими для разных объектов .
Контроль над некрозом и апоптозом позволит создавать средства , регулирующие продолжительность жизни , устойчивость к патогенам , синхронность созревания урожая , проводить биомониторинг окружающей среды , осуществлять диагностику повреждений растительности под влиянием неблагоприятных факторов среды на ранних этапах развития без использования дорогостоящего оборудования , т . е . разрабатывать методы тестирования .
В связи с этим целью наших исследований являлось изучение проявления апоптоза в различных растительных объектах , выделение компонентов системы апоптоза и испытание их на проростках гороха .
М атериалы и методика исследований
Из молодого листа монстеры , колеоптилей пшеницы и ячменя выделены предполагаемые индукторы апоптоза ; перед проращиванием в лабораторных условиях проведено замачивание семян гороха полученными вытяжками индукторов . Контролем служили не обработанные семена . Из полученных проростков гороха на вторые , четвертые , пятые , седьмые , восьмые и десятые сутки выделяли ДНК .
Изучение активности ферментов антиоксидантной системы : супероксиддисмутазы, каталазы и пероксидазы проводили на полученных проростках гороха в те же фазы . Пероксидазную активность определяли колориметрическим методом Бояркина с модификациями. Метод основан на определении скорости реакции окисления бензидина до образования синего продукта окисления определенной концентрации, заранее устанавливаемой на фотоэлектроколориметре [8].
Для определения активности каталазы была использована модифицированная методика , основанная на измерении объема выделившегося кислорода после прибавления к водному экстракту каталазы перекиси водорода . Объем выделившегося кислорода регистрировали с 3- ей по 15- ю минуту после начала реакции с интервалом 3 мин . Затем выстраивали кинетические кривые зависимости объема выделившегося O2 от времени и аппроксимировали их функцией вида y = a ⋅ ln(x)+ b . В качестве исходного показателя активности каталазы использовали предлогарифмический коэффициент a ( расчет методом дифференциального анализа кинетических кривых ). Затем коэффициент a делили на массу навески , получая , таким образом , приведенный предлогарифмический коэффициент , являющийся окончательным показателем активности каталазы [2].
Для определения активности супер - оксиддисмутазы была использована модифицированная методика с использованием прибора ( фотореактора ) [3,12].
Для определения динамики изменений ДНК колеоптили или листья отделяли от прочих органов растения , размещали в незамкнутой стеклянной таре и замораживали в течение суток . Далее пробы быстро измельчали алюминиевым пестиком в пробирке Эппендорфа .
Выделение ДНК производилось с помощью набора реагентов и методики , разработанной предприятием Biokom. Методика выделения ДНК базируется на извлечении ДНК сорбентом NucleOS из продуктов обработки пробы лизисным реагентом , в дальнейшем NucleOS промывается солевым буфером и ДНК десорбируется и переводится в раствор реагентом ExtraGene. ДНК , растворенная в ExtraGene, подвергается электрофоретическому разделению . Электрофорез осуществляют на агарозном геле (1.5% раствор агарозы в воде ) в TBE- буфере с добавлением бромистого этидия . Фотографии гелевой пластины получают на ультрафиолетовом трансиллюминаторе (Biokom), используя способность комплекса бромистого этидия с ДНК светиться в ультрафиолетовом свете .
Исследования проводились на водных культурах . Для создания необходимых условий выращивания использовалась программируемая климатокамера “ Фитотрон ” производства компании Biokom. Выращивание растений с целью получения экстрактов из колеоптилей пшеницы и ячменя производилось при температуре 25° С и отсутствии освещенности ( этиолирование ). Статистическую обработку проводили на компьютере в программе Exsel и в программе , разработанной Гринблатом .
Результаты и их обсуждение
Известно, что при апоптозе в клетках происходит деградация хроматина ступенчато под действием индуцированных различными факторами каспаз и эндонуклеаз . При электрофоретическом разделении в агарозном геле такая ДНК выглядит в виде некой лестницы [1].
Поэтому , как правило , наиболее надежно апоптоз детектируется путем оценки выявления специфических маркеров апоптоза , среди которых межнуклеосомная фрагментация ДНК занимает ведущее место . В отличие от некоторых обратимых начальных стадий апоптоза у растений такая фрагментация ДНК является уже одной из терминальных и необратимых стадий апоптоза , за которой следует дальнейшая быстрая , уже относительно неспецифическая и глубокая деградация ДНК нуклеазами [1].
После обработки семян гороха вытяжкой из колеоптиля пшеницы , наблюдается фрагментация ДНК у проростков гороха в виде характерной « лесенки », усиливающейся на седьмые , восьмые и десятые сутки ( Рис .1).
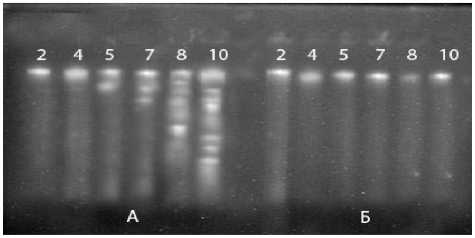
Рисунок 1 – Электрофореграмма ДНК выделенной из проростков гороха в процессе жизнедеятельности (2, 4, 5, 7,8, 10 сутки ): А - под влиянием вытяжки из колеоптиля пшеницы , Б – контроль без обработки
На электрофореграмме четко видно , что в контрольных проростках гороха ДНК представляет собой ярко светящуюся зону ( рис .1, Б ), причем во все периоды прорастания от 2- х до 10 дней . У обработанных вытяжкой из колеоптилей пшеницы проростков гороха на 5- ый день наблюдается деградация ДНК в виде двух светящихся в ультрафиолетовом свете полос , а на 8- ой и 10- ый день распад ДНК виден в виде лестницы ( рис .1, А ).
По электрофореграмме ДНК проростков гороха под влиянием вытяжек из листа монстеры ( рис .2) и колеоптилей ячменя ( рис .3) также можно наблюдать типичную для апоптоза картину – лестницеобразные пятна на электрофореграмме , связанные с апоптотической формой деградации ДНК и хроматина .
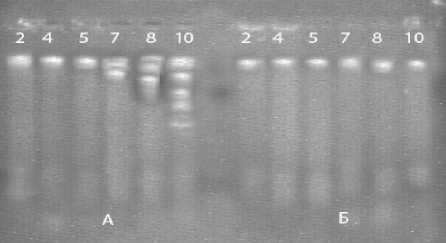
Рисунок 2 – Электрофореграмма ДНК выделенной из проростков гороха в процессе жизнедеятельности (2, 4, 5, 7,8, 10 сутки ): А - под влиянием вытяжки из молодого листа монстеры , Б – контроль без обработки
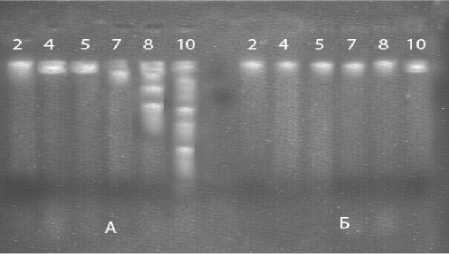
Рисунок 3 – Электрофореграмма ДНК выделенной из проростков гороха в процессе жизнедеятельности (2, 4, 5, 7,8, 10 сутки ): А - под влиянием вытяжки из колеоптиля ячменя , Б – контроль без обработки
Таким образом , выделенные предполагаемые индукторы апоптоза из разных объектов : колеоптилей пшеницы и ячменя и молодых несформированных листьев монстеры действуют в одинаковой степени на проявление фрагментации ДНК у проростков гороха , что может указывать на их общую природу .
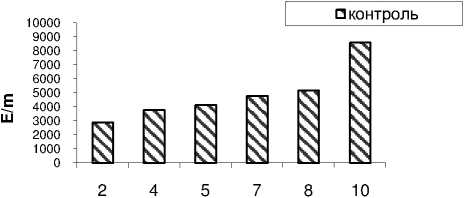
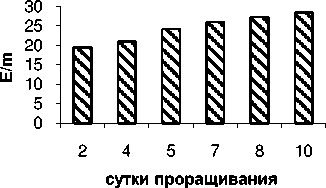
Известно , что апоптоз сопровождается увеличением выхода активных форм кислорода (АФК) или свободных радикалов, повреждающих клетку и приводящую к летальному исходу. Активную роль в обезвреживании клетки от загрязнения АФК играют компоненты антиоксидантной системы : супероксиддисмутаза, пероксидаза и каталаза. Нами установлено , что в норме активность супероксиддисмутазы плавно возрастает в процессе развития проростков гороха от 3000 Е/m у 2-дневных до 9000 Е/m – у 10-дневных (рис.4).
сутки проращивания
Рисунок 4 – Активность фермента супероксиддисмутазы в проростках гороха без обработки
Это указывает на тот факт , что в норме активность супероксиддисмутазы возрастает в связи с синтезом фермента de novo. Вместе с тем это указывает на тот факт , что в норме активность данного фермента высока из - за низкой востребовательности .
В случае замачивания семян в вытяжках из объектов , обладающих апоптозной активностью , происходит расход супероксиддисмутазы на нейтрализацию свободных радикалов и активность фермента изначально низкая . Так , в вариантах ( рис .5) под влиянием вытяжек из колеоптилей пшеницы , ячменя активность супероксиддисмутазы в 2 дневных проростках гороха не превышает 1000-1400 Е /m. Рост проростков гороха под влиянием вытяжек из колеоптилей злаков сопровождается некоторым подъемом активности СОД до 4- х дней , а затем происходит резкое снижение активности вплоть до 10 дней прорастания и достигает 400 Е /m.
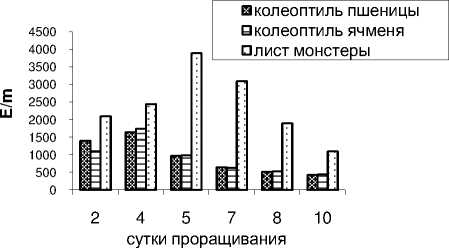
Рисунок 5 – Активность фермента супероксиддисмутазы под влиянием вытяжек из колеоптилей пшеницы , ячменя и молодых листьев монстеры в проростках гороха
Под влиянием вытяжки из молодых листьев монстеры активность супероксиддисмутазы проростков гороха в 3-4 раза выше , чем в предыдущих вариантах , что объясняется более слабым апоптозным эффектом монстеры . Активность СОД возрастает от 2100 Е /m у 2- дневных до 4000 Е /m – у 5- дневных , а затем начинается плавное снижение активности до 1000 Е /m – у 10- дневных проростков гороха . Таким образом , установлено четкое снижение активности супероксиддисмутазы у проростков гороха под влиянием вытяжек их апоптозных объектов .
Аналогичная закономерность наблюдается и в случае измерения активности пероксидазы и каталазы ( рис . 6-9).
□ контроль
Рисунок 6 – Активность фермента каталазы в проростках гороха без обработки
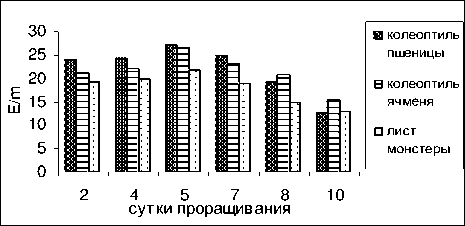
Рисунок 7 – Активность фермента каталазы под влиянием вытяжек из колеоптилей пшеницы , ячменя и молодых листьев монстеры в проростках гороха
Под влиянием вытяжек из колеоптилей злаков и листьев монстеры происходит аналогичное снижение активности пероксидазы от 200 – у 2- дневных проростков до 70 Е /m – у 10- дневных проростков с небольшим подъемом у 4-5 дневных проростков .
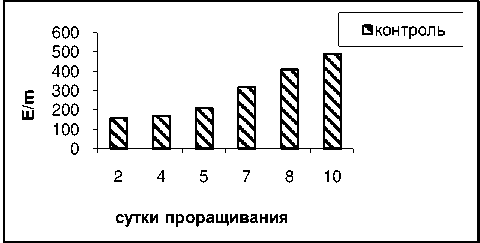
Рисунок 8 – Активность фермента пероксидазы в проростках гороха без обработки
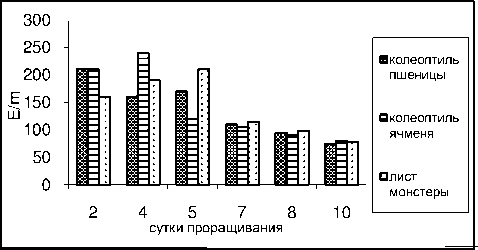
Рисунок 9 – Активность фермента пероксидазы под влиянием вытяжек из колеоптилей пшеницы, ячменя и молодых листьев монстеры в проростках гороха
Таким образом , исследованные ферменты антиоксидантной системы проявляют синхронность в своей работе . В норме активность ферментов возрастает в процессе роста проростков гороха , а под влиянием вытяжек из колеоптилей злаков и молодых листьев монстеры снижается с небольшим подъемом в 4-5 – дневных , что указывает на их активизацию в связи со стрессом .
Список литературы Индуцирование апоптоза в проростках гороха
- Ванюшин, Б. Ф. Апоптоз у растений/Б. Ф. Ванюшин//Успехи биологической химии -2001. -Т. 41. -С. 3-38
- Гринблат А.И. Разработка биоинформационной модели апоптоза и некроза у растений./Автореф…канд. дис., 2007, 22 с
- Гринблат А.И. Способ определения активности фермента. Патент на изобретение №2293969Б-Опубликовано «Бюллетень изобретений», №5 от 20.02.2007
- Дзюбинская Е.В., Киселевский Д.Б. Бакеева Л.Е. Самуилов В.Д. Программируемая клеточная смерть у растений: действие ингибиторов синтеза белка и структурные изменения в устьичных клетках гороха Биохимия, 2006 Т.71,N 4. -С. 493-504
- Дьяков Ю.Т., Озерецковская О.Л., Джавахил В.Г., Багирова С.Ф.Общая и молекулярная фитопатология/Ю. Т. Дьяков [и др.]. -2001. -М.: Общество фитопатологов. -301 с
- Лушников Е.Ф., Абросимов А.Ю., Гибель клетки (апоптоз). -М.: Медицина,2001. -192 с
- Лэмб, М. Биология старения/М. Лэмб. -М.: Мир, 1980. -206 с
- Методы биохимического исследования растений/под ред. Е. А. Ермакова -Л.: Агропромиздат. -1987. -С. 38-39
- Павловская Н.Е., Гринблат А.И. Активные формы кислорода и апоптоз у пшеницы и гороха/Сельскохозяйственная биология, 2010,№1, с.51-55
- Полесская О.Г., Каширина Е.И., Алехина Н.Д. Влияние солевого стресса на антиоксидантную систему растений в зависимости от условий азотного питания/Физиология растений, 2006, ТОМ 53, № 2, С. 207-214
- Скулачев, В. П. Кислород и явления запрограммированной смерти/В. П. Скулачев//Биохимия. -1999. -Т. 64. -С. 1418-1426
- Giannopolities, C. N. Superoxid dismutase. I. Occurrence in higher plants/C. N. Giannopolities, S. K. Ries//Plant Physiology. -1977. -Vol. 59. -P. 309-314
- Mittler, R. Characterization of nuclease activities and DNA fragmentation induced upon hypersensitive response cell death and mechanical stress/R. Mittler, E. Lam//Plant Mol. Biol. -1997. -Vol. 34. -P. 209-221
- Sionov, R. V. C-ABL regulates p5-levels under export and ubiquitination/R. V. Sionov [et al.]//Mol. Cell. Biol. -2001. -Vol. 21. -P. 5869-5878


