Индуцированные химиотерапией широкореактивные аутоантитела в лечении злокачественных новообразований
Автор: Шанина Е.В., Бркер Ф., Лысов Н.А., Шанин В.Ю., Пономарева Ю.В., Супильников А.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 3 т.13, 2023 года.
Бесплатный доступ
Цель исследования - оценить связь между химиотерапией и аутоиммунными реакциями у пациентов с метастатическим раком толстой кишки. Известно, что рак и аутоиммунность взаимосвязаны, но до сих пор было неясно, насколько именно химиотерапия способствует развитию аутоиммунных реакций. Изучили уровни иммуноглобулина M (IgM) в ответ на введение различных тканей человека до и во время адъювантной химиотерапии. Пациентам было проведено семь циклов химиотерапии по схеме FOLFIRI плюс цетуксимаб. Уровни IgM против исследуемых тканей увеличились уже после первого цикла химиотерапии и продолжали возрастать во время второго и третьего циклов. Затем аутоиммунные реакции начали снижаться с четвёртого по седьмой циклы, однако оставались повышенными по сравнению с исходным уровнем для большинства исследуемых тканей. Наши результаты свидетельствуют о том, что химиотерапия может вызывать широкий спектр аутоиммунных реакций. Мониторинг самореактивных IgM-ответов во время лечения может помочь предотвратить или облегчить побочные эффекты, связанные с аутоиммунитетом.
Рак толстой кишки, аденокарцинома, химиотерапия, токсичность, аутоиммунитет, igm, экспресс-диагностика, агглютинационный анализ
Короткий адрес: https://sciup.org/143180678
IDR: 143180678 | УДК: 616.348-89+616-006.611-69:616-097 | DOI: 10.20340/vmi-rvz.2023.3.CLIN.12
Текст научной статьи Индуцированные химиотерапией широкореактивные аутоантитела в лечении злокачественных новообразований
ОРИГИНАЛЬНАЯ СТАТЬЯ
Cite as: Shanina E.V, Breker F., Lysov N.A., Shanin V.Yu., Ponomareva Yu.V., Supil'nikov A.A. Chemotherapy-induced broadly reactive autoantibodies in the treatment of malignancies. Bulletin of the Medical Institute “REAVIZ”. Rehabilitation, Doctor and Health. 2023;13(3):103–108.
Злокачественные опухоли являются известной причиной аутоиммунных реакций, которые включают выработку аутоантител [1]. Индуцированный раком аутоиммунитет был связан с развитием различных аутоиммунных заболеваний, таких как ревматические болезни, па-ранеопластическая дегенерация мозжечка и другие [1–4]. Эти нарушения могут быть, по крайней мере частично, вызваны аутоантителами, вырабатываемыми против опухолевых антигенов, которые также экспрессируются в здоровых тканях. Эти антитела могут, например, индуцироваться внутриклеточными антигенами, высвобождаемыми из апоптотических опухолевых клеток [5], или мутировавшими белками, которые вызывают антитела, перекрёстно реагирующие с немутировавшими аналогами. Например, было показано, что антитела против опухолеспецифического мутанта субъединицы РНК-полимеразы III (RPC1) перекрёстно реагируют с нормальным RPC1, тем самым способствуя развитию аутоиммунного заболевания – склеродермии [6, 7]. На сегодняшний день выявлено более 100 специфических аутоантител к различным неопластическим заболеваниям, которые могут быть использованы для диагностики и лечения [8]. Аутоантитела, индуцированные раком, могут быть класса IgM (первичный ответ), IgG (вторичный ответ) и IgA (слизистые) [9, 10]. Таким образом, вызванные раком самореактивные IgM-ответы могут подвергаться аффинному созреванию и формировать иммунологическую память.
В отличие от этого, мало что известно о влиянии химиотерапии на аутоиммунные реакции. Индуцированная химиотерапией гибель клеток приводит к высвобождению опухолевых антигенов из умирающих опухолевых клеток вместе с молекулярным паттерном, ассоциированным с повреждением (DAMPs), которые связывают рецепторы иммунных клеток, стимулируя иммунный ответ [11]. Тем не менее, сообщалось лишь о нескольких ассоциациях между химиотерапией и аутоиммунитетом. Недавно был описан случай с пациентом с энцефалитом, вызванным химиотерапией [12]. Кроме того, гемофагоцитарный лимфогистиоцитоз и артропа- тия были связаны с химиотерапие участие аутоантител в артропатии казано, что цетуксимаб (анти-EGFR титело) истощает регуляторны можно, способствуя активации ских B-клеток [15]. Однако ко аутоиммунитета, индуцированн й, причем доказано [13, 14]. Было по-моноклональное ан-(Treg) клетки, воз-
аутоантиген-специфиче-плексное исследование ого химиотерапией и те-
рапией моноклональными антителами, отсутствует. Поэтому мы определили аутоиммунную реакцию у пациента с метастазированным раком толстой кишки после комбинированной адъювантной химиотерапии и терапии моноклональными антителами. С этой целью мы использовали анализ агглютинации для количественного определения IgM-антител (отражающих первичный аутоиммунный ответ) против различных органов человека и опухоли пациента. IgM-ответы наблюдались до и во время семи циклов лечения фолиновой кисло-той/фторурацилом/ иринотеканом (FOLFIRI) в сочетании с цетуксимабом. Мы обнаружили, что лечение было связано с сильным увеличением IgM, реагирующих на все исследуемые ткани, особенно в течение первых трёх циклов лечения. Хотя мы наблюдали снижение уровня IgM в течение последующих циклов, IgM против большинства органов оставались выше исходного уровня до седьмого цикла. Наши данные подтверждают, что химиотерапия может вызывать аутоиммунные реакции против различных тка- невых антигенов чело помочь предотвратит ления, связанные с и
Мониторинг IgM-ответов может смягчить неблагоприятные яв-тетом, в ответ на химиотерапию.
Описание
Во время
тиро ения
. Гис
был диагно распростра моидэктоми ренно диф циному, про фоваскуляр химиотерап
Гистология
инического случая ановой операции у 55-летней женщины ан рак сигмовидной кишки. Признаков опухоли не было. Была проведена сиг-тологическое исследование выявило уме- еренцированную колоректальную аденокар-никшую в жировую ткань и с обширной лимой инвазией. Пациент получил восемь циклов и (режим XELOX). Позитронно-эмиссионная ая томография (ПЭТ-КТ) и магнитно-резонанс-фия (МРТ) не выявили распространения рака. но через год после постановки первоначаль-а УЗИ брюшной полости и ПЭТКТ выявили рак тенциально метастатического происхождения. м предполагаемые метастазы были обнаружены одмышечном лимфатическом узле. Пациентке ена экстирпация матки с придатками и сальника. далённых органов выявила умеренно диффе- ренцированную аденокарциному левого яичника, вероятно, метастатического происхождения. Иммуногистохимия показала, что фенотип опухоли соответствует колоректальной карциноме. Последующая компьютерная томография показала метастаз в левом лёгком. В связи с этим пациент получил радиотерапевтическое лечение этого метастаза, ко-I торое, как показали последующие ПЭТ-КТ-сканирования, было успешным.
Примерно через девять месяцев ПЭТ-КТ выявила новый гиперметаболический узел в левом лёгком и гиперметаболическую лимфаденопатию в субкаринальном лимфатическом узле, скорее всего неопластического происхождения. Гиперметаболические очаги были выявлены в прямой мышце живота и правой подвздошной области. Была проведена тотальная биопсия метастатического очага передней брюшной стенки с частичной резекцией прямой мышцы живота слева. Гистологические результаты соответствовали метастазам аденокарциномы.
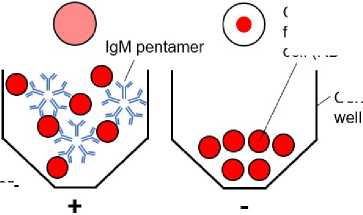
Пациентка получила семь циклов химиотерапевтического лечения по схеме FOLFIRI плюс цетуксимаб в течение примерно трёх месяцев. Оценка ПЭТ-КТ подтвердила стабилизацию состояния пациентки. Для мониторинга состояния здоровья пациентки и аутоиммунного ответа на химиотерапию мы провели количественную оценку самореактив-ных IgM-ответов на уровне органов, используя исследовательский диагностический подход. Вкратце, растворимые компоненты гомогенатов различных органов человека и опухолевой ткани пациента были иммобилизованы на поверхно- сти козьих эритроцитов (РБК). Функционализированные человеческим антигеном РБК инкубировали с серийными разведениями сыворотки пациента, в результате чего органоспецифический IgM, благодаря своей олигомерной природе, сшивал РБК (рис. 1, a). Подобно стандартному анализу на гемагглютинацию, считывание показаний основано на дифференциации диффузных лунок и лунок с
РБК, осевших на дно 96-луночного планшета с U- или V-образным дном. Последовательные разведения позволяют количественно определить органоспецифические титры IgM, выраженные в виде коэффициентов разведения сыворотки (рис. 1, b). Изображения репрезентативных анализов агглютинации с использованием сыворотки пациента показаны на рисунке 1, c.
a
b
Organ-or tumorspecific IgM
Top view
Side view
Cone-shaped
IgM titers:
Antigen A: 32
Antigen B: 128
Antigen C: 2
Organ- or tumor antigen functionalized red blood cell (RBC) or microparticle
|
ABC |
Dilution |
ABC |
|
ЮОО |
1:4 |
lOO® |
|
2OOO |
1:8 |
200® |
|
3 000 |
1:16 |
300® |
|
4 000 |
1:32 Incubate |
400® |
|
5 000 |
1:64 ----------► |
5000 |
|
6 000 |
1:128 |
6®O® |
|
7 000 |
1:256 |
7®®® |
|
8 000 |
1:512 |
8®®® |
Combine antigen-functionalized RBCs with serially diluted serum
Рисунок 1. Принцип анализа для количественного определения IgM: a – красные кровяные тельца (ККТ) или микрочастицы функционализируются антигенами, выделенными из органов или опухолевой ткани. В присутствии антиген-специфического IgM (слева) РБК/микрочастицы агглютинируются (образуется решётка), видимая как диффузная светло-красная суспензия. В присутствии антиген-специфического IgM (справа) РБК/микрочастицы не агглютинируются и опускаются на дно конусообразной лунки, что видно в виде отчётливой темно-красной точки; b – титрование образцов сыворотки для определения титра IgM против различных антигенов (A, B и C). Титр IgM определяется как самый высокий коэффициент разведения сыворотки, при котором наблюдается агглютинация;
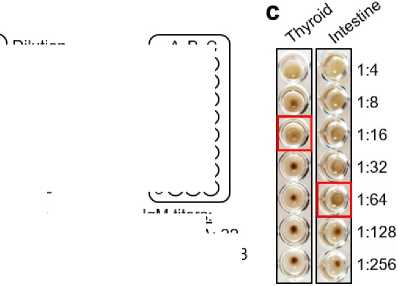
c – репрезентативные изображения анализов агглютинации с использованием сыво указанных органов. Лунки, представляющие предполагаемые титры IgM, выделен Figure 1. Assay principle for quantification of IgM: a – Red blood cells (RBCs) or micro organs or tumor tissue. In the presence of antigen-specific IgM (left), the RBCs/micropart diffuse light red suspension. In the presence of antigen-specific IgM (right), the RBCs/mic of the cone-shaped well, visible as a distinct dark red dot; b – titration of serum sample
ротки пациента после третьего цикла химиотерапии ы красными квадратами particles are functionalized by antigens isolated from icles are agglutinated (a lattice is formed), visible as a roparticles do not agglutinate and sink to the bottom s to determine the IgM titer against different antigens
(A, B, and C). The IgM titer is defined as the highest serum dilution factor at agglutination assays using patient serum after the third cycle of chemotherap are highlighted in red squares
Во всех органах и опухолевой ткани мы на

т развед Высок


дали быстрое первоначальное повышение уровня IgM (четырех–восьмикратное увеличение по сравнению с исходным уровнем). На следующий день титры снизились, но затем снова возросли и стабилизировались на уровне выше исходного на шесть–девять дней после первого цикла химиотерапии. Особенно высокими были титры IgM к лёгким (титр 64, 32-кратное увеличение по сравнению с исходным уровн
кор (бл
glutination is observed; c – representative images of indicated organs. Wells representing putative IgM titers

и
ляли ≥ 512 – конечный коэффици-оротки, который тестировался.
ие титры самореактивных IgM предсказывают потенциально смертельный аутоиммунный оту было начато иммуносупрессивное лечение, е внутривенное введение раствора Рингера-козы, гидроксиэтилкрахмала и иммуноглобу-гащённых IgM (Пентаглобин), а также глюко-
оидов (Преднизолон), антигистаминных препаратов оры гистамина H1 и H2) и гепарина. В дальней-
32, 16-кратное увеличение) (рис. дения второго цикла у пациентк рая токсичность. Цикл был у снижения скорости инфузии ского эффекта. Титры IgM ко

c). Во время вве-тяжёлая ост-о завершён путем рования токсиче-рганам сразу после
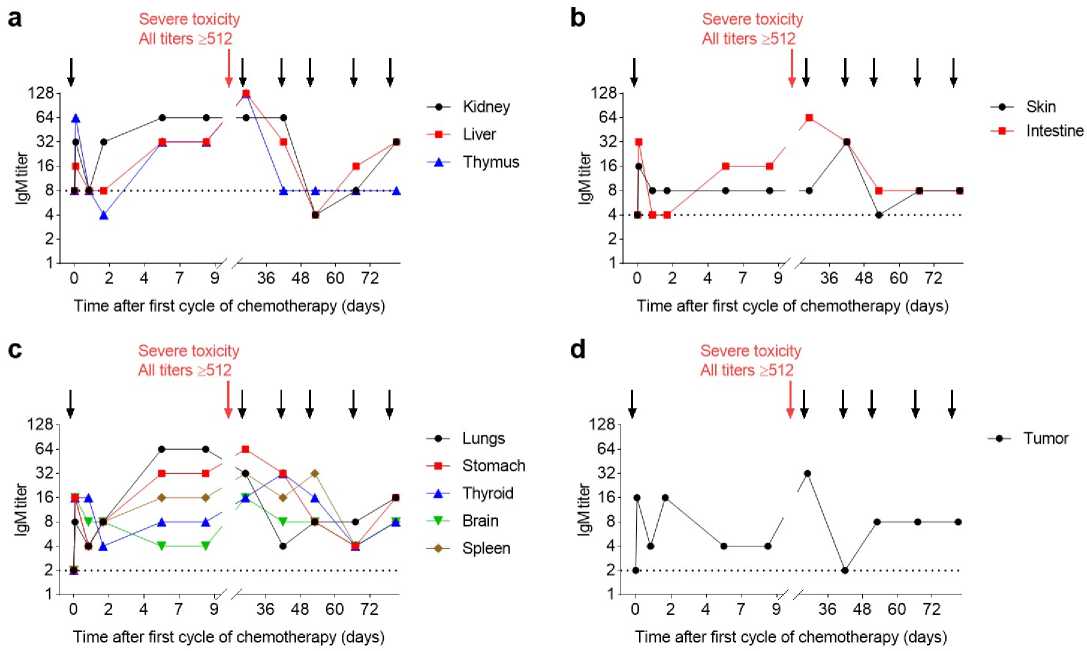
Рисунок 2. Титры IgM к различным органам и опухоли пациента до временные точки введения химиотерапии (FOLFIRI плюс цетуксимаб), при этом токсичность, выделено красной стрелкой. Титры сразу после второго цикла были На панели a показаны органы с относительно высоким исходным титром, b и соответственно. На панели d показаны титры IgM против опухоли пациента. Для о самом низком разведении сыворотки (4-кратном), титр IgM был определён как 2. ходные титры, наблюдавшиеся до первого цикла химиотерапии 1
Figure 2. IgM titers for various organs and patient's tumor before and during chemother ии. На всех панелях стрелками указаны ведение, вызвавшее тяжёлую острую всех тканей (на графиках не показано). омежуточным и низким исходным титром зцов, не обнаруживающих гемагглютинации при нктирные горизонтальные линии показывают ис-
и во время хим

otherapy administration (FOLFIRI plus cetuximab), with the second administrati arrow. Titers immediately after the second cycle were ≥ 512 for all tissues (not initial titers, b and c with intermediate and low initial titers, respectively. Panel d did not detect blood agglutination at the lowest serum dilution (4x), the IgM titer w before the first cycle of chemotherapy
py. In all panels, arrows indicate time points of chem-caused severe acute toxicity, highlighted by the red
own in the graphs). Panel a shows organs with relatively high hows IgM titers against the patient's tumor. For samples that s defined as 2. Dotted horizontal lines show initial titers observed
Вскоре после седьмого цикла химиотерапии пациентка была госпитализирована с симптомами острой респираторной инфекции. Результаты ПЦР-теста

е с
reg-кл генспеци

COVID-19 были положительными. Пациентка сконча-дели. ханизм, на мыш тканей г
Ps, которые могут стимулировать иммунный е того, вызванное цетуксимабом истощение ] могло способствовать активации аутоанти-ских IgM-продуцирующих B-клеток. Другой ме-
лась от тяжёлой пневмонии примерно через три не
Обсуждение
Мы наблюдали повышение уровня аутореа
раково-специфических IgM-антител после хи по схеме FOLFIRI плюс цетуксимаб. Диагнос ществляли с помощью биопроб по разра приоритетной методике с использование рованного туморного маркера пациента
певтические препараты, как правило, сичностью и поэтому могут поврежда важных органов. Это может вызыват акции через различные механизмы. клеток может привести к высв


кл
х и ии осунами
имиотера- т цитоток-тки жизненно иммунные ре-
Например, гибель нию аутоантигенов
который был экспериментально продемонстрирован иной модели, заключается в том, что повреждение может привести к появлению неоэпитопов, которые
знаются циркулирующими аутореактивными IgM-анти-
телами [16]. Это может вызвать экспансию В-клеток, продуцирующих IgM [16, 17]. Индукция аутореактивных адаптивных иммунных ответов и экспансия самореактивных иммуноглобулинов после физической травмы (например, тупой травмы живота или ожоговой раны), вероятно, связаны с поглощением дендритными клетками апоптотических клеток с комплементом [18]. Ещё предстоит выяснить, применимы ли вышеупомянутые механизмы к повреждению тканей, вызванному химиотерапией, и аутореактивным IgM-ответам, наблюдаемым в данном исследовании. Высокие титры аутоиммунных IgM ко всем исследованным органам после второго
цикла химиотерапии/цетуксимаба, вызвавшего сильную токсичность, могли отражать аутоиммунную бурю – состояние, о котором ранее сообщалось после лечения пемб-ролизумабом (анти-PD1) пациента с раком лёгких [19]. В последнем (смертельном) случае пембролизумаб вызвал воспалительное состояние различных органов (тиреоидит, миокардит, пневмонит) наряду с повышенным уровнем различных аутоиммунных антител, в том числе против тиреоглобулина, тиреоидной пероксидазы, митохондрий, ацетилхолинового рецептора, полосатой мышцы и других. Мониторинг аутоиммунного статуса различных органов во время лечения рака, как в описанном здесь случае, может помочь своевременно начать меры по смягчению токсичности, вызванной терапией, до появления симптомов. В более общем плане было показано, что аутореактивные антитела увеличиваются, например, у пациентов с аутоиммунными заболеваниями, после физической травмы или во время COVID-19, среди прочих [14, 16, 17, 20]. Ранняя и быстрая диагностика реакций аутоантител на тканевом уровне может привести к улучшению прогноза для таких пациентов.
Выводы
Это исследова мореактивные IgM индуцированы х на основе аггл определить Мониторинг тов с рако повышен

э ли лило сделать вывод, что са-азличных органов могут быть ией. Экспериментальный анализ позволил быстро количественно тветы с органной специфичностью.
-ответов может улучшить прогноз пациен-ругими заболеваниями, связанными с я аутоантител.
Список литературы Индуцированные химиотерапией широкореактивные аутоантитела в лечении злокачественных новообразований
- Johnson A.K. Repercussions of occult malignancy - an etiologic basis for rheumatic disease. Med Hypotheses. 2013;80:447-51. https://doi.Org/10.1016/j.mehy.2012.12.038
- Naschitz J.E. Rheumatic syndromes: clues to occult neoplasia. Curr Opin Rheumatol. 2001;13:62-6. https://doi.org/10.1097/00002281-200101000-00010
- Chatham M., Niravath P. Anti-Yo-Associated Paraneoplastic Cerebellar Degeneration: Case Series and Review of Literature. Cureus. 2021;13:e20203. https://doi.org/10.7759/cureus.20203
- Mandal S., Pile K., Chacko R.T., Danda D. Malignancy and autoimmunity: causally or casually related? Int J Rheum Dis. 2014;17:601-5. https://doi.org/10.1111/1756-185X.12536
- Albert M.L., Darnell R.B. Paraneoplastic neurological degenerations: keys to tumour immunity. Nat Rev Cancer. 2004;4:36-44. https://doi.org/10.1038/nrc1255
- Joseph C.G., Darrah E., Shah A.A. et al. Association of the autoimmune disease scleroderma with an immunologic response to cancer. Science. 2014;343:152-7. https://doi.org/10.1126/science.1246886
- Teng M.W., Smyth M.J. Cancer. Can cancer trigger autoimmunity? Science. 2014;343:147-8. https://doi.org/10.1126/science.1249486
- De Jonge H., lamele L., Maggi M., Pessino G., Scotti C. Anti-Cancer Auto-Antibodies: Roles, Applications and Open Issues. Cancers (Basel). 2021 ;13:813. https://doi.org/10.3390/cancers13040813
- Wilson A.L., Moffitt L.R., Duffield N., Rainczuk A., Jobling T.W., Plebanski M., Stephens A.N. Autoantibodies against HSF1 and CCDC155 as Biomarkers of Early-Stage, High-Grade Serous Ovarian Cancer. Cancer Epidemiol Biomarkers Prev. 2018;27:183-192. https://doi.org/10.1158/1055-9965.EPI-17-0752
- Roney M.SI., Lanagan C., Sheng Y.H. et al. IgM and IgA augmented autoantibody signatures improve early-stage detection of colorectal cancer prior to nodal and distant spread. Clin TranslImmunology. 2021 ;10:e1330. https://doi.org/10.1002/cti2.1330
- Ocadlikova D., Lecciso M., Isidori A. et al. Chemotherapy-Induced Tumor Cell Death at the Crossroads Between Immunogenicity and Im-munotolerance: Focus on Acute Myeloid Leukemia. Front Oncol. 2019;9:1004. https://doi.org/10.3389/fonc.2019.01004
- Yamada N., Yamasaki K., Yamamoto N., Kuki I., Sakuma H., Hara J. Chemotherapy-induced autoimmune-mediated encephalitis during germinoma treatment. Brain Dev. 2021 ;43:967-971. https://doi.org/10.1016/j.braindev.2021.05.010
- Strenger V., Merth G., Lackner H. et al. Malignancy and chemotherapy induced haemophagocytic lymphohistiocytosis in children and ado-lescents-a single centre experience of 20 years. Ann Hematol. 2018;97:989-998. https://doi.org/10.1007/s00277-018-3254-4
- Kim M.J., Ye Y.M., Park H.S., Suh C.H. Chemotherapy-related arthropathy. J Rheumatol. 2006;33:1364-8.
- Wang L., Wei Y., Fang W., Lu C., Chen J., Cui G., Diao H. Cetuximab Enhanced the Cytotoxic Activity of Immune Cells during Treatment of Colorectal Cancer. Cell Physiol Biochem. 2017;44:1038-1050. https://doi.org/10.1159/000485404
- Narang A., Qiao F., Atkinson C., et al. Natural IgM antibodies that bind neoepitopes exposed as a result of spinal cord injury, drive secondary injury by activating complement. JNeuroinHammation. 2017;14:120. https://doi.org/10.1186/s12974-017-0894-6
- Needham E.J., Stoevesandt O., Thelin E.P. et al. Complex Autoantibody Responses Occur following Moderate to Severe Traumatic Brain Injury. J Immunol. 2021;207:90-100. https://doi.org/10.4049/jimmunol.2001309
- Chakraborty S., Karasu E., Huber-Lang M. Complement After Trauma: Suturing Innate and Adaptive Immunity. Front Immunol. 2018; 9:2050. https://doi.org/10.3389/fimmu.2018.02050
- Fuentes-Antrás J., Peinado P., Guevara-Hoyer K., Del Arco C.D., Sánchez-Ramón S., Aguado C. Fatal autoimmune storm after a single cycle of anti-PD-1 therapy: A case of lethal toxicity but pathological complete response in metastatic lung adenocarcinoma. Hematol Oncol Stem Cell Ther. 2020;S1658-3876(20)30098-4. https://doi.org/10.1016/j.hemonc.2020.04.006
- Sotzny F., Filgueiras I.S., Kedor C. et al. Dysregulated autoantibodies targeting vaso- and immunoregulatory receptors in Post COVID Syndrome correlate with symptom severity. Front Immunol. 2022;13:981532. https://doi.org/10.3389/fimmu.2022.981532
- Shanin V.Y. Immunologically substance, process for preparing same, bioprobe, pharmaceutical composition, diagnostics and treatment methods. WO2012053928A1. 2012, EA 018848B1.


