Индукция анаэробных процессов у байкальских эндемиков Eulimnogammarus vittatus (Dyb.) и Е. verrucosus (Dyb.) (Amphipoda, Crustacea)
Автор: Тимофеев М.А., Кириченко К.А., Рохин А.В., Бедулина Д.С., Чернышова К.П., Побежимова Т.п
Журнал: Журнал стресс-физиологии и биохимии @jspb
Рубрика: Original article
Статья в выпуске: 1 т.2, 2006 года.
Бесплатный доступ
В исследовании представлены материалы, подтверждающие способность байкальских эндемичных видов амфипод Eulinmogammarus verrucosus (Dyb.) и Е. vittatus (Dyb.) активировать анаэробный гликолиз в условиях гипоксии. У представленных видов отмечены различия в степени, скорости накопления молочной кислоты и скорости ее реметаболизации при возвращении к аэробиозу. На примере Е. vittatus показана способность байкальских энденимиков к активации и других анаэробных процессов - анаэробного липолиза и процесса анаэробного образования сукцината
Гипоксия, кислород, байкал, анаэробиоз, амфиподы
Короткий адрес: https://sciup.org/14323454
IDR: 14323454
Текст обзорной статьи Индукция анаэробных процессов у байкальских эндемиков Eulimnogammarus vittatus (Dyb.) и Е. verrucosus (Dyb.) (Amphipoda, Crustacea)
Вода озера Байкал насыщена кислородом, ее насыщение близко к 100% и не падает ниже 80% даже на глубине 1000 м в том числе зимой под льдом. Концентрация кислорода в байкальской воде меняется незначительно в ходе суточных и годовых циклов в поверхностных слоях воды содержание кислорода составляет в среднем 11,7 – 11,9 мг/л, а на глубине 1400 м – 9,9 – 10,6 мг/л (Вотинцев, 1961; Галазий, 1987).
Существует точка зрения, что стабильное и высокое насыщение байкальской воды кислородом способствовало формированию видов со слабо выраженными или редуцированными механизмами адаптации к гипоксии. Такое предположение базируется на мнении, что данные виды на протяжении своего эволюционного развития не сталкивались с необходимостью адаптироваться к низким концентрациям кислорода. Так в работах В.И. Колупаева (1984; 1989), говорится об отсутствии у байкальских видов развитых адаптивных механизмов к пониженному содержанию кислорода и неспособности использовать анаэробное дыхание.
Предполагается, что чувствительность байкальских эндемиков к недостатку кислорода, является важным фактором обуславливающих несмешиваемость байкальской и палеарктической фауны (Тимофеев, Кириченко, 2003).
В ходе наших предварительных исследований было показано, что некоторые байкальские виды амфипод способны активировать анаэробные процессы. Так в исследовании, проведенном на оксичувствительном глубоководном байкальском виде Ommatogammarus flavus (Dyb.) была показана активация анаэробного гликолиза (Тимофеев и др., 2003). Позже была установлена способность к индукции анаэробного гликолиза у байкальского (E. cyaneus Dyb.) и палеарктического (Gammarus lacustris Sars.) видов амфипод, выявлены различия в степени активации анаэробных процессов у данных видов (Кириченко и др., 2004; Тимофеев и др., 2005).
Целью данного исследования было установить особенности активации анаэробного гликолиза при гипоксии в воде а так же специфику метаболизации лактата при возвращении к нормоксии у двух эндемичных видов байкальских амфипод Eulimnigammarus vittatus и E. verrucosus . Дополнительно оценивали способность к активации других биохимических механизмов, кроме анаэробного гликолиза, подключающихся в условиях пониженного содержания кислорода.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования были выбраны литоральные байкальские виды амфипод Eulimnogammarus vittatus и Eulimnogammarus verrucosus . Виды широко распространенные по всему Байкалу (Базикалова, 1941; Тимофеев, 2000).
Сбор амфипод проводили на урезе воды в районе пос. Большие Коты. Амфипод содержали в аэрируемых аквариумах, при температуре 6-8оС не менее 1-2 суток преаклимации. Во всех экспериментах использовали здоровых и активно плавающих амфипод.
В ходе экспериментов амфипод содержали в воде с пониженным уровнем кислорода: 3–4 мгО 2 /л (гипоксия). В качестве контрольной группы использовались рачки, содержащиеся в воде с концентрацией кислорода 10-11 мгО2/л в условиях постоянной аэрации (нормоксия). Длительность экспозиции составляла от 1 до 6 часов. У амфипод оценивали уровни накопления продуктов анаэробного обмена – лактата, ацетона, ацетоуксусной кислоты и сукцината. После 6 ч. гипоксии амфипод помещали в воду с нормальным содержанием кислорода (10-11 мгО 2 /л) и определяли уровень метаболизации лактата. Концентрацию молочной кислоты, ацетона, ацетоуксусной кислоты и сукцината определяли в очищенном от белков и липидов водном экстракте из недифференцированных тканей. Для этого зафиксированный материал сушили в течение 1 часа при 100оС, растирали в ступке, а порошок растворяли в дистиллированной воде. После центрифугирования в течение 15 мин. при 14000 об/мин (Minispin, Eppendorf), отбирали супернатант, к которому добавляли равный объем хлороформа. Для анализа использовали водорастворимую фракцию. Определение ацетона, ацетоуксусной кислоты и сукцината проводили с использованием метода ядерно-магнитного резонанса (ЯМР). Определение содержания лактата проводили энзиматическим спектрофотометрическим методом с помощью стандарт-набора. Принцип метода: под воздействием лактатоксидазы из лактата и кислорода образуется пировиноградная кислота и Н 2 О 2 , количественно равная присутствующему лактату, а затем в процессе взаимодействия 4-аминоантипирина и п-хлорфенола с Н 2 О 2 в присутствии пероксидазы образуется окрашенный в красный цвет хинониминовый продукт, с максимумом поглощения в области 505 нм. Концентрацию лактата находили по калибровочной кривой. Количественный расчет лактата проводили на мг. сухого веса. Анализ выполняли на спектрофотометре UNICO 1200.
РЕЗУЛЬТАТЫ
На рисунках 1 и 2 представлены результаты спектрофотометрического определения уровня лактата у амфипод в условиях гипоксии и нормоксии. Как видно из представленных данных содержание амфипод обоих видов в условиях пониженного уровня кислорода вызывало увеличение концентрации молочной кислоты в тканях относительно контрольного уровня.
Причем, достоверное увеличение содержания лактата в тканях амфипод наблюдалось уже после 1 часа содержания амфипод в условиях гипоксии. Затем, через 3 часа экспонирования, концентрация молочной кислоты продолжала расти и к 6-ти часам эксперимента достигла максимального значения. При помещении амфипод в условия нормальной аэрации наблюдается снижение уровня молочной кислоты.
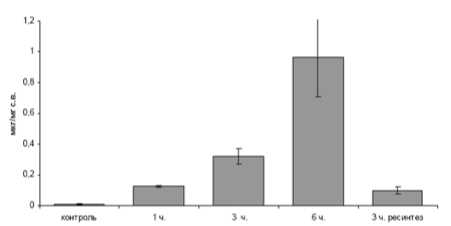
Рис. 1 . Уровень лактата у E. vittatus в контроле, после экспозиции в условиях гипоксии и при возвращении в условия нормоксии после 6ти часовой гипоксии
Стоит отметить, что определенный уровень лактата присутствует и в условиях контроля, при нормальном содержании кислорода.
Контрольный уровень содержания молочной кислоты у исследованных видов отличается. Наибольшая концентрация характерна для E. verrucosus – 0,025 (±0,006) мкг/мг сух.в., для E. vittatus – 0,011 (±0,006) мкг/мг сух.в.
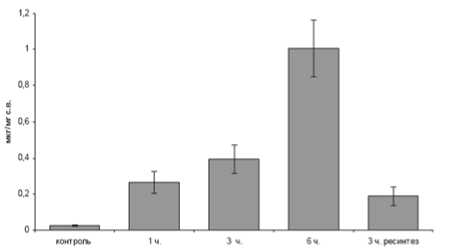
Рис. 2. Уровень лактата у E. verrucosus в контроле, после экспозиции в условиях гипоксии и при возвращении в условия нормоксии после 6ти часовой гипоксии.
На рисунке 3 представлены результаты ЯМР-оценки накопления сукцината, ацетона и ацетоуксусной кислоты у амфипод, подверженных влиянию гипоксии. Как видно из представленных данных экспозиция в условиях пониженного содержания кислорода, ведет к последовательному повышению уровня данных веществ. Так, в контрольных условиях (Рис. 3. А)
концентрация янтарной кислоты составляет 0,0044 мМ на 1 мг сух. веса, ацетон и ацетоуксусная кислота не детектируются. После 1 часа экспозиции в условиях пониженной концентрации кислорода происходит увеличение содержания данных продуктов – ацетона до 0,0066 мМ на мг сух.в., ацетоуксусной кислоты до 0,0078 мМ на мг сух.в., янтарной кислоты до
0,0066 мМ на мг сух.в. После 3х часов экспозиции концентрация данных веществ возрастает до 0,0078, 0,0130 и 0,0270 мМ на мг сух.в. соответственно, концентрация достигает своих максимальных значений через 6 часов экспе-римента - 0,0097, 0,0133 и 0,0420 мМ на мг сух.в.
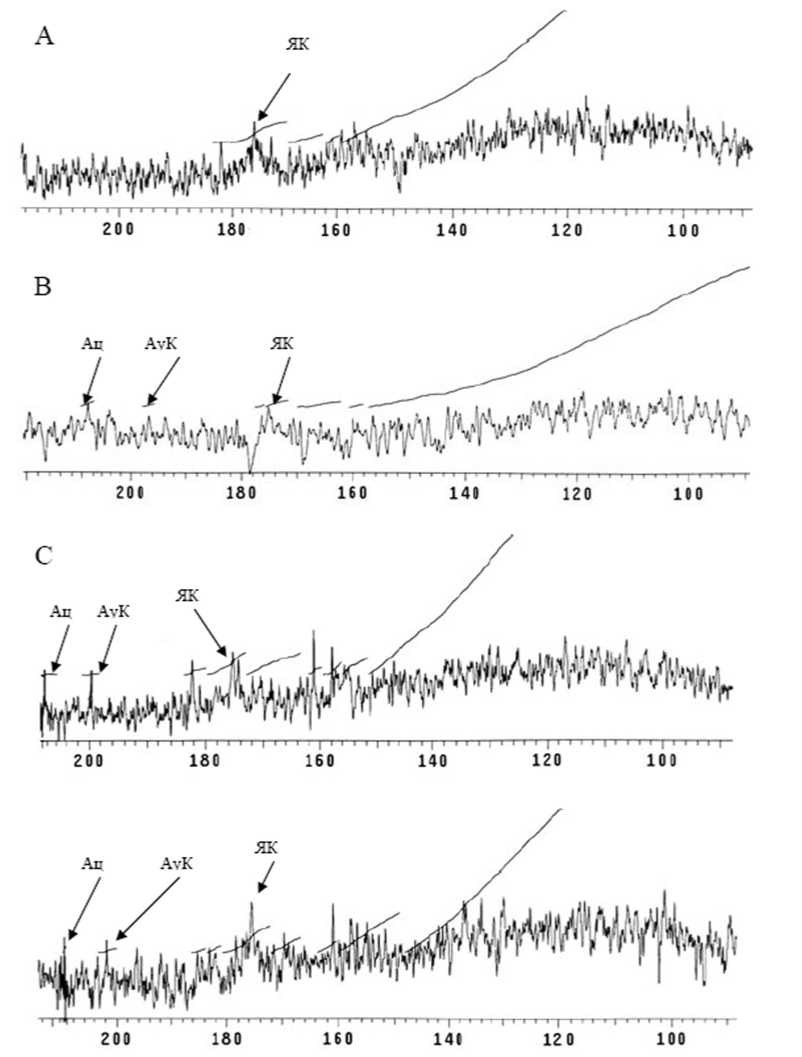
Рис. 3. Содержание ацетона (Ац), ацетоуксусной кислоты (АуК) и янтарной кислоты (ЯК) в тканях E. vittatus в контроле и условиях гипоксии. А – контроль, В – 1 ч., С – 3 ч, D – 6 ч. в условиях гипоксии
ОБСУЖДЕНИЕ
Из полученных нами данных можно сделать заключение, что в условиях гипоксии у амфипод видов E. vittatus и E. verrucosus происходит достоверное накопление лактата.
При этом содержание амфипод обоих видов в условия гипоксии 1, 3 и 6 ч. приводит к неоднородному накоплению лактата у представителей разных видов. В целом скорость и степень его прироста выше у E. verrucosus.
Скорость утилизации лактата, накопленного в ходе экспонирования в условиях гипоксии, также неодинакова для представленных видов. Для E. verrucosus характерна меньшая скорость метаболизации молочной кислоты по сравнению с E. vittatus .
Известно, что лактат, являясь конечным продуктом анаэробного гликолиза у ракообразных, накапливается в условиях гипоксии и не выводится, а лишь реметаболизируется в гептопанкриасе (De Wachter et al., 1997; Hervant et al., 1999).
Подключение анаэробного гликолиза характерно для поддержания энергопродукции в условиях дефицита кислорода для многих ракообразных (De Wachter et al., 1997; Hervant et al., 1999).
Таким образом показано, что E. vittatus и E. verrucosus , как и ранее исследованные байкальские виды Ommatogammarus flavus , E. cyaneus и палеарктический Gammarus lacustris , при гипоксии способны активировать анаэробный гликолиз (Тимофеев и др., 2003; Кириченко, Тимофеев, 2004; Кириченко и др., 2004).
Накопление сукцината указывает на то, что кроме гликолиза и липолиза у E. vittatus в условиях гипоксии активируется процесс анаэробного образования сукцината.
Из литературы известно, что использование дополнительных путей анаэробной продукции энергии связано с тем, что для поддержания синтеза АТФ в анаэробных условиях требуется гораздо больше глюкозы, чем в аэробных. При переходе на анаэробный распад углеводов -гликолиз, в результате следующего за ним дефицита глюкозы организм вынужден подключать процесс распада липидов – липолиз (Страйер, 1985; Уайт и др., 1981). В условиях пониженного содержания кислорода распад липидов происходит не полностью, а лишь до промежуточных продуктов – ацетил-КоА, из которого в данных условиях образуются кетоновые тела (ацетон, ацетоуксусная кислота и β-оксимаслянная кислота), накапливающиеся в тканях (Tsubokawa et al., 1998. Vannucci et al., 2004). Следует отметить, что данный путь так же можно назвать вынужденным, поскольку образующиеся продукты сами по себе являются токсичными для клеток (Tsubokawa et al., 1998. Susan et al., 2004).
Отмеченное накопление ацетона и ацетоуксусной кислоты говорит о том, что в условиях гипоксии у E. vittatus помимо анаэробного гликолиза подключается и липолиз, конечными продуктами которого и являются упомянутые метаболиты.
Отмеченное накопление янтарной кислоты в условиях гипоксии у E.vittatus также свидетельствует о присутствии процесса анаэробного образования сукцината в дополнение к ранее перечисленным процессам. Накопление сукцината в условиях гипоксии характерно и для других видов водных организмов (Hervant et al. 1997). При гипоксии сукцинат образуется из НАД-зависимых субстратов и аминокислот (Маевский и др. 2000).
Таким образом, полученные данные не позволяют говорить о принципиальных отличиях байкальских амфипод от большинства ракообразных. Эндемичные байкальские E. vittatus и E. verrucosus, как и многие небайкальские ракообразные, в условиях пониженной концентрации кислорода способны к активации как анаэробного гликолиза, так и других анаэробных процессов.
Работа поддержана грантом РФФИ № 05-04-97239-р_байкал.
Список литературы Индукция анаэробных процессов у байкальских эндемиков Eulimnogammarus vittatus (Dyb.) и Е. verrucosus (Dyb.) (Amphipoda, Crustacea)
- Базикалова А.Я. (1941) Материалы по изучению размножения байкальских амфипод. Изв. АН. СССР серия биол. -№3. -С. 407-425.
- Вотинцев К. К. (1961) Гидрохимия озера Байкал. М.: Изд-во АН СССР. -311 с.
- Галазий Г.И. (1987) Байкал в вопросах и ответах. Восточно-Сибирское книжное изд-во. -384 с.
- Колупаев Б.И. (1984) Дыхательный коэффициент у байкальских гидробионтов//Экология. №2. -С. 79-81.
- Колупаев Б.И. (1989) Дыхание гидробионтов в норме и патологии. Казань,. -190 с.
- Кириченко К.А., Тимофеев М.А. (2004) Индукция анаэробного метаболизма в ответ на снижение содержание кислорода в воде у байкальских амфипод//Вестник Иркутского университета. Специальный выпуск. Материалы ежегодной научно-теоретической конференции молодых ученых.-Иркутск: Иркут. ун.-т., -С. 13-14.
- Кириченко К.А., Бедулина Д.С., Тимофеев М.А. (2004) Индукция анаэробных процессов у байкальских эндемичных амфипод в условиях гипоксии//Вестник Томского государственногоуниверситета. Приложение. №11. -С. 116.
- Маевский Е.И., Гришина Е.В., Розенфельд A.C., Зякун A.M., Верещагина И.М., Кондрашова М.Н. (2000) Анаэробное образование сукцината и облегчение его окисления -возможные механизмы адаптации клетки к кислородному голоданию. Российский Биомедицинский Журнал, 2000. С. 32-36
- Страйер Л. (1985) Биохимия в 3-х томах. -М.: Мир.
- Тимофеев М.А. (2000) Сравнительная оценка отношения байкальских гаммарид и голарктического Gammarus lacustris к абиотическим факторам/Дис.... канд. биол. наук. Иркутск. -139 с.
- Тимофеев М.А., Кириченко К.А., Рохин А.В. (2003) К вопросу о существовании механизмов устойчивости к гипоксии у байкальских амфипод//Бюллетень ВСНЦ СО РАМН. №7. -С. 152-155.
- Тимофеев М.А., Кириченко К.А. (2004) Экспериментальнаяоценкароли абиотических факторов в ограничении распространения эндемиком за пределы озера Байкал на примере амфипод//Сибирский экологический журнал. №1. -С. 41-50.
- Тимофеев М.А., Кириченко К.А., Чернышова К.П., Протопопова М.В. (2005) Особенности индукции анаэробных процессов у байкальских амфипод и палеарктического Gammarus lacustris II Актуальные проблемы экологической физиологии, биохимии и генетики животных: Мат. межд. научн. конф. Саранск: Изд-во Мордов. ун-та. -С. 237-238.
- Уайт А., Хендлер Ф., Смит Э. и др. (1981) Основы биохимии. -М.: Мир. Т 1 -3. -1879 с.
- De Wachter B., Sactoris F-J., Portner H-O. (1997) The anaerobic endproduct lactate has a behavioral and metabolic signaling function in the shore crab Carcinus maenas II The Journal of Experimental Biology. 200, 1015-1024.
- Hervant F., Garin D., Mathieu J., Freminet A. (1999) Lactate metabolism and glucose turnover in the subterranean crustacean Niphargus virei during post-hypoxic recovery//The Journal of Experimental Biology. 202. 579-592.
- Hervant F., Matieu J., Messana G. (1997) Locomotory, ventilator and metabolic responses of the subterranean Stenosellus verei (Crustacea. Isopoda) to sever hypoxia and subsequent recovery//С R Acad. Sci III, 320, №2. 139-148.
- Tsubokawa T., Yamamoto K., Nishimura K., Yagi T. and Kobayashi T. (1998) Effects of inhaled oxygen concentration on fat metabolism during propofol infusion in rabbits. British Journal of Anaesthesia, 81, 5, 761-765.
- Vannucci S. and Hagberg H. (2004) Hypoxia-ischemia in the immature brain. Journal of Experimental Biology 207, 3149-3154.


