Индукция бактерицидной активности разлагаемыми имплантатами
Автор: Попков А.В., Кононович Н.А., Попков Д.А., Годовых Н.В., Твердохлебов С.И., Больбасов Е.Н., Стогов М.В., Киреева Е.А., Горбач Е.Н., Литвинов Ю.Ю.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.29, 2023 года.
Бесплатный доступ
Введение. Проблема имплантат-ассоциированных инфекций в артропластике, остеосинтезе переломов и патологии позвоночника далека от своего разрешения. Перспективной является разработка биоразлагаемых имплантатов с биоактивными свойствами.Цель. Оценить in vitro бактерицидную активность имплантатов, изготовленных из разлагаемого материала (поликапролактона), пропитанного гидроксиапатитом и антибиотиком.Материалы и методы. Для изучения доступности антибиотиков цилиндрические образцы из PCL, импрегнированные антибиотиком (n = 6), инкубировали в дистиллированной воде при температуре 37 °С. Для оценки антибактериальных свойств использовали образцы в виде пористых дисков: контроль - образцы из PCL; 1 - образцы из PCL, покрытые антибиотиком и гидроксиапатитом; 2 - образцы из PCL, покрытые только антибиотиком; 3 - образцы из PCL, покрытые только гидроксиапатитом (n = 6 на каждый вид тестируемых образцов). Применяли диско-диффузионный метод определения чувствительности микроорганизмов к антибиотикам. Использовали штаммы микробов S. aureus ATCC 25923, P. aeruginosa ATCC 27853 и E. coli АТСС 25922. Тест-микроорганизмы культивировали на говяжье-пептонном агаре (МПА) при 37 °С в течение 24 часов. Количественные данные подвергали статистической обработке.Результаты. Определили, что 82,6 % антибиотика выделяется в течение первых суток инкубации и 8,2 % - на вторые сутки. Контрольные образцы не оказали бактерицидного действия. У образцов 3 выявлен антибактериальный эффект в отношении культуры E. coli. Образцы 1 и 2 в равной степени продемонстрировали значительное ингибирование роста S. aureus, P. aeruginosa, E. coli. Обсуждение. Большая часть антибиотика выделяется в гидролизат в течение первых двух суток инкубации. Пористые имплантаты, изготовленные из PCL и пропитанные антибиотиком, обладают выраженной антимикробной активностью в отношении наиболее распространенных грамотрицательных и грамположительных бактерий, вызывающих гнойные осложнения в хирургической практике. Наноструктурированный гидроксиапатит на поверхности имплантата не снижает бактерицидную активность.Заключение. Имплантаты из пористого поликапролактона, наполненные гидроксиапатитом и антибиотиками, будут способствовать стимуляции регенерации кости и одновременно обеспечивать антимикробный эффект. Наноструктурированный гидроксиапатит на поверхности имплантата не снижает бактерицидную активность.
Биоактивный имплантат, поликапролактон, гидроксиапатит, staphylococcus aureus, pseudomonas aeruginosa, escherichia coli, антимикробная активность, гидролитическая деградация
Короткий адрес: https://sciup.org/142240029
IDR: 142240029 | УДК: 615.33:616.71-089.844-77-003.95 | DOI: 10.18019/1028-4427-2023-29-6-596-601
Текст научной статьи Индукция бактерицидной активности разлагаемыми имплантатами
За последние десять лет достигнут значительный прогресс в разработке хирургических технологий реконструкции кости с использованием биорезорбиру-емых имплантатов, обладающих остеоиндуктивной активностью. Первые фиксирующие устройства, изготовленные из биоразлагаемых материалов, стали доступны с начала 1980-х годов [1, 2]. Они до сих пор используются в травматологии в качестве штифтов и винтов и позволяют избежать операции по удалению имплантата [3-7]. Такие штифты в основном изготовлены из полимолочной кислоты и не обладают остеогенной активностью, а заживление перелома происходит в обычные сроки [4, 8].
Риски септических осложнений после внутреннего остеосинтеза не являются незначительными. Исследования, направленные на повышение биоактивности полимерных имплантатов, наполненных антибиотиками (Биоматрикс, Алломатрикс-имплант, Остеоматрикс,
КоллаПан G, КоллаПан L), продемонстрировали эффективность данного подхода [9, 10]. Однако матрица таких имплантатов имеет форму мелкозернистого материала или тонкой волокнистой пленки. Таким образом, они не обеспечивают стабильного остеосинтеза. В моделировании методом наплавления [11] для печати имплантатов с 3D-структурой в настоящее время используются нити из линейных биорезорбируемых полиэфиров, таких как полимолочная кислота (PLLA), поликапролактон (PCL), полигликолевая кислота (PGA) и их сополимеры. Насыщение этих имплантатов антибиотиками может обеспечить антимикробную активность, связанную со структурной целостностью и контролируемой резорбцией имплантата.
Цель – оценить in vitro бактерицидную активность имплантатов, изготовленных из разлагаемого материала (поликапролактона), пропитанного гидроксиапатитом и антибиотиком.
МАТЕРИАЛЫ И МЕТОДЫ
Два типа образцов имплантатов были изучены in vitro . Тип 1 имел форму интрамедуллярной спицы, используемой в ортопедической хирургии (цилиндрические образцы PCL длиной 10,0 мм и шириной 2,4 мм). С его использованием оценивалась доступность антибиотиков. Для изучения бактерицидной активности использовали диски диаметром 10 мм и толщиной 1 мм, изготовленные из PCL с помощью технологии 3D-печати. Диски имели ячейки диаметром 1-1,5 мм, ограниченные перекладинами диаметром 1 мм (как имплантаты, предназначенные для лечения дефектов кости). Поверхность всех имплантатов была пропитана цефотаксимом, который относится к антибиотикам широкого спектра действия.
Имплантаты были разработаны и изготовлены в Томском политехническом университете. Компонентами для приготовления композиционных материалов служили ε -поликапролактон (Sigma-Aldrich, США; Mn 80000) и гидроксиапатит (Fluidinova, Португалия; 10 ± 5 мкм). Для приготовления композита PCL растворяли в ацетоне особой чистоты («ЭКОС-1», Россия) в концентрации 15 мас. %. Гидроксиапатит (ГА) предварительно измельчали в шаровой мельнице в керамической камере с керамическими мелющими телами с добавкой ацетона в массовом соотношении 1,5:1 при скорости вращения 72 об/мин в течение 12 часов. После измельчения ГА в камеру добавляли раствор PCL и перемешивали в шаровой мельнице. После сушки полученный композит измельчали в низкоскоростной полимерной дробилке (Shini SG-1621N, Тайвань). Измельченные композиты экструдировали с помощью одношнекового экструдера Filabot EX2 (Filabot, США) с получением нитей диаметром 4 мм. Кроме того, частицы ГА наносились на поверхность имплантата путем погружения в суспензию порошка ГА и антибиотика цефотаксима в растворителе, а затем высушивались для удаления остатков растворителя.
Для изучения гидролитической деградации каждый цилиндрический образец из PCL (n = 6), импрегниро-ванный антибиотиком, помещали в отдельную измерительную ячейку, заполненную дистиллированной водой, объем которой определялся из расчета 4 мл на 1 см2 поверхности образца. Далее образцы инкубировали в термостате при температуре 37 °С. Инкубационную среду меняли ежедневно. Гидролизат подвергали химическому анализу на содержание антибиотика, которое определяли на спектрофотометре по интенсивности поглощения на длине волны 243 нм относительно стандартной калибровочной кривой. Продолжительность инкубации составила 7 дней.
Для выявления бактерицидной активности применяли диско-диффузионный метод определения чувствительности микроорганизмов к антибиотикам [12].
Для оценки антибактериальных свойств использовали следующие штаммы микробов: Staphylococcus aureus ATCC 25923 (грамположительные бактерии), Pseudomonas aeruginosa ATCC 27853 (грамотрица-тельные бактерии) и Escherichia coli АТСС 25922 (кишечные бактерии). Условия культивирования тест-микроорганизмов: тест-микроорганизмы культивировали на говяжье-пептонном агаре (МПА) при 37 °С в течение 24 часов. Рабочую суспензию тест-культур готовили из культуры данного тест-штамма, выращенной на плотной питательной среде (МПА) при 37 °С в течение 24 часов. Питательной средой для оценки бактерицидных свойств продуктов служил агар Мюллера-Хинтона. Для приготовления инокулята использовали метод прямого суспендирования колоний чистой культуры бактерий в стерильном изотоническом растворе 18-24-часовой, выращенных на плотной неселективной питательной среде (МПА). Плотность суспензии составляла 0,5 стандарта мутности МакФарланда.
На суточную свежую среду микробной тест-культуры наносили диски тестируемых продуктов. Время между подготовкой микробного культурного газона и нанесением на него дисков составляло не более 15 минут.
Контролем служили диски без покрытия фосфатом кальция и без антибиотиков. Другими типами были диски, покрытые гидроксиапатитом и антибиотиком (1), диски, покрытые только антибиотиком без гидроксиапатита (2), диски, покрытые только гидроксиапатитом (3).
Инкубация после наложения дисков проводилась при температуре 35 ± 1 °С и продолжалась 18 часов. Всего проведено 36 исследований (n = 6 на каждый вид тестируемых образцов).
Бактерицидную активность имплантата оценивали по зоне задержки роста тестируемых микроорганизмов вокруг дисков. Проверка проводилась в отраженном свете. При измерении зоны задержки роста ориентировались на зону полного подавления видимого роста.
Бактерицидную активность препаратов считали значимой, если зона задержки роста вокруг дисков составляла более 1 мм.
Статистический анализ проводился с использованием программы AtteStat 13.1 (Россия). Определяли медианные значения (Me), стандартное отклонение (SD), а также нижний и верхний квартили (Q1-Q3). Оценку нормального распределения выборок проводили с помощью критерия Шапиро – Уилка.
РЕЗУЛЬТАТЫ
Исследование показало, что 82,6 % антибиотика высвободилось в первый день инкубации (табл. 1). За этот период незначительно увеличилась масса образцов, что можно объяснить поглощением воды полимером. В остальные дни периода наблюдения значимого изменения массы проб не происходило. Целостность всех образцов за весь период инкубации сохранялась.
Контрольные диски, нанесенные на газоны от всех видов бактерий, не оказали бактерицидного действия. Вокруг дисков наблюдался непрерывный рост микробных культур (рис. 1). У всех образцов зона задержки ро- ста вокруг дисков не определялась (табл. 2). Эта серия подтвердила, что матрица имплантата из чистого поликапролактона не оказывает бактерицидного действия.
Диски образца 3, покрытые только гидроксиапатитом (без антибиотика), показали бактерицидное действие только в отношении культуры Escherichia coli (рис. 2, в). Зона задержки роста у этих образцов в среднем превышала 4 мм (табл. 2).
Диски с антибиотиком или антибиотиком в сочетании с гидроксиапатитом продемонстрировали значительное ингибирование роста бактерий (рис. 3).
Таблица 1
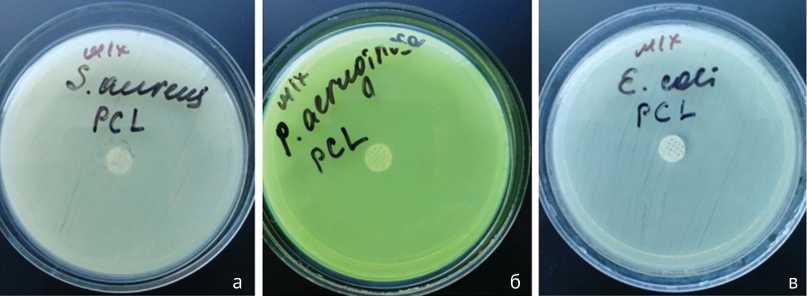
Рис. 1. Модифицированный диско-диффузионный метод определения чувствительности микроорганизмов к антибиотикам, отсутствие зоны ингибирования роста: а – S. aureus ; б — P. aeruginosa ; в – E. colli
Средние значения содержания цефотаксима в гидролизате и средний вес образцов
|
Сутки инкубации |
САНТ, мг/см2, М ± SD |
В АНТ , V |
Масса, мг |
% изменения массы от исходного уровня (0) |
|
0 |
0 |
0 |
66,2 ± 2,9 |
0 |
|
1 |
0,534 ± 0,074 |
82,6 |
66,5 ± 3,0 |
100,5 |
|
2 |
0,044 ± 0,009 |
8,2 |
66,4 ± 2,8 |
99,8 |
|
3 |
0,019 ± 0,012 |
3,6 |
66,3 ± 2,9 |
99,8 |
|
4 |
0,022 ± 0,008 |
4,0 |
66,0 ± 3,0 |
99,6 |
|
5 |
0,004 ± 0,001 |
0,8 |
66,0 ± 3,0 |
99,6 |
|
6 |
0,002 ± 0,001 |
0,4 |
65,9 ± 3,0 |
99,6 |
|
7 |
0,002 ± 0,001 |
0,4 |
65,5 ± 2,9 |
99,3 |
|
Итого за 7 дней |
0,627 ± 0,050 |
100 |
– |
– |
Список литературы Индукция бактерицидной активности разлагаемыми имплантатами
- Luo Y, Wang J, Ong MTY, et al. Update on the research and development of magnesium-based biodegradable implants and their clinical translation in orthopaedics. Biomater Transl. 2021;2(3):188-196. doi: 10.12336/biomatertransl.2021.03.003
- Rokkanen PU, Bostman O, Hirvensalo E, et al. Bioabsorbable fixation in orthopaedic surgery and traumatology. Biomaterials. 2000;21(24):2607-13. doi: 10.1016/s0142-9612(00)00128-9
- Heye P, Matissek C, Seidl C, et al. Making Hardware Removal Unnecessary by Using Resorbable Implants for Osteosynthesis in Children. Children (Basel). 2022 M;9(4):471. doi: 10.3390/children9040471
- Агаджанян В.В., Пронских А.А., Демина В.А., Гомзяк В.И., Седуш Н.Г., Чвалун С.Н. Биодеградируемые имплантаты в ортопедии и травматологии. Наш первый опыт. Политравма. 2016;(4):85-93.
- Haseeb M, Butt MF, Altaf T, Muzaffar K, Gupta A, Jallu A. Indications of implant removal: A study of 83 cases. Int J Health Sci (Qassim). 2017;11(1):1-7.
- Reith G, Schmitz-Greven V, Hensel KO, et al. Metal implant removal: benefits and drawbacks--a patient survey. BMC Surg. 2015;15:96. doi: 10.1186/ s12893-015-0081-6
- Zamora R, Jackson A, Seligson D. Correct techniques for the use of bioabsorbable implants in orthopaedic trauma. Curr Orthop Pract. 2016;27(4):469-473. doi: 10.1097/BCO.0000000000000378
- Голубев В.Г., Зеленяк К.Б., Старостенков А.Н. Применение биодеградируемых фиксаторов в лечении переломов области голеностопного сустава (сравнительное исследование). Кафедра травматологии и ортопедии. 2018;(2(32)):66-73.. doi: 10.17238/issn2226-2016.2018.2.66-73
- Аснина С.А., Агапов В.С., Савченко З.И., Игнатьев Е.В. Использование биокомпозитного материала «Остеоматрикс» для профилактики осложнений при удалении ретинированных третьих моляров. Институт Стоматологии. 2004;(1): 46-48.
- Литвинов С.Д., Рахимов Р.И. Фиксация зачатка зуба материалом ЛитАр. Стоматология. 2005;84(2):62-65.
- Wang X, Xu S, Zhou S, et al. Topological design and additive manufacturing of porous metals for bone scaffolds and orthopaedic implants: A review. Biomaterials. 2016;83:127-41. doi: 10.1016/j.biomaterials.2016.01.012
- Поляк М.С., Азанчевская С.В., Цветкова И.А. Стандартизация контрольных исследований при определении чувствительности микроорганизмов к антимикробным препаратам диск-диффузионным методом с использованием отечественных питательных сред. Клиническая лабораторная диагностика. 2004;(11):53-56.
- Хонинов Б.В., Сергунин О.Н., Скороглядов П.А. Анализ клинической эффективности применения биодеградируемых имплантатов в хирургическом лечении вальгусной деформации I пальца стопы. Вестник РГМУ. 2015;(3):20-24.
- Washington MA, Swiner DJ, Bell KR, et al. The impact of monomer sequence and stereochemistry on the swelling and erosion of biodegradable poly(lactic-co-glycolic acid) matrices. Biomaterials. 2017;117:66-76. doi: 10.1016/j.biomaterials.2016.11.037
- Krul LP, Volozhyn AI, Belov DA, et al. Nanocomposites based on poly-D,L-lactide and multiwall carbon nanotubes. Biomol Eng. 2007;24(1):93-5. doi: 10.1016/j.bioeng.2006.05.02
- Gaiarsa GP, Dos Reis PR, Mattar R Jr, Silva Jdos S, Fernandez TD. Comparative study between osteosynthesis in conventional and bioabsorbable implants in ankle fractures. Acta Ortop Bras. 2015;23(5):263-267. doi: 10.1590/1413-785220152305121124
- Zhang J, Ebraheim N, Lause GE, et al. A comparison of absorbable screws and metallic plates in treating calcaneal fractures: a prospective randomized trial. J Trauma Acute Care Surg. 2012;72(2):E106-E110. doi: 10.1097/ta.0b013e3182231811
- Nishizuka T, Kurahashi T, Hara T, Hirata H, Kasuga T. Novel intramedullary-fixation technique for long bone fragility fractures using bioresorbable materials. PLoS One. 2014;9(8):e104603. doi: 10.1371/journal.pone.0104603
- Попов В.П., Завадовская В.Д., Шахов В.П., Игнатов В.П.. Использование биоактивных и биоинертных имплантатов в лечении переломов. Фундаментальные исследования. 2012;(8):135-139.
- Твердохлебов С.И., Игнатов В.П., Степанов И.Б. и др. Гибридный метод формирования биокомпозитов на поверхности имплантатов из нержавеющей стали. Биотехносфера. 2012;(5-6):62-68.
- Popkov AV, Popkov DA, Kononovich NA, et al. Osseointegration of the intramedullary implant in fracture of the diaphysis of a long bone. J Global Pharma Tech. 2016;11(8):1-7.
- Клюшин Н.М., Люлин С.В., Шипицына И.В., Кочнев Е.Я. Анализ результатов бактериологического исследования ран пациентов с им-плант-ассоциированной инфекцией позвоночника. Гений ортопедии. 2019;25(3):355-359. doi: 10.18019/1028-4427-2019-25-3-355-359
- Naumenko ZS, Silanteva TA, Ermakov AM, et al. Challenging Diagnostics of Biofilm Associated Periprosthetic Infection in Immunocompromised Patient: A Clinical Case. Open Access Maced J Med Sci. 2019;7(5):786-790. doi: 10.3889/oamjms.2019.180
- Попков А.В., Попков Д.А., Кононович Н.А. и др. Остеоинтеграция биоактивных имплантатов при лечении переломов длинных трубчатых костей: учебное пособие. Томск: Изд-во Томского политехнического университета; 2017:304 с.
- Епишин В.В., Борзунов Д.Ю., Попков А.В., Шастов А.Л. Комбинированный остеосинтез при реабилитации пациентов с ложными суставами и дефектами длинных костей. Гений Ортопедии. 2013;(3):37-42.
- Park S, Kim JH, Kim IH, et al. Evaluation of poly(lactic-co-glycolic acid) plate and screw system for bone fixation. J Craniofac Surg. 2013;24(3):1021-5. doi: 10.1097/SCS.0b013e31827fee09
- Sheikh Z, Najeeb S, Khurshid Z, et al. Biodegradable Materials for Bone Repair and Tissue Engineering Applications. Materials (Basel). 2015;8(9):5744-5794. doi: 10.3390/ma8095273
- Sousa AC, Biscaia S, Alvites R, et al. Assessment of 3D-Printed Polycaprolactone, Hydroxyapatite Nanoparticles and Diacrylate Poly(ethylene glycol) Scaffolds for Bone Regeneration. Pharmaceutics. 2022;14(12):2643. doi: 10.3390/pharmaceutics14122643
- Demina TS, Bolbasov EN, Peshkova MA, et al. Electrospinning vs. Electro-Assisted Solution Blow Spinning for Fabrication of Fibrous Scaffolds for Tissue Engineering. Polymers (Basel). 2022;14(23):5254. doi: 10.3390/polym14235254
- Colon G, Ward BC, Webster TJ. Increased osteoblast and decreased Staphylococcus epidermidis functions on nanophase ZnO and TiO2. J Biomed Mater Res A. 2006;78(3):595-604. doi: 10.1002/jbm.a.30789


