Индукция физиологической активности чистой культуры гриба вешенка обыкновенная (Pleurotus ostreatus) на лабораторной стадии
Автор: Качмазов Г.С., Багаева У.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Биологические науки
Статья в выпуске: 2, 2016 года.
Бесплатный доступ
На основании сопоставления средней величины линейного прироста колонии чистой культуры гриба вешенка (Pleurotus ostreatus) в стандартных условиях со скоростью потребления кислорода, измеренного с помощью разработанного авторами манометрического метода, было установлено, что культуральные свойства и линейные размеры прироста колонии за определенный промежуток времени не могут быть использованы в качестве единственного критерия оценки качества культуры. Оценка физиологической активности биомассы является необходимым критерием в комплексе требований, предъявляемых к качеству чистой культуры, и определение величины дыхательной активности вполне может быть объективным критерием оценки физиологического потенциала биомассы. Включение в состав питательных сред источников целлюлозы и других растительных полимеров положительно влияет как на морфологические, так и на физиологические свойства чистой культуры. По результатам измерений линейных размеров колоний лучшими индукторами генеративной активности, использованными в эксперименте, являются лигнин гидролизный, лузга подсолнечника и отруби пшеничные. По результатам определения скорости потребления кислорода лучшими индукторами физиологической активности являются отруби пшеничные, измельченные листья каштана и лузга подсолнечника.
Вешенка обыкновенная, физиологическая активность, активность потребления кислорода, целлюлоза, лузга подсолнечника, отруби пшеничные, листья каштана, лигнин гидролизный, опилки бука, мезокарпий грейпфрута
Короткий адрес: https://sciup.org/14084607
IDR: 14084607 | УДК: 635.1
Текст научной статьи Индукция физиологической активности чистой культуры гриба вешенка обыкновенная (Pleurotus ostreatus) на лабораторной стадии
Введение . В результате стабильного увеличения объемов производства и совершенствования технологических приемов промышленного культивирования не прекращаются теоретические и экспериментальные исследования высших базидиомицетов, к которым относятся практически все традиционно употребляемые человеком съедобные грибы [1]. Поскольку культура формируется еще на лабораторной стадии разводочного цикла, в разносторонних исследованиях высших базидиомицетов особое место занимает оптимизация физиологического и, как следствие, технологического потенциала чистой культуры [2].
Показатели характеризующие различные векторы метаболизма в разных фазах роста мицелиальных грибов, позволяют получить наиболее полную информацию о физиологически значимых процессах, происходящих в культивируемой биомассе. К таким показателям следует отнести потребленный кисло-род/потребленная глюкоза, потребленный кис-лород/общий азот, общий азот/сухая масса и др. [8–10].
В этой связи актуальными остаются дальнейшие исследования особенностей культивирования, определение условий, способствующих более быстрому росту и накоплению биомассы, подбор наиболее сбалансированных питательных сред для воспроизводства чистой культуры, разработка надежных методов контроля на лабораторной стадии разводочного цикла [3–7, 11].
Цель исследования. Оптимизация лабораторной стадии разводочного цикла чистой культуры и разработка достоверных методов контроля физиологической активности биомассы.
Конструирование сбалансированных питательных сред для воспроизводства чистой культуры, разработка надежных методов контроля на лабораторной стадии разводочного цикла остаются актуальными и при существующем уровне развития отрасли.
Материал и методы исследования. Физиологическая активность чистой культуры на питательных средах с различными видами клетчатки оценивалась нами по скорости захвата субстрата (мм/сут или дм2/сут) и показателю дыхательной активности – потребленный кислород (мл О 2 ) на единицу площади колонии (дм2) за единицу времени (час).
Чистую культуру выделяли из свежих плодовых тел грибов вешенка ( Pleurotus ostreatus ), приобретенных в торговой сети и у мелких производителей. Отбирались экземпляры хорошо сформированные, не поврежденные, без заметных признаков порчи и болезней. Кусочки первичного посевного материала, вырезанные стерильным скальпелем из плодового тела, отбирались с соблюдением всех требований микробиологической техники, исключающих вторичное инфицирование инокулята.
Первичный посев производили в чашки Петри с 2,5%-м сусло-агаром (СА), приготовленным из пивного сусла, содержащего 3 % СВ (сухих веществ), 0,5 % дрожжевого автолизата и антибиотик (гентамицин – 0,3 мл препарата на 100 мл среды).
Культуры инкубировали при температуре 24– 25оС до полного захвата поверхности агара (9– 10 дней). В течение этого времени регистрировали характер роста и выбраковывали чашки с признаками постороннего роста, с деформированными или содержащими различного рода включения колониями вешенки, что является свидетельством либо деградации культуры, либо ее скрытыми поражениями. Партии грибов, в которых выявлялась хотя бы одна колония с выраженными признаками деградации или болезни, выбраковывались полностью.
Для дальнейших исследований отбирались чашки с колониями, полностью соответствующими требованиям здоровой и активной культуры: белые без включений колонии, правильной формы с ровными краями, с хорошо сформированными волновыми кольцами. Чашки с выбранными колониями упаковывались в стерильные полиэтиленовые пакеты и хранились при 2– 4оС до использования.
Для постановки эксперимента СА с грибным мицелием из одной чашки нарезался круглым штампом ∅ 5,5 мм. Полученные блоки извлекались стерильной иглой и переносились в центр заранее приготовленных контрольных чашек с 2,5%-м СА, приготовленным из пивного сусла, содержащего 3 % СВ, 0,5 % дрожжевого автолизата и антибиотик в указанной выше дозе. Опытные среды, кроме перечисленных ингредиентов, вносили в дозе 2 % к объему среды тщательно измельченные источники целлюлозы: микрокристаллическая целлюлоза, лузга подсолнечника, очищенные от примесей пшеничные отруби, сухие опавшие листья каштана, сухие опавшие листья ясеня, лигнин гидролизный, мезокарпий грейпфрута, опилки бука. Чашки с инокулятом инкубировали при 24–25оС до полного захвата поверхности агара. В течение этого времени регистрировали скорость захвата поверхности среды и характер роста. Выбраковывались чашки с признаками постороннего роста и с деформированными или содержащими различного рода включения колониями вешенки.
Контрольные измерения скорости роста производили на 3-й, 5-й, 7-й и 10-й день инкубирования.
Определение показателя дыхательной активности производили на 15-й день инкубирования. Для этого использовали манометрический прибор собственной конструкции, состоящий из стеклянного эксикатора, манометрической трубки (бюретки), заполненной окрашенной метиленовым синим дистиллированной водой, и компенсаторной колбы. На дно реактора наливали 600–700 мл 10%-го раствора NaOH, что позволяло получить 6500 мл (6,5 дм3) свободного объема. Затем устанавливали фарфоровую подставку, на которую выстраивали из каждой серии по 13 чашек с посевами (без крышек) мицелием вниз для свободного воздухообмена. С помощью перепускного краника столбик жидкости устанавливался на «0». С этого момента регистрировалась высота поднятия столбика жидкости (мл) в течение 3 часов, что должно соответствовать потребленному количеству кислорода за регистрируемый промежуток времени. Полученную величину пересчитывали на 1 час и единицу площади колонии (дм2).
Результаты исследований и их обсуждение. Результаты эксперимента представлены в таблице. На 3-й день инкубации при оценке характера роста и измерении диаметра колоний установили, что как на контрольной, так и на экспериментальных средах единичные колонии росли со слабовыраженными неровностями по окружности, однако в процессе дальнейшего инкубирования такие неровности сглаживались и к 5–7-му дню не регистрировались. Средний диаметр колоний в контрольных чашках составил 22,4 мм (от 20,9 до 23,6), такого же диаметра колонии образовались на среде с целлюло- зой микрокристаллической – 22,4 мм (от 21,2 до 23,7), на среде с измельченной лузгой подсолнечника – 23,0 мм (от 22,0 до 23,8), с пшеничными отрубями – 21,8 мм (от 20,9 до 23,0), с измельченными листьями каштана – 22,5 мм (от 22,0 до 23,1), с лигнином гидролизным – 22,8 мм (от 22,0 до 23,2), с буковыми опилками – 20,6 мм (от 19,6 до 23,0), измельченным мезокарпием грейпфрута – 22,5 мм (от 21,5 до 23,5).
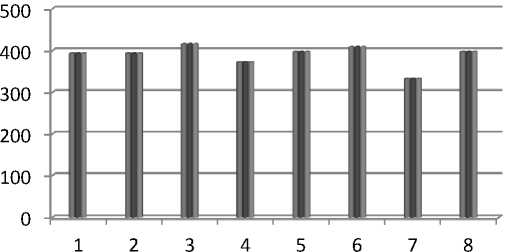
Соответственно этому площадь захвата колоний составила 393,88 мм2; 393,88; 415,26; 373,06; 397,40; 408,07; 333,12; 397,40 мм2 (рис. 1).
Показатели генеративной и дыхательной активности на различных субстратах
|
№ п/п |
Источник углерода |
3-й день |
5-й день |
7-й день |
10-й день |
О 2 |
|||||
|
∅ мм |
S мм2 |
∅ мм |
S мм2 |
∅ мм |
S мм2 |
∅ мм |
S мм2 |
Всего |
мл/дм2/ ч |
||
|
1 |
Контроль |
22,4 |
393,88 |
41,4 |
1345,45 |
69,6 |
3802,66 |
90,0 |
6358,50 |
4,5 |
0,1814 |
|
2 |
Целлюлоза |
22,4 |
393,88 |
39,3 |
1212,42 |
70,1 |
3857,49 |
90,0 |
6358,50 |
5,2 |
0,2097 |
|
3 |
Лузга подсолнечника |
23,0 |
415,26 |
51,0 |
2041,78 |
79,2 |
4924,02 |
90,0 |
6358,50 |
6,9 |
0,2782 |
|
4 |
Отруби пшеничные |
21,8 |
373,06 |
44,1 |
1526,67 |
73,8 |
4275,45 |
90,0 |
6358,50 |
7,7 |
0,3105 |
|
5 |
Листья каштана |
22,5 |
397,40 |
45,5 |
1625,14 |
71,6 |
4024,34 |
90,0 |
6358,50 |
7,1 |
0,2863 |
|
6 |
Гидролизный лигнин |
22,8 |
408,07 |
54,1 |
2297,54 |
83,3 |
5447,02 |
90,0 |
6358,50 |
6,1 |
0,2460 |
|
7 |
Опилки бука |
20,6 |
333,12 |
36,4 |
1040,09 |
66,3 |
3450,61 |
90,0 |
6358,50 |
6,5 |
0,2621 |
|
8 |
Мезокарпий грейпфрута |
22,5 |
397,40 |
46,1 |
1668,28 |
72,5 |
4126,15 |
90,0 |
6358,50 |
6,5 |
0,2621 |
-
■ 1 Контроль
-
■ 2 Целлюлоза
-
■ 3 Лузга
-
■ 4 Отруби
-
■ 5 Каштан
-
■ 6 Лигнин
-
■ 7 Бук
-
■ 8 Мезокарпий
Рис. 1. Площадь захвата на 3-й день инкубации, мм2
На 5-й день инкубации средний диаметр колоний в контрольных чашках составил 41,4 мм (от 36,5 до 47,0), на среде с целлюлозой микрокристаллической – 39,3 мм (от 37,3 до 42,3), на среде с измельченной лузгой подсолнечника – 51,0 мм (от 48,0 до 52,8), с пшеничными отрубями – 44,1 мм (от 39,3 до 48,5), с измельченными листьями каштана – 45,5 мм (от 43,3 до
-
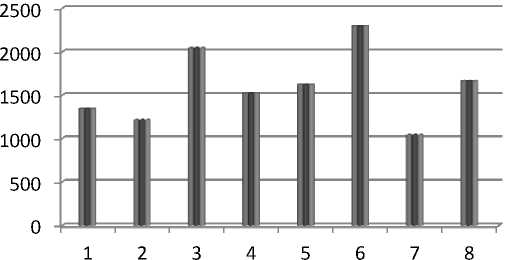
48,1) , с лигнином гидролизным – 54,1 мм (от 51,3 до 58,9), с буковыми опилками – 36,4 мм (от 34,0 до 39,1), измельченным мезокарпием грейпфрута – 46,1 мм (от 42,8 до 49,2). Соответственно этому площадь захвата колоний составила 1345,45 мм2; 1212,42; 2041,78; 1526,67; 1625,14; 2297,54; 1040,09; 1668,28 мм2(рис. 2).
-
■ 1 Контроль
-
■ 2 Целлюлоза
-
■ 3 Лузга
-
■ 4 Отруби
-
■ 5 Каштан
-
■ 6 Лигнин
-
■ 7 Бук
-
■ 8 Мезокарпий
Рис. 2. Площадь захвата на 5-й день инкубации
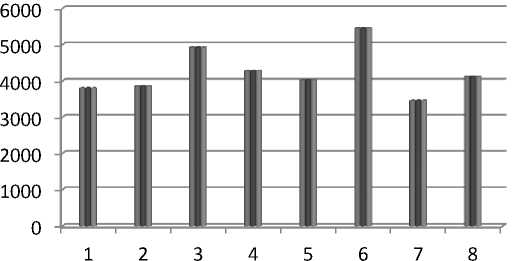
На 7-й день инкубации средний диаметр колоний в контрольных чашках составил 69,6 мм (от 65,3 до 73,9), на среде с целлюлозой микрокристаллической – 70,1 мм (от 68,3 до 73,3), на среде с измельченной лузгой подсолнечника – 79,2 мм (от 76,9 до 82,0), с пшеничными отрубями – 73,8 мм (от 70,4 до 78,6), с измельченными листьями каштана – 71,6 мм (от 64,5 до 75,8), с лигнином гидролизным – 83,3 мм (от 77,4 до 86,8), с буковыми опилками – 66,3 мм (от 64,4 до 70,0), измельченным мезокарпием грейпфрута – 72,5 мм (от 67,9 до 76,2). Соответственно этому площадь захвата колоний составила 3802,66 мм2; 3857,49; 4924,02; 4275,45; 4024,34; 5447,02; 3450,61; 4126,15 мм2 (рис. 3).
На 9-й день инкубации все среды были покрыты грибным мицелием, а на 10-й день в посевах с наиболее активным предшествующим ростом (целлюлоза, лузга, отруби, каштан, лигнин) регистрировался густой рост по стенкам чашек.
Выращенный мицелий, оцененный по культуральным свойствам, исследовали на дыхательную активность в манометрическом приборе.
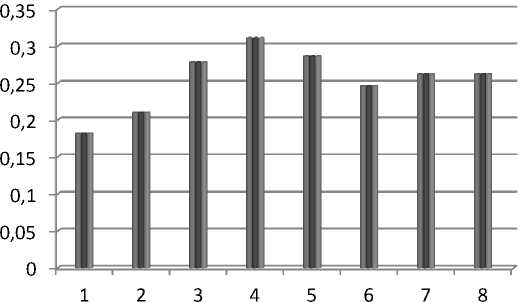
В результате было установлено (рис. 4), что 13 чашек Петри с мицелием, выращенным на контрольной среде общей площадью 8,2660 дм2, за 3 часа сместили водяной столбик на 4,5 мл по шкале бюретки, что соответствует объему потребленного кислорода. Из этого следует, что биомасса, выросшая на 1 дм2 сусло-агара указанного состава, за 1 час израсходовала 0,1814 мл О 2 . Мицелий, выращенный на среде с микрокристаллической целлюлозой общей площадью 8,2660 дм2, за 3 часа сместил водяной столбик на 5,2 мл по шкале бюретки, что соответствует объему потребленного кислорода. Из этого следует, что биомасса, выросшая на 1 дм2 сусло-агара указанного состава, за 1 час израсходовала 0,2097 мл О 2 .
-
■ 1 Контроль
-
■ 2 Целлюлоза
-
■ 3 Лузга
-
■ 4 Отруби
-
■ 5 Каштан
-
■ 6 Лигнин
-
■ 7 Бук
-
■ 8 Мезокарпий
Рис. 3. Площадь захвата на 7-й день инкубации, мм2
-
■ 1 Контроль
-
■ 2 Целлюлоза
-
■ 3 Лузга
-
■ 4 Отруби
-
■ 5 Каштан
-
■ 6 Лигнин
-
■ 7 Бук
-
■ 8 Мезокарпий
Рис. 4. Активность потребления кислорода, мл/дм2/ч
Мицелий, выращенный на среде с лузгой подсолнечника общей площадью 8,2660 дм2, за 3 часа сместил водяной столбик на 6,9 мл по шкале бюретки. Из этого следует, что биомасса, выросшая на 1 дм2 сусло-агара указанного состава, за 1 час израсходовала 0,2782 мл О 2 .
В тех же условиях мицелий, выращенный на среде с пшеничными отрубями, за 3 часа сместил водяной столбик на 7,7 мл по шкале бюретки. Из этого следует, что биомасса, выросшая на 1 дм2 сусло-агара указанного состава, за 1 час израсходовала 0,3105 мл О 2 .
Биомасса, выросшая на среде с измельченными листьями каштана, за 3 часа сместила водяной столбик на 7,1 мл. Из этого следует, что 1 дм2 сплошного роста на этой среде за 1 час израсходовал 0,2863 мл О 2 .
Биомасса, выросшая на среде с гидролизным лигнином, за 3 часа сместила водяной столбик на 6,1 мл. Из этого следует, что 1 дм2 сплошного роста на этой среде за 1 час израсходовал 0,2460 мл О 2 .
Мицелий, выращенный на среде с буковыми опилками общей площадью 8,2660 дм2, за 3 часа сместил водяной столбик на 6,5 мл по шкале бюретки. Из этого следует, что биомасса, выросшая на 1 дм2 сусло-агара указанного состава, за 1 час израсходовала 0,2621 мл О 2 .
Такой же результат показал мицелий на 13 чашках Петри, выращенный на среде с мезокарпием, за 3 часа сместивший водяной столбик на 6,5 мл по шкале бюретки, что соответствует объему потребленного кислорода. То есть биомасса, выросшая на 1 дм2 сусло-агара указанного состава, за 1 час израсходовала 0,2621 мл О2.
Выводы
-
1. Культуральные свойства и линейные размеры прироста колонии за определенный промежуток времени не могут быть использованы в качестве единственного критерия оценки качества культуры.
-
2. Оценка физиологической активности биомассы является необходимым критерием в комплексе требований, предъявляемых к качеству чистой культуры.
-
3. Определение величины дыхательной активности вполне может быть объективным критерием оценки физиологического потенциала биомассы.
-
4. Включение в состав питательных сред источников целлюлозы и других растительных полимеров положительно влияет как на морфологические, так и на физиологические свойства чистой культуры.
-
5. Лучшими индукторами генеративной активности, использованными в эксперименте, являются лигнин гидролизный ( ∅ 8,33 мм), лузга подсолнечника ( ∅ 7,92 мм) и отруби пшеничные ( ∅ 7,38 мм).
-
6. Лучшими индукторами физиологической активности, использованными в эксперименте, являются отруби пшеничные (0,3105 мл О 2 /дм2/ч), измельченные листья каштана (0,2863 мл О 2 /дм2/ч) и лузга подсолнечника (0,2782 мл О 2 /дм2/ч).
Список литературы Индукция физиологической активности чистой культуры гриба вешенка обыкновенная (Pleurotus ostreatus) на лабораторной стадии
- Бухало А. Высшие съедобные базидиомицеты в чистой культуре. -Киев: Наук. думка, 1988. -144 с.
- Викторов А.С. Разработка и освоение биотехнологии производства коммерческого мицелия на основе виноградной выжимки и лозы: автореф. дис. … канд. техн. наук. -Ялта, 1994. -18 с.
- Методы экспериментальной микологии: справ./И.А. Дудка, С.П. Вассер, И.А. Элланская . -Киев: Наук. думка, 1982. -552 с.
- Изучение интенсивности роста чистой культуры гриба вешенка/Г.С. Качмазов, И.К. Сатцаева, М.Т. Батырова //Пищевая промышленность. -2001. -№ 6. -С. 56.
- Оценка физиологической активности чистой культуры гриба вешенка (Pleurotus ostreatus)/Г.С. Качмазов, У.В. Багаева, В.А. Кочиева //Актуальные проблемы экологии и сохранения биоразнообразия России и сопредельных стран: мат-лы Всерос. науч. конф. Вып. XI. -Владикавказ: Изд-во СОГУ, 2015. -С. 20-25.
- Кураков А.В., Лаврентьев Р.Б., Соина В.С. Культурально-морфологические особенности роста мицелиальных грибов в анаэробных условиях//Микология и фитопатология. -2007. -Т. 41, № 6. -С. 526-535.
- Мюллер Е., Леффлер В. Микология: пер. с нем. -М.: Мир, 1995. -343 с.
- Рынок консервированных грибов в России 2010-2020 гг. Показатели и прогнозы. Исследования рынка//TEBIZGROUP. -2014. -82 с.
- Штаер О.В., Шнырева А.В. Структура мицелия в зоне антогонизма генетически различных индивидуумов Pleurotus ostreatus//Микология и фитопатология. -2008. -Т. 42, № 5. -С. 481-490.
- Ostreolysin enhances fruiting initiation in the oyster mushroom (Pleurotus ostreatus)/S. Berne, J. Pohleven, I. Vidic //Mycological Research. -2007. -Vol. 111, № 12. -P. 1431-1436.
- Мельникова Е.А., Литовка Ю.А., Миронов П.В. Морфологические особенности базидиального гриба Pleurotus pulmonarius в поверхностной и глубинной культуре//Вестник КрасГАУ. -2013. -№ 7. -С. 170-175.


