Индукция ионами ртути (II) микроядер в эритроцитах личинок зелёной жабы
Автор: Крюков В.И., Жучков С.А., Лазарева Т.Н., Киреева О.С., Поповичева Н.Н.
Журнал: Биология в сельском хозяйстве @biology-in-agriculture
Рубрика: Актуальные вопросы экологии
Статья в выпуске: 2 (35), 2022 года.
Бесплатный доступ
Изучены частоты микроядер (МЯ) и ядерных аномалий (ЯА) в эритроцитах личинок жабы Bufo viridis после 6-, 12-, 18- и 24-часового пребывания в воде содержащей ионы ртути (II) в концентрациях 5, 10, 20, 50, 100 и 150 мкг/л. При концентрациях ртути 5-50 мкг/л 6-часовая экспозиция вела к статистически недостоверному повышению частот МЯ и ЯА. Увеличение концентрации до 100 и 150 мкг/л вызывало статистически достоверное увеличение частоты МЯ и ЯА. Воздействие ионов ртути в течение 12, 18 и 24 часов вызывало статистически достоверное увеличение частот МЯ и ЯА при всех исследованных концентрациях. Рассмотрены возможные причины аномалий и дан краткий обзор исследований мутагенности ртути.
Ртуть, нитрат ртути, мутагенность, амфибии, bufo, микроядра, ядерные аномалии
Короткий адрес: https://sciup.org/147238695
IDR: 147238695 | УДК: 575.2.084
Текст научной статьи Индукция ионами ртути (II) микроядер в эритроцитах личинок зелёной жабы
Целью эксперимента, результаты которого изложены ниже, был анализ цитогенетических эффектов ртути в эритроцитах личинок зелёной жабы.
Материалы и методы исследований
Объектом исследований служили эритроциты головастиков зелёной жабы Bufo viridis (L.), находившихся на 46-й и 47-й стадиях развития [1] и отловленных в природном водоёме. Водоём представлял собой заброшенный котлован, вырытый под фундамент здания и обвалованный извлечённым из него грунтом. Поверхностные стоки в водоём отсутствовали. Он пополнялся только атмосферными осадками. Поэтому можно предполагать, что в его воде не было каких-либо активных ксенобиотиков, способных влиять на исследуемые параметры. Отловленных головастиков трое суток выдерживали в лабораторном аквариуме, затем делили на группы по 7 особей. Одна группа интактных животных служила контролем. Другие группы подвергали воздействию исследуемых факторов.
Мутагенный эффект ртути исследовали, используя водные растворы нитрата ртути, Hg(NO3)2×H2O квалификации ч.д.а. Группы головастиков B. viridis помещали в аквариумы с водой, содержащей нитрат ртути в концентрациях 5, 10, 20, 50, 100 и 150 мкг Нg+2/л. на 6, 12, 18 и 24 ч. По истечении установленного времени воздействия вещества, головастиков пересаживали в аквариумы с чистой водой, где их выдерживали 24 ч. для реализации индуцированных солью металла цитогенетических нарушений в эритроцитах. По окончании указанного времени у 5 случайно выбранных в каждой группе личинок отсекали заднюю треть хвостового плавника и готовили мазки крови. Контрольные группы животных в течение все- го времени эксперимента содержали в чистой воде и мазки крови от них готовили одновременно с мазками крови опытных животных. Мазки крови высушивали, затем фиксировали в течение 30 мин в охлаждённой смеси этилового спирта с уксусной кислотой (3:1) промывали дистиллированной водой и окрашивали азур-эозином по Романовскому.
Препараты просматривали при увеличении (100×15×1,5)× (микроскоп «Laboval 4»). На окрашенных препаратах подсчитывали по 2 тыс. нормальных эритроцитов от каждого животного, фиксируя при этом (дополнительно к количеству нормальных эритроцитов) число клеток с микроядрами (далее – МЯ) и ядерными аномалиями (далее – ЯА). Экспериментальный материал получен до опубликования классификации ЯА [2], поэтому МЯ типизировали в соответствии со схемой [3] Краткая характеристика аномалий приведена в примечании к таблице 1.
Частоты МЯ и ЯА выражали в долях от общего числа проанализированных эритроцитов и процентах. Достоверность различий между сравниваемыми частотами определяли с помощью критерия u для сравнения малых (р<0,2) и больших (p>0,8) долей после их φ –преобразования [4, с. 154-169]. Интерполяция эмпирического распределения величин теоретическим известным распределением выполнена с использованием программы Stadia 4.5.
Результаты и обсуждение
Результаты микроскопического анализа показаны в табл. 1.
Таблица 1 – Количество микроядер и ядерных аномалий различных типов в периферической крови личинок
B. viridis , индуцированное различными экспозициями и концентрациями ртути
|
Время воздействия, ч |
Концентрация Нg+2, мкг/л |
Всего клеток |
Число клеток с микроядрами и ядерными аномалиями* |
||||||
|
1 а |
1 б |
1 в |
1 г-I |
г-II |
1 д |
1 е |
|||
|
Контроль |
10042 |
18 |
19 |
4 |
1 |
||||
|
6 |
5 |
10050 |
14 |
19 |
5 |
1 |
3 |
7 |
1 |
|
10 |
10049 |
9 |
26 |
4 |
– |
8 |
– |
2 |
|
|
20 |
10058 |
19 |
29 |
2 |
– |
– |
4 |
4 |
|
|
50 |
10063 |
18 |
40 |
2 |
– |
– |
3 |
– |
|
|
100 |
10092 |
35 |
42 |
2 |
– |
1 |
– |
12 |
|
|
150 |
10091 |
29 |
35 |
9 |
1 |
2 |
4 |
11 |
|
|
12 |
5 |
10068 |
22 |
25 |
2 |
1 |
11 |
4 |
3 |
|
10 |
10076 |
29 |
21 |
8 |
– |
5 |
9 |
4 |
|
|
20 |
10118 |
32 |
58 |
4 |
2 |
4 |
6 |
12 |
|
|
50 |
10103 |
35 |
28 |
14 |
2 |
7 |
11 |
6 |
|
|
100 |
10119 |
39 |
43 |
6 |
– |
8 |
9 |
17 |
|
|
150 |
10114 |
41 |
32 |
19 |
1 |
4 |
7 |
10 |
|
|
18 |
5 |
10078 |
31 |
25 |
4 |
2 |
8 |
5 |
3 |
|
10 |
10112 |
33 |
43 |
17 |
– |
7 |
9 |
2 |
|
|
20 |
10148 |
42 |
68 |
23 |
1 |
2 |
5 |
7 |
|
|
50 |
10155 |
39 |
55 |
27 |
2 |
9 |
14 |
9 |
|
|
100 |
10179 |
59 |
79 |
24 |
– |
4 |
13 |
– |
|
|
150 |
10198 |
70 |
96 |
11 |
– |
2 |
7 |
12 |
|
|
24 |
5 |
10099 |
29 |
41 |
19 |
– |
3 |
4 |
3 |
|
10 |
10106 |
34 |
36 |
14 |
1 |
9 |
8 |
4 |
|
|
20 |
10162 |
47 |
72 |
19 |
3 |
7 |
14 |
||
|
50 |
10160 |
43 |
54 |
24 |
4 |
16 |
11 |
8 |
|
|
100 |
10182 |
43 |
95 |
18 |
3 |
– |
6 |
17 |
|
|
150 |
10194 |
66 |
83 |
32 |
2 |
– |
4 |
7 |
|
*Примечание. Микроядра, изолированные от ядра (а), примыкающие к ядру (б), соединёнными с ядром нитью хроматина (в). Ядерные аномалии: неоформленного хроматиновый материал в виде палочек (г-I) или клубков (г-II), округлые образо- вания ядерного материала в виде лопастей (д), двуядерные» клетки (е).
Статистический анализ этих данных свидетель- статистически достоверному увеличению частоты ствует (табл. 2), что при 6-часовой экспозиции ртуть в аномалий. Экспозиции длительностью 12 часов и бо-концентрациях до 50 мкг/л не вызывала статистиче- лее вызывали статистически достоверное увеличение ски достоверного увеличения частот МЯ и ЯА. Одна- частот МЯ и ЯА при всех исследованных концентра-ко концентрации 100 и более мкг/л ртути приводили к циях.
Таблица 2 – Частоты эритроцитов с микроядрами в периферической крови личинок B. viridis после воздействия различных экспозиций и концентраций ртути
|
Время воздействия, ч |
Концентрация Hg+2, мкг/л |
Клеток с аномалиями |
Критерий Фишера |
Достоверность различий, Р |
|
|
количество |
частота (р ±τ·σ р ), % |
||||
|
Контроль |
42 |
0,42 ±0,13 |
|||
|
6 |
5 |
50 |
0,50+0,14 |
0,73 |
>0,05 |
|
10 |
49 |
0,49 ±0,14 |
0,63 |
>0,05 |
|
|
20 |
58 |
0,58 ±0,15 |
1,50 |
>0,05 |
|
|
50 |
63 |
0,63 ±0,15 |
1,95 |
>0,05 |
|
|
100 |
92 |
0,91 ±0,19 |
4,29 |
<0,001 |
|
|
150 |
91 |
0,90 ±0,18 |
4,22 |
<0,001 |
|
|
12 |
5 |
68 |
0,68 ±0,16 |
2,39 |
<0,05 |
|
10 |
76 |
0,75 ±0,17 |
3,06 |
<0,01 |
|
|
20 |
118 |
1,17 ±0,21 |
6,09 |
<0,001 |
|
|
50 |
103 |
1,02 ±0,20 |
5,08 |
<0,001 |
|
|
100 |
119 |
1,18 ±0,21 |
6,15 |
<0,001 |
|
|
150 |
114 |
1,13 ±0,21 |
5,83 |
<0,001 |
|
|
18 |
5 |
78 |
0,77 ±0,17 |
3,22 |
<0,01 |
|
10 |
109 |
1,11 ±0,20 |
5,69 |
<0,001 |
|
|
20 |
148 |
1,46 ±0,23 |
7,92 |
<0,001 |
|
|
50 |
155 |
1,52 ±0,24 |
8,43 |
<0,001 |
|
|
100 |
179 |
1,76 ±0,26 |
9,62 |
<0,001 |
|
|
150 |
198 |
1,94 ±0,27 |
10,60 |
<0,001 |
|
|
24 |
5 |
99 |
0,98±0,19 |
4,79 |
<0,001 |
|
10 |
106 |
1,05 ±0,20 |
5,23 |
<0,001 |
|
|
20 |
162 |
1,59 ±0,24 |
8,71 |
<0,001 |
|
|
50 |
160 |
1,57 ±0,24 |
8,60 |
<0,001 |
|
|
100 |
182 |
1,79 ±0,26 |
9,79 |
<0,001 |
|
|
150 |
194 |
1,90 ±0,27 |
10,40 |
<0,001 |
|
Для определения силы влияния концентраций ртути и продолжительности её экспозиции на частоту индуцируемых МЯ был проведён двухфакторный параметрический дисперсионный анализ (табл. 3). Его результаты доказывают существование статистически достоверного отклика исследуемого параметра (частоты МЯ и ЯА) на оба фактора.
Таблица 3 – Результаты двухфакторного дисперсионного анализа влияния длительности экспозиции и концентрации ртути на частоту эритроцитов с МЯ в периферической крови личинок B. viridis.
|
Источник |
Сумма квадратов |
Число степеней свободы |
Средняя сумма квадратов |
Сила влияния факторов |
|
Экспозиция |
2,667 |
3 |
0,889 |
0,9696 |
|
Концентрация Нg+2 |
1,729 |
5 |
0,346 |
0,9292 |
|
Регрес.остатки |
0,331 |
15 |
0,022 |
|
|
Общая вариация |
4,728 |
23 |
0,206 |
|
|
F (Экспоз.)=40,3 F (Концент.)=15,7 |
Р<0,001 Р<0,001 |
Степ. свободы =3, 15 Степ. свободы = 4, 15 |
Есть влияние Есть влияние |
|
Кроме интерфазных эритроцитов с МЯ и ЯА на препаратах были обнаружены аномальные эритроциты, находящиеся на стадии метафазы митоза. Анома- лии заключались в том, что эти клетки вместо полного набора хромосом содержала всего одну или несколько метафазных хромосом (рис. 1).
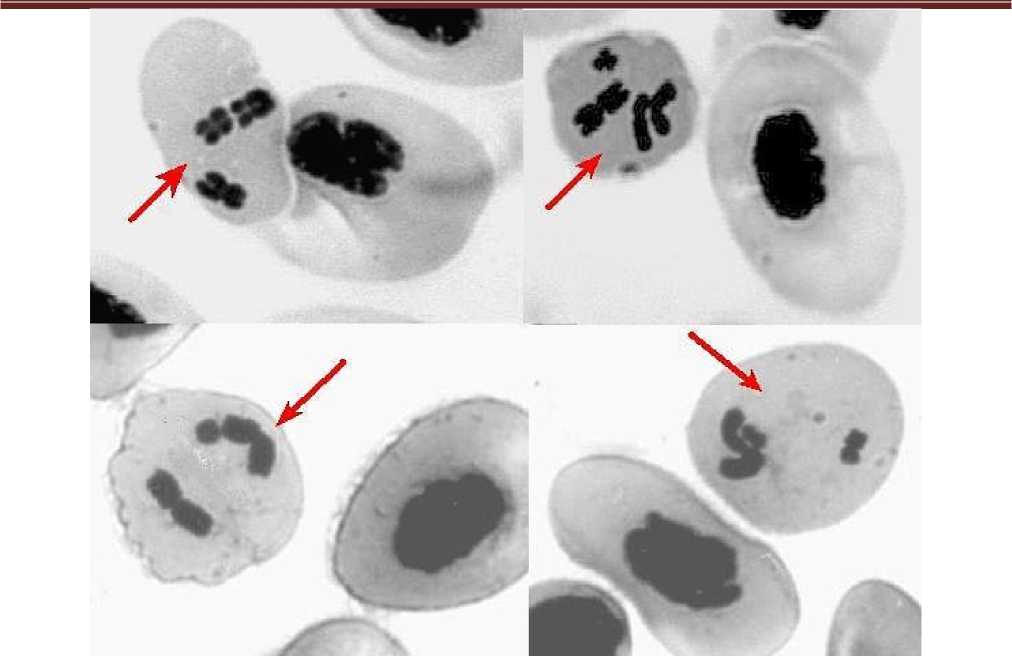
Рис. 1. Аномальные эритроциты с единичными метафазными хромосомами, возникшие после воздействия ртути
При сравнительном анализе частот различных МЯ и ЯА, индуцированных различными экспозициями ртути, видно некоторое уменьшение доли клеток с изолированными МЯ за счёт увеличения доли клеток с примыкающими МЯ, клеток с большими фрагментами хроматина и двуядерных клеток. Появление таких клеток свидетельствует о том, что неорганическая ртуть нарушает не только структуру хромосом, но и митотическое веретено деления и, возможно, механизмы цитокинеза. В настоящее время известно, что соединения ртути могут нарушать структуры клеточ- ного веретена благодаря аффинности к тиоловым группам. Аномальное распределение хромосом между делящимися клетками под влиянием НgCl2 ранее было обнаружено на клетках Vicia faba [5].
Зависимость частоты ядерных аномалий в эритроцитах личинок B. viridis от концентрации ртути при различной длительности экспозиции удовлетворительно интерполируется уравнениями вида · со следующими величинами коэффициентов (табл. 4).
Таблица 4 - Величины коэффициентов уравнения у=а+Ьx* , интерполирующих зависимость частоты микроядер и ядерных аномалий в эритроцитах личинок B. viridis от концентрации ртути при различной продолжительности ее воздействия
|
Длительность экспозиции, ч |
а |
b |
R |
F |
P |
|
6 |
0,389 |
4,36 ⋅ 10–2 |
0,968 |
59,3 |
1,00 ⋅ 10–4 |
|
12 |
0,596 |
5,56 ⋅ 10–2 |
0,829 |
8,8 |
1,90 ⋅ 10–3 |
|
18 |
0,625 |
0,119 |
0,947 |
34,9 |
2,00 ⋅ 10–4 |
|
24 |
0,707 |
0,111 |
0,918 |
21,3 |
4,00 ⋅ 10–4 |
Примечание: R – множественный коэффициент корреляции; F – значение критерия Фишера; Р – уровень значимости нулевой гипотезы.
Результаты исследований мутагенности ртути существенно зависят от химической природы образованного ею вещества и типа клеток, используемых для анализа.
Большинство бактериальных генетических тестов показали, что соединения ртути не мутагенны для прокариот. Объяснют это явление высокой рези- стентностью бактериальной клеточной мембраны к проникновению ионов ртути. У некоторых прокариот обнаружены ферментативные механизмы детоксикации неорганических и органических соединений ртути с использованием, соответственно, ртутной редуктазы (MerA) и ртутьорганической лиазы (MerB) [6].
У дрожжей хлорид ртути подавлял митотическую генную конверсию, что, возможно, связано с ингибированием ртутью ферментов репарации пред-мутационных повреждений [5].
Нитрат ртути в концентрации 1×10–5 М не проявлял мутагенных свойств при воздействии на клетки корневой меристемы С. capillaris, но иодид ртути был мутагенен при значительно меньшей концентрации (3×10–6 М) [7]. Хлорид ртути в концентрации 0,05 и 0,1%, хлорид этилртути (0,01-2,5%) и ацетат фе-нилртути (0,01-1,0%) вызывали аберрации хромосом, повышали частоту полиплоидных и двуядерных клеток в клетках меристемы корешков Allium сера, индуцировали у Vicia faba в мейозе образование МЯ и аберраций хромосом [8] Мутагенность ртути для растений Pisum sativum подтверждена исследованиями [9]
Доказана мутагенность различных соединений ртути для рыб [10-18]. Очень мало публикаций, освещающих вопросы мутагенности ртути для амфибий и пресмыкающихся. Установлено, что хлорид ртути (HgCl 2 ) и метилхлорид ртути (CH 3 HgCl) индуцировал нарушение митоза, разрывы хромосом и образование МЯ в клетках тритона Pleurodeles waltl [19]. В тканях кайманов, обитающих на территориях, прилегающих к горнодобывающим предприятиям Колумбии, установлено 6-15 кратное накопление ртути. У таких животных методом кометного анализа выявлено значительное увеличение частоты повреждений в ДНК [20]
Токсичность различных соединений ртути для птиц освещена во многих публикациях. Вместе тем публикаций результатов исследования мутагенности ртути и её соединений для птиц мы не обнаружили.
В культивируемых клетках млекопитающих ртуть даже при низких концентрациях индуцировала одноцепочечные разрывы ДНК. Соединения ртути увеличивали частоту мутирования в локусе тимидин-киназы в клетках лимфомы мыши [21], индуцировали сестринские хроматидные обмены и аберрации хромосом в культивируемых клетках СНО и лимфоцитах человека [22-24]. Эксперименты, выполненные с культурой эмбриональных фибробластов мыши, привели к заключению, что наблюдаемые мутации могут быть следствием окислительных процессов, а не прямым взаимодействием ртути с ядерной ДНК [25].
Соединения ртути, попадающие в организм млекопитающих, могут индуцировать точковые мутации, доминантные летальные мутации, хромосомные и геномные повреждения. Так, хлорид ртути в дозе 0,375 мг/кг внутрижелудочно вводимый крысам в течение 45 дней вызывал повреждения ДНК, обусловленные усилением окислительного стресса и митохондриальной дисфункцией [26]. Одноразовое внутрибрюшинное введение самцам крыс дихлорида ртути в количестве ЛД 50 и 2/3 ЛД 50 (7,5 мг/кг и 5 мг/кг, соответственно) приводило к статистически достоверному увеличению частоты МЯ в полихроматических эритроцитах костного мозга [27-28]. Хлорид ртути и хлорид метилртути индуцировали статистически достоверное увеличение частоты доминантных летальных мутаций у самок крыс и мышей [29-31].
У людей, употреблявших в пищу мясо и рыбу, загрязнённые соединениями ртути, а также лиц, подверженных в процессе профессиональной деятельности воздействию паров и аэрозолей ртутьсодержащих веществ, обнаруживали существенное увеличение частот сестринских хроматидных обменов, структурных и численных аберраций хромосом и МЯ в клетках различных тканей [32-35].
В последнее десятилетие получены сведения, указывающие на то, что ртуть может быть активна эпигенетически, поскольку способна влиять на метилирование ДНК у млекопитающих [36-37]. Широкое варьирование результатов исследования биологических свойств ртути может быть обусловлено не только различиями в протоколах и условиях экспериментов, но и различиями эпигенетических механизмов регуляции генов, участвующих в метаболизме ртути у организмов разных видов.
Заключение
Ртуть интенсивно используется в различных отраслях промышленности, и большое её количество поступает в окружающую среду с отходами, стоками и газовыми выбросами. Эксперты ВОЗ прогнозируют дальнейший рост концентрации ртути в окружающей среде в результате хозяйственной деятельности человека, а изменение климата, как ожидается, усугубит воздействие этого вездесущего загрязнителя. Токсичность ртути хорошо исследована, её канцерогенность остаётся предметом споров и дальнейших исследований онкологов. Факты мутагенность ртути установлены для растений и многих типов и видов животных. Вместе с тем степень изученности мутагенных эффектов у разных классов позвоночных животных очень различна. Мутагенность соединений ртути для амфибий, пресмыкающихся и птиц рассматривается в очень небольшом количестве публикаций. Полученные нами результаты доказывают потенциальную генетическую опасность неорганических соединений ртути для амфибий и указывают на необходимость генетического мониторинга животных, обитающих в водоёмах, расположенных в районах ртутного загрязнения экосистем.
Выводы
-
1. Пребывание личинок зелёной жабы в воде содержащей 5, 10, 20 и 50 мкг/л ионов ртути в течение 6 часов приводит к некоторому повышению частот микроядер и ядерных аномалий в эритроцитах подопытных животных, но этот рост остаётся статистически недостоверным.
-
2. Увеличение концентрации ионов ртути до 100 и 150 мкг/л при 6 часовой экспозиции вызывает статистически достоверное увеличение частот микроядер и ядерных аномалий в эритроцитах личинок.
-
3. Воздействие ионов ртути в течение 12, 18 и 24 часов вызывало статистически достоверное увеличение частот микроядер и ядерных аномалий при всех исследованных концентрациях.
Список литературы Индукция ионами ртути (II) микроядер в эритроцитах личинок зелёной жабы
- Дабагян Н.В., Слепцова Л.А. Травяная лягушка Rana temporaria L. //Объекты биологии развития. -М.: Наука, 1975. -С. 442-462.
- Крюков В.И. Вариант методики учёта ядерных аномалий в эритроцитах птиц. // Вестник аграрной науки, 2020, № 1. -С.81-100.
- Жулева Л.Ю., Дубинин Н.П. Использование микроядерного теста для оценки экологической обстановки в районах Астраханской области //Генетика. -1994. Т. 30, № 7. -С. 999-1004.
- Урбах В.Ю. Статистический анализ в биологических и медицинских исследованиях. -М.: Медицина, 1975. -295 с.
- Helmi S. et al. Genotoxity of inorganic mercury. / Helmi S., El-Seehi M., El-Ziat H. // Environ. and mol. mutagenes. 1989. V. 14. Suppl. -P. 87.
- Christakis C.F. et al. Expanded diversity and phylogeny of mer genes broadens mercury resistance paradigms and reveals an origin for MerA among thermophilic Archaea. / Christos A. Christakis, Tamar Barkay, Eric S. Boyd. // Front Microbiol. 2021. V.12 № 682605.
- Реутова Н.В. Мутагенный потенциал ряда тяжёлых металлов //Экологическая генетика. 2015. Т. 13. № 3. - С. 70-75
- Nandi S. Studies on the cytogenetic effect of some mercuric fungicides //Cytologia. 1985. V. 50. № 4. -P. 921-926.
- Azevedo R. et al. Inorganic Hg toxicity in plants: A comparison of different genotoxic parameters. / Raquel Azevedo, Eleazar Rodriguez, Rafael José Mendes et al. // Plant Physiol. Biochem. 2018. V. 125. -P. 247-254.
- Krishnaja A.P., Rege M.S. Induction of chromosomal aberrations in fish Boleophthalmus dussumieri after exposure in vivo to mitomycin C and heavy metals mercury, selenium and chromium. // Mutat. Res. 1982. V. 102. № 1. -P. 71-82.
- Al-Sabti K. An in vitro binucleated blocked hepatic cell technique for genotoxicity testing in fish //Mutat. Res. Environ. Mutatgenes and Related Subj. 1995. -V. 335, № 2. -P. 109-120.
- Cava§ T. In vivo genotoxicity of mercury chloride and lead acetate: Micronucleus test on acridine orange stained fish cells. // Food and Chemical Toxicology. 2008. V. 46. № 1. -P. 352-358.
- Rocha C.A.M. et al. The micronucleus assay in fish species as an important tool for xenobiotic exposure risk assessment - a brief review and an example using neotropical fish exposed to methylmercury / Carlos Alberto Machado da Rocha, Raquel Alves dos Santos, Marcelo de Oliveira Bahia et al. // Reviews in Fisheries Science. 2009. V. 17. № 4. -P 478-484. .
- Rocha C.A.M. et al. Studies of micronuclei and other nuclear abnormalities in red blood cells of Colossoma macropomum exposed to methylmer-cury. / Rocha, C.A.M. da, Cunha, L.A. da, Pinheiro, R.H. da S. et al. // Genetics and Molecular Biology. 2011 V. 34. № 4. -P. 694-697. .
- Rocha C et al. Comet Assay and Micronucleus Test in Circulating Erythrocytes ofAequidens tetramer-us Exposed to Methylmercury / Carlos Rocha, Bruno Cavalcanti, Claudia Ó. Pessoa et al. // In Vivo. November 2011, 25 (6) 929-933.
- Rodríguez A.P.C. et al. Chronic effects of methylmercury on Astronotus ocellatus, an Amazonian fish species. / Rodríguez, A.P.C., Maciel, P. Silva, L.C.P. et al. // Journal of Aquatic Pollution and Toxicology. 1917. V. 1. № 2 -P. 1-14.
- Nirchio M. et al. Genotoxic effects of mercury chloride on the Neotropical fish Andinoacara rivula-tus (Cichlidae: Cichlasomatini). / Nirchio M., Choco-Veintimilla O., Quizhpe-Cordero P.F. et al. // Revista de Biología Tropical, 2019. V. 67. № 4. -P. 745-754.
- Maktoof A.A. et al. Study the impact of the concentration of mercury chloride on micronuclei formation and some organs of juveniles of Ctenopharyngodon idella. / Afrah Abed Maktoof, Rasha Salih Nuhair, Awatif Mokar Al-Saaedi et al. // Indian Journal of Forensic Medicine & Toxicology. 2020. V. 14. № 3. -P. 2690-2695
- Zoll C. et al. Genotoxicity and bioaccumulation of methyl mercury and mercuric chloride in vivo in the newt Pleurodeles waltl. / C. Zoll, E. Saouter, A. Boudou et al. // Mutagenesis. 1988. V. 3. № 4. -P. 337-343.
- Marrugo-Negrete J. et al. Mercury levels and genotoxic effect in caimans from tropical ecosystems impacted by gold mining. / Marrugo-Negrete José, Durango Hernández José, Calao Ramos Clelia et al // Science of The Total Environment. 2019. V. 664.
- Oberly T.J., Piper C.E. Mutagenicity of metal salts in the L5178Y mouse lymhpoma assay //Environ. Mutagenes. 1980. V. 2, № 2. -P. 281.
- Howard W. et al. 1991. Induction of chromosome changes by metal compounds in cultured CHO cells / Howard W., Leonard B., Moody W. // Toxicol. Lett. 1991. V. 56, № 1-2. -P. 179-186.
- Betti C. et al. Genotoxic effects induced by mercuric compounds in human lymphocytes. / Betti C., Dav-ini T., Barale R. // Mutat. Res. Rev. Genet. Toxicol. 1992. V. 271. № 2. -P.165-166.
- Kochhar T.S. et al. Influence of organomercurials on the induction chromosome aberrations in CHO cells. / Kochhar T.S., Wilson A., Andersen A. // Environ. and Mol. Mutagenes. 1994. V. 23. -P. 33.
- Schurz F et al. Mutagenicity of mercury chloride and mechanisms of cellular defence: the role of metal-binding proteins. / F Schurz, M Sabater-Vilar, J Fink-Gremmels // Mutagenesis. 2000. V. 15, № 6. -P. 525-530.
- Aragao W.A.B.A. et al. DNA Damage and Proteomic Profile Changes in Rat Salivary Glands After Chronic Exposure to Inorganic Mercury. / Walessa Alana Braganga Aragao, Leonardo Oliveira Bittencourt, Leidiane Alencar de Oliveira Lima et al. // Biol. Trace. Elem. Res. 2022. DOI: 10.1007/s12011-021-02986-7.
- Бошнакова Е. Влияние на живачния двухлорид и на мангановия двухлорид въерху доминантните летални мутации у лабораторни животни //Генет. и селек. (Болгария). 1989а. Т. 22. № 1. -С. 7175.
- Бошнакова Е. Микронуклеус-тест при лабораторни животни, въздействувани с живачен двухло-рид и манганов двухлорид //Генет. и селек. (Болгария). 19896. Т. 22. № 3. -С. 253-258.
- Васильева И.М. и др. Определение мутагенного потенциала одного из загрязнителей окружающей среды - хлорида ртути. / Васильева И.М., Сдиркова Н.И., Засухина Г.Д. // Цитология и генетика. 1982. Т. 16, № 2. -С. 21-24.
- Zasukhina G.D. et al. Mutagenic effect of thallium and mercury salts on rodent cells with different repair activities. / Zasukhina G.D., Vasilyeva I.M., Sdirkova N.I. //Mutat. Res. 1983. V. 124, № 2. -P. 163-173.
- Verschaeve I., Leonard A. Dominant lethal test in female mice treated with methyl mercury chloride //Mutat. Res. 1984. V. 136, № 2. -P. 131-136.
- Monsalve M.V., Chiappe C. Genetic effects of methylmercury in human chromosomes. I. A cytogenetic study of people exposed through eating contaminated fish // Environ and Mol. Meta-genes. 1987. V.10, № 4. -P. 367-376.
- Loprieno G. et al. Cytogenetic monitoring of fishermen exposed to mercury through fish consumption. / Loprieno G., Franchi E., Petrozzi L. // Mutat. Res. Rev. Genet. Toxicol. 1992. V. 271, № 2. -P.192-193.
- Kocadal K. et al. Cellular pathologies and genotoxic effects arising secondary to heavy metal exposure: A review. / K. Kocadal, F.B. Alkas, D. Battal, S. Saygi. // Human and Experimental Toxicology. 2020. V. 39. № 1. -P. 3-13.
- Sanchez-Alarcon J. et al. Genotoxicity of mercury and its derivatives demonstrated in vitro and in vivo in human populations studies. Systematic review. / Juana Sanchez-Alarcon, Mirta Milic, Lilia Patricia Bustamante-Montes et al. // Toxics. 2021. V. 9. № 12. -P. 326.
- Basu N. et al. Effects of methylmercury on epigenetic markers in three model species: Mink, chicken and yellow perch. / Niladri Basu, Jessica Head, Dong-Ha Nam et al. // Comparative Biochemistry and Physiology. Part C: Toxicology & Pharmacology. 2013. V. 157. № 3. -P. 322-327.
- Basu N. et al. Ecogenetics of mercury: from genetic polymorphisms and epigenetics to risk assessment and decision-making. / Niladri Basu, Jaclyn M. Goodrich, Jessica Head // Environmental Toxicology and Chemistry. 2014. V. 33. -P. 1248-1258.


