Индукция эмбриогенеза в культуре изолированных микроспор пшеницы ( Triticum aestivum L.)
Автор: Нескородов Я.Б., Тураев А.М., Зубарева И.А., Мишуткина Я.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Селекция пшеницы: генетические основы и IN VITO технологии
Статья в выпуске: 3 т.49, 2014 года.
Бесплатный доступ
Гаплоиды и удвоенные гаплоиды пшеницы служат ценным материалом для селекции. Они могут быть использованы при изучении комбинативной изменчивости и поиске подходов для ее закрепления в гомозиготных линиях. Четыре отечественных сорта озимой (Московская 56, Московская 39, Галина, Немчиновская 24) и три яровой (Эстер, МИС, Амир) пшеницы были проверены на эффективность эмбриогенеза в изолированных микроспорах. Контролем служил сорт яровой пшеницы Фалат. В основу работы взят протокол по индукции прямого эмбриогенеза в культуре изолированных микроспор. Все озимые сорта показали низкую частоту образования цитоплазматических тяжей, характерных для эмбриогенных микроспор, тогда как у яровых отмечена высокая частота формирования аналогичных структур. Через 4 сут культивирования в питательной среде для индукции наблюдалось снижение жизнеспособности микроспор озимых сортов, а еще через 10 сут в культуре живые клетки не обнаруживались. Яровые сорта продемонстрировали способность формировать многоклеточные структуры, которые могли развиться в эмбриоиды. У контрольного сорта Фалат количество проэмбриодных структур составило 28 %, при этом большая их часть в дальнейшем развивалась в эмбриоиды. Исходя из полученных данных, возникла необходимость в модификации имеющегося протокола по индукции прямого эмбриогенеза в микроспорах пшеницы, а именно в изменении таких параметров, как концентрация мальтозы в индукционной среде, температурная обработка колосков пшеницы, число завязей и время их добавления в среду, тип и концентрация гормонов в индукционной среде и среде для культивирования.
Микроспоры, пшеница, эмбриогенез, регуляторы роста растений
Короткий адрес: https://sciup.org/142133514
IDR: 142133514 | УДК: 633.11:576.3/.7.086.83:58
Текст научной статьи Индукция эмбриогенеза в культуре изолированных микроспор пшеницы ( Triticum aestivum L.)
Гаплоиды и удвоенные гаплоиды пшеницы — ценный материал для селекции и решения ряда научно-практических проблем, в том числе связанных с изучением комбинативной изменчивости и поиском подходов для ее эффективного использования и закрепления в гомозиготных линиях. Изначально для получения гаплоидов пшеницы использовали методы элиминирования хромосом и культуры пыльников (1, 2).
Относительно недавно получил развитие метод культуры изолированных микроспор (3). Его суть заключается в следующем. Растения пшеницы выращивают при определенных условиях (этап яровизации, температура 15-20 ° C, освещенность 5-15 тыс. лк и 16-часовой фотопериод). Для культуры используют микроспоры, находящиеся на поздней одноядерной или ранней двухъядерной стадии развития (4-6). Колоски или изолированные микроспоры сначала культивируют на питательных средах, блокирующих гаметофитный путь и индуцирующих формирование эмбриогенных микроспор (обычно бедные среды с маннитолом и/или сорбитолом) при низких температурах (4-7 ° C). Далее эмбриогенные микроспоры переносят на питательную среду с углеводами и гормонами, инкубируют при 22-25 ° C в темноте до формирования эмбриоидов, которые, в свою очередь, переносят на плотные питательные среды для регенерации растений, содержащие фитогормоны, низкие концентрации сахаров, и поддерживают определенный световой режим (3-5). Весь процесс обычно занимает около 2 мес.
Несмотря на постоянное совершенствование методик, получение гомозиготных дигаплоидных линий пшеницы возможно только посредством адаптации существующих протоколов для конкретных гено-
Исследование выполнено при поддержке Министерства образования и науки РФ в рамках Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы, соглашение № 8483.
типов растений.
Целью настоящей работы было определение эффективности индукции эмбриогенеза в культуре изолированных микроспор у сортов яровой и озимой пшеницы отечественной селекции с использованием разработанных ранее протоколов.
Методика. В работе использовали сорта пшеницы ( Triticum aesti-vum L.) — озимой (Московская 56, Московская 39, Галина, Немчиновская 24) и яровой (Эстер, МИС, Амир). Контролем служил сорт яровой пшеницы Фалат. Ранее было показано, что он обладает наибольшей восприимчивостью к индукции эмбриогенеза и максимальной частотой регенерации (7). Растения-доноры культивировали по стандартным методикам (4, 7). Материал отбирали, когда 80 % микроспор в пыльниках колоса находились на стадии одной клетки.
В основу нашей работы был взят протокол по индукции прямого эмбриогенеза в культуре изолированных микроспор пшеницы (7). Согласно этой методике стрессовая обработка микроспор не предполагалась.
Оптимальную стадию развития определяли с помощью светового инвертированного микроскопа ЛабоМед ИЗ («Labor-microscopes», Россия). Препараты пыльников окрашивали ацетокармином или DAPI (4 ‘ ,6-диамидино-2-фенилиндол) (8, 9). Микроспоры выделяли из свежесрезанных колосков.
Колоски стерилизовали в 70 % этаноле, замачивая их в течение 1 мин. Пыльники боковых цветков изолировали и промывали в жидкой среде АВ (7). Микроспоры из пыльников высвобождали, используя центрифугирование в течение 2-3 мин (600 об/мин). Полученную суспензию помещали в пробирки для центрифугирования, пропуская через фильтр (60 мкм). Затем отмывали микроспоры в среде АВ 2-кратным центрифугированием (по 5 мин при 600 об/мин). Осажденные микроспоры с плотностью приблизительно 2 х 104 тщательно суспендировали в 1,5 мл среды А2 (7).
Культивирование микроспор осуществляли в запечатанных чашках Петри (35x10 мм) в темноте при температуре 25 ° C. Через 7 сут от начала культивирования к ним добавляли регуляторы роста растений 2,4-дихлор-феноксиуксусную кислоту (2,4-Д, 1 мг/л), кинетин (0,2 мг/л), а также завязи (6-7 шт.) и продолжали культивирование при тех же условиях.
Завязь извлекали в асептических условиях из колоса и культивировали на плотной среде А2 при температуре 25 ° С (7). При необходимости завязь помещали в жидкую индукционную среду.
Наличие крахмала в культивируемых клетках определяли под световым инвертированным микроскопом ЛабоМед ИЗ («Labor-microscopes», Россия) после окрашиваниях раствором Люголя.
Результаты . Жизнеспособность изолированных микроспор пшеницы непосредственно после выделения составляла 58,2 % у сорта Фалат и 31,5-48,3 % — у остальных сортов. Микроспоры на поздней одноядерной стадии имели большую вакуоль, тонкий слой цитоплазмы и круглое ядро напротив зародышевой поры (рис., а).
Через 4 сут культивирования их жизнеспособность снижалась до 42,3 % у сорта Фалат, до 32,2-41,0 % — у яровых сортов и до 8,0-11,5 % — у озимых. В большинстве случаев ядра перемещались в центр клетки, вакуоль исчезала, плотность цитоплазмы повышалась. Некоторые микроспоры увеличивались в размерах до 60-80 мкм. У части из них имелись звездоподобные структуры, представляющие собой измененные вакуоли с цитоплазматическими тяжами (см. рис., б). Визуально они были анало-84
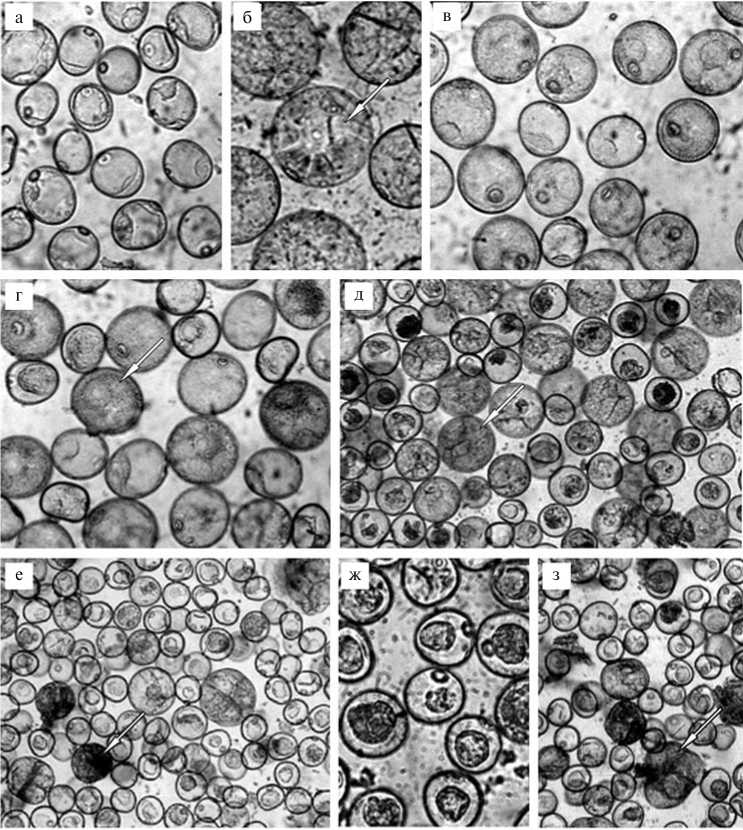
Изолированные и культивируемые in vitro микроспоры пшеницы сорта Амир: а — микроспоры непосредственно после выделения из свежесрезанных колосков, б — эмбриогенные микроспоры через 4 сут культивирования при 25 ° C (стрелкой отмечена звездоподобная структура), в — незрелые двухклеточные пыльцевые зерна, г — микроспоры в стадии двух клеток через 4 сут культивирования на питательной среде А 2 , д — многоклеточные структуры, образовавшиеся в результате митотического деления через 1-2 нед культивирования, е — эм-бриоподобные структуры (отмечены стрелкой), ж — плазмолиз микроспор через 10 сут культивирования на питательной среде А2, з — формирование многоклеточных структур без их дальнейшего развития (световая микроскопия, увеличение *600).
гичны описанным ранее структурам микроспор табака, характерным для эмбриогенной микроспоры (4, 7).
Если для культивирования использовали ранние двухклеточные незрелые пыльцевые зерна (см. рис., в), то в клетках происходило накопление крахмала в течение первых 4 сут инкубации и они гибли. Добавление регуляторов роста и завязей приводило к разрыву оболочек и значительному снижению жизнеспособности клеток, хотя часть все-таки формировала многоклеточные структуры (см. рис., з), небольшая доля которых могла развиться в эмбриоиды.
Через 1 нед после добавления завязей и регуляторов роста доля живых клеток составляла 33,1 % для сорта Фалат и 0-9,2 % — для остальных сортов (табл.). При этом у всех озимых сортов живые клетки отсутст- вовали. В течение 1-2 нед микроспоры проходили через серию митотических делений и формировали предшественники эмбриоидов (см. рис., д). Часть многоклеточных проэмбриоидов разрывали клеточную стенку и выходили наружу, другие выбрасывали цитоплазму и ядерный материал и погибали. Некоторые развивались в глобулярные эмбриоподобные структуры, затем — в эмбриоиды посредством прямого эмбриогенеза и могли расти как нормальные зиготические эмбриоиды с различными формами и размерами, в то время как остальные формировали каллус (см. рис., з).
Жизнеспособность микроспор у пшеницы яровых и озимых сортов на разных стадиях развития in vitro
|
Сорт |
Доля живых микроспор, % |
||
|
после выделения |
через 4 сут |
через 1 нед после добавления регуляторов роста и завязей |
|
|
Фалат (контроль) |
58,2 |
42,3 |
33,1 |
|
Московская 56 (озимый) |
35,2 |
9,3 |
0 |
|
Московская 39 (озимый) |
39,6 |
8,3 |
0 |
|
Галина (озимый) |
33,4 |
11,5 |
0 |
|
Немчиновская 24 (озимый) |
31,5 |
10,2 |
0 |
|
Эстер (яровой) |
48,3 |
41,0 |
9,2 |
|
МИС (яровой) |
42,2 |
35,8 |
7,3 |
|
Амир (яровой) |
38,5 |
32,2 |
7,4 |
Через 2-3 нед после добавления завязей и регуляторов роста многоклеточные структуры у яровых сортов составляли менее 5 %. В дальнейшем они не развивались в эмбриоиды. У контрольного сорта Фалат доля проэмбриодных структур составила 28 %, при этом большая их часть в дальнейшем развивалась в эмбриоиды.
Таким образом, все исследованные озимые сорта пшеницы отечественной селекции показали низкую частоту образования звездоподобных структур, характерных для эмбриогенных микроспор. После 4 сут культивирования в индукционной среде было отмечено снижение жизнеспособности микроспор, а через 10 сут живых клеток в культуре не обнаруживали. Яровые сорта продемонстрировали способность формировать многоклеточные структуры, которые останавливались в развитии через 3 нед культивирования. Исходя из полученных данных, возникла необходимость в модификации имеющегося протокола, а именно в изменении таких параметров, как концентрация мальтозы в индукционной среде, температурная обработка колосков пшеницы, число завязей и время их добавления в среду, тип и концентрация гормонов в индукционной среде и в среде для культивирования.
Л И Т Е Р А Т У Р А
-
1. Advances in haploid production in higher plants /A. Touraev, B.P. Forster, S. Jain (eds.). Springer, 2009. ISBN 978-1-4020-8854-4.
-
2. Guzy - Wr у belska J., Labocha - Pawlowska A., Kwasniewski M., Szare-j k o I. Different recombination frequencies in wheat doubled haploid populations obtained through maize pollination and anther culture. Euphytica, 2007, 156: 173-183.
-
3. Gustafson V.D., Baenziger P.S., Wright M.S., Stroup W.W., Yen Y. Isolated wheat microspore culture. Plant Cell Tiss. Org. Cult., 1995, 42: 207-213.
-
4. Touraev A., Indrianto A., Wratschko I., Vicente O., Heberle-Bors E. Efficient microspore embryogenesis in wheat ( Triticum aestivum L.) induced by starvation at high temperature. Sex Plant Reprod., 1996, 9: 209-215.
-
5. Hu T.C., Kasha K.J. Improvement of isolated microspore culture of wheat ( Triticum aestivum L.) through ovary co-culture. Plant Cell Rep., 1997, 16: 520-525.
-
6. W e y e n J. Barley and wheat doubled haploids in breeding. In: Advances in haploid production in higher plants /A. Touraev, B.P. Forster, S. Jain (eds.). Springer, 2009: 179-187. ISBN 978-14020-8854-4.
-
7. Shariatpanahi M.E., Belogradova K., Hessamvaziri L., Heberle-Bors E., T o u r a e v A. Efficient embryogenesis and regeneration in freshly isolated and cultured wheat
( Triticum aestivum L.) microspores without stress pre-treatment. Plant Cell Rep., 2006, 25: 1294-1299.
-
8. Li G.P., Huang Q. Whole stain-clearing technique for observation of pollen grain structure of Keteleeria fortune . J. Zhengzhou Univ. (Natural Science Edition), 2005, 37(2): 44-47.
-
9. Vergne P., Delvallee I., Dumas C. Rapid assessment of microspore and pollen development stage in wheat and maize using DAPI and membrane permeabilization. Stain Technology, 1987, 62: 299-304.
1 ФГБУН Центр «Биоинженерия» РАН, Поступила в редакцию
117312 Россия, г. Москва, проси. 60-летия Октября, 7, корп. 1, 10 апреля 2014 года
2ФГБ0У ВП0 Московский государственный университет им. М.В. Ломоносова,
119991 Россия, г. Москва, Ленинские горы, 1,
INDUCTION OF EMBRYOGENESIS IN WHEAT (Triticum aestivum L.) CULTIVATED MICROSPORES
Ya.B. Neskorodov1, A.M. Touraev2, I.A. Zubareva1, Ya.V. Mishutkina1
Received April 10, 2014
Supported by Ministry of Education and Science of the Russian Federation, Federal Target Program for Innovation (2009-2013)


