Инъекции инкапсулированного ph-сенсора SNARF-1 не вызывают явной реакции стресса у личинок эндемичных байкальских caddisflies Baicalina thamastoides
Автор: Гурков А.Н., Белоусова И.А., Щапова Е.П., Бадуев Б.К., Верещагина К.П., Тимофеев М.А.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 1 т.12, 2016 года.
Бесплатный доступ
В настоящем исследовании была оценена возможность стресс-реакции личинок caddisflies Baicalina thamastoides Martynov, 1914 на инъекцию инкапсулированных датчиков. В качестве биомаркеров использовались супероксиддисмутаза, неспецифические эстеразы и S-трансфераза глутатиона, которые играют важную роль в функционировании систем защиты организма. Активность энзимов измеряли после инъекций пустых микрокапсул и микрокапсул с флуоресцентным датчиком рН SNARF-1, а также после вскрытия физиологического солевого раствора и раствора флуоресцентного датчика. Полученные результаты свидетельствуют о нетоксичности и отсутствии кажущейся реакции стресса антиоксидантных и детоксикационных систем личинок B. thamastoides на оба типа микрокапсул.
Короткий адрес: https://sciup.org/14323985
IDR: 14323985
Текст научной статьи Инъекции инкапсулированного ph-сенсора SNARF-1 не вызывают явной реакции стресса у личинок эндемичных байкальских caddisflies Baicalina thamastoides
Микрокапсулы являются не только перспективным средством целевой доставки генно-модифицирующих векторов и лекарственных средств в ткани живого организма, но и могут быть использованы как носители широкого круга молекулярных сенсоров, спектр или яркость флуоресценции которых реагирует на такие параметры как pH, ионный состав и т. д. (Johnson & Spence, 2011). Микрокапсулы, наполненные флуоресцентными сенсорами и введённые в живой организм, являются перспективным инструментом для прижизненной оценки стрессовых состояний организма и могут найти широкое применение в экологическом мониторинге водных экосистем (Sadovoy et al. , 2012). Однако, введение микрокапсул в организм для регистрации физиологических параметров само по себе может сопровождаться реакцией защитных систем организма на введённые микрокапсулы, что может помешать адекватной оценке состояния организма с помощью микрокапсул. Это обуславливает необходимость предварительной оценки возможной стресс-реакции организмов на инъекции микрокапсул, особенно у видов, перспективных для использования в качестве тест-объектов.
В данной работе оценивали возможность развития стресс-ответа организма личинки ручейника при инъекции инкапсулированных сенсоров. В качестве стресс-маркера были использованы показатели активности трёх ферментов, играющих ключевую роль в функционировании защитных систем организма: супероксиддисмутазы (СОД), неспецифических эстераз (НЭ) и глутатион-S-трансферазы (ГСТ). СОД — это один из ключевых ферментов, ответственных за утилизацию активных форм кислорода, чья продукция в митохондриях увеличивается при множестве нарушений в организме. ГСТ и НЭ являются одними из основных ферментов системы детоксикации ксенобиотиков.
Активность ферментов оценивали в ответ на инъекции пустых микрокапсул и микрокапсул, содержащих флуоресцентный pH-сенсор SNARF-1. Также проводили оценку в ответ на инъекции физиологического раствора и раствора флуоресцентного сенсора.
MATERIALS AND METHODS
Подготовка микрокапсул
Микрокапсулы подготавливали методом наслоения противоположно заряженных полимеров. Вначале получали пористые ядра карбоната кальция, смешивая 0,625 мкл 1М раствора Na2CO3 и 0,625 мкл 1М раствора CaCl2 с 2 мл раствора декстрана, меченого чувствительным к pH флуоресцентным красителем SNARF-1 (Invitrogen, D-3304), с концентрацией 2 мг/мл, при интенсивном перемешивании. Через 10 с перемешивания полученные ядра карбоната кальция три раза отмывали осаждением с помощью центрифугирования и разведением в деионизированной воде. Поры ядер, сформированных в растворе меченого SNARF-1 декстрана, содержали данный краситель. Затем на ядра последовательно наносили слои положительно заряженного полимера полиаллиламин гидрохлорида (ПАГ; Aldrich, 2832315) и отрицательно заряженного полистиролсульфоната натрия (ПСН; Aldrich,
243051). Для этого ядра помещали в раствор соответствующего полимера с концентрацией 4 мг/мл (содержащий также 1М NaCl) на 5 мин при ультразвуковом воздействии для снижения агрегации ядер. Ядра трижды отмывали от раствора оставшегося полимера, после чего наслаивали второй полимер, а затем повторяли процедуру несколько раз. Для повышения биосовместимости покрывали полученные структуры дополнительным слоем cополимера поли-L-лизина и полиэтиленгликоля (ПЛЛ-ПЭГ; SuSoS, SZ34-67), экспонируя ядра в растворе данного полимера с концентрацией 2 мг/мл в течение двух часов. Наконец, ядра из карбоната кальция растворяли в 0,1М растворе ЭДТА c pH 7.0, после чего получали полые микрокапсулы с формулой стенки (ПАГ/ПСН) 5 -(ПЛЛ-ПЭГ), содержащие SNARF-1. Поскольку SNARF-1 ковалентно связан с декстраном, он не может покинуть полость микрокапсулы. Пустые капсулы получали аналогично, но без добавления меченого SNARF-1 декстрана при формировании ядер.
Измерение концентрации микрокапсул проводили в камере Горяева. Концентрации микрокапсул в растворах, использованных позже для инъекций, были доведены примерно до 6700 шт/мкл и 67000 шт/мкл для содержащих и не содержащих SNARF-1 микрокапсул соответственно. Данные концентрации выбраны, поскольку микрокапсулы с декстраном, меченым SNARF-1, оказались примерно в 5 раз крупнее микрокапсул без него (в среднем 5 мкм и 1 мкм соответственно) из-за различий в размерах кристаллизовавшихся ядер карбоната кальция. При выбранных концентрациях растворы микрокапсул обладают близкими суммарными площадями поверхности микрокапсул.
Отлов ручейников и проведение экспериментов
В качестве объекта данного исследования были выбраны личинки массового эндемичного вида ручейников Baicalina thamastoides Martynov, 1914, населяющие литоральную зону озера Байкал. Отлов производили с глубины 2-3 м в прибрежной зоне озера Байкал в п. Большие Коты в сентябре 2015 г. Вид определяли по (Timoshkin, 2004; Lepneva, 1964). Отловленные личинки ручейников были прикреплены к мелким валунам в тех местах, где отсутствовало обрастание водорослями. Температура отлова — 12 °C, при данной температуре животных содержали и проводили все последующие эксперименты. После отлова личинки ручейников были акклимированы к лабораторным условиям в течение 4-5 суток: их содержали в холодильнике в аквариумах по 2-3 л в хорошо аэрируемой байкальской воде при низком освещении. В аквариумы помещали небольшие валуны, схожие по форме с теми, к которым ручейники были прикреплены в естественной среде. Важно отметить, что покидание домиков личинками, свидетельствующее о стрессовом состоянии ручейника, в течение акклимации не наблюдали. При проведении экспериментов использовали только личинок без внешних паразитов и симбионтов.
Для проведения эксперимента ручейники были разделены на 5 групп: контрольная группа, оставленная в условиях акклимации, и 4 экспериментальные тест-группы. В жировые тела ручейников тест-групп делали инъекции, сопровождавшиеся последующим экспонированием животного под объективом флуоресцентного микроскопа Микмед-2 (ЛОМО) с зелёным освещением в течение около 30 с. Данное экспонирование имитировало процесс снятия сигнала с флуоресцентных сенсоров в тканях ручейника. Инъекции в личинки ручейников были следующих типов: введение физиологического раствора, введение «пустых» микрокапсул в физиологическом растворе, введение микрокапсул с флуоресцентным pH-чувствительным красителем SNARF-1, введение меченого SNARF-1 декстрана в физиологическом растворе. Концентрация декстрана, меченого SNARF-1, в физиологическом растворе составляла 0,2 мг/мл, что соответствует средней молярной концентрации SNARF-1, используемой для измерения pH на культурах клеток (Venn et al., 2009). Инъекции производили с помощью шприца на 100 мкл (Hamilton) с насаженной иглой с внешним диаметром 0,25 мм.
Перед инъекцией по центру длины домика личинки с латеральной стороны в нём делали отверстие размером 2-3 мм, мягко откалывая песчинки пинцетом. Через это отверстие под углом примерно 30 ° вводили 2 мкл соответствующего раствора в латеральную часть жирового тела личинки. После проведённых процедур животных возвращали в условия акклимации. Через сутки после инъекции и экспозиции под флуоресцентным микроскопом личинок быстро вынимали из домиков и фиксировали в жидком азоте.
Биохимические анализы
Зафиксированных в жидком азоте ручейников гомогенизировали полипропиленовым пестиком в фосфатносолевом буфере. Затем образцы центрифугировали при 10000 g 10 мин. Полученный супернатант использовали для определения активности ферментов. Активность СОД измеряли по методике (Beauchamp & Fridovich, 1971), активность НЭ — по методике (Serebrov et al. , 2006), активность ГСТ — по методике (Habig et al. , 1974) с модификациями (Timofeyev, 2010). Концентрацию общего белка определяли по методике Брэдфорд.
Активность СОД и НЭ измерена для 10 биологических повторностей в рамках каждой экспериментальной группы, активность ГСТ — для 4-12 биологических повторностей. Измерения проведены в трёх технических повторах для всех ферментов. Данные были проверены на соответствие нормальному распределению тестом Шапиро-Уилка, после чего логарифмированы для нормализации. Статистическую значимость различий оценивали однофакторным дисперсионным анализом. Статистический анализ проведён в пакете R (R Core Team, 2015).
RESULTS AND DISCUSSION
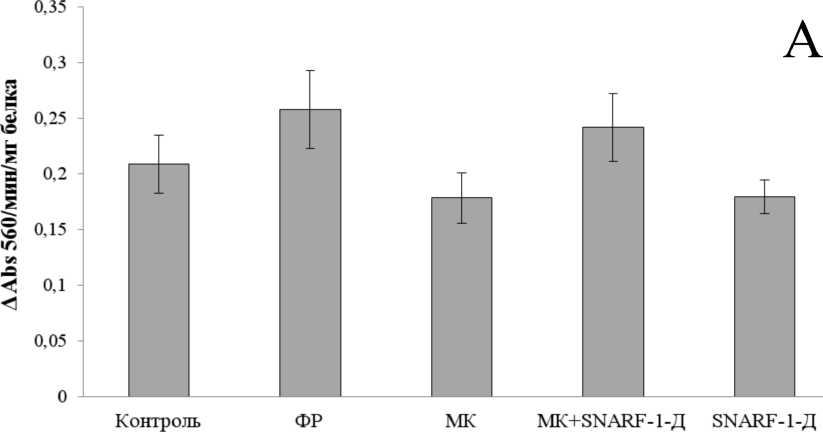
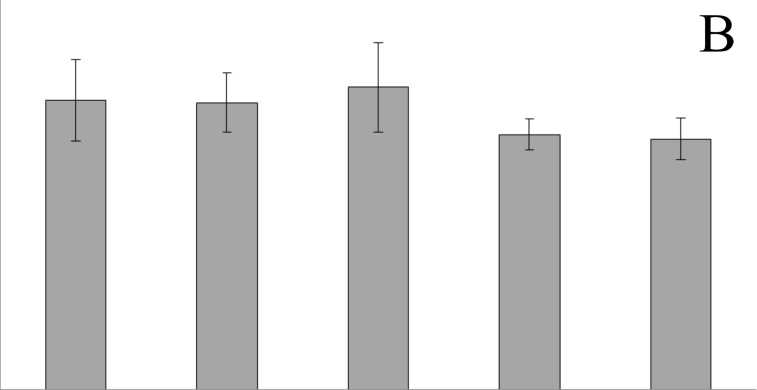
Полученные результаты приведены на Рис. 1. Как следует из представленных материалов и проведённого статистического анализа, для всех трёх ферментов не отмечено наличия статистически значимых отличий между выборками (P-значения равны соответственно 0,16, 0,9 и 0,37 для СОД, НЭ и ГСТ). В то же время, из ранее проведённых исследований на личинках ручейников известно, что экспонирование в присутствии различных токсикантов должно вызывать значительную реакцию антиоксидантной и детоксицирующей систем, в первую очередь СОД, ГСТ и экстераз (Xie et al., 2009; Berra et al., 2006). Таким образом, полученный в данной работе результат может свидетельствовать о том, что микрокапсулы (в том числе содержащие флуоресцентный краситель) нетоксичны, и их инъекции не вызывают развития стресс-реакции антиоксидантной и детоксицирующей систем у личинок ручейников B. thamastoides.
Следует отметить, что отсутствие токсичности микрокапсул может иметь и кратковременный характер, поскольку остается небольшая доля вероятности того, что ответ защитных систем может развиваться в другие временные точки после инъекции. Однако, в таком случае, воздействие непосредственно инъекции должно быть нивелировано через сутки содержания в условиях акклимации, в то время как ответ защитных систем на введённые в ткани микрокапсулы мог ещё не успеть развиться.
од
0,09
g 0,06 = I 0,05 ® 0,04 -
В 0,03 < 0,02 -0,01 0
Контроль ФР MK MK+SNARF-1-Д SNARF-1-Д
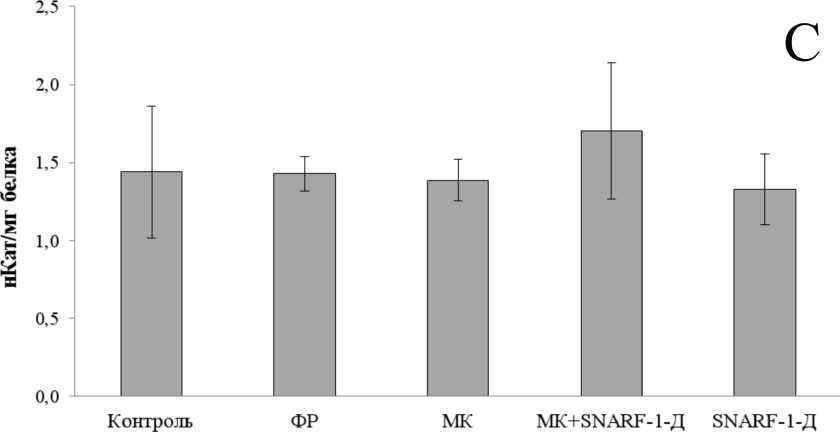
Figure 1. Активность СОД (A), НЭ (B) и ГСТ (C) в гомогенате тела личинки ручейников
B. thamastoides в контрольной группе и через сутки после инъекции физиологического раствора (ФР), пустых микрокапсул (МК), микрокапсул с содержанием SNARF-1 (МК+SNARF-1-Д) и раствора меченого SNARF-1 декстрана (SNARF-1-Д).
CONCLUSIONS
Таким образом, предварительные результаты наших исследований свидетельствуют в пользу нетоксичности и отсутствия выраженного стресс-ответа антиоксидантной и детоксицирующей систем у личинок B. thamastoides как на инъекции микрокапсул и экспонирование под флуоресцентным микроскопом, так и на инъекции инкапсулированного pH-сенсора SNARF-1. Возможность отложенных хронических эффектов на организм при применении инкапсулированных сенсоров, требует дальнейшего изучения, включающего большее количество временных точек и оцениваемых параметров стресс-реакции.
ACKNOWLEDGMENT
Коллектив авторов благодарит Адельшина Р.В. за помощь в отлове личинок ручейников, а также Рожкову Н.А., Мартемьянова В.В. и Меглинского И.В. за ценные рекомендации при проведении данной работы. Работа проведена при финансовой поддержке гранта РНФ (№ 15-14-10008).
Список литературы Инъекции инкапсулированного ph-сенсора SNARF-1 не вызывают явной реакции стресса у личинок эндемичных байкальских caddisflies Baicalina thamastoides
- Bajkalovedenie (Baicalogy) (2012) Nauka, Novosibirsk. 1114 p.
- Beauchamp C. & Fridovich I. (1971) Superoxide Dismutase: Improved Assays and an Assay Applicable to Acrylamide Gels. Analytical Biochemistry, 44(1), 276-287
- Berra E., Forcella M., Giacchini R., Rossaro B. & Parenti P. (2006) Biomarkers in Caddisfly Larvae of the Species Hydropsyche Pellucidula (Curtis, 1834) (Trichoptera: Hydropsychidae) Measured in Natural Populations and after Short Term Exposure to Fenitrothion. Bulletin of environmental contamination and toxicology, 76(5), 863-70
- Habig W.H., Pabst M.J. & Jakoby W.B. (1974) Glutathione S-Transferases. The First Enzymatic Step in Mercapturic Acid Formation. J. Biol. Chem., 249(22), 7130-7139
- Hodkinson I.D. & Jackson J.K. (2005) Terrestrial and Aquatic Invertebrates as Bioindicators for Environmental Monitoring, with Particular Reference to Mountain Ecosystems. Environmental management, 35(5), 649-66
- Johnson I. & Spence M.T.Z. (2011) Molecular Probes Handbook, A Guide to Fluorescent Probes and Labeling Technologies. Life Technologies (Invitrogen), NY, USA
- Lepneva S. G. (1964) Fauna of USSR. Caddisflies. Publishing House of Academy of Sciences, Moscow-Leningrad, USSR
- Martens K. (1997) Speciation in Ancient Lakes. Trends in Ecology & Evolution, 12(5), 177-182
- Moore M.V., Hampton S.E., Izmest’eva L.R., Silow E.A., Peshkova E.V. & Pavlov B.K. (2009) Climate Change and the World’s ‘Sacred Sea’-Lake Baikal, Siberia. BioScience, 59(5), 405-417
- R Core Team. (2015). R: A Language and Environment for Statistical Computing (http://www.r-project.org)
- Sadovoy A., Teh C., Korzh V., Escobar M. & Meglinski I. (2012) Microencapsulated Bio-Markers for Assessment of Stress Conditions in Aquatic Organisms in Vivo. Laser Physics Letters, 9(7), 542
- Serebrov V.V., Gerber O.N., Malyarchuk A.A., Martemyanov V.V., Alekseev A.A. & Glupov V.V. (2006) Effect of Entomopathogenic Fungi on Detoxification Enzyme Activity in Greater Wax Moth Galleria Mellonella L. (Lepidoptera, Pyralidae) and Role of Detoxification Enzymes in Development of Insect Resistance to Entomopathogenic Fungi. Biology Bulletin, 33(6), 581-586
- Timofeyev M.A. (2010) Ecological and Physiological Aspects of Adaptation to Abiotic Environmental Conditions of Endemic Baikalian and Palearctic Amphipods. Thesis for Dr. Sci. degree. Tomsk, 384.
- Timoshkin O.A. (2004) Index of Animal Species Inhabiting Lake Baikal and Its Catchment Area. Nauka, Novosibirsk.
- Timoshkin O.A., Bondarenko N.A., Volkova Y A., Tomberg I.V., Vishnyakov V.S. & Malnik V V. (2015) Mass Development of Green Filamentous Algae of the Genera Spirogyra and Stigeoclonium (Chlorophyta) in the Littoral Zone of the Southern Part of Lake Baikal. Hydrobiological Journal, 51(1), 13-23
- Venn A.A., Tambutté E., Lotto S., Zoccola D., Allemand D. & Tambutté S. (2009) Imaging Intracellular pH in a Reef Coral and Symbiotic Anemone. Proceedings of the National Academy of Sciences of the United States of America, 106(39), 16574-9
- Xie L., Flippin J.L., Deighton N., Funk D.H., Dickey D.A. & Buchwalter D.B. (2009) Mercury(II) Bioaccumulation and Antioxidant Physiology in Four Aquatic Insects. Environmental Science & Technology, 43(3), 934-940


