Инфаркт миокарда правого желудочка у больной с хронической тромбоэмболической легочной гипертензией при малоизменённых коронарных артериях
Автор: Архипова Ольга Александровна, Кузнецова Эльвира Газинуровна, Мартынюк Тамила Витальевна, Чазова Ирина Евгеньевна
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Клинический случай
Статья в выпуске: 1, 2018 года.
Бесплатный доступ
Чаще всего острый инфаркт миокарда правого желудочка диагностируется у пациентов с острым поражением левого желудочка и ассоциирован с атеросклеротическим процессом в коронарном русле. Изолированный острый инфаркт миокарда правого желудочка диагностируется достаточно редко и нередко выявляется лишь при проведении аутопсии. Ранее считалось, что при отсутствии значимого коронарного поражения, острый инфаркт миокарда правого желудочка ассоциирован с гипертрофией миокарда правого желудочка. Позднее появились результаты исследования, в котором острый инфаркт миокарда правого желудочка был обнаружен у пациентов, умерших вследствие острой массивной тромбоэмболии легочной артерии и не имеющих гипертрофии правого желудочка. Остается много вопросов относительно тактики терапии этого осложнения, особенно у пациентов с легочной гипертензией, находящихся на терапии легочными артериальными вазодилататорами. В статье описан редкий клинический случай посмертного выявления инфаркта миокарда правого желудочка на фоне малоизмененных коронарных артерий у пациентки 41 года с диагнозом хроническая тромбоэмболическая легочная гипертензия, обсуждаются трудности прижизненной диагностики и ограничения лекарственной терапии.
Острый инфаркт миокарда правого желудочка, ишемия миокарда при отсутствии коронарного атеросклероза, хроническая тромбоэмболическая легочная гипертензия
Короткий адрес: https://sciup.org/143165144
IDR: 143165144
Текст научной статьи Инфаркт миокарда правого желудочка у больной с хронической тромбоэмболической легочной гипертензией при малоизменённых коронарных артериях
Острый инфаркт миокарда (ОИМ) правого желудочка (ПЖ) обычно ассоциирован с наличием коронарного атеросклероза и практически всегда сопровождает ОИМ левого желудочка (ЛЖ) сердца. Вовлечение ПЖ зависит от локализации ОИМ: при поражении нижней стенки регистрируется в 24-50% случаев; в редких случаях он развивается при поражении передней стенки ЛЖ [1]. Относительно небольшая частота ОИМ ПЖ может быть объяснена несколькими факторами: более низ- кие потребление кислорода из-за меньшей мышечной массы и рабочей нагрузки; большая скорость кровотока во время диастолы и систолы; более обширная коллатеральная сеть, в том числе от левой коронарной артерии; диффузия кислорода из внутриполостной крови через тонкую стенку ПЖ и через мельчайшие вены, идущие от эндокарда непосредственно к коронарным артериям крупного и среднего порядка [1].
В редких случаях изолированный ОИМ ПЖ описан у паци- ентов с острой тромбоэмболией легочной артерии и диагностируется, как правило, посмертно [2]. Клинический случай пациентки Ж. 41 года, наблюдавшейся в ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России в течение 11 месяцев на фоне хронической тромбоэмболической легочной гипертензии вследствие рецидивирующих тромбоэмболий в систему позволит проанализировать это редкое осложнение.
Впервые пациентка поступила в клинику с жалобами на одышку при минимальной физической нагрузке (ходьба на расстояние 10 метров) и разговоре, боль колющего характера в левой половине грудной клетки, возникающую без связи с физической нагрузкой, проходящую при изменении положения тела или после приема валокардина в течение 5-10 минут, учащенное сердцебиение и периодически возникающие отеки нижних конечностей.
Из анамнеза известно, что впервые появление одышки пациентка стала отмечать летом 2012 года при ходьбе по лестнице, когда при подъеме была вынуждена останавливаться на 3-ем этаже. Тогда одышка была незначительной, за медицинской помощью не обращалась. Резкое ухудшение состояния отметила в июне 2013 года, когда спустя 2 дня после перенесенной кишечной инфекции появилась одышка при небольшой физической нагрузке, обычной ходьбе на расстояние около 50 метров, а также отеки на ногах. Впервые обратилась к врачу 16 декабря 2013 г., когда после перенесенной ОРВИ появились массивные отеки нижних конечностей, одышка стала беспокоить в покое. 25 декабря 2013 года была госпитализирована по месту жительства. По данным проведенного обследования отмечалось повышение уровня Д-димера до 1,8 мкг/мл (норма <0,5); электрокардиография (ЭКГ) – отклонение электрической оси вправо, выраженная гипертрофия и перегрузка правых отделов сердца, неполная блокада правой ножки пучка Гиса; эхокардиография (ЭхоКГ) – расширены правые отделы сердца, систолическое давление в легочной артерии (СДЛА) – 120 мм рт. ст., недостаточность трикуспидального клапана 3-4 степени; мультиспиральная компьютерная томография легких (МСКТ) – пристеночные тромботические массы в проекции ствола, левой и правой легочных артерий. Был выставлен диагноз: рецидивирующая тромбоэмболия легочной артерии, посттромбоэмболическая легочная гипертензия тяжелой степени. Проводилась тромболитическая терапия актилизе 100 мг, антикоагулянтная терапия (эноксапарин, варфарин), диуретическая терапия, на фоне которой состояние пациентки стабилизировалось. Повторно, спустя 15 дней после проведенного лечения, вновь проводилась ангиопульмоногра-фия, отмечалась положительная динамика: дефекты контрастирования в стволе легочной артерии, левой ЛА не визуализировались. Объем тромботических масс в правой легочной артерии существенно уменьшился. После выписки, на фоне соблюдения режима и приема медикаментозной терапии постепенно нарастала одышка, снизилась толерантность к физической нагрузке.
В августе 2012 года, пациентка впервые перенесла синко-пальное состояние. Всего с 2012 по 2014 гг. отмечалось 6 эпизодов синкопе, в связи с чем было выполнена МРТ головного мозга, патологии не обнаружено.
С февраля 2014 г. после повторной госпитализации по месту жительства получала варфарин 2,5 мг без достижения целевого уровня МНО, бисопролол 2,5 мг, торасемид 2,5 мг, спиронолактон 25 мг в сутки.
В ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России пациентка поступила в тяжелом состоянии. Сознание ясное. Обращал на себя бледный цвет кожных покровов, наличие румянца на щеках и акроцианоз. Слизистые оболочки обычной окраски, влажности. Зев не гипе-ремирован. Подкожно-жировой слой развит умеренно. Индекс массы тела 28 кг/м2. Грубых нарушений со стороны 12-пар черепно-мозговых нервов не выявлено. Лимфоузлы не увеличены. Костно-суставная и мышечная системы, молочные железы, щитовидная железа без особенностей. Отмечалась пастозность голеней. ЧДД 20 в мин. Обе половины грудной клетки участвовали в акте дыхания равномерно. Перкуторный звук над легочными полями с коробочным оттенком, при аускультации легких – дыхание проводилось во все отделы с жестким оттенком, хрипов нет. При аускультации сердца тоны приглушены, выслушивался акцент II тона над легочной артерией, нежный систолический шум над проекцией трикуспидального клапана. Шумы над магистральными артериями не выслушивались. Ритм сердца правильный, ЧСС 80 в минуту, АД на правой руке 90/60 мм рт. ст., на левой 95/70 мм рт. ст. Пульсация периферических сосудов хорошая, состояние вен удовлетворительное. Живот при пальпации мягкий, безболезненный во всех отделах, печень у края реберной дуги, селезенка не увеличена. Почки не пальпируются, симптом "поколачивания" отрицательный с обеих сторон, дизурии нет.
При регистрация ЭКГ была выявлена синусовая тахикардия с ЧСС 105 уд. в минуту, отклонение электрической оси сердца вправо, изменение предсердного компонента по типу р-pulmonale, признаки изменения миокарда вследствие гипертрофии правого желудочка, нарушение внутрижелудочковой проводимости (рис. 1).
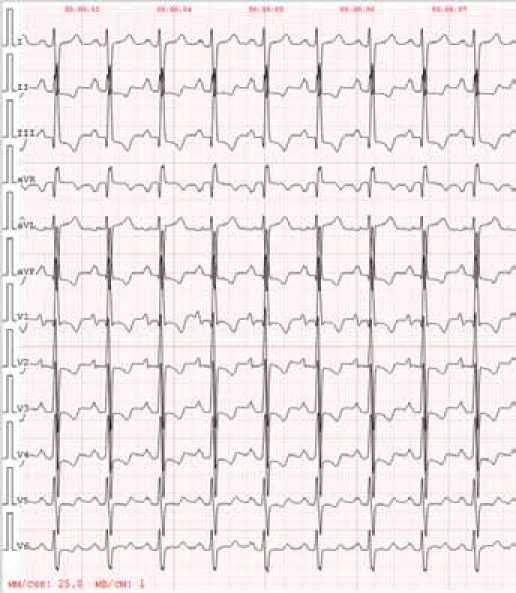
Рисунок 1. Электрокардиография пациентки Ж.
во время первой госпитализации
Суточное мониторирование ЭКГ по Холтеру: основной ритм синусовый, средняя ЧСС – 80 уд/мин., максимальная – 154 уд/мин., минимальная – 54 уд/мин. Ишемической динамики сегмента ST не выявлено, зарегистрировано 3 желудочковых экстасистолы, суправентрикулярных экстрасистол и пауз не выявлено.
Результаты эхокардиографии представлены в таблице 1. Обращает на себя внимание дилатация правых отделов серд- ца с признаками перегрузки правого желудочка давлением, гипертрофия миокарда ПЖ, дилатация легочной артерий и её ветвей, высокая лёгочная гипертензия, относительная недостаточность трикуспидального клапана II степени, клапана легочной артерии I-II степени, расширение нижней полой вены, признаки коллабирования левого желудочка за счет сдавления его расширенным правым желудочком.
Таблица 1. Результаты ЭхоКГ пациентки Ж. в динамике
|
Норма |
Первая госпитализация |
Повторная госпитализация |
|
|
Аорта, см |
2,9-4,5 |
3,4 |
3,0 |
|
ЛП, см |
2,0-4,0 |
3,1 |
3,6 |
|
КДР ЛЖ, см |
4,0-5,5 |
3,8 |
2,6 |
|
ТМЖП, см |
0,7-1,1 |
1,0 |
1,0 |
|
ТЗСЛЖ, см |
0,7-1,1 |
1,0 |
1,0 |
|
S ПП, см2 |
<18 |
32 |
32 |
|
ПЗР ПЖ, см |
≤ 2,9 |
4,3 |
4,8 |
|
ТПС ПЖ, см |
≤ 0,5 |
0,9 |
1,1 |
|
СДЛА, мм рт. ст. |
<30 |
105 |
105 |
|
ТР, степень |
0-I |
II |
III |
|
ЛР, степень |
0-I |
I-II |
I-II |
|
Ствол ЛА, см |
≤ 2,6 |
4,1 |
4,8 |
|
ПЛА / ЛЛА, см |
≤ 1,5 |
3,5 / 3,0 |
4,3 / 3,0 |
|
НПВ, см |
≤ 2,2 |
2,4 / 1,0 на вдохе |
2,6 / 1,6 на вдохе |
По данным рентгенографии органов грудной клетки, очаговых и инфильтративных изменений не выявлено, легочный рисунок диффузно обеднен за счет сосудистого компонента, визуализируются расширенные сегментарные и субсегментарные артерии высокой интенсивности. Сердце в поперечнике расширено, по левому контуру выступает ствол легочной артерии. Визуализируются количественные признаки легочной артериальной гипертензии (ЛАГ) (табл. 2). Плевральные синусы свободны.
Таблица 2. Количественные признаки легочной гипертензии по данным рентгенографии органов грудной клетки у больной Ж. в динамике
|
Показатели |
Норма |
Май 2014 г. |
Февраль 2015 г. |
|
Правый корень, мм |
≤ 15 |
18 |
18 |
|
Левый корень, мм |
- |
40 |
44 |
|
Коэф. Мура, % |
≤ 30 |
38 |
40 |
|
Коэф. Люти, % |
≤ 33 |
39 |
39 |
|
КТИ, % |
≤ 50 |
55 |
58 |
При проведении совмещенной однофотонной эмиссионной компьютерной томографии и компьютерной томографии (ОЭКТ/КТ-томография) легких с внутривенным введением радиофармпрепарата 99mTc-МАА регистрируется участок неоднородного снижения накопления РФП в области S4 средней доли правого легкого с достаточно четким контуром. По остальным отделам легких распределение РФП равномерное. При оценке КТ-исследования очаговых и инфильтративных изменений легочной ткани не определяется. КТИ >50%. Жидкости в плевральных полостях не выявлено. Сцинтиграфическая картина может соответствовать перенесенной эмболии в бассейне правой ветви легочной артерии.
Больной была выполнена мультиспиральная компьютерная томография с контрастным усилением (МСКТ-ангипульмонография): определялось расширение ствола ЛА до 4,2 см, правая легочная артерия (ПЛА) – 3,6 см, левая легочная артерия (ЛЛА) – 3,4 см. По нижнему контуру ПЛА визуализировался тромб толщиной до 1,2 см, стенозириру-ющий просвет артерии до 35%, дистальнее до уровня субсегментарных ветвей дефектов наполнения не выявлено. Ствол ЛА и ЛЛА до уровня субсегментарных ветвей контрастировались без стенотических изменений. Правые отделы сердца выраженно расширены. В легких без свежих очаговых и инфильтративных изменений. Легочный рисунок диффузно усилен. Фиброзные изменения средней доли правого легкого. Просветы трахеи и крупных бронхов свободны. Корни легких структурны. Увеличение подмышечных, внутригрудных лимфоузлов не определяется. Костной деструкции на исследованном уровне не обнаружено. Заключение: тромб по нижней стенке ПЛА. Признаки легочной гипертензии.
При проведении катетеризации правых отделов сердца СДЛА 121 мм рт. ст., среднее – 69 мм рт. ст., среднее давление в правом предсердии 3 мм рт. ст., давление заклинивания легочной артерии 6 мм рт. ст., сатурация капиллярной крови 94%, сатурация крови из легочной артерии 50%, сердечный индекс 1,3 л/мин х м2, легочное сосудистое сопротивление (ЛСС) 2260 дин х сек/см5; острая фармакологическая проба положительная (снижение среднего давления ЛА с 69 до 32 мм рт. ст., сердечный выброс увеличился с 2,3 до 3,4 л/мин.). При проведении селективной ангиопульмонографии выявлено расширение ствола и основных ветвей легочной артерии, значимых нарушений перфузии не регистрировалось.
По данным ультразвукового исследования размеры печени в пределах нормальных значений, контуры ее четкие, ровные, эхогенность умеренно повышена, структура диффузно однородная, мелкозернистая, сосудистый рисунок без особенностей. Дополнительные структуры в паренхиме не выявлены. Воротная вена не расширена, нижняя полая вена – на верхней границе нормы (23 мм при норме до 22 мм), печеночные вены не расширены. Внепеченочные желчные протоки, холедох не расширены. Дополнительные структуры в просвете не определяются. Желчный пузырь с перегибом в шейке, нормальных размеров, стенки не утолщены, умеренно уплотнены, содержимое полости однородное. УЗДГ вен нижних конечностей – тромботических масс не выявлено.
По данным компьютерной спирометрии жизненная емкость легких и показатели проходимости дыхательных путей в пределах возрастной нормы (ЖЕЛ > 0%, ОФВ1 >70%).
В анализах крови обращало на себя внимание небольшое повышение уровня общего билирубина до 41,3 мкМоль/л (норма 3-29 мкМоль/л), мочевой кислоты до 619 мкМоль/л (норма 142,8-339,2 мкМоль/л), С-реактивного белка до 1,06 мг/дл (норма до 0,5 мг/дл), гемоглобина до 16,2 г/дл (12-16 г/ дл), Д-димера до 2,58 мкг/мл (норма до 0,5 мкг/мл). Уровень МНО при поступлении 1,49, что свидетельствует о проведении недостаточной антикоагуляционной терапии. При проведении генетического анализа крови на выявление наследственных тромбофилий был выявлен гетерозиготный полиморфизм в гене ингибитора/активатора плазминогена 1 типа.
На основании проведенного обследования был подтвержден диагноз: хроническая тромбоэмболическая легочная гипертензия. Функциональный класс III-IV (ВОЗ). Рецидивирующие тромбоэмболии в систему легочной артерии. Легочное сердце:
недостаточность трикуспидального клапана II степени, легочного клапана I-II степени. Хроническая сердечная недостаточность II А стадии. Хронический геморрой. Хронический аднексит.
Проводилась терапия эноксапарином 160 мг, торасемидом 5-7,5 мг, спиронолактоном 50 мг в сутки. Бисопролол был заменен на дилтиазем с титрацией дозы до 180 мг в сутки, начата патогенетическая терапия силденафилом 60 мг в сутки с хорошей переносимостью.
Повторно пациентка поступила в стационар через 11 месяцев после первой госпитализации. При расспросе выяснилось, что вскоре после выписки она снизила дозу силденафила до 12,5 мг в сутки в связи со сложностями лекарственного обеспечения и появлением стойкой гипотонии (систолическое АД 80-90 мм рт. ст.). С момента выписки у пациентки были три эпизода ухудшения состояния, которые сопровождались усилением одышки и появлением отеков, однако за медицинской помощью она не обращалась.
При поступлении предъявляла жалобы на одышку в покое и при минимальной физической (ходьба на расстояние 10 метров), интенсивные боли колющего характера в левой половине грудной клетки с иррадиацией в левую руку, возникающие без связи с физической нагрузкой, проходящие при изменении положении тела или после приема валокардина в течение 5-10 минут, эпизоды учащенного сердцебиения, купирующиеся самостоятельно, периодические отеки нижних конечностей.
Объективно состояние тяжелое, кожные покровы бледные, выраженный румянец на щеках, отмечается пастозность голеней. При аускультации легких дыхание проводилось во все отделы, с жестким оттенком, хрипы не выслушивались, ЧДД 20 в минуту. Перкуторно относительная граница сердца расширена вправо. При аускультации тоны сердца ритмичные, выслушивался акцент II тона над проекцией легочной артерии, систолический шум над проекцией трикуспидального клапана и диастолический шум вдоль левого края грудины. ЧСС 80 в минуту, АД 80/60 мм рт. ст. Живот при пальпации был мягкий, безболезненный. Печень выступала на 3 см из-под края ребер-
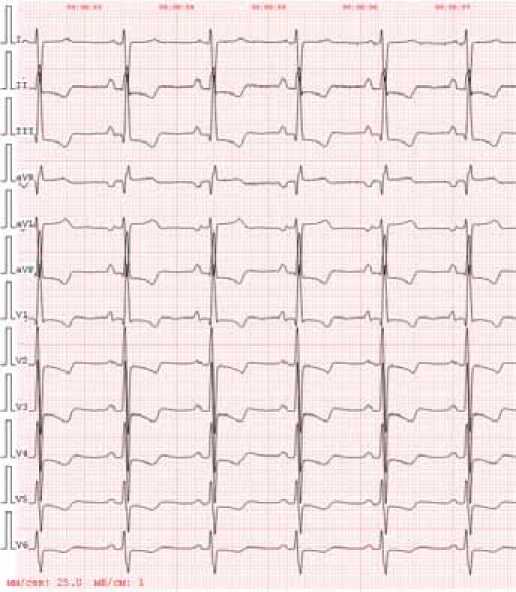
Рисунок 2. Электрокардиография пациентки Ж. во время повторной госпитализации ной дуги, слегка болезненная при пальпации. Со стороны мочевыделительной, нервной систем – без особенностей.
По данным электрокардиографии при поступлении ритм синусовый с ЧСС 65 в мин., отклонение электрической оси сердца вправо, изменение предсердного компонента по типу p-pulmonale, признаки гипертрофии миокарда правого желудочка. При сравнении с данными ЭКГ в динамике без существенных изменений (рис. 2). Во время госпитализации ЭКГ снималась повторно на фоне болей в грудной клетке, однако конфигурация комплекса оставалась без изменения.
По данным рентгенографии органов грудной клетки очаговых и инфильтративных изменений не выявляется, легочный рисунок обеднен диффузно слева и на периферии справа за счет сосудистого компонента, в проекции левого корня определяются расширенные и "обрубленные" сегментарные артерии. В динамике отмечается увеличение размера левого корня, коэф. Мура и кардио-торакальный индекс (табл. 2).
При проведении ЭхоКГ в динамике выявлено увеличение полости и толщины передней стенки ПЖ, ствола легочной артерии и ее правой ветви, уменьшение КДР ЛЖ (табл. 1). По данным УЗИ признаки правожелудочковой сердечной недостаточности в виде увеличения и застойных явлений в печени, расширения НПВ, печеночных вен.
Пациентке было выполнена МСКТ грудной клетки с контрастным усилением: определяется расширение ствола ЛА до 5,3 см, ПЛА 4,4 см, ЛЛА 3,9 см. По нижнему контуру ПЛА определяется тромб толщиной до 1,2 см, стенозирующий до 35% просвет артерии, тромб распространяется на устье среднедолевой ветви, обтурируя просвет на всем протяжении. Ствол ЛА и ЛЛА до уровня субсегментарных ветвей конра-стистируются без стенотических изменений. Правые отделы сердца выраженно дилатированы. В легких рисунок диффузно усилен, определяется "мозаичная" перфузия легких. Фиброзные изменения средней доли правого легкого. Просвет трахеи и крупных бронхов свободны. Корни легких структурны. Увеличенных подмышечных, внутригрудных лимфоузлов не определяется.
Таким образом, пациентка поступила в отделение повторно в крайне тяжелом состоянии, обусловленным наличием высокой легочной гипертензии вследствие рецидивирующей ТЭЛА, а также декомпенсацией хронической сердечной недостаточности. Учитывая стойкую гипотонию, была проведена коррекция подобранной ранее терапии: дилтиазем заменен на ивабрадин 15 мг/сут., варфарин на эноксапирин 140 мг / сут.; учитывая стойкую гипотонию силденафил был назначен в дозе 15 мг в сутки, предполагалась титрация дозы под контролем АД. Наличие сердечной недостаточности, необходимость назначения парентеральных петлевых диуретиков потребовали провести установку центрального катетера с целью проведения инфузии прессорных аминов, на фоне которой отмечалась временная стабилизация АД на уровне 90-110/6080 мм рт. ст., диурез был положительным (+300-500 мл). К терапии присоединены ингаляции илопроста по 20 мкг/сут.
Учитывая тяжесть состояния, сохраняющуюся стойкую гипотонию, отрицательный диурез, невозможность продолжать терапию силденафилом и илопростом в назначенных дозах пациентка была переведена в БИТ, установлен центральный катетер, начата инфузия добутамина со скоростью 10 мкг/кг/мин., на фоне которой наблюдалось относительное повышение АД до 95-105/62-70 мм рт. ст. На прикроватном мониторе регистрировался синусовый ритм с признаками перегрузки правых
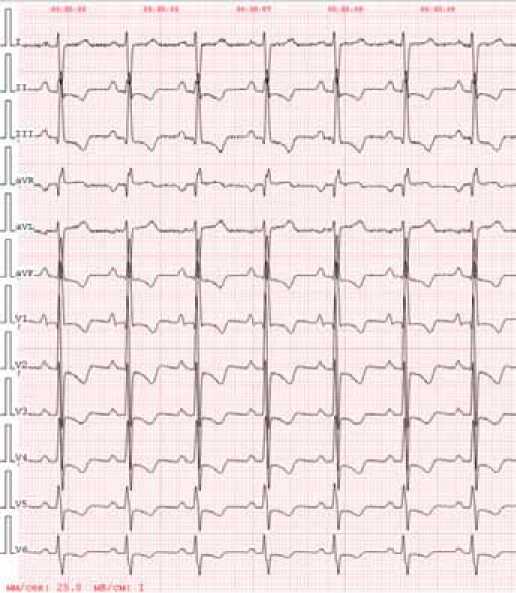
Рисунок 3. Электрокардиография пациентки Ж. во время повторной госпитализации во время болевого синдрома отделов сердца (рис. 3). В дальнейшем отмечалась тенденция к гипотонии 80-85/64 мм рт. ст., в связи с чем скорость добута-мина увеличена до 15 мкг/кг/мин. За весь период наблюдения в БИТ сохранялась анурия. Из-за появления рвоты, нарастание кашля, одышки ингаляции илопроста были прекращены. На фоне проводимой терапии, включающей инфузию добутамина спустя 7 часов больная внезапно потеряла сознание, захрипела. По монитору – урежение гемодинамически неэффективного синусового ритма до 30 уд/мин и ниже, начаты реанимационные мероприятия: непрямой массаж сердца, ИВЛ мешком Амбу, внутривенное введение атропина, адреналина, проведена интубация трахеи, налажена аппаратная ИВЛ, внутривенная инфузия адреналина с возрастающей скоростью. При проведении экстренной ЭхоКГ – отсутствие механической систолы желудочков – электромеханическая диссоциация. Несмотря на проводимые реанимационные мероприятия в течение 50 минут восстановить сердечную и дыхательную деятельность не удалось, констатирована биологическая смерть.
На вскрытии был обнаружен хронический тромбоэмболический синдром, проявивший себя тромбоэмболией сегментарной ветви легочной артерии правого легкого, геморрагическим инфарктом средней доли правого легкого, ателектазом нижней доли правого легкого, хроническим легочным сердцем. Помимо этого, в области верхушки правого желудочка был выявлен бледно-коричневый малокровный участок неправильной формы, размерами 4,0х2,5х2,0см. При гистологическом исследовании – очаг некроза в области верхушки правого желудочка давностью около суток. Коронарные артерии сердца извитые, зияют, стенки местами утолщены за счет плотных бело-желтых бляшек. Гемодинамически значимого атеросклеротического поражения коронарных артерий не выявлено. Непосредственной причиной смерти явилась острая легочно-сердечная недостаточность.
Таким образом, у пациентки с рецидивирующей тромбоэмболией, высокой легочной гипертензией по данным аутопсии выявлен острый инфаркт миокарда на фоне малоизменных коронарных артерий, клинические проявления которого были малохарактерными для этого заболевания. Предъявляемые пациенткой жалобы на боли в области сердца были нетипичными для острого коронарного синдрома, возникали без связи с физической нагрузкой, купировались после приема седативных препаратов. ЭКГ изначально имела изменения в виде выраженной гипертрофии и перегрузки правого желудочка и в динамике не демонстрировала изменения, характерные для ОИМ.
Изолированный инфаркт миокарда правого желудочка встречается крайне редко, в 1,9-4,2% случаев как находка при проведении аутопсии [2]. Наиболее же частой причиной является атеросклеротическое поражение (30-50% всех случаев) правой коронарной артерии, реже – огибающей артерии [3].
Ранее считалось, что при отсутствии значимого коронарного поражения, ОИМ ПЖ ассоциирован с гипертрофией миокарда ПЖ [4]. Позднее появились результаты исследования, в котором ОИМ ПЖ был обнаружен у 6 пациентов, умерших вследствие острой массивной тромбоэмболии легочной артерии и не имеющих гипертрофии ПЖ, при этом у 5 пациентов имелось значимое стенозирующее поражения коронарного русла [5]. Вместе с тем, описано несколько случаев выявления ОИМ ПЖ у пациентов с острой ТЭЛА, не имеющих гипертрофии миокарда ПЖ и гемодинамически незначимые поражения коронарного русла (имелись стенозы коронарных артерий <50%) [2]. Также случаи развития ОИМ ПЖ описаны у новорожденных и младенцев при наличии перинатальной асфиксии, миокардита, легочной дисплазии и легочной артериальной гипертензии новорожденных [6].
Таким образом, у пациентов с легочной гипертензией, в особенности с ХТЭЛГ, в случае развития резкого ухудшения состояния при наличии болевого синдрома и нестабильной гемодинамикой следует исключать ОИМ ПЖ. Дифференциальный диагноз также необходимо проводить с рецидивом тромбоэмболии в систему легочной артерии, диссекцией легочной артерии, компрессией ствола левой коронарной артерии.
Причины развития острой ишемии ПЖ на фоне отсутствия значимого атеросклеротического поражения коронарного русла в настоящее время не достаточно изучены. Ранее нами было показано наличие признаков ишемии миокарда у больных легочной артериальной гипертензией по данным синхронизированной однофотонной эмиссионной компьютерной томографии миокарда с 99Тс-МИБИ в покое и в сочетании с нагрузочными пробами [7]. Вероятно, в условиях, когда ПЖ работает против высокого легочного сосудистого сопротивления иногда достаточно незначительного уменьшения суммарного просвета легочного русла (например, эмболия одного сегмента легкого), дополнительного прироста ЛСС для развития острой ишемии миокарда даже без значимого атеросклеротического поражения за счет возрастания потребности в кислороде [8]. Гипертрофию ПЖ следует рассматривать в качестве предрасполагающего фактора в этой ситуации. В отношении схожего механизма развития ишемии ЛЖ в 2013 г. Европейским обществом по лечению стабильной стенокардии предложен термин «микроваскулярная стенокардия» [9].
Диагностика ОИМ ПЖ у больных с ЛГ значительно затруднена. Клиническими признаками являются болевой синдром в грудной клетке, артериальная гипотензия, вздутие вен шеи, симптом Куссмауля (увеличение давления в венах шеи и их расширение на вдохе), при этом характерно отсутствие физикальных и рентгенологических признаков застоя в малом круге кровообращения [3]. Стоит отметить, что подобные клини- ческие симптомы присутствуют у большинства больных с ЛГ в клинически развернутой стадии заболевания.
Всем пациентам с подозрением на ОИМ ПЖ необходимо выполнять регистрацию ЭКГ в отведении V1 и, особенно, V3R и V4R (элевация ST ≥ 1 мм) [10], хотя в условиях исходно измененной ЭКГ с признаками гипертрофии и перегрузки правых отделов сердца это может быть малоиформативно. Дополнительное проведение ЭхоКГ также может быть не информативно: характерные для инфаркта миокарда правого желудочка признаки, такие как расширение полости ПЖ, повышение давления в правом предсердии (до 10 мм рт. ст. и более) и трикуспидальная регургитация выявляются у всех пациентов с легочной гипертензией. Поражение миокарда ПЖ может быть подтверждено радионуклидным исследованием (накопление Тс-пирофосфата в очаге поражения или отсутствие микроциркуляции в соответствующей области) или с помощью МРТ с контрастированием.
Остается много вопросов относительно тактики терапии. При ОМИ ПЖ рекомендовано увеличение притока крови к правым отделам сердца за счет введения объем замещающих растворов (плазмоэкспандеры) [10]. Однако в условиях высокого ЛСС повышение преднагрузки ПЖ не целесообразно, так как может привести к развитию электромеханической диссоциации. В условиях гипотонии и олигоурии оправдано назначение симпатомиметиков. Более предпочтительно в такой ситуации использование добутамина. Показано, что применение добу-тамина приводит к увеличению сердечного индекса, ударного объема ПЖ [11]. Добутамин также может уменьшить ЛСС, тем самым уменьшая постнагрузку ПЖ, что актуально для больных с ЛГ. Однако добутамин следует применять с осторожность у больных с ОИМ, так как в высоких дозах он может привести к увеличению ЧСС и сократимости миокарда, что ведет к повышению потребности в кислороде и усилению ишемии [12].
При ОИМ ПЖ следует избегать диуретиков и, особенно, периферических вазодилататоров. Однако у больных с ЛГ часто имеются проявления сердечной недостаточности, требующие применения петлевых диуретиков, а современные ЛАГ-специфические препараты являются вазодилататорами и их отмена сопряжена с риском возрастания ЛСС.
Таким образом, данный клинический случай и анализ литературных данных демонстрирует, что у пациентов с ХТЭЛГ резкое ухудшение состояния может быть обусловлено развитием острого инфаркта миокарда правого желудочка. Механизмы этого осложнения до последнего времени недостаточно изучены, заболевание диагностируется в основном посмертно, лечение требует значительной осторожности. Тем не менее, своевременная диагностика значительно повышает шансы на благоприятный исход. Учитывая вышеописанные сложности ведения пациентов с ОИМ ПЖ, целесообразно уделять больше внимания ранней диагностике заболевания, профилактике осложнений ЛГ, тщательному контролю состояния в динамике, своевременной коррекции ЛАГ-специфической терапии.
Список литературы Инфаркт миокарда правого желудочка у больной с хронической тромбоэмболической легочной гипертензией при малоизменённых коронарных артериях
- Ondrus Т., Kanovsky J., Novotny N. et al. Right ventricular myocardial infarction: From pathophysiology to prognosis. Exp Clin Cardiol. 2013; 18(1): 27-30.
- Garcia-Rojo M, Porras L., Ortega J., Carbajo M. Right ventricular acute infarct associated with massive acute arterial pulmonary thrombosis without coronary obliteration. An autopsy study. The Electronic Journal of Autopsy 2003:35-37
- Руда М.Я., Голицын С.П., Грацианский Н.А. и др. Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ. Кардиоваскулярная терапия и профилактика. 2007; 6 (8), Приложение 1:415-500
- Carlson E.B., Reimer KA., Rankin J.S. et al. Right ventricular infarction in patient pulmonary hypertrophy and normal coronary arteries. Clin Cardiol 1985;8:499-502.
- Coma-Canella I., Gamallo C., Martinez Onsurbe P., Lopez-Sendon J. Acute right ventricular infarction secondary to massive pulmonary embolism. Eur Heart J. 1988 May; 9(5):534-40.
- Booth G.R., Thornton K., Jureidini S., Fleming R.E. Subendocardial infarction associated with ventricular hypertrophy in preterm infants with chronic lung disease. Journal of Perinatology (2008); 28:580-583
- Архипова О.А., Мартынюк Т.В., Валеева Э.Г. и соавт. Ишемия миокарда у пациентов с легочной артериальной гипертензией. Системные гипертензии. 2015; 2 (4): 52-56
- Haji Sh.A., Movahed A. Right ventricular infarction -Diagnosis and Treatment. Clin. Cardiol. 2000; 23:473-482
- 2013 ESC guidelines on the management of stable coronary artery disease. The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. http://eurheartj.oxfordjournals.org/content/early/2013/08/28/e urheartj.eht296
- Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ. Клинические рекомендации 2013 г. http://mzdrav.rk.gov.ru/file/mzdrav_18042014_Klinicheskie_rekomendacii_0stryj_ infarkt_miokarda.pdf
- Dell'Italia L.J., Starling M.R., Blumhardt R. et al. Comparative effects of volume loading, dobutamine, and nitroprusside in patients with predominant right ventricular infarction. Circulation 1985; 72:1327-1335
- Инструкция по применению лекарственного препарата добутамин. https://medi.ru/instrukciya/dobutamin_3192


