Инфекции, вызванные Acinetobacter baumannii, у онкологических больных
Автор: Дмитриева Наталья Владимировна, Эйдельштейн Михаил Владимирович, Агинова Виктория Викторовна, Григорьевская Злата Валерьевна, Петухова Ирина Николаевна, Терещенко Инна Васильевна, Багирова Наталья Сергеевна, Дьякова Светлана Андреевна, Калинчук Татьяна Алексеевна, Дмитриева Анна Игоревна, Шек Евгений Александрович, Склеенова Елена Юрьевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.18, 2019 года.
Бесплатный доступ
Цель исследования - оценить частоту выделения мультирезистентных Acinetobacter baumannii у онкологических больных и выявить механизмы резистентности к карбапенемам. Материал и методы. Проанализировано 942 штамма A. baumannii, выделенных из патологических материалов от онкологических больных в 2014-16 гг. Определен уровень резистентности к ампициллину-сульбактаму, пиперациллину-тазобактаму, цефтазидиму, цефепиму, имипенему, меропенему, ципрофлоксацину, амикацину и другим антибиотикам в динамике. Резистентные к карбапенемам (Car-R) штаммы исследовали на наличие карбапенемаз. Результаты. Число штаммов, резистентных к ампициллину-сульбактаму, в период с 2014 по 2016 г. составило 95,5-74,6 % (p
Онкологические больные, карбапенемазы, мультирезистентные микроорганизмы, карбапенемы, антибиотики
Короткий адрес: https://sciup.org/140254259
IDR: 140254259 | УДК: 616-006-06:616.9 | DOI: 10.21294/1814-4861-2019-18-3-26-33
Текст научной статьи Инфекции, вызванные Acinetobacter baumannii, у онкологических больных
Acinetobacter baumannii входит в число шести самых опасных бактериальных патогенов, относящихся к группе ESKAPE, включающей также резистентные Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae, Pseudomonas aeruginosa, Enterococcus faecium [1]. Его роль как возбудителя оппортунистических инфекций неуклонно растет, следовательно, повышается и его клиническая значимость. По многочисленным данным, наиболее негативным свойством Acinetobacter baumannii является множественная ( MDR ) и высокая антибиотикорезистентность [2–6]. Процент карбапенем-резистентных ( СarR) и MDR штаммов, вызывающих внутрибольничные вспышки в самых разных регионах мира, растет в геометрической прогрессии [7–12].
Развитию устойчивости к противомикробным препаратам способствует ненадлежащее использование антибиотиков, а ее распространению – несоблюдение правил асептики и антисептики. По данным ежегодного отчета Центра по контролю и предотвращению заболеваний в Европе (ECDC), более половины изолятов Acinetobacter spp., выделенных в 2016 г., обладали комбинированной устойчивостью к множеству антибиотиков. Наиболее распространенный фенотип резистентности характеризуется устойчивостью к трем важнейшим группам антибактериальных препаратов: фторхи-нолонам, аминогликозидам и карбапенемам. По данным ECDC, отмечается постепенное ухудшение эпидемиологической ситуации в ряде стран Европы [13]. В таких странах, как Италия, Греция, Хорватия, Литва, Латвия, наблюдается эндемическая ситуация по Car-R A. baumannii (рис. 1).
Материал и методы
Была проанализирована таксономическая структура микроорганизмов, выделенных из 24 357 патологических биоматериалов (без учета грибковой микрофлоры) от онкологических больных, проходивших лечение в НМИЦ онкологии им. Н.Н. Блохина МЗ РФ в 2014–16 гг., и 4104 выделенных за 3 года грамотрицательных микроорганизмов, включая A. baumannii . Культивирование микроорганизмов проводилось по стандартным микробиологическим методикам. Все изоляты были идентифицированы до вида колориметрическим методом на анализаторах «Mi-croscan WalkAway – 40 SI» (производитель Siemens Healthcare Diagnostics, США) и «Vitek 2» (производитель BioMerieux, Франция)), а также методом матрично-ассоциированной лазерной десорбции/
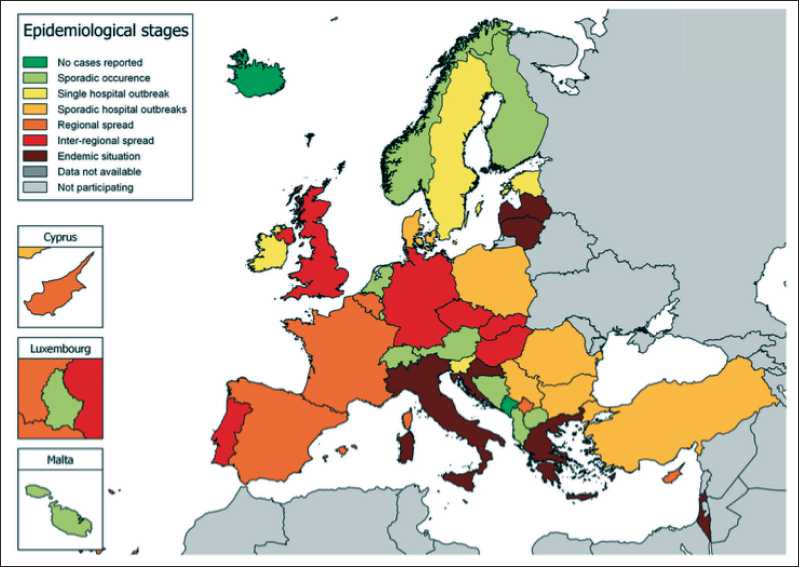
Рис. 1. Распространенность Car-R A. baumannii в странах Европы в 2013 г. [14]. Примечания : темно-зеленый цвет – случаев не отмечено, светло-зеленый – спорадические случаи, светло-желтый – единичные госпитальные вспышки, темно-желтый – спорадические госпитальные вспышки, оранжевый – региональное распространение, красный – межрегиональное распространение, вишневый – эндемическая ситуация, серый – данные недоступны
ионизации – времяпролетной масс-спектрометрии (MALDI-TOF) и программного обеспечения MALDI Biotyper v.3.0 (Bruker Daltonics, Германия). Определение лекарственной устойчивости к антибиотикам проводили турбидиметрическим методом при помощи анализаторов «Vitek 2» и методом флюоресцентной детекции на анализаторе «Microscan WalkAway – 40 SI».
Определение лекарственной устойчивости к антибиотикам при проведении молекулярногенетических исследований проводилось методом разведений в бульоне Мюллера – Хинтон (Oxoid, Великобритания) в соответствии со стандартом ISO 20776 / ГОСТ Р ИСО 20776-1-2010. Категории чувствительности определяли на основании пограничных значений МПК, установленных Европейским комитетом по определению чувствительности к антимикробным препаратам – EUCAST v 6.0.
Определение минимальных ингибирующих концентраций к карбапенемам проводили эпси-лометрическим методом (Е-тест). Технология градиента E-теста основана на сочетании концепций принципов разбавления и диффузии для тестирования чувствительности. Подавление роста микроорганизма вокруг полоски Е-теста определяли в зоне, где концентрация АБП, диффундирующего из носителя, была выше минимальной подавляющей концентрации (каплевидные зоны ингибиции).
Нечувствительные (умеренно-резистентные или резистентные) к карбапенемам штаммы ис- следовали на наличие карбапенемаз. Гены приобретенных металло-β-лактамаз (VIM, IMP, NDM) и сериновых карбапенемаз OXA-типа (подгруппы OXA-23, OXA-40, OXA-58) определяли с помощью ПЦР в режиме реального времени. Выявление продукции карбапенемаз проводилось в лаборатории НИИ антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России (заведующий лабораторией – к.б.н. М.В. Эйдельштейн).
Результаты
Среди 4104 выделенных за 3 года (2014–16 гг.) грамотрицательных микроорганизмов А. baumannii составил 22,4 %. Была проведена оценка динамики частоты выделения A. baumannii из биоматериалов от больных, полученных за вышеуказанный период времени (рис. 2). За этот период наблюдалось незначительное увеличение числа штаммов A. bau-mannii в патологических материалах от больных с 280 штаммов в 2014 г. до 333 и 329 штаммов в 2015 и 2016 гг. соответственно. Однако в процентном отношении количество исследуемых бактерий уменьшалось (рис. 3). В 2014 г. A. bau-mannii составил 32,4 % от выделенных штаммов , а в 2015 г. и в 2016 г. произошло достоверное уменьшение частоты обнаружения A. baumannii до 26,7 и 16,4 % соответственно. Чаще всего A. baumannii обнаруживался в отделяемом нижних дыхательных путей (40,9 %), что значимо выше
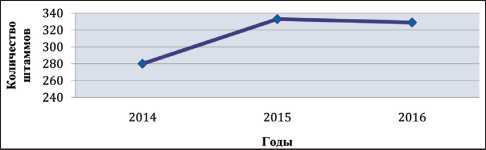
Рис. 2. Динамика частоты выделения A. baumannii в 2014–16 гг. в абсолютных значениях
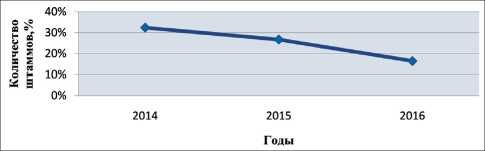
Рис. 3. Динамика частоты выделения A. baumannii в 2014–16 гг. в относительных значениях
(p<0,001), чем в раневом отделяемом, отделяемом из дренажей (21,9 %) и крови (15,9 %). Реже всего A. baumannii выделялся из мочевыводящих путей (6,7 %) (табл. 1).
При изучении лекарственной чувствительности А.baumannii была выявлена высокая устойчивость этих условно-патогенных бактерий к различным классам антибактериальных препаратов (табл. 2). При рассмотрении лекарственной устойчивости к β-лактамным антибиотикам выявлено, что устойчивость А. baumannii к пенициллинам в комбинации с бета-лактамными ингибиторами, в част- ности к ампициллину/сульбактаму, в 2014–16 гг. имела тенденцию к снижению (с 95,5 % в 2014 г. до 74,6 % в 2016 г. (р≤0,0001)), а устойчивость к пиперациллину/тазобактаму достоверно увеличилась с 64,3 % в 2014 г. до 73,6 % в 2015 г. (р<0,01) и до 98,1 % в 2016 г. (p≤0,0001).
По отношению к антибиотикам цефалоспоринового ряда выявлено, что в период 2014–16 гг. произошло достоверное (p≤0,0001) снижение устойчивости к препаратам III поколения – цефтазидиму и цефтриаксону. Так, если в 2014 г. число устойчивых штаммов к цефтазидиму составило 66,1 %, а к цефтриаксону – 93,9 %, то уже в 2016 г. было выявлено 44,3 % устойчивых штаммов к цефтазидиму и 73,8 % – к цефтриаксону, что, вероятно, обусловлено снижением назначения больным цефалоспоринов III поколения в пользу препаратов IV поколения. Число резистентных штаммов А. baumannii к препаратам IV поколения, в частности к цефепиму, в 2014–15 гг. было очень высоким – 94,7 и 93,4 %, в 2016 г. увеличилось до 98,3 % (p≤0,01).
Говоря о чувствительности A. baumannii к цефалоспоринам следует иметь в виду, что не все полученные in vitro данные можно однозначно переносить в лечебную практику. В частности, это касается использования цефтриаксона. Более того, терапия мультирезистентных A. baumannii , как правило, осуществляется комбинацией препаратов.
Наиболее важным вопросом при изучении устойчивости A. baumannii является наличие или
Таблица 1
Частота выделения A. baumannii из различных патологических материалов
(2014–16 гг.)
|
Виды патологических материалов |
Частота выделения A. baumannii |
|
Отделяемое из нижних дыхательных путей |
386 (40,9 %) |
|
Отделяемое из ран и дренажей |
207 (21,9 %) |
|
Моча |
63 (6,7 %) |
|
Кровь |
150 (15,9 %) |
|
Прочие биоматериалы |
136 (14,4 %) |
|
Всего |
942 (100 %) Таблица 2 |
Устойчивость A. baumannii к различным группам антибактериальных препаратов по годам (2014–16 гг.)
|
Антибиотики |
Годы/количество штаммов A. baumannii , резистентных к различным антибиотикам |
||
|
2014 (n=280) |
2015 (n=333) |
2016 (n=329) |
|
|
Ампициллин/сульбактам |
267 (95,5 %) |
308 (92,5 %) |
245 (74,6 %) |
|
Пиперациллин/тазобактам |
180 (64,3 %) |
245 (73,6 %) |
322 (98,1 %) |
|
Цефтазидим |
185 (66,1 %) |
92 (27,5 %) |
144 (44,3 %) |
|
Цефтриаксон |
263 (93,9 %) |
306 (91,8 %) |
243 (73,8 %) |
|
Цефепим |
265 (94,7 %) |
311 (93,4 %) |
323 (98,3 %) |
|
Имипенем/циластатин |
280 (100 %) |
333 (100 %) |
329 (100 %) |
|
Меропенем |
216 (77,2 %) |
280 (84,1 %) |
296 (90,0 %) |
|
Ципрофлоксацин |
268 ( 95,8 %) |
301 (90,3 %) |
302 (91,8 %) |
|
Амикацин |
217 (77,7 %) |
183 (55,0 %) |
299 (91,0 %) |
|
Триметоприм/сульфаметоксазол |
176 (62,8 %) |
93 (27,9 %) |
213 (64,7 %) |
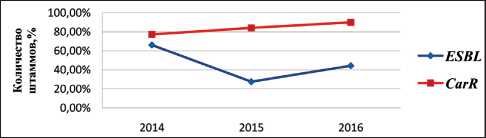
Рис. 4. Динамика выделения ESBL- продуцентов и CarR штаммов À. baumannii в 2014–16 гг.
отсутствие устойчивости к препаратам класса карбапенемов. По нашим данным, количество устойчивых к меропенему штаммов А. baumannii увеличилось с 77,2 % в 2014 г. до 84,1 % в 2015 г. (р<0,05) и до 90,0 % в 2016 г. (р<0,05). Разница между данными 2014 и 2016 гг. статистически значима (р≤0,0001). По отношению к имипе-нему сохраняется ситуация, характерная для 2008–12 гг. – штаммы А. baumannii были устойчивы к имипинему в 100 % случаев.
За период 2014–16 гг. произошло нарастание числа устойчивых штаммов к аминогликозидам, в частности к амикацину, с 77,7 % до 91,0 % (р≤0,0001). Устойчивость А. baumannii к фторхи-нолонам (ципрофлоксацину) была крайне высокой, хотя за исследуемый период отмечено незначительное снижение относительного количества резистентных штаммов – с 95,8 % в 2014 г. до 91,8 % в 2016 г. (р<0,05). Число устойчивых штаммов А.
Таблица 3
Минимальные подавляющие концентрации антибактериальных препаратов для A. baumannii (красным цветом обозначены МПК, соответствующие резистентности к антибиотику)
Патоло- Антибактериальные препараты/ Пограничные значения МПК (мг/л) (Ч≤ Р>) EUCAST
|
№ |
гический материал |
A/S 8/4–16/8 |
CAZ 8–16 |
CAX 16–32 |
CPE 8–16 |
IM 2–8 |
MER 2–8 |
CP 1–1 |
AK 8–16 |
T/S 2–4* |
|
1 |
ОД |
>16/8 |
>16 |
>32 |
>16 |
4 |
>2 |
>32 |
>2/38 |
|
|
2 |
ОД |
>16/8 |
4 |
32 |
>16 |
>8 |
>8 |
>2 |
>32 |
<2/38 |
|
3 |
ОНДП |
>16/8 |
>16 |
>32 |
>16 |
>8 |
>8 |
>2 |
>32 |
<2/38 |
|
4 |
PО |
>16/8 |
>16 |
>32 |
>16 |
>8 |
>8 |
>2 |
>32 |
>2/38 |
|
5 |
ОНДП |
>16/8 |
>16 |
>32 |
>16 |
>8 |
>8 |
>2 |
>32 |
>2/38 |
|
6 |
ОД |
>16/8 |
>16 |
>32 |
>16 |
>8 |
>2 |
>32 |
>2/38 |
|
|
7 |
Кровь |
>16/8 |
16 |
>32 |
>16 |
>8 |
>2 |
>32 |
>2/38 |
|
|
8 |
ОНДП |
>16/8 |
>16 |
>32 |
>16 |
>8 |
>8 |
>2 |
>32 |
>2/38 |
|
9 |
ОНДП |
>16/8 |
>16 |
>32 |
>16 |
>8 |
>8 |
>2 |
>32 |
>2/38 |
|
10 |
ОНДП |
>16/8 |
>16 |
>16 |
>16 |
4 |
>2 |
>32 |
>2/38 |
|
|
11 |
ОНДП |
>16/8 |
4 |
32 |
>16 |
>8 |
>8 |
>2 |
>32 |
<2/38 |
|
12 |
РО |
<=8/4 |
<=1 |
>16 |
<=2 |
<=1 |
<0,5 |
<4 |
<2/38 |
|
|
13 |
ОД |
>16/8 |
>16 |
>32 |
>16 |
>8 |
>2 |
>32 |
>2/38 |
|
|
14 |
ОД |
>16/8 |
>16 |
>32 |
>16 |
4 |
>2 |
>32 |
>2/38 |
|
|
15 |
РО |
>16/8 |
4 |
32 |
>16 |
>8 |
>2 |
>32 |
<2/38 |
|
|
16 |
ОНДП |
>16/8 |
16 |
>32 |
>16 |
>8 |
>8 |
>2 |
>32 |
<2/38 |
|
17 |
ОНДП |
>16 |
>32 |
>16 |
>8 |
>8 |
>2 |
>16 |
>2/38 |
|
|
18 |
Желчь |
>16/8 |
8 |
32 |
>16 |
>8 |
>8 |
>2 |
>32 |
<2/38 |
|
19 |
ОНДП |
>16/8 |
16 |
>32 |
>16 |
>8 |
>8 |
>2 |
>32 |
<2/38 |
|
20 |
ОД |
>16/8 |
>16 |
>16 |
>16 |
8 |
>2 |
<=4 |
>2/38 |
Примечание: ОД – отделяемое из дренажей, ОНДП – отделяемое из нижних дыхательных путей, РО – раневое отделяемоен, А/S – ампициллин/сульбактам, СAZ – цефтазидим, СAX – цефтриаксон, СPE – цефепим, IMP – имипенем, MER – меропинем, CP – ципрофлоксацин, АK – амикацин, T/S – триметоприм/сульфаметоксазол, * – пограничные значения представлены по триметоприму.
Таблица 4
Продукция карбапенемаз штаммами À. baumannii, циркулирующими в онкологической клинике
|
№ |
Патологический материал |
Вид выделенного микроорганизма |
VIM |
Виды карбапенемаз |
ОХA-58 |
||
|
IMP |
NDM OXA-23 |
OXA-40 |
|||||
|
1 |
Моча |
A. baumannii |
– |
– |
–+ |
– |
– |
|
2 |
ОНДП |
A. baumannii |
– |
– |
–+ |
– |
– |
|
3 |
ОНДП |
A. baumannii |
– |
– |
–+ |
– |
– |
|
4 |
ОД |
A. baumannii |
– |
– |
–+ |
– |
– |
|
5 |
ОНДП |
A. baumannii |
– |
– |
–+ |
– |
– |
|
6 |
ОНДП |
A. baumannii |
– |
– |
–+ |
– |
– |
Примечание: ОНДП – отделяемое нижних дыхательных путей, ОД – отделяемое из дренажа.
baumannii к триметоприму/сульфаметоксазолу в 2014 г. составило 62,8 %, в 2015 г. снизилось до 27,9 % (р≤0,0001), а в 2016 г. снова увеличилось до 64,7 % (р≤0,0001). Достоверных причин подобной динамики не выявлено. Кроме того, достоверной разницы при сравнении показателей 2014 г. и 2016 г. не выявлено (р>0,05).
Отдельно была проанализирована динамика выявления штаммов, резистентных к цефалоспоринам и продуцирующих бета-лактамазы расширенного спектра действия (англ. – ESBL ) и карбапенем-резистентных ( CarR) штаммов А. baumannii (рис. 4). Произошло достоверное нарастание количества CarR штаммов А. baumannii c 77,2 % в 2014 г. до 90,0 % в 2016 г. (р≤0,0001) и снижение количества ESBL- продуцирующих А. baumannii с 66,1 % до 44,3 % (р≤0,0001).
Также мы определили значения минимальных подавляющих концентрации (МПК) антибактериальных препаратов для A. baumannii. Нами был проведен анализ простой случайной выборки (20 штаммов) A. baumannii, продуцирующих бета-лактамазы и карбапенемазы (табл. 3). Из простой случайной выборки двадцати результатов устойчивости А. baumannii к антибактериальным агентам почти все образцы имели максимальные значения, превышающие МПК, за исключением бисептола (триметоприм/сульфаметоксозола), к которому не были резистентны 35,0 % штаммов. Однако данные по бисептолу, полученные in vitro, нельзя однозначно интерпретировать как возможную клиническую эффективность данного препарата. В целом резистентность штаммов А. baumannii была отмечена в 89,4 % случаев, при этом значения МПК в среднем составляли 16–32 мг/л.
Список литературы Инфекции, вызванные Acinetobacter baumannii, у онкологических больных
- Чеботарь И.В., Лазарева А.В., Масалов Я.К., Михайлович В.М., Маянский Н.А. Acinetobacter: микробиологические, патогенетические и резистентные свойства. Вестник РАМН. 2014; 9-10: 39-50.
- Григорьевская З.В., Петухова И.Н., Дьякова С.А., Дмитриева Н.В. Эпидемиология внутрибольничных инфекций в онкологическом стационаре. Сибирский онкологический журнал. 2016; 15(3): 62-66.
- Дмитриева Н.В., Петухова И.Н., Багирова Н.С. Резистентность микроорганизмов -возбудителей инфекций у онкологических больных. Сопроводительная терапия в онкологии. 2005; 1: 17.
- Решедько Г.К., Рябкова Е.Л., Фаращук А.Н., Страчунский Л.С., Туркутюков В.Б., Нехаева Г.И., Розанова С.М., Боронина Л.Г., Агапова Е.Д., Марусина Н.Е., Мултых И.Г., Тарабан В.К., Здзитовецкий Д.Э., Сарматова Н.И., Тихонов Ю.Г., Поликарпова С.В., Большаков Л.В., Богомолова Н.С., Дмитриева Н.В., Петухова И.Н., Галеева Е.В., Круглов А.Н., Вышелесская Н.Д., Александрова И.А., Белобородова Н.В., Вострикова Т.Ю., Ильина В.Н., Иванова С.Ф., Скальский С.В., Зубарева Н.А., Суборова Т.Н., Кречикова О.И., Щетинин Е.В., Николаева Т.А., Мартьянова Н.М., Гудкова Л.В., Ортенберг Э.А., Ушакова М.А., Хасанова С.Г., Габбасова Л.А., Колесник Т.И., Торопова И.А., Палютин Ш.Х., Монахова С.И. Неферментирующие грамотрицательные возбудители нозокомиальных инфекций в ОРИТ России: проблемы антибиотикорезистентности. Клиническая микробиология и антимикробная химиотерапия. 2006; 8(3): 243-259.
- Zeana C., Larson E., Sahni J., Bayuga S.J., Wu F, Della-Latta P. The epidemiology of multidrug-resistant Acinetobacter baumannii: does the community represent a reservoir? Infect Control Hosp Epidemiol. 2003 Apr; 24(4): 275-9. DOI: 10.1086/502209


