Ингаляционная терапия коморбидного пациента с COVID-19 высокими дозами оксида азота: клинический случай
Автор: Каменщиков Н. О., Кузнецов М. С., Дьякова М. Л., Подоксенов Ю. К., Калашникова Т. П., Т М. А., Чурилина Е. А., Козлов Б. Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 4 т.37, 2022 года.
Бесплатный доступ
В статье описан клинический случай терапии коморбидной пациентки с тяжелым течением COVID-19 с использованием ингаляционной терапии высокими дозами оксида азота (NO). Воздушный поток, содержащий NO, был генерирован при помощи аппарата «ПЛАЗОН». Данная терапия проводилась в качестве жизнеспасающей в связи с отсутствием эффекта от лечения, проводимого согласно действующим национальным клиническим рекомендациям по терапии COVID-19. Продемонстрирована безопасность и клиническая эффективность примененной методики.
Терапия оксидом азота, covid-19, плазон, коморбидность, кардиология, пневмония
Короткий адрес: https://sciup.org/149141460
IDR: 149141460 | УДК: 616.98:578.834.1-036.21]-085.835.5:546.172.6-31:[616/618] | DOI: 10.29001/2073-8552-2022-37-4-180-187
Текст научной статьи Ингаляционная терапия коморбидного пациента с COVID-19 высокими дозами оксида азота: клинический случай
Терапия пациентов с COVID-19-ассоциированной пневмонией и прогрессирующим первичным острым респираторным дистресс-синдромом (ОРДС) представляет серьезную клинико-социальную проблему, обусловленную ограниченным арсеналом методов терапии с доказанной эффективностью, отсутствием убедительных данных об оптимальных сроках старта медикаментозных интервенций, потенциальной опасностью лекарственных взаимодействий, что в совокупности обусловливает крайне неудовлетворительные результаты лечения, особенно у коморбидных пациентов. При этом ингаляционный способ доставки некоторых лекарственных препаратов может быть предпочтителен в качестве целевого при условии соблюдения оптимальной модальности проводимой терапии (обоснованное выделение субпопуляции потенциальных пациентов, своевременное начало, адекватная доза и продолжительность терапии). Оптимально, если используемый фармакологический агент может оказывать положительное влияние не только локально на респираторный тракт, но и системно, позволяя снизить выраженность экстрапульмональной эндотелиальной дисфункции, характерной для COVID-19. Оксид азота (NO) – селективный легочный вазодилататор с известными положительными эффектами при использовании у пациентов с ОРДС, основанными на оптимизации вентиляционно-перфузионного соотношения. В исследованиях in vitro и in vivo показаны прямые вирулицидные и антимикробные эффекты NO при его применении в высоких дозах (более 80 ppm) [1]. Таким образом, представляется перспективным применение высокодозной ингаляционной терапии NO у коморбидных пациентов с тяжелым течением COVID-19-ассоциированной пневмонии, поскольку, являясь универсальным регулятором множества биологических и физиологических процессов, NO при воспалении обладает антибактериальной активностью, стимулирует местный иммунитет, ингибирует процессы свободно радикального окисления. Аппарат «ПЛАЗОН» является единственным в мире аппаратом, реализующим способ лечения различных заболеваний воздушным потоком, содержащим NO, получаемым плазмохимическим методом из атмосферного воздуха (метод NO-терапии).
Представляем клинический случай успешного лечения пациентки с использованием ингаляционной пульс-терапии NO с использованием генератора воздушно-плазменного потока СКСВП/NO-01 «ПЛАЗОН» (регистрационное удостоверение № ФСР 2007/00583 от 21 марта 2012 г.). Аппарат серийно выпускается НИИ ЭМ МГТУ им. Н.Э. Баумана по техническим условиям ТУ 9444-001-05693446-00 (регистрационное удостоверение МЗ РФ № 29/01040400/2722-01 от 28.11.2001 г.). Данный прибор представляет собой основной блок, соединенный посредством мягкого электрогидро-газового проводника, окончательным элементом которого является манипулятор (рис. 1).
Комплект аппарата включает сменные манипуляторы 4 видов: коагулятор, деструктор, стимулятор-коагулятор и манипулятор для подачи охлажденной газовой смеси с повышенной концентрацией NO. Все они представляют собой генераторы плазмы (плазматроны) постоянного тока, отличающиеся друг от друга внутренним строением, и применяются в зависимости от поставленных целей и задач. Основной механизм действия прибора основан на образующем в воздушной плазме в процессе плазмохимической реакции монооксида азота (NO). В процессе работы прибора воздух подается в манипулятор компрессором сервисного блока. Проходя через электрическую дугу между катодом и анодом манипулятора, воздух ускоряется и нагревается, переходя в плазменное состояние, и далее устремляется через отверстие в аноде в выходной канал. Визуально плазменный поток, истекающий из манипулятора, представляет собой светящийся факел (при использование манипуляторов типа: коагулятор, деструктор, стимулятор-коагулятор). В данной работе использовался манипулятор для подачи охлажденной газовой смеси с повышенной концентрацией NO с отсутствием прямого воздействия температуры. Струя плазменного потока на выходе из манипулятора данного вида не имеет «факела», имеет умеренный газодинамический напор и низкую температуру < 40 °С. что достигается охлаждением плазмы внутри самого манипулятора. Концентрация NO при использовании манипулятора данного вида составила от 900 до 1000 ppm.

Рис. 1. Аппарат «ПЛАЗОН»
Fig. 1. PLAZON device
Проведение данного вида терапии носило характер жизнеспасающего и было начато после подписания информированного согласия пациентки с соблюдением Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266.
Клинический случай
Пациентка З., 63 лет (индекс массы тела 29 кг/м2, рост 159 см, вес 74 кг), имеющая в анамнезе ишемическую болезнь сердца (ИБС), микрососудистую ангиопатию, пароксизмальную форму наджелудочковой тахикардии, хронический аутоиммунный тиреоидит, дистальный рефлюкс-эзофагит, грыжу пищеводного отверстия диафрагмы, хронический гастрит, хронический холецистит, хронический панкреатит, кисты печени, остеохондроз позвоночника, варикозную болезнь вен нижних конечностей. гипертоническую болезнь последние 7 лет. В течение последнего года – микроскопический полиангиит: гломерулонефрит с тубулоинтерстициальным компонентом. Пациентка была госпитализирована в НИИ кардиологии Томского НИМЦ для планового обследования и коррекции лечения по поводу ИБС и гипертонии. Постоянно принимала бисопролол 2,5 мг утром, аторвастатин 40 мг вечером, апиксабан 2,5 мг 2 раза в сутки, метилпреднизолон 6 мг утром, омепразол 20 мг 2 раза в день. На 5-е сут пребывания в стационаре отмечено повышение температуры тела до 37,2 °С, кашель с небольшим количеством светлой мокроты, проведена ПЦР диагностика РНК SARS-CoV-2 с получением положительного результата. Дополнительно к основной терапии начата терапия фавипиравиром по схеме 1800 мг 2 раза в день в течение 1 сут, затем по 800 мг 2 раза в день. Субфебрильная температура сохранялась в течение 2 сут, сатурация оставалась в пределах нормальных значений. На 3-и сут заболевания проведена спиральная компьютерная томография органов грудной клетки (СКТ ОГК), диагностирована вирусная пневмония с поражением легочной паренхимы 16% (рис. 2).
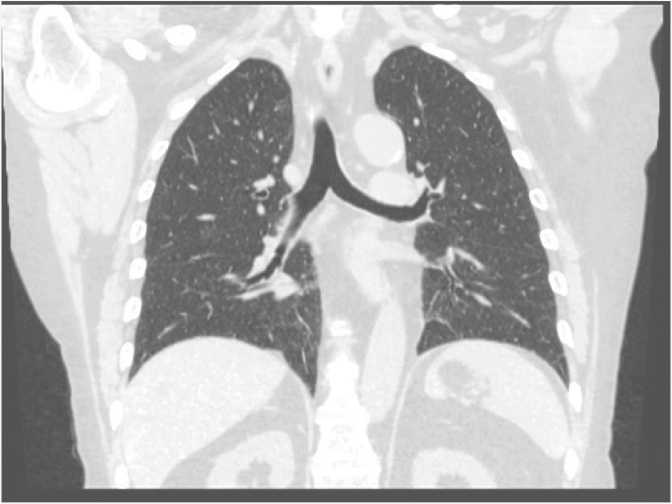
Рис. 2. Спиральная компьютерная томография органов грудной клетки на 3-и сутки заболевания, поражение легочной паренхимы 16% Fig. 2. Spiral computed tomography of the chest at day 3 of the disease showing 16% of lung parenchyma affected by COVID-19 lesions
Сатурация, определяемая при проведении пульсокси-метрии, при дыхании атмосферным воздухом составляла
97–99%. Результаты анализов крови представлены на рисунках 3, 4, в таблице 1.
4 10 ^11^12 13 14^13 16 11"
cyT.(day)cyT.(day)cyT.(day)cyT.(day)cyT.(day)cyT.(day)cyT.(day)cyT.(day)cyT.(day)cyT.(day)cyT.(day)
♦ Лейкоциты (*109/л) leukocytes (*10 9/1)
■ Эритроциты (*1012/л) erythrocytes (*1012/1)
Рис. 3. Динамика уровня эритроцитов и лейкоцитов в общем анализе крови
Fig 3. Changes in the levels of erythrocytes and leukocytes in the general blood test
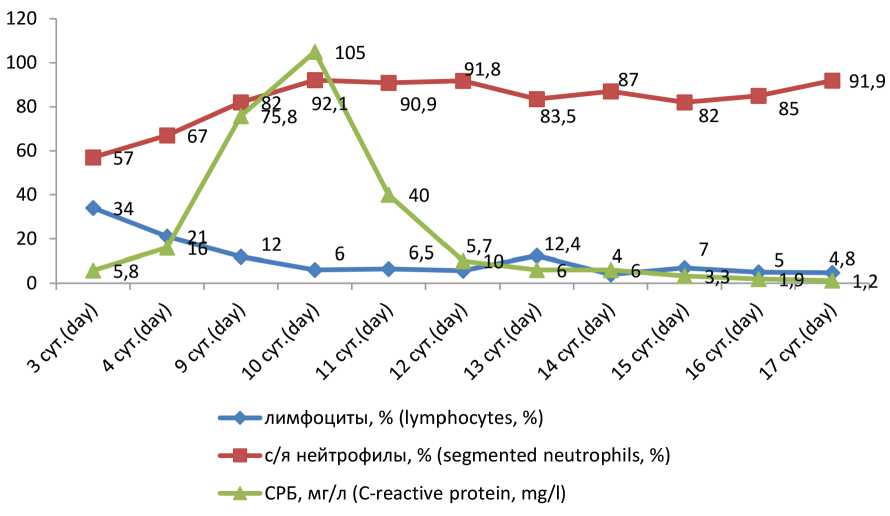
Рис. 4. Динамика уровня лимфоцитов, сегментоядерных нейтрофилов (с/я нейтрофилы) в общем анализе крови и С-реактивного белка (СРБ) в биохимическом анализе крови
Fig. 4. Changes in the levels of lymphocytes and segmented neutrophils (s/n neutrophils) in the general blood test and C-reactive protein (CRP) in the biochemical blood test
На 8-е сут от начала заболевания отмечалось снижение сатурации до 92%, начата инсуффляция увлажненного кислорода через назальные канюли со скоростью потока 3 л/мин (табл. 2).
На 9-е сут отмечено повышение температуры тела до 37,8 °С, усилилась слабость, появились жалобы на тошноту, боли в животе, потребность в кислороде возросла до 12 л/мин, назначен тоцилизумаб 400 мг в/в капельно (на 9-е сут заболевания). На 10-е сут заболевания в связи со снижением сатурации до 92% на фоне инсуффляции кислорода 12 л/мин начата высокопоточная оксигеноте-рапия, пациентка переведена в отделение интенсивной терапии. Повторно выполнена СКТ ОГК, выявлена отрицательная динамика с увеличением площади поражения легких до 76% (рис. 5).
С учетом отрицательной динамики клинического течения COVID 19 и данных клинико-лабораторных показателей (см. рис. 3–5, табл. 1, 2), а также результатов компьютерной томографии начата пульс-терапия NO (на 11-е сут заболевания).
Таблица 1. Результаты анализа кислотно-щелочного равновесия крови (в артериальной крови)
Table 1. Results of the analysis of the acid-base balance of blood (in arterial blood)
|
11 сут Day 11 |
12 сут Day 12 |
13 сут Day 13 |
14 сут. Day 14 |
15 сут Day 15 |
16 сут Day 16 |
17 сут Day 17 |
|
|
FiO 2 |
55 |
68 |
58 |
55 |
30 |
33 |
20,9 |
|
рН |
7,4 |
7,3 |
7,4 |
7,4 |
7,4 |
7,4 |
7,4 |
|
pCO2, мм рт. ст. pCO2, mmHg |
37,4 |
36,6 |
36,8 |
34,2 |
33,4 |
35 |
35,1 |
|
pO2, мм рт. ст. pO2, mmHg |
98,6 |
97,2 |
97,4 |
129 |
106,9 |
132 |
117 |
|
SаO2, % |
97,9 |
36 |
97,6 |
99,3 |
98,3 |
99,5 |
98,5 |
|
Lac, ммоль/л Lac, mmol/L |
0,8 |
1,4 |
1,6 |
2,5 |
2,6 |
2,6 |
2,5 |
Примечание: FiО2 – фракция кислорода во вдыхаемой смеси, рН – кислотно-основное состояние, pCO2 – парциальное давление в артериальной крови CO2, pO2 – парциальное давление в артериальной крови O2, SаO2 – сатурация в артериальной крови, Lac – лактат в артериальной крови.
Note: FiO2 – oxygen fraction in the inhaled mixture, pH – the acid-base state, pCO2 – partial pressure of carbon dioxide in arterial blood, pO2 – partial pressure of oxygen in arterial blood, SaO2 – oxygen saturation in arterial blood, Lac – lactate in arterial blood.
Таблица 2. Динамика клинических показателей
Table 2. Dynamics of clinical indicators
|
3 сут Day 3 |
4 сут Day 4 |
8 сут Day 8 |
9 сут Day 9 |
10 сут Day 10 |
11 сут Day 11 |
12 сут Day 12 |
13 сут Day 13 |
14 сут Day 14 |
15 сут Day 15 |
16 сут Day 16 |
17 сут Day 17 |
|
|
АД, мм рт. ст. BP, mmHg |
124/91 |
112/81 |
120/80 |
102/65 |
124/78 |
115/53 |
136/66 |
132/82 |
125/80 |
114/88 |
135/86 |
120/80 |
|
ЧСС, уд/мин Heart rate, beats per minute |
83 |
95 |
64 |
78 |
90 |
52 |
44 |
75 |
78 |
64 |
78 |
95 |
|
ЧД, в мин CHD, per minute |
18 |
20 |
18 |
30 |
28 |
22 |
23 |
20 |
25 |
22 |
20 |
18 |
|
Температура тела, °С Body temperature, °С |
36,4 |
37,1 |
36,9 |
37,8 |
36,8 |
36,3 |
36,2 |
37 |
36,8 |
36,9 |
36,8 |
36,2 |
|
Кислородная поддержка, л/мин Oxygen support, L/ minute |
0 |
0 |
3 |
12 |
60 (ВПОТ) (HPOT) |
60 (ВПОТ) (HPOT) |
60 (ВПОТ) (HPOT) |
60 (ВПОТ) (HPOT) |
60 (ВПОТ) (HPOT) |
55 (ВПОТ) (HPOT) |
40 |
2 |
|
P/F |
179 |
179 |
167 |
330 |
481 |
370 |
365 |
|||||
|
SPO2, % |
98 |
97 |
92 |
93 |
92 |
98 |
97 |
95 |
99 |
96 |
96 |
96 |
Примечание: АД – артериальное давление, ЧСС – частота сердечных сокращений, ЧДД – частота дыхания, P/F – индекс оксигенации, парциальное давление кислорода в артериальной крови к фракции кислорода во вдыхаемой смеси, ВПОТ – высокопоточная оксигенотерапия, SPO2 – сатурация, определяемая по пульоксиметрии.
Note: BP – blood pressure, HR – heart rate, RR – respiratory rate, P/F – oxygenation index calculated as a ratio of partial pressure of oxygen in arterial blood to the fraction of oxygen in the inhaled mixture, HPOT – high-flow oxygen therapy, SPO2 – pulse oximetry-based oxygen saturation.
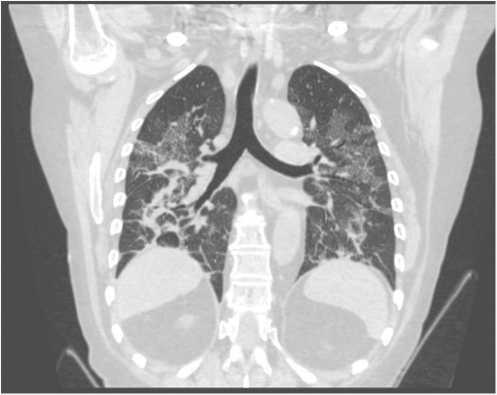
Рис. 5. Спиральная компьютерная томография органов грудной клетки на 10-е сутки заболевания, отрицательная динамика, увеличение площади поражения легочной паренхимы до 76%
Fig. 5. Computed tomography scan of the thoracic organs at day 10 of the disease showing negative dynamics and an increase in the area of damage to the lung parenchyma up to 76%
Терапию проводили с помощью аппарата для терапии экзогенным NO «ПЛАЗОН» дважды в сутки, каждые 12 ч. Аппарат «ПЛАЗОН» является генератором плазмы постоянного тока (см. рис. 1). Пациентке подавался охлажденный NO-содержащий газовый поток. Манипулятор располагался на расстояние 5–8 см от ротовой полости и носовых ходов, кумулятивная продолжительность обработки и сеанса дыхания NO – 2 мин через носовые ходы (по 1 мин каждый) и 1 мин путем дыхания через рот. На таком расстоянии манипулятора от ротовой и носовой полости температура воздействия газовой смеси с NO не превышала 30–40 °C. Концентрация NO во вдыхаемой смеси составляла от 900 до 1000 ppm. Кислородотера-пия во время проведения сеанса NO-терапии не проводилась. Сатурация в момент проведения NO-сеанса не снижалась ниже 75%. По лабораторным показателям, начиная с 1 мин, показатели метгемоглобина нарастали от 0,9% с максимальной концентрацией до 8% к концу сеанса. Уровень метгемоглобина крови и сатурации возвращались к исходным значениям в течение 30 мин на фоне возобновления кислородотерапии.
На фоне проводимой терапии NO в течение 5 дней (11–15-е сут заболевания) отмечалась положительная динамика в виде уменьшения проявлений дыхательной недостаточности, снижения потребности в дотации кислорода (рис. 6). Пациентка была переведена в общую палату, получала инсуффляцию кислорода 6 л/мин через назальные канюли. На 13-е сут заболевания ПЦР тест на определение РНК возбудителя COVID-19 еще оставался положительным. На 17-е сут РНК возбудитель COVID-19 методом ПЦР уже не обнаруживался.
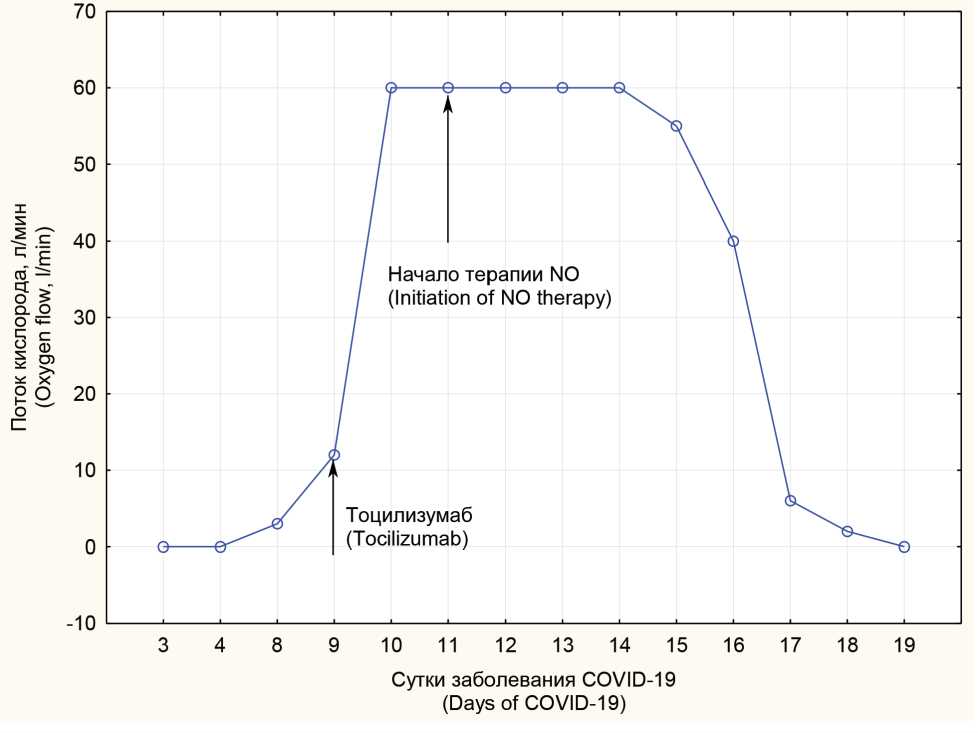
Рис. 6. Требуемый поток кислорода при оксигенотерапии на фоне терапии. С 10 по 16 сутки проводилась высокопоточная оксигенотерапия
Fig. 6. Required oxygen flow during oxygen therapy in the course of treatment. High-flow oxygen therapy was administered from day 10 to 16
На 17-е сут заболевания по результатам контрольной СКТ ОГК отмечена положительная динамика в виде уменьшения площади поражения легочной паренхимы до 52% (рис. 7).
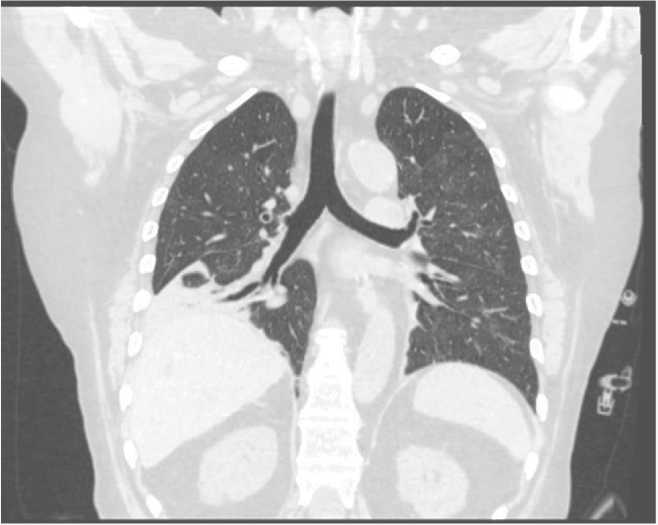
Рис. 7. Спиральная компьютерная томография органов грудной клетки на 17е сутки заболевания, положительная динамика, поражение легочной паренхимы 52%
Fig. 7. Computed tomography scan of thoracic organs showing positive dynamics and 52% damage to the lung parenchyma at day 17 of the disease
В течение последующих 3 сут оксигенотерапия этапно отменена. Пациентка выписана из стационара на 19-е сут от начала заболевания. Сатурация при дыхании на атмосферном воздухе составляла 96%.
Обсуждение
В настоящее время обсуждается непосредственно противовирусное действие ингаляционного NO, а также его системные эффекты. NO-зависимая элиминация вируса, скорее всего, опосредована ингибированием репликации вируса с помощью генетической модификации [2–6]. Механизмы противовирусной защиты включают дезактивацию вирусных белков, необходимых для репликации вируса: вирусных протеаз, обратных транскриптаз, факторов транскрипции и др., опосредованную S-нитрозилированием незаменимых тиоловых групп [7]. Динитрозильные комплексы железа с тиоловыми лигандами в тканях легких и дыхательных путей, образующиеся при высокодозной ингаляционной NO-терапии за счет пролонгированного высвобождения доноров катионов нитрозония (NO+), могут подавлять различные метаболические процессы, используемые коронавирусом, ответственные за проникновение в клетки, а также репликацию [8, 9]. А.Ф. Ванин и соавт. на экспериментальной модели и на здоровых добровольцах продемонстрировали, что после ингаляции высоких доз NO может происходить адсорбция значительной части препарата в легких и дыхательных тканях в виде динитрозильных комплексов железа с тиолами [10]. Антимикробный и противогрибковый эффекты ингаляционного NO, убедительно показанные в ряде исследований, могут улучшить клиническое течение COVID-19 в условиях ко- и суперинфекции [11, 12], что особенно актуально, так как частота выявления атипичных респираторных возбудителей и вирусных коинфекций в общей популяции госпитализированных пациентов с COVID-19 достигает 15,6–20,7% [13, 14].
Возможные благоприятные системные эффекты лечения ингаляционного NO включают антиагрегантный, лейкоцитарный антиадгезивный и противовоспалительный эффекты, которые потенциально могут предотвратить цитокиновый шторм и снизить риск внелегочных органных осложнений [15–17]. Более того, наличие резервного пула NO во внелегочных тканях за счет механизма S-нитро-зилирования приводит к снижению тонуса сосудов, снижению риска тромбообразования и адгезии лейкоцитов к системному эндотелию сосудов [18]. У нашей пациентки имела место коморбидная патология, включавшая в том числе аутоиммунные расстройства – гломерулонефрит и хронический тиреоидит, что требовало постоянного приема глюкокортикостеоридов, а также патологию сердечно-сосудистой системы – ИБС, микрососудистую коронарную ангиопатию. Несмотря на проводимую противовирусную терапию COVID-19 на 9-е сут у пациентки выявлена отрицательная динамика в виде нарастания дыхательной недостаточности, увеличения выраженности системных воспалительных процессов, что было расценено как проявления так называемого цитокинового шторма, назначен толицизумаб, однако явления нарастающей дыхательной недостаточности сохранялись. На 11-е сут заболевания была начата ингаляционная NO-терапия аппаратом «ПЛАЗОН». На фоне терапии достигнуто уменьшение выраженности дыхательной недостаточности, а также уменьшение системного воспаления. На 17-е сут заболевания проведенный ПЦР тест подтвердил отсутствие РНК вируса SARS-CоV-2 в организме пациентки.
Заключение
Таким образом, представленный нами клинический случай продемонстрировал безопасность применения данной методики у коморбидных больных COVID-19, а также проявления местного и системного эффектов данной терапии, позволяющих добиться положительных результатов в отсутствии эффективности терапии, проводимой в соответствии с текущими рекомендациями.
Список литературы Ингаляционная терапия коморбидного пациента с COVID-19 высокими дозами оксида азота: клинический случай
- Ichinose F., Roberts J.D. Jr., Zapol W.M. Inhaled nitric oxide: A selective pulmonary vasodilator: Current uses and therapeutic potential. Circulation. 2004;109(25):3106-3111. DOI: 10.1161/01.CIR.0000134596.80170.62.
- Mehta D.R., Ashkar A.A., Mossman K.L. The Nitric Oxide Pathway Provides Innate Antiviral Protection in Conjunction with the Type I Interferon Pathway in Fibroblasts. PLoS One. 2012;7(2):e31688. DOI: 10.1371/ journal.pone.0031688.
- Akerstrom S., Gunalan V., Keng C.T., Tan Y.-J., Mirazimi A. Dual effect of nitric oxide on SARS-CoV replication: Viral RNA production and pal-mitoylation of the S protein are affected. Virology. 2009;395(1):1-9. DOI: 10.1016/j.virol.2009.09.007.
- Xu W., Zheng S., Dweik R.A., Erzurum S.C. Role of epithelial nitric oxide in airway viral infection. Free Radic. Biol. Med. 2006;41(1):19-28. DOI: 10.1016/j.freeradbiomed.2006.01.037.
- Klingstrom J., Akerstrom S., Hardestam J., Stoltz M., Simon M., Falk K.I. et al. Nitric oxide and peroxynitrite have different antiviral effects against hantavirus replication and free mature virions. Eur. J. Immunol. 2006;36(10):2649-2657. DOI: 10.1002/eji.200535587.
- Jung K., Gurnani A., Renukaradhya G.J., Saif L.J. Nitric oxide is elicited and inhibits viral replication in pigs infected with porcine respiratory coronavirus but not porcine reproductive and respiratory syndrome virus. Vet. Immunol. Immunopathol. 2010;136(3-4):335-339. DOI: 10.1016/j. vetimm.2010.03.022.
- Uehara E.U., de Stefano Shida B., de Brito C.A. The role of nitric oxide in immune responses against viruses is beyond microbicidal activity. Inflamm. Res. 2015;64(11):845-852. DOI: 10.1007/s00011-015-0857-2.
- Vanin A.F. Dinitrosyl iron complexes with thiolate ligands: Physico-chem-istry, biochemistry and physiology. Nitric. Oxide. 2009;21(1):1-13. DOI: 10.1016/j.niox.2009.03.005.
- Vanin A.F. Dinitrosyl Iron TOmplexes as a "working form" of nitric oxide in living organisms. Cambridge, UK: Cambridge Scholars Publ.; 2019:276.
- Vanin A.F. Dinitrosyl iron complexes with thiol-containing ligands can suppress viral infections as donors of the nitrosonium cation (hypothesis). Biophysics (Oxf.). 2020;65(4):698-702. DOI: 10.1134/ S0006350920040260.
- 11 Deppisch C., Herrmann G., Graepler-Mainka U., Wirtz H., Heyder S., Engel C. et al. Gaseous nitric oxide to treat antibiotic resistant bacterial and fungal lung infections in patients with cystic fibrosis: A phase I clinical study. Infection. 2016;44(4):513-520. DOI: 10.1007/s15010-016-0879-x.
- Miller C., McMullin B., Ghaffari A., Stenzler A., Pick N., Roscoe D. et al. Gaseous nitric oxide bactericidal activity retained during intermittent high-dose short duration exposure. Nitric. Oxide. 2009;20(1):16-23. DOI: 10.1016/j.niox.2008.08.002.
- Ma L., Wang W., Le Grange J.M., Wang X., Du S. Li C. et al. Coinfection of SARS-CoV-2 and other respiratory pathogens. Infect. Drug Resist. 2020;13:3045-3053. DOI: 10.2147/IDR.S267238.
- Kim D., Quinn J., Pinsky B., Shah N.H., Brown I. Rates of co-infection between SARS-CoV-2 and other respiratory pathogens. JAMA. 2020;323(20):2085-2086. DOI: 10.1001/jama.2020.6266.
- Kobayashi J., Murata I. Nitric oxide inhalation as an interventional rescue therapy for COVID-19-induced acute respiratory distress syndrome. Ann. Intensiv. Care. 2020;10(1):61. DOI: 10.1186/s13613-020-00681-9.
- Kamenshchikov N.O., Berra L., Carroll R.W. Therapeutic effects of inhaled nitric oxide therapy in COVID-19 patients. Biomedicines. 2022;10(2):369. DOI: 10.3390/biomedicines10020369.
- Kamenshchikov N.O., Kozlov B.N., Dish A.Y., Podoksenov Y.K., Anfino-genova N.D., Boshchenko A.A. et al. Abstract 11986: A Safety Study of Intermittent versus Continuous Inhaled NO Therapy in Spontaneously Breathing COVID-19 Patients: A Randomized Controlled Trial. Circulation. 2021;144(1):A11986.
- McMahon T.J., Doctor A. Extrapulmonary effects of inhaled nitric oxide: Role of reversible S-nitrosylation of erythrocytic hemoglobin. Proc. Am. Thorac. Soc. 2006;3(2):153-160. DOI: 10.1513/pats.200507-066BG.


