Ингибирование экспрессии гена REDD1 для снижения побочных эффектов глюкокортикоидов
Автор: Лылова Евгения Сергеевна, Савинкова Алена Валерьевна, Жидкова Екатерина Михайловна, Кирсанов Кирилл Игоревич, Якубовская Марианна Геннадиевна, Будунова Ирина Владимировна, Лесовая Екатерина Андреевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.19, 2020 года.
Бесплатный доступ
Глюкокортикоиды (GC) являются неотъемлемым компонентом терапии лейкозов и лимфом на протяжении нескольких десятков лет. Их специфическое цитотоксическое действие на трансформированные лимфобласты обусловливает применение данных препаратов как при индукции ремиссии, так и в ходе дальнейшего лечения. Однако одной из проблем, осложняющих длительное применение GC, является развитие атрофических и метаболических побочных эффектов, а также резистентности. Биологические эффекты GC реализуются посредством активации глюкокортикоидного рецептора (GR) по двум механизмам: трансрепрессии (TR), обусловливающей терапевтическое действие GC, и трансактивации (TA), опосредующей развитие побочных эффектов. В частности, с индукцией трансактивации связано увеличение экспрессии GC-зависимого гена REDD1, ассоциированного с GC-индуцированной атрофией кожного покрова, мышечной и костной ткани. В связи с этим актуальным является поиск потенциальных ингибиторов экспрессии REDD1 и изучение их эффектов в комбинации с GC на моделях лейкозов и лимфом. Ранее нами с помощью биоинформатического анализа был отобран ряд препаратов класса модуляторов сигнального пути PI3K/Akt/mTOR. Данные лекарственные средства оказались эффективными ингибиторами экспрессии гена REDD1, модулировали активность GR, усиливая трансрепрессию, а также предотвращали развитие GC-индуцированных побочных эффектов у мышей. В представленной работе изучены эффекты потенциальных ингибиторов экспрессии REDD1, соединений других фармакологических групп, эметина и CGP-60474 на клетки лейкозов и лимфом совместно с GC. Было отмечено противоопухолевое действие соединений in vitro, снижение экспрессии генов, ассоциированных с TA, и усиление TR. В связи с этим дальнейшее изучение противоопухолевых эффектов ингибиторов экспрессии REDD1 эметина и CGP-60474 является перспективным направлением исследований.
Глюкокортикоиды, глюкокортикоидный рецептор, лимфомы, лейкозы, эметин
Короткий адрес: https://sciup.org/140254402
IDR: 140254402 | УДК: 615.28: | DOI: 10.21294/1814-4861-2020-19-6-73-81
Текст научной статьи Ингибирование экспрессии гена REDD1 для снижения побочных эффектов глюкокортикоидов
Глюкокортикоиды (GC) широко используются в терапии лейкозов и лимфом, однако их долговременное применение проблематично. Одним из недостатков, снижающих терапевтическую эффективность глюкокортикоидов, является развитие побочных эффектов: остеопороза, атрофии кожного покрова и мышечной ткани, нарушения образования жировой ткани, гипергликемии, резистентности к инсулину, гипертонии. Данные осложнения могут сохраняться спустя годы после лечения и существенно ухудшать качество жизни пациентов. Другим недостатком GC как терапевтических агентов является глюкокортикоидная резистентность, которая развивается при лечении не только онкологических заболеваний, но и астмы, хронической обструктивной болезни легких, сепсиса [1, 2]. Реализация биологического действия GC осуществляется посредством активации глю- кокортикоидного рецептора (GR). Терапевтические эффекты GC обусловлены активацией механизма трансрепрессии (TR), белок-белковым взаимодействием GR c рядом про-пролиферативных транскрипционных факторов (CCND2, ALOX5AP), что подавляет их активность и снижает жизнеспособность опухолевой клетки. Побочные эффекты обусловлены запуском трансактивации (ТА) – взаимодействия димеров GR c GC-респонсивными элементами ДНК и запуском транскрипции анти-апопототических и про-пролиферативных генов (GILZ, FKBP51) [3, 4] (рис. 1).
Отдельную роль в реализации GC-опосредованных метаболических и атрофических нарушений играет ген REDD1 , консервативный GR-зависимый ген, белковый продукт которого ингибирует пролиферативный комплекс mTOR [5, 6]. Повышение экспрессии REDD1 коррелирует с развитием кожной и мышечной атрофии и остео-
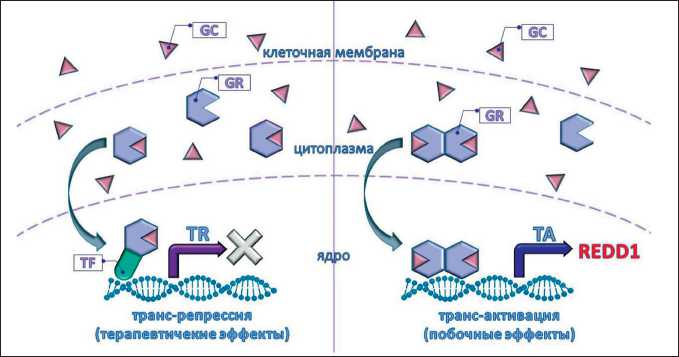
Рис. 1. Механизмы действия глюкокортикоидного рецептора. Примечание: GC – глюкокортикоид, GR – глюкокортикоидный рецептор, TF – транскрипционный фактор, TR – трансрепрессия, ТА – трансактивация
Fig. 1. Mechanisms of action of a glucocorticoid receptor. Note: GC – glucocorticoid, GR – glucocorticoid receptor, TF – transcription factor, TR – transrepression, TА – transactivation
пороза, а ингибирование экспрессии, напротив, препятствует развитию побочных эффектов [2]. В наших предыдущих исследованиях с помощью биоинформатического анализа на основании идеи перепрофилирования лекарственных средств был отобран ряд соединений класса модуляторов сигнального пути PI3K/Akt/mTOR в качестве потенциальных ингибиторов экспрессии REDD1: рапамицин, вортманнин, LY294002, AZD8055 и ряд других [7, 8]. В экспериментах in vivo была показана способность рапамицина снижать степень стероид-индуцированной атрофии, не влияя в то же время на терапевтический противовоспалительный эффект глюкокортикоидов [7].
В данной работе с помощью биоинформати-ческого скрининга были отобраны новые перспективные ингибиторы экспрессии REDD1 , не относящиеся к классу ингибиторов PI3K/Akt/ mTOR: антипротозойное средство эметин и ингибитор протеинкиназы С CGP-60474 (рис. 2).
Цель исследования – изучение влияния потенциальных ингибиторов экспрессии гена REDD1 на биологические эффекты GC на моделях лейкоза и лимфомы.
Материал и методы
Клеточные культуры . Клеточные линии острого лимфобластного лейкоза CEM и мантийноклеточной лимфомы Granta культивировали в стандартной среде RPMI (ПанЭко, Россия), содержащей 10 % эмбриональную сыворотку телят,
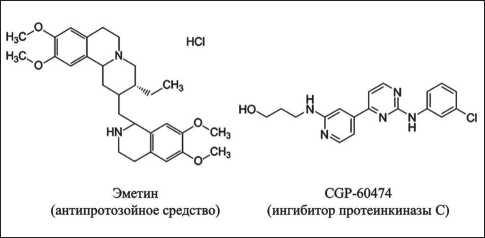
Рис. 2. Структурные формулы эметина и CGP-60474
Fig. 2. Structural formulas of Emetine and GGP-60474
L-глутамин (2 мМ), пируват натрия (2,5 мМ), пенициллин (50 ед/мл) и стрептомицин (50 ед/мл) («ПанЭко», Россия) при 37 о С в атмосфере 5 % СО 2 .
Обработка клеток. Клетки рассаживали в планшеты и культивировали сутки при 37 ºС и при 5 % содержании СО 2 . Далее проводили обработку эметином или CGP-60474 (1 мкМ), по прошествии 6 ч проводили обработку дексаметазоном (10 мМ).
Оценка жизнеспособности клеток. Оценку жизнеспособности клеток после воздействия веществ определяли методом прямого подсчета клеток в камере Горяева. Клетки рассаживали в 24-луночные планшеты (25000 кл/мл) и обрабатывали, как описано ранее. Подсчет клеток проводили каждые 48 ч.
Вестерн-блоттинг. Клетки отделяли от среды центрифугированием, промывали PBS. Лизис клеток проводили в буфере RIPA с добавлением ингибитора протеиназ. Лизат отделяли центрифугированием. Белки разделяли методом вертикального электрофореза в полиакриламидном геле в Tris-глициновом буфере с 1 % SDS. Перенос на нитроцеллюлозную мембрану осуществляли мокрым способом. Для предотвращения неспецифической сорбции мембраны инкубировали с 5 % раствором обезжиренного молока в PBS, затем проводили гибридизацию с первичными антителами к PARP (Santa Cruz Biotechnology, USA). В качестве контроля загрузки проводили гибридизацию с антителами к глицеральдегид-3-фосфатдегидрогеназе (Abcam, US). Далее проводили гибридизацию с вторичными антителами (Abcam, US). Белки проявляли, нанося на мембрану реагент для проявления на основе люминола. Количественный анализ проводился путем денситометрического сканирования.
Проточная цитофлуориметрия. Клетки высевали в 6-луночный планшет в концентрации 100 тыс. клеток/лунка и инкубировали 1 сут. Затем клетки обрабатывали 1 мкМ эметина или CGP-60474, 10 мМ Dex, их комбинацией или растворителем, инкубировали в течение 24 ч. Затем клетки отделяли от среды центрифугированием, отмывали центрифугированием в холодном PBS. Далее к клеткам добавляли 50 мкл холодного PBS и фиксировали 70 % EtOH 1 ч при 4 °С. Фиксированные клетки отмывали от спирта центрифугированием, ресуспендировали осадок в PI-буфере. Полученные образцы анализировали на проточном цитофлуориметре FACSCalibur (Becton Dickinson and Company, США).
Количественная ПЦР-амплификация (Q-PCR). Для получения кДНК проводили реакцию обратной транскрипции с использованием коммерческого набора («Синтол», Россия) по протоколу производителя. Затем к 2 нг кДНК добавляли по 500 нМ обратного и прямого праймеров (табл. 1) и по 18 мкл реакционной смеси, содержащей Eva Green Master Mix. Амплификацию проводили в следующем режиме: 95 °С, 10 мин (95 °С, 15 с; 72 °С, 30 с; 60 °С, 30 с) – 40 циклов. Детекцию результатов Q-PCR проводили при помощи флуоресцентного красителя EVA GREEN. Относительное изменение экспрессии, исследуемой мРНК, вычисляли методом ΔΔCt, где ΔΔCt определяли путем вычитания среднего значения ΔCt для контрольного гена из ΔCt для экспериментальных образцов. Для каждого гена интереса ПЦР-анализ был проведен в трех повторах. Количество ПЦР-продуктов оценивали и нормализовали по количеству ПЦР-продукта рибосомного белка L27 ( Rpl27 ).
Статистическая обработка данных . Все эксперименты выполнены в трех повторах. Средние значения и среднеквадратичные отклонения рассчитывали с помощью пакета программ Microsoft
Excel. Для определения статистической значимости выявленных различий использовали t-тест Стьюдента для средних.
Результаты
Первостепенной задачей в данной работе являлась оценка влияния исследуемых соединений на экспрессию REDD1. По результатам Q-PCR эметин и CGP-60474 статистически значимо снижали базальный и GC-индуцированный уровень экспрессии REDD1 , что подтверждает их ингибирующее действие в отношении данного гена (табл. 2) .
На следующем этапе было оценено влияние соединений на противоопухолевое действие GC in vitro путем оценки жизнеспособности клеток и индукции апоптоза. Цитотоксичность оценивали методом прямого подсчета клеток в камере Горяева. Для клеточной линии CEM наблюдали более выраженное снижение числа живых клеток, чем для линии Granta. На 6-e сут эксперимента количество жизнеспособных клеток обеих линий не превышало 2–5 %. Цитотоксический эффект эметина и CGP-60474 оценивали в двух концентрациях, однако дозозависимый эффект был слабо выражен. На клетках линии Granta наблюдали слабый кооперативный эффект эметина и CGP-60474 в комбинации с дексаметазоном (Dex) (рис. 3)
С помощью проточной цитофлуориметрии для линии Granta было показано увеличение SubG1-популяции клеток, что свидетельствует об индукции апоптоза. Эффект наблюдали как для ингибиторов экспрессии REDD1 при индивидуальной обработке, так и при использовании их комбинации с
Таблица 1/table 1
Последовательности праймеров для Q-pcR primer sequences for Q-pcR
|
Праймер/ Primer |
Последователь Прямой праймер |
ность/Sequences Обратный праймер |
|
FKBP51 |
5’-gaatggtgaggaaacgccgat-3' |
5’-tgccaagactaaagacaaatggt-3' |
|
GILZ |
5’-cagcccgagccatgaacacc-3' |
5’-cgcagaaccaccaggggcct-3' |
|
RPL27 |
5’-accgctacccccgcaaggtg-3' |
5’-cccgtcgggccttgcgttta-3' |
|
CCND2 |
5’-accttccgcagtgctccta-3' |
5’-cccagccaagaaacggtcc-3' |
|
REDD1 |
5’-tagcctttgggaccgcttctcgt-3' |
5’-caggtaagccgtgtcttcctccg-3' |
|
ALOX5AP |
5’-ttgcctttgagcgggtctac-3’ |
5’-gcctcacaaacaagtacatcagt-3’ |
Таблица 2/table 2
Относительная экспрессия гена REDD1 после обработки эметином (em), cgp-60474 (cgp) и их комбинацией с дексаметазоном (dex)
Fold change of REDD1 expression after the treatment with emetine, cgp-60474 and their combination with dex
|
Клеточная линия/ Cell line |
Ген/ Gene |
Ctrl |
Dex |
Em |
Em + Dex |
CGP |
CGP + Dex |
|
Granta |
Р17ГЛГЛ 7 |
1 ± 0,01 |
1,90 ± 0,03a |
0,48 ± 0,04a |
0,67 ± 0,08a,b |
0,30 ± 0,05a |
0,41 ± 0,03 a,b |
|
CEM |
REDD1 |
1 ± 0,01 |
3,73 ± 0,2a |
0,07 ± 0,008a |
0,03 ± 0,004a,b |
0,01 ± 0,001a |
0,01 ± 0,001 a,b |
Примечание: a – статистически значимое различие по отношению к контролю, b – статистически значимое различие по отношению к Dex.
Note: a – statistically significant difference in relation to control, b – statistically significant difference in relation to Dex.
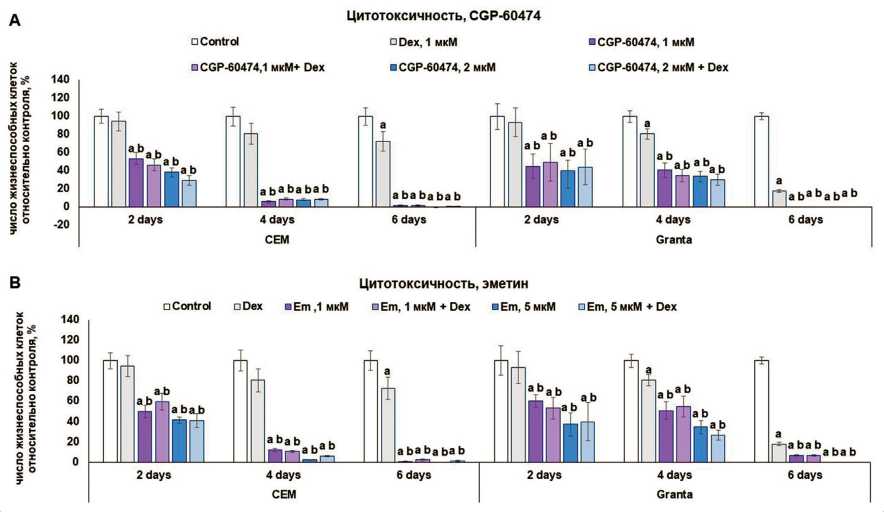
Рис. 3. Цитотоксический эффект ингибиторов экспрессии REDD1 на клетки CEM и Granta.
Клетки культивировали в присутствии растворителя, дексаметазона (Dex, 10 мМ), CGP-60474 ( a , 1 мкМ, 2 мкМ), эметина ( B , 1 мкМ, 5 мкМ) или их комбинации. Оценку числа жизнеспособных клеток осуществляли каждые 2 дня методом прямого подсчета клеток. Данные представлены как M ± SD (n=3). Примечание: a – статистически значимое отличие от контроля, b – статистически значимое отличие от образцов, обработанных Dex (p<0,05)
Fig. 3. Cytotoxic effect of the inhibitors of REDD1 expression on CEM and Granta cells. Cells were cultivated in the presence of solvent, Dex (10 mM), Emetine ( А , 1 μM, 5 μM), CGP-60474 ( В , 1 μM, 2 μM), or their combinations. The number of viable cells was evaluated every 2 days by direct cell counting. Data are presented as M ± SD (n=3). Note: a – a statistically significant difference from the control, b – a statistically significant difference from the samples treated with Dex (p<0.05)
A
uncleaved PARP
В
cleaved PARP
GAPDH
Dex Em CGP-60474
Dex Em
CG P-60474
C
Granta, PARP, 24h
D
CEM, PARP, 24h
uncleaved
□ cleaved
uncleaved
□ cleaved
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
a b
a b
0,9
In,,iUlin
о
Gc
«o'
^ «о0*
z
^
Рис. 4. Анализ индукции апоптоза в клетках линий Granta (А) и СЕМ (B) после обработки ингибиторами экспрессии REDD1 с помощью проточной цитофлуориметрии . Клетки культивировали в течение 24 ч в присутствии растворителя, дексаметазона (Dex, 10 мМ), эметина (1 мкМ), CGP-60474 (1 мкМ) или их комбинации. Уровень индукции апоптоза определяли методом проточной цитофлуориметрии с использованием окраски йодидом пропидия. Данные представлены как M ± SD (n=3). Примечание: a – статистически значимое отличие от контроля, b – статистически значимое отличие от образцов, обработанных Dex (p<0,05)
Fig. 4. Аnalysis of apoptosis induction in Granta (А) and CEM (В) cells after the treatment of the inhibitors of REDD1 expression using flow cytometry. Cells were cultured for 24 hours in the presence of a solvent, Dex (10 mM), Emetine (1 μM), CGP-60474 (1 μM), or their combinations. Аpoptosis induction was determined by flow cytometry using propidium iodide staining. Data are presented as M ± SD (n=3). Note: a – a statistically significant difference from the control, b – a statistically significant difference from the samples treated with Dex (p<0.05)
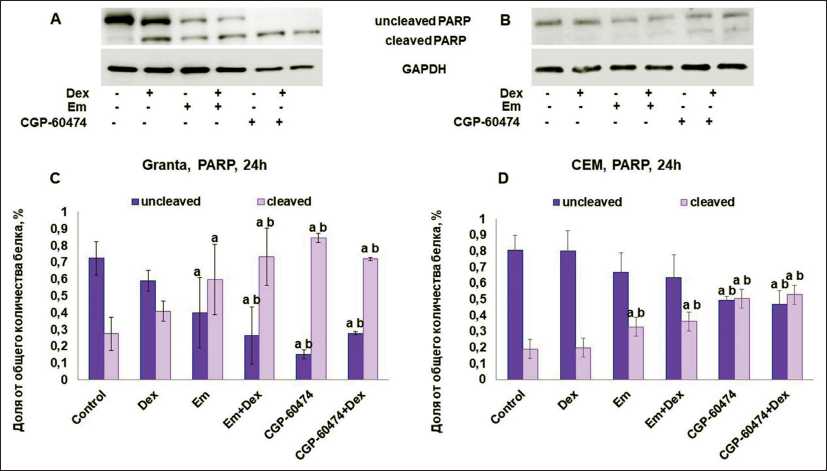
Рис. 5. Анализ индукции апоптоза в клетках линий Granta (А, C) и СЕМ (B, D) после обработки ингибиторами экспрессии REDD1 по степени расщепления белка PАRP . А, B – Вестерн блоттинг; C, D – денситометрический анализ интенсивности полос в долях единицы, анализ проводили с использованием программного обеспечения Image Quant для Windows
Fig. 5. Аnalysis of apoptosis induction in Granta (А, C) and CEM (B, D) cells after the treatment of the inhibitors of REDD1 expression using PАRP cleavage. А, B results of Western blot analysis; C, D – densitometry of the band intensity as relative units, densitometry was performed using Image Quant for Windows free software
Dex. Для комбинации эметин+Dex было отмечено статистически значимое отличие от эффекта, возникающего при обработке эметином. Для клеточной линии только CEM тенденция к увеличению SubG1-популяции клеток была отмечена только для CGP-60474 и его комбинации с Dex (рис. 4). Индукция апоптоза оценивалась также с помощью Вестерн-блоттинга по расщеплению белка PARP1. Наблюдали увеличение фракции расщепленного PARP1 для обеих клеточных линий при обработке как только ингибиторами экспрессии REDD1 , так и их комбинацией с Dex (рис. 5).
При оценке степени запуска механизма трансактивации (ТА) по результатам Q-PCR для клеточной линии Granta отмечали снижение
GC-индуцированного уровня экспрессии ТА-ассоциированных генов GILZ и FKBP51 при обработке СGP-60474 индивидуально и его комбинацией с Dex. Для эметина снижение GC-индуцированной экспрессии данных генов было статистически незначимо. Для линии CEM под воздействием ингибиторов экспрессии REDD1 показано снижение GC-индуцированного уровня экспрессии GILZ и FKBP51 , однако для гена GILZ при обработке CGP-60474 этот показатель статистически не отличался от контроля.
Степень запуска механизма трансрепрессии (TR) также оценивали с помощью Q-PCR. Снижение экспрессии маркера ТR, ALOX5AP отмечали как при обработке CGP-60474, так и в случае
Таблица 3/table 3
Относительная экспрессия генов, ассоциированных с трансактивацией и трансрепрессией глюкокортикоидного рецептора после обработки ингибиторами REDD1 и их комбинацией с дексаметазоном (dex)
Fold change of the expression of ta- and tR-associated genes after treatment with REDD1 inhibitors and their combination with dex
|
Клеточная линия/ Cell line |
Ген/ Gene |
Ctrl |
Dex |
Em |
Em + Dex |
CGP |
CGP + Dex |
|
GILZ |
1 ± 0,01 |
6,24 ± 0,5 a |
1,80 ± 0,21 a |
9,39 ± 0,72 a, b |
1,60 ± 0,02 a |
2,02 ± 0,31 a, b |
|
|
Granta |
FKBP51 |
1 ± 0,001 |
2,39 ± 0,32 a |
1,57 ± 0,13 a |
2,72 ± 0,15 a, b |
1,04 ± 0,005 |
1,08 ± 0,2 b |
|
ALOX5AP |
1 ± 0,013 |
0,85 ± 0,04 a |
0,73 ± 0,03 a |
0,74 ± 0,04 a |
0,32 ± 0,02 a |
0,21 ± 0,03 a, b |
|
|
GILZ |
1 ± 0,01 |
8,87 ± 0,94 a |
4,74 ± 0,52 a |
7,54 ± 0,82 a, b |
1,41 ± 0,15 a |
12,88 ± 1,42 a, b |
|
|
CEM |
FKBP51 |
1 ± 0,004 |
1,23 ± 0,30 a |
1,17 ± 0,23 |
0,38 ± 0,05 a, b |
0,76 ± 0,06 a |
0,15 ± 0,01 a, b |
|
CCND2 |
1 ± 0,002 |
1,18 ± 0,12 |
0,10 ± 0,02 a |
0,14 ± 0,01 a, b |
0,10 ± 0,02 a |
0,07 ± 0,003 a, b |
|
|
Примечание: a – |
статистически значимое различие по отношению к контролю, b – статистически значимое различие по отношению к Dex. |
||||||
Note: a – statistically significant difference in relation to control, b – statistically significant difference in relation to Dex.
эметина, однако для эметина эффект был менее выражен. В клетках линии CEM под воздействием ингибиторов REDD1 было показано снижение экспрессии гена CCND2 , также ассоциированного с ТR (табл. 3).
Обсуждение
Поскольку фармакологические ингибиторы REDD1 не описаны в литературе, ранее в нашей лаборатории в сотрудничестве с лабораториями И.В. Будуновой (Northwestern University, Чикаго, США) и Дж.Т. Дадли (госпиталь Маунт-Синай, Нью-Йорк, США) с использованием аналитической системы Connectivity Map (CMap) был проведен биоинформатический скрининг 1300 зарегистрированных и одобренных к использованию лекарственных препаратов различных классов [7]. Подобное перепрофилирование препаратов позволяет снизить стоимость исследований за счет отсутствия стадии разработки схем синтеза соединений и значительного сокращения стадии доклинических испытаний, необходимых для регистрации препарата и введения его в клиническую практику [9]. В ходе скрининга были отобраны соединения, для которых REDD1 входил в 10 % генов, экспрессия которых падала наиболее выраженно. Так, был идентифицирован ряд предполагаемых ингибиторов REDD1 , среди которых перспективными кандидатами являлись ингибиторы сигнального пути PI3K/Akt/mTOR рапамицин, LY294002, вортманнин, AZD8055 и др. [10]. Было показано, что данные соединения ингибируют как базальный, так и GC-индуцированный уровень белка и мРНК REDD1 . Более того, было продемонстрировано, что модуляторы PI3K/Akt/mTOR вызывают ингибирование трансактивации GR и усиление трансрепрессии. В экспериментах in vivo была показана способность рапамицина снижать степень стероид-индуцированной атрофии, не влияя в то же время на терапевтический противовоспалительный эффект GC.
Новые потенциальные ингибиторы экспрессии REDD1 были отобраны с помощью расширенной базы данных LINCS (The Library of Integrated Network-Based Cellular Signatures LINCS/). Среди 10 наиболее активных ингибиторов экспрессии REDD1 нами для анализа были выбраны антипротозойное средство эметин и ингибитор протеинкиназы С – CGP-60474 [10].
Эметин является основным алкалоидом ипекакуаны, или рвотного корня – травянистого растения семейства Мареновых рода Carapichea. Он ингибирует синтез белка в эукариотических клетках путем необратимого блокирования движения рибосом вдоль цепи мРНК за счет ингибирования переноса пептидил тРНК из акцепторного в донорный сайт рибосомы [11]. В недавних исследованиях было показано, что эметин индуцирует апоптоз за счет повышения экспрессии генов проапоптотических факторов (антагонист-киллер Bcl-2 (BAK1), каспаза 8, каспаза 9, ассоциированный с клеточной гибелью белок DAXX, гранзим B (GZMB)) и снижения экспрессии антиапоптотических генов (Bcl-xL, рецептор эпидермального фактора роста (EGFR), фактор некроза опухоли (TNF)) [12, 13]. По своей структуре эметин относится к флавоноидам изохинолинового ряда [14], что предполагает его потенциальное ингибирующее действие на пролиферативную активность опухолевых клеток [15]. Такой эффект дает возможность рассматривать эметин в качестве потенциального противоопухолевого средства. В настоящее время проводят исследования его противоопухолевой активности in vitro на клетках линий рака легкого и мочевого пузыря [16, 17].
Фениламинопиримидины, такие как 3-{4-[2-(3-хлорфениламино) пиримидин-4-ил] пиридин-2-иламино}пропанол (CGP-60474), представляют собой перспективный класс ингибиторов протеинкиназы С с высокой степенью селективности, способный также конкурентно взаимодействовать с АТФ [18]. Были получены данные, что CGP-60474 является двойным ингибитором циклинзависимых киназ cdk1/cdk2 и запускает обратимую остановку клеточного цикла в G1/S фазах [18]. Таким образом, данный препарат также может быть рассмотрен в качестве потенциального противоопухолевого средства.
Выявленный цитотоксический и проапопто-тический эффект соединений на культивируемые клетки в настоящее время принято рассматривать как противоопухолевую активность препарата в системе in vitro . Соответственно, исходя из полученных данных о снижении жизнеспособности и индукции апоптоза при обработке клеток лейкоза и лимфомы исследуемыми соединениями, мы можем говорить о противоопухолевом потенциале эметина и CGP-60474. Более того, в наших исследованиях было показано, что совместное использование GC c эметином и CGP-60474 не приводит к повышению жизнеспособности и подавлению проапоптотического действия, и, следовательно, возможно комбинированное использование данных препаратов в исследованиях in vivo .
Для оценки трансактивационного потенциала были выбраны гены GILZ и FKBP51 , несущие в своих промоторах множественные GC-респонсивные элементы и являющиеся маркерами запуска процесса трансактивации. Для оценки транс-репрессорного потенциала были выбраны гены ALOX5AP для линии Granta и CCND2 для линии СЕМ, экспрессия которых регулируется провоспа-лительными и про-пролиферативными факторами NF-kB, AP-1 и др. и снижается при обработке GC. По совокупности эффектов на вышеупомянутые гены было показано, что эметин и CGP-60474 препятствуют TA, что способствует снижению интенсивности побочных эффектов при использовании
GC. Однако действие соединений не затрагивает механизм TR, это позволяет предположить, что терапевтические эффекты GC будут сохраняться в полном объеме. Совокупность биологических свойств соединений позволяет рекомендовать их дальнейшее исследование для включения в протоколы терапии лейкозов и лимфом, где проблема побочных эффектов при применении GC стоит особенно остро.
Заключение
На модели лейкозов и лимфом получены данные, подтверждающие подавление базального и
Список литературы Ингибирование экспрессии гена REDD1 для снижения побочных эффектов глюкокортикоидов
- Barnes P.J., AdcockI.M. Glucocorticoid resistance in inflammatory diseases. Lancet. 2009 May; 373(9678): 1905-17. doi: 10.1016/S0140-6736(09)60326-3.
- Baida G., Bhalla P., Kirsanov K., Lesovaya E., Yakubovskaya M., Yuen K., Guo S., Lavker R.M., Readhead B., Dudley J.T., Budunova I. REDD1 functions at the crossroads between the therapeutic and adverse effects oftopical glucocorticoids. EMBO Mol Med. 2015 Jan; 7(1): 42-58. doi: 10.15252/emmm.201404601.
- Miller W.L., Auchus R.J. The molecular biology, biochemistry, and physiology of human steroidogenesis and its disorders. Endocr Rev. 2011; 32(1): 81-151. doi: 10.1210/er.2010-0013.
- De Bosscher K., Beck I.M., Haegeman G. Classic glucocorticoids versus non-steroidal glucocorticoid receptor modulators: survival of the fittest regulator of the immune system? Brain Behav Immun. 2010 Oct; 24(7): 1035-42. doi: 10.1016/j.bbi.2010.06.010.
- Lim H.W., Uhlenhaut N.H., Rauch A., Weiner J., Hübner S., HübnerN., Won K.J., Lazar M.A., Tuckermann J., Steger D.J. Genomic redistribution of GR monomers and dimers mediates transcriptional response to exogenous glucocorticoid in vivo. Genome Res. 2015 Jun; 25(6): 836-44. doi: 10.1101/gr. 188581.114.
- Sofer A., Lei K., Johannessen C.M., Ellisen L.W. Regulation of mTOR and cell growth in response to energy stress by REDD1. Mol Cell Biol. 2005 Jul; 25(14): 5834-45. doi: 10.1128/MCB.25.14.5834-5845.2005.
- Lesovaya E., Agarwal S., Readhead B., Vinokour E., Baida G., Bhalla P., Kirsanov K., Yakubovskaya M., Platanias L.C., Dudley J.T., Budunova I. Rapamycin Modulates Glucocorticoid Receptor Function, Blocks Atrophogene REDD1, and Protects Skin from Steroid Atrophy. J Invest Dermatol. 2018 Sep; 138(9): 1935-1944. doi: 10.1016/j. jid.2018.02.045.
- Agarwal S., Mirzoeva S., Readhead B., Dudley J.T., Budunova I. PI3K inhibitors protect against glucocorticoid-induced skin atrophy. EBio-Medicine. 2019 Mar; 41: 526-537. doi: 10.1016/j.ebiom.2019.01.055.
- Савинкова А.В., Жидкова Е.М., Тилова Л.Р., Лаврова М.Д., Лылова Е.С., Кузин К.А., Портянникова А.Ю., Максимова В.П., Холодова А.В., Власова О.А., Фетисов Т.И., Кирсанов К.И., Белицкий Г.А., Якубовская М.Г., Лесовая Е.А. Варианты и перспективы перепрофилирования лекарственных препаратов для использования в терапии онкологических заболеваний. Сибирский онкологический журнал. 2018; 17(3): 77-87. [Savinkova A.K, Zhidkova E.M., Tilova L.R., Lav-rovaM.D., LylovaE.S., KuzinK.A., PortyannikovaA.Yu., Maximova V.P., Kholodova A.V., Vlasova O.A., Fetisov T.I., Kirsanov K.I., Belitskiy G.A., YakubovskayaM.G., LesovayaE.A. Variants and perspectives of drug re-purposing for cancer treatment. Siberian journal of oncology. 2018; 17(3): 77-87. (in Russian)]. doi: 10.21294/1814-4861-2018-17-3-77-87.
- Lamb J, CrawfordE.D., PeckD., ModellJ.W., Blatl.C., WrobelMJ., Lerner J., Brunet J.P., Subramanian A., Ross K.N., ReichM., Hieronymus H., Wei G., Armstrong S.A., Haggarty S.J., Clemons P.A., Wei R., Carr S.A., Lander E.S., Golub T.R. The Connectivity Map: using gene-expression signatures to connect small molecules, genes, and disease. Science. 2006 Sep; 313(5795): 1929-35. doi: 10.1126/science.1132939.
- Akinboye E.S., Rosen M.D., Bakare O., Denmeade S.R. Anticancer activities of emetine prodrugs that are proteolytically activated by the prostate specific antigen (PSA) and evaluation of in vivo toxicity of emetine derivatives. Bioorg Med Chem. 2017 Dec 15; 25(24): 6707-17. doi: 10.1016/j.bmc.2017.11.015.
- Akinboye E.S., Bakare O. Biological activities of emetine. The Open Nat Prod J. 2011; 4: 8-15. doi: 10.2174/1874848101104010008.
- Boon-Unge K., Yu Q., Zou T., Zhou A., Govitrapong P., Zhou J. Emetine regulates the alternative splicing of Bcl-x through a protein phosphatase 1-dependent mechanism. Chem Biol. 2007 Dec; 14(12): 1386-92. doi: 10.1016/j.chembiol.2007.11.004.
- Nomura T., Kutchan T.M. Three new O-methyltransferases are sufficient for all O-methylation reactions of ipecac alkaloid biosynthesis in root culture of Psychotria ipecacuanha. J Biol Chem. 2010 Mar 5; 285(10): 7722-38. doi: 10.1074/jbc.M109.086157.
- Белицкий Г.А., Кирсанов К.И., Лесовая Е.А., Якубовская М.Г. Механизмы антиканцерогенного действия флавоноидов. Успехи молекулярной онкологии. 2014; 1(1): 56-68. [Belitsky G.A., Kirsanov K.I., LesovayaE.A., YakubovskayaM.G. Mechanisms of carcinogenesis prevention by flavonoids. Advances in Molecular Oncology. 2014; 1(1): 56-68. (in Russian)]. doi: 10.17650/2313-805X.2014.1.1.56-68.
- Möller M., Herzer K., Wenger T., Herr I., WinkM. The alkaloid emetine as a promising agent for the induction and enhancement of drug-induced apoptosis in leukemia cells. Oncol Rep. 2007 Sep; 18(3): 737-44.
- StreetE.W. Cyclophosphamide plus emetine in lung cancer. Lancet. 1972 Aug 19; 2(7773): 381-2. doi: 10.1016/s0140-6736(72)91771-0.
- Meyuhas O. Ribosomal Protein S6 Phosphorylation: Four Decades of Research. Int Rev Cell Mol Biol. 2015; 320: 41-73. doi: 10.1016/ bs.ircmb.2015.07.006.


