Ингибирование пролиферации опухолевых клеток импульсно-периодическим рентгеновским излучением
Автор: Литвяков Н.В., Ростов В.В., Булдаков М.А., Чердынцева Н.В., Большаков М.А., Афанасьев К.В., Коровин С.Д., Кутенков О.П., Семенов С.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 (17), 2006 года.
Бесплатный доступ
В экспериментах изучалось действие импульсно-периодического рентгеновского излучения (ИПРИ) на опухолевые клетки мастоцитомы Р-815 и карциномы Эрлиха. Установлено существование зависимости антипролиферативного эффекта от частоты повторения импульсов и суммарной дозы ИПРИ. 5-минутное воздействие излучения с частотой повторения импульсов 13-16 Гц может практически полностью подавлять пролиферацию опухолевых клеток в дозах, которые на несколько порядков меньше используемых в лучевой терапии опухолей. Показана способность ИПРИ подавлять рост опухоли у мышей на 28-47 %. Обсуждаются возможные механизмы биологического действия ИПРИ.
Короткий адрес: https://sciup.org/14054243
IDR: 14054243
Текст научной статьи Ингибирование пролиферации опухолевых клеток импульсно-периодическим рентгеновским излучением
ИНГИБИРОВАНИЕ ПРОЛИФЕРАЦИИ ОПУХОЛЕВЫХ КЛЕТОК ИМПУЛЬСНО-ПЕРИОДИЧЕСКИМ РЕНТГЕНОВСКИМ ИЗЛУЧЕНИЕМ
Н.В. Литвяков1, В.В. Ростов2, М.А. Булдаков1, Н.В. Чердынцева1,М.А. Большаков3, К.В. Афанасьев2, С.Д. Коровин2, О.П. Кутенков2,С.fi. Семёнов3
НИИ онкологии Томского научного центра СО РАМН1 Институт сильноточной электроники СО РАН, г. Томск2 Томский государственный университет3
В экспериментах изучалось действие импульсно-периодического рентгеновского излучения (ИПРИ) на опухолевые клетки мастоцитомы Р-815 и карциномы Эрлиха. Установлено существование зависимости антипролиферативного эффекта от частоты повторения импульсов и суммарной дозы ИПРИ. 5-минутное воздействие излучения с частотой повторения импульсов 13‒16 Гц может практически полностью подавлять пролиферацию опухолевых клеток в дозах, которые на несколько порядков меньше используемых в лучевой терапии опухолей. Показана способность ИПРИ подавлять рост опухоли у мышей на 28‒47 %. Обсуждаются возможные механизмы биологического действия ИПРИ.
INHIBITION OF TUMOR CELL PROLIFERATION BY PULSE-REPETITIVE X-RAY IRRADIATION
N.V. Litvyakov1, V.V. Rostov2, M.A. Buldakov1, N.V. Cherdyntseva1, M.A. Bolshakov3, K.V. Afanasyev2, S.D.
Korovin2, O.P. Kutenkov2, S.Yu. Semenov3
Cancer Research Institute, Tomsk1
Institute of High Current Electronics Sibirian Department
Russian Academy of Science, Tomsk2
Tomsk State University 3
The effect of X-ray irradiation given in pulse-repetitive regimen on the proliferation of P-815 mastocytoma and Ehrlich carcinoma tumor cells was studied. The antiproliferative effect was found to depend on the pulse-repetitive frequency and sum absorbed dose of irradiation. Irradiation at an impulse frequency in a range 13‒16 Hz is appeared to completely inhibit tumor cell proliferation despite on the fact that absorbed doses are some fold less than those used in radiotherapy for cancer. The ability of pulse-repetitive X-ray to inhibit tumor growth rate in mice was shown. Mechanisms of the action of pulsed X-ray irradiation are discussed.
При лучевой терапии злокачественных новообразований используются рентгеновское и (-излучение, получаемое с помощью электронных ускорителей или изотопных источников, а также корпускулярные потоки альфа-частиц, электронов или нейтронов. Как правило, это источники ионизирующего излучения (ИИ) непрерывного действия. В тех случаях, когда имеется модуляция мощности во времени, период этой модуляции не варьируется. Сеанс радиотерапии обычно колеблется от единиц секунд до нескольких часов. При одинаковых дозовых нагрузках от разных источников возможны колебания в показателях одного и того же биологического эффекта [23], что зачастую связывается лишь с различием в поглощенной энергии на единицу длины (линейной передачей энергии ‒ ЛПЭ), то есть в пространственных размерах и плотности ионизованных частиц в треках. Общей закономерностью для всех типов ИИ является то, что для эффективного противоопухолевого действия необходимо обеспечить соответствующую дозу облучения. Но с повышением дозы начинают нарастать побочные эффекты излучений на нормальные ткани и организм в целом. Так, при облучении рентгеновскими лучами с ЛПЭ = 2 кэВ/мкм (характерно для тормозного излучения электронных ускорителей с ускоряющим напряжением 250 кВ) 10 % гибель нормальных клеток за счет нерепарированных двухнитевых раз-
Работа частично поддержана грантом РФФИ № 04-02-08029, грантом Фонда содействия отечественной медицине.
рывов ДНК соответствует поглощенной дозе порядка 1‒2 Гр [4]. Тяжесть клинических проявлений от лучевых повреждений определяется не только величиной поглощенной дозы, но и временем облучения и другими факторами.
По-видимому, новые возможности биологического действия ИИ могут появиться при использовании импульсно-периодического режима облучения с определенными частотами повторения импульсов. Рядом авторов выявлена зависимость биологического действия импульсно-периодического электромагнитного излучения от частоты следования импульсов, при этом величина эффекта была существенно выше, чем при воздействии неимпульсного излучения той же интенсивности [10‒12, 22, 24]. Нами продемонстрирована зависимость биологического эффекта импульсно-периодического СВЧ-излучения от частоты модуляции. Воздействие импульсно-периодическим СВЧ-излучением на частоте 10 ГГц (напряженность электрического поля до 2 кВ/см в импульсах длиной порядка 10-7с) на культуру опухолевых клеток мастоцитомы Р-815 приводило к значительному ингибированию их пролиферации в диапазоне частот повторения импульсов 10‒16 Гц [21], в то время как облучение на других частотах оказывалось неэффективным. В этой связи можно предположить, что импульсно-периодическое ИИ будет обладать значительно большей противоопухолевой активностью при облучении в малых дозах, чем непрерывное ИИ. Это позволило бы значительно уменьшить дозовую нагрузку на нормальные ткани и, соответственно, уменьшить развитие лучевых повреждений.
Цель работы заключалась в исследовании влияния импульсно-периодического рентгеновского излучения (ИПРИ) при различных дозах и частотах повторения импульсов на пролиферацию опухолевых клеток.
Материалы и методы
Для проведения исследований в Институте сильноточной электроники СО РАН (Томск) была специально создана рентгеновская установка на основе малогабаритного электронного ускорителя прямого действия СИНУС-150, позволяющая генерировать импульсно-периодическое излучение [1]. Высоковольтный импульс напряжения имел длительность на полувысоте 4 нс и амплитуду 270 кВ. Геометрия планарного диода с катодом диаметром 2 см, работающим в режиме взрывной электронной эмиссии, обеспечивала ток сильноточного электронного пучка до 4 кА. С учетом поперечного разлета частиц в промежутке катод ‒ анод (6 мм) диаметр электронного пучка на аноде составлял около 3 см. Охлаждаемый проточной водой анод из 0,8-мм нержавеющей стали выполнял также функцию конверсии энергии электронов в поток тормозного рентгеновского излучения. Фильтрация низкоэнер-гетичной компоненты излучения осуществлялась двумя пластинами из стали суммарной толщиной 1,6 мм и промежуточным слоем воды толщиной 6 мм. Стабильность амплитуды импульсов диодного напряжения в режиме тактовой частоты непрерывно контролировалась с помощью емкостного датчика и цифрового осциллографа. Среднеквадратичное отклонение амплитуд импульсов в диапазоне частот повторения от 3 до 40 Гц не превышало 1,5 %.
В соответствии с численными расчетами коэффициент конверсии при передаче энергии из электронного потока в тормозное излучение составляет около 0,2 %. Расчетный энергетический спектр фотонов имеет максимум в области 90 кэВ, а основная часть потока квантов (около 90 %) находится в диапазоне 60‒200 кэВ.
В качестве основной дозиметрической методики использовалась стандартная процедура измерений поглощенной дозы LiF-детекторами в комплекте поверенного дозиметра КДТ-02М. Наборы таблеток по 3 шт. устанавливались на различных расстояниях от коллектора, а необходимая для минимизации погрешности суммарная поглощенная доза за акт измерения набиралась числом импульсов. В частности, на расстоянии 20 см от анода ускорителя по оси системы измеренное значение поглощенной дозы в среднем составило 2,1 Рад (0,021 Гр) за 103 импульсов. Таким образом, в данной точке пространства обеспечивается 21 мкГр за один импульс при мощности экспозиционной дозы в одном импульсе порядка 5*105 Р/с. Погрешность измерения дозы оценивается величиной около +15 % при достоверности 95 %. Полученные данные по дозам на различных расстояниях от анода ускорителя были использованы для сравнения с показаниями вспомогательных средств дозиметрического контроля: электростатических дозиметров с кварцевым волокном VICTOREEN 541R («Victoreen Quartz Dosimeters», США), а также их аналогов фирмы “Arrow-Tech” в пластиковом корпусе и шкалой 200 mR. Для этих дозиметров не наблюдалось снижение эффективности собирания ионов вплоть до уровня мощности доз порядка 3 х 106 Р/с. Таким образом, в экспериментах поглощенная доза рентгеновского излучения за один импульс (D0) могла варьироваться при удалении пробирки с клеточной суспензией от анода в пределах от максимальной дозы 200 мкГр/имп до минимальной дозы порядка 0.1 мкГр/имп (нa рaс-стоянии 220 см). Все сеансы облучения имели продолжительность 5 мин. Поэтому суммарная доза облучения в соответствии с частотой повторения импульсов f (Гц) могла рассчитываться по формуле D3 = 300*f*D0.
Для сравнения эффектов импульсно-периодического и непрерывного рентгеновского излучений объекты облучались на установке RUM-17 (ускоряющее напряжение 210 кВ, ток пучка 15 мА) при том же времени экспозиции (5 мин) с эквивалентными поглощенными дозами. В данном случае стандартные тестовые дозиметры помещались в зону облучения.
В работе использовались клетки мастоцитомы Р-815 и карциномы Эрлиха, поддерживаемые в асцитной форме на мышах линии DBA2j и C57Bl/6j co-ответственно. Пролиферативную активность клеток оценивали по уровню включения Н3-тимидина в ДНК опухолевых клеток. Клеточную суспензию в объеме 2 мл помещали в стеклянные флаконы, которые подвергались облучению (опыт), либо экспонировали перед ускорителем без его включения (группа «ложного» облучения). После облучения клетки переносили в 96-луночные планшеты по 0,2 мл на лунку из расчета по 10 лунок на каждый флакон и добавляли Н3-тимидин по 1 мкКи/лунку. Клетки инкубировались 24 ч при 37o C ʙ атмосфере c 5 % CO2. Включение метки в ДНК измеряли c помощью $ -счетчика MicroBeta Trilux (Perkin Elmer). B качестве результата использовали среднее по 10 лункам значение числа импульсов в минуту (cpm ‒ count per minute).
Действие ИПРИ на опухоль in vivo оценивали на мышах линии С57Bl/6j с асцитной карциномой Эрлиха. Мышей-опухоленосителей помещали в пластиковую камеру и облучали область живота в течение 5 мин. Мышей группы «ложного облучения» также помещали в камеру на 5 мин, но облучение не проводили. Подсчет опухолевых клеток в асците проводили на 10-е сут после трансплантации.
После облучения эритроцитов крови человека определяли уровень ПОЛ по концентрации малонового диальдегида (МДА) [25].
Индукцию экспрессии гeна р53 в опухолевых клетках мастоцитомы Р-815 после воздействия ИПРИ оценивали методом обратно-транскриптазной ПЦР. Через 2 и 4 ч после облучения из опухолевых клеток выделяли мРНК («Рибозоль», НИИ эпидемиологии МЗ РФ, Москва). Концентрацию полученной мРНК определяли спектрофотометрически по адсорбции при длине волны 260 нм. 1 мкг мРНК брали для постановки реакции обратной транскрипции и получения на ее матрице кДНК (набор «Реверта», НИИ эпидемиологии МЗ РФ, Москва). С полученной кДНК проводили ПЦР, как описано в [3] с праймерами к 7-му экзону гeна р53 сeнс ‒ GCC TCA TCT TGG GCC TGT GTT ATC, антисенс ‒ AAA TGT GAT GAG AGG TGG ATG GGT AGT AG, размер амплифицируемого фрагмента составляет 266 bp. Электрофорез продуктов амплификации проводили в 2,5 % агарозном гeлe ʙ TBE-буфере, окрашивали бромистым этидием. Об экспрессии гeна р53 в опухолевых клетках судили по наличию полоски 266 bp на дорожках гeля.
Статистическую значимость различий оцениваемых величин между группами облученных и «ложно облученных» объектов определяли с помощью нe-параметрического критерия Вилкоксона ‒ Mанна ‒ Уитни.
Результаты и обсуждение
Оценивалось влияние ИПРИ с разной частотой следования импульсов на пролиферацию опухолевых клеток мастоцитомы Р-815 и карциномы Эрлиха. В серии экспериментов с высокой воспроизводимостью показано выраженное ингибирующее действие ИПРИ в малых дозах (общая поглощенная доза D ∑ =30-60 мГр) при частотах следования импульсов 10, 13, 16 Гц (рис. 1). В нескольких повторах опыта ингибирующий эффект проявлялся на частотах 13, 16 Гц (рис. 1 а, б), в других ‒ на частотах 10, 16 Гц (рис. 1 в, г). Механизмы этого феномена пока не ясны. По нашим предварительным данным, проявление различной реакции клеток может быть ассоциировано с сезонными хронобиологическими ритмами. Следует особо отметить, что при воздействии ИПРИ с другими частотами следования импульсов ингибирующий эффект или отсутствовал, или не повторялся в других опытах.
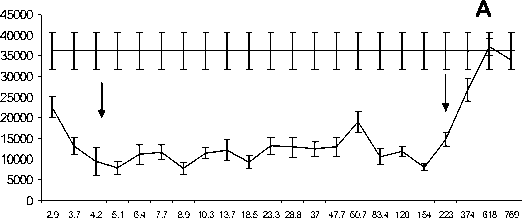
На следующем этапе была изучена дозовая зависимость эффектов при нескольких фиксированных частотах следования импульсов ИПРИ. На рис. 2 представлены результаты по влиянию ИПРИ на пролиферацию опухолевых клеток мастоцитомы Р-815 при частоте повторения импульсов 10 и 16 Гц в диапазоне доз D3 от 0,2 до 58 мГр и при частоте 13 Гц в диапазоне доз от 3 до 770 мГр. Антипролифератив-ный эффект излучения проявляется в определенном диапазоне доз, и этот диапазон неодинаков для разных частот следования импульсов (на рис. 2 диапазон отмечен вертикальными стрелками). При асимптотически малых поглощенных дозах (D < 1 мΓp) пpo- явление эффекта исчезает, а при дозах больше 600 мГр отличие от группы ложного облучения также незначительно. Таким образом, ингибирующее действие ИПРИ при фиксированной тактовой частоте в диапазоне 10‒16 Гц проявляется в некотором определенном диапазоне доз.
Весьма вероятно, что относительная биологическая эффективность импульсно-периодического рентгеновского излучения на частотах воздействия в пределах 10‒16 Гц может резко возрастать в силу каких-то неизвестных закономерностей. В самом деле, известно, что столь существенный эффект ингибирования пролиферации при непрерывном рентгеновском излучении с энергией фотонов 250 кэВ достигается при поглощенной дозе порядка 10 Гр [2]. Что же касается действия непрерывного ИИ при низкой суммарной дозе 20‒100 мГр, мы показали, что после 5минутной экспозиции опухолевых клеток мастоцитомы Р-815 отмечается незначительная стимуляция клеточной пролиферации (табл. 1).
Таблица 1 Влияние импульсно-периодического и стационарного рентгеновского излучения на пролиферацию опухолевых клеток мастоцитомы Р-815 in vitro
|
D v за 5 мин облучения, мГр |
Частота следования импульсов, Гц |
ИПРИ |
Стационарное рентгеновское излучение |
|
10,6 |
3 |
49942±3102 #* |
н/о |
|
21,6 |
6 |
95015±4848 |
87728±4534 |
|
28,8 |
8 |
90626±5276 |
н/о |
|
36 |
10 |
2230±354 #* |
105967±2830# |
|
46,8 |
13 |
85048±5910 |
113205±2317# |
|
57,6 |
16 |
3406±885#* |
80956±5376 |
|
68,4 |
19 |
93032±6040 |
н/о |
|
79,2 |
22 |
85196±8471 |
н/о |
|
90 |
25 |
96120±4280 |
111916±4152 |
|
100,8 |
28 |
28937±1474# |
н/о |
|
126 |
35 |
101869±5281 |
н/о |
|
146 |
40 |
2778±346# |
н/о |
|
Ложное облучение |
74927±5382 |
81616±6068 |
|
Примечание: приведены значения уровня включения Н3-тимидина в ДНК опухолевых клеток (cpm), # ‒ статистически значимые различия с группой «ложного облучения»; * ‒ с группой стационарноого рентгеновского облучения (p<0,05); н/o ‒ не определяли.
После исследований in vitro представлялось целесообразным оценить влияние ИПРИ на рост опухоли у мышей in vivo. B группе животных, тотально облученных в день трансплантации опухоли (D3=47 мГр), торможение роста опухоли составило 16 % (клеточ- ность асцита составила 355 ± 17 млн) по сравнению с группой «ложного облучения» (424 + 10 млн). В группе животных, облученных на 7-е сутки (D3=47 мГр), и группе животных, облученных трехкратно (0, 3, 7 сут D3=141 мГр), ингибирование роста опухолевого узла составило 21% (335 + 12 млн) и 23 % (326 + 23 млн) соответственно. Максимальный эффект наблюдался в группе животных, облученных на 3-и сут после трансплантации опухоли (D?=47 мГр), и составил 28 % (306 +18 млн). Полученный эффект усиливался при введении гипоксического радиосенсибилизатора (мисо-нидазол в дозе 40 мг/кг за 1 час до облучения) и достигал 47 % (226 + 39 млн) по отношению к группе «ложного облучения». Увеличение дозы облучения при трехкратной схеме воздействия не приводит к усилению противоопухолевого эффекта ИПРИ.
Попытки объяснения эффектов ингибирования пролиферации клеток при их облучении ИПРИ, вероятно, следует связывать с возможным воздействием либо на клеточный геном, либо на мембраны и мембранные комплексы [17]. Изменения в этих системах могут быть взаимосвязаны между собой, влияя друг на друга и на итоговый эффект, в зависимости от поглощенной дозы и других факторов. Мы попытались проанализировать основные характеристики осуществляемого воздействия на клетки.
Необходимо учитывать, что импульс радиационного воздействия создает в клетке ряд ионизованных пар, электронов и возбужденных молекул. В случае относительно короткой длительности импульсов и при достаточно высокой дозе могут иметь место нелинейные эффекты, обусловленные совмещением треков и повышенным выходом реакций продуктов радиолиза между собой. То есть в принципе вполне возможны условия для повышения локальной концентрации активных частиц, что объясняло бы возрастание ОБЭ. Однако оценки показывают, что вероятность таких событий для характерного диапазона используемых доз порядка 1‒10 мкГр/имп относительно мала. Таким образом, хотя роль длительности импульсов представляет интерес для экспериментальной проверки, вряд ли она была существенной в проведенных экспериментах.
Допустим для определенности, что поглощенная доза составляет 10 мкГр/имп в объеме 104 мкм3, который может соответствовать сферической клетке с диаметром 13 мкм. В таком объеме вещества с плотностью 1 г/см3 (вода, клеточная среда) в среднем выделяется энергия 600 эВ. Данная энергия распределяется главным образом между 18 парами ионов и электронов и 50‒70 возбужденных молекул [17]. Образо- вавшиеся в водной среде электроны достаточно быстро гидратируются и при относительно высокой подвижности имеют характерное время жизни в миллисекундном диапазоне длительностей. В принципе они могут обеспечивать кратковременное изменение потенциалов внутриклеточных мембран. Время жизни и активность остальных повреждающих агентов в клетке разнообразны, как и набор мишеней. В порядке убывания химической активности обычно рассматриваются короткоживущие радикалы OH. (время жизни 10-9 с), пергидроксидный радикал HO2. (10-8 с), синглетный кислород 1O2 (10-6с), супероксид анион кислорода O2-. (10-6с) [14]. К числу сравнительно долгоживущих метаболитов в клетках относят: нитроксиль-ный радикал NO2. (10-1 с), а также перекись водорода H2O2 и перекисные радикалы RO2. [6, 15]. Средний суммарный выход прямых и непрямых (активными радикалами) повреждений нуклеиновых кислот распределяется следующим образом: разрывы водородных связей ‒ до 120 (на 600 эВ), распад оснований ‒ 6‒ 18, одиночные разрывы ‒ 1, 2‒2 ,4 и, наконец, двойные разрывы ‒ 0,0024‒0,03 [17]. Известно, что при нормально функционирующей системе репарации подавляющее большинство подобных повреждений «залечивается». В силу гетерогенной радиочувствительности хромосомной ДНК массовая доля наиболее чувствительной ‒ якорной ‒ ДНК составляет порядка 10-2 [4, 9]. Из этой доли только часть двунитевых разрывов не воссоединяется или репарируется ошибочно с вероятностью до 0,25 для ЛПЭ = 2 кэВ/мкм. Заметим, что повреждения, связанные с ошибками репарации, вносят основной вклад в случае редко-ионизирующего излучения, к которому относятся (-лучи [4, 16, 12]. При умножении на число импульсов N ≈ 4х103 за весь сеанс облучения в итоге получаем, что вероятность повреждения генома в выделенной клетке остается много меньше единицы. Отсюда следует вывод, что если повреждения генома и существуют, то они могут быть следствием либо активации эндонуклеаз, либо угнетения системы репарации, например, за счет истощения ресурсов в других процессах.
Ряд авторов [6, 15, 18] склоняются к мнению, что фосфолипидные мембраны внутриклеточных структур весьма уязвимы для прямого и непрямого повреждения под действием радиоактивного облучения в малых дозах, а биологический механизм подобен токсическому действию активных форм кислорода и прооксидантных форм, таких как NO-радикал. В самом деле, уязвимость мембран, проявляющуюся в снижении или полной потере барьерных функций, можно объяснить целым рядом причин. Это и значи- тельная объемная доля липидов, что важно с точки зрения теории мишеней; и развитая поверхность мембран, особенно внутренних мембран митохондрий, что должно повышать вероятность встречи с диффундирующими активными радикалами; и повышенная концентрация кислорода в жирах, по сравнению с водной фазой и средней внутриклеточной концентрацией (до 10 раз) [20]. Имеется и ряд условий для амплификации воздействия:
-
1) возможность протекания цепных реакций перекисного окисления липидов;
-
2) значительный запас свободной энергии в клетках, связанный с градиентами концентраций ионов на мембранах,
-
3) наличие электрического поля в мембранах, возможность образования дефектов и обратимого изменения проницаемости мембран для ионов, а в критической ситуации и возможность самопробоя,
-
4) наличие ряда локализованных на внутренней мембране митохондрий белков-переносчиков электронов и вероятность флавопротеидных переносчиков из триплетного состояния образовывать синглетный кислород, добавляя число активных окислителей (полная аналогия с фотодинамическими эффектами) [7].
Поясним возможность инициирования окислительных процессов при действии на доноры электронов ‒ пункт (4). Для восстановленной формы ферментов, содержащих в активном центре металлы переменной валентности (Fe, Cu, Zn, Co и др.) и осуществляющих перенос электронов, высота потенциального барьера для электронов на внешних оболочках атомов металла относительно невелика. Повышение вероятности туннелирования может происходить за счет снижения потенциального барьера, например при накачке колебательных степеней у соседних атомов. Поэтому различные типы внешнего воздействия, такие как раскачка макромолекулы-диполя в интенсивном СВЧ-поле, поглощение фотона или столкновение с возбужденной молекулой, могут облегчить окисление фермента, например, с переходом Fe2+ 6 Fe3+ и переносом электрона на не свойственный для нормального процесса субстрат. Примечательно, что механизм «облегченного» туннелирования электронов лежит в основе действия химических дозиметров ионизирующего излучения [19]. Например, ферро-сульфатный раствор, с близкой к внутриклеточной молярной концентрацией железа, характеризуется весьма высоким выходом G(Fe3+) . 16/100эВ в широком диапазоне доз излучения и энергий квантов ‒ от десятков кэВ до нескольких десятков МэВ. Причем величина G(Fe3+) лишь незначительно снижается при
25000 0
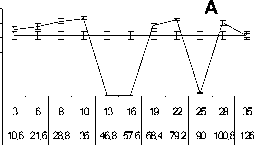
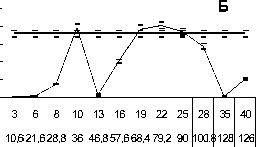
Рис. 1. Влияние импульсно-периодического рентгеновского излучения нa пролиферацию опухолевых клеток. A, В ‒ мастоцитома
Р-815; Б, Г ‒ карцинома Эрлиха.
Примечание: по оси абсцисс ‒ частота следования импульсов (Гц) и соответствующая ей суммapнaя доза облучения за 5 мин (мГp); по оси ординат ‒ включение Н3-тимидина в ДНК (cpm); пpямaя линия ‒ гpуппa ложного облучения.
Рис. 2. Зависимость от дозы ингибирующего действия импульсно-периодического рентгеновского излучения на пролиферацию опухолевых клеток мастоцитомы Р-815 при различных частотах следования импульсов: А
‒ частота 13 Гц; Б ‒ частота 10 Гц; В ‒ частота 16 Гц.
Примечание: по оси абсцисс ‒ суммарная доза облучения за 5 мин (мГр); по оси ординат ‒ включение Н3-тимидина в ДНК (cpm); пpямaя линия ‒ гpуппa ложного облучения
Г
В
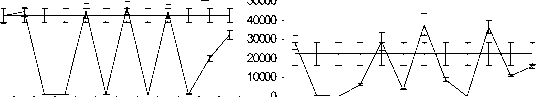
10,6 21,6 28,8 36
46,8 57,6 68,479,2 90
100,8128
10,6 21,6
28,8 36
46,8 57,6
68,479,2
100,8 128
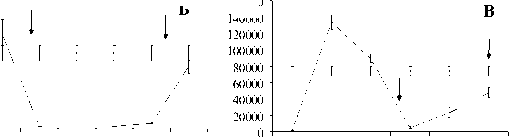
0,2 0,7 2,9 7,8 20,4 36
0,4 1,2 4,6 12,5 32,6 57,6
увеличении pH (в штатном варианте pH < 1, a пpи pH = 6 ‒ G(Fe3+) » 13) и дефиците растворенного кислорода, но может существенно возрастать в присутствии органических молекул [19]. С другой стороны, окисление активными формами кислорода аминокислотных остатков, расположенных близко к активному центру фермента, может изменять eго активность. Так, дегидрогеназы, содержащие железо-серные центры, инактивируются пpи одноэлектронном восстановлении кислорода и последующем образовании гидропероксида и гидроксид радикала [6]. К числу инактивируемых радикалами ферментов принадле- жат и ряд антиоксидантов. В данном контексте действие видимого света нa мембранные комплексы даже в отсутствии специальных фотосенсибилизаторов [14] и порождаемый, главным образом, за счет иниции-pовaния 1O2 фотодинамический эффект [8] могут pac-сматриваться как частный случай окислительного стресса в ряду других факторов воздействия.
Таким образом, не исключено, что облучение клетки ИПРИ сопровождается окислительным стрессом со всеми сопутствующими процессами, характерными для фотодинамического эффекта [8]. Принципиальное отличие состоит в относительно высокой проникающей способности рентгеновского излучения и, соответственно, возможности нелокального действия. Однако совершенно новое качество и количественное наполнение эффектов обусловлены тактовой частотой импульсов. Можно предполагать, что в цепи критических событий, происходящих на отдельных митохондриях клетки, повергнутой облучению импульсами ионизирующего излучения, начальными звеньями могут быть нарушения работы дыхательных ансамблей, повышенная концентрация активных радикалов и, по-видимому, обратимое повышение проницаемости внутренних мембран. В этом случае процесс возбуждения митохондриями колебаний концентрации ионов Ca2+ в цитоплазме [13] мог бы стать одним из факторов вынужденной пространственно-временной самоорганизации для клетки в целом. Имея в виду важную роль митохондрий в регуляции окислительного метаболизма в клетках и известную взаимосвязь Ca2+ с системой циклических нуклеотидов, модуляция концентрации кальция в цитоплазме может обусловить угнетение или инициирование синтеза ДНК. По-видимому, при таком механизме возможны не только ингибирование активной пролиферации, но и стимуляция апоптоза (вероятнее всего, через активацию фосфолипаз и необратимые повреждения мембран). Подобное развитие процессов косвенно подтверждается результатами дополнительных экспериментов. Факт инициирования перекисного окисления липидов под действием ИПРИ с различной интенсивностью в зависимости от частоты повторения импульсов был установлен в опыте с эритроцитами свежей крови человека по изменению концентрации мaлонового диальдегида (МДА). Концентрация МДА статистически значимо повышалась для частот 13 и 16 Гц (3,01 + 0,14 и 3,30 + 0,24 мкмоль/л) и снижалась при частоте 10 Гц (1,18 + 0,07 мкмоль/л) по сравнению с группой «ложного» облучения (2,07 + 0,13 мкмоль/л). Имеются также предварительные данные, полученные на клетках мастоцитомы Р-815, которые указывают на появление морфологической картины, характерной для апоптозных клеток при использовании частот 13 и 16 Гц. Через 4 ч (но не через 2 ч) после облучения ИПРИ при тактовых частотах 10 и 16 Гц в опухолевых клетках мастоцитомы Р-815 происходит экспрессия мРНК гeна р53. С одной стороны, это может свидетельствовать об индукции апоптоза, с другой ‒ не исключена возможность простого торможения клеток в G1 фазе клеточного цикла и включения систем репарации. Так или иначе это выразится в конечном результате ‒ снижении включения Н3-тими-дина в ДНК опухолевых клеток (рис. 1).
Таким образом, ИПРИ оказывает ингибирующее влияние на пролиферацию опухолевых клеток. Эф- фект зависит от частоты повторения импульсов и величины поглощенной дозы. При выборе определенных частот повторения импульсов ИПРИ подавляет пролиферацию опухолевых клеток при дозах, которые на несколько порядков меньше доз, используемых в лучевой терапии опухолей. В целом представляется необходимым расширить круг задач для последующих экспериментов как с точки зрения изучения механизмов, так и в практическом направлении.


