Инновационные гибридные иммуномодуляторы растений на основе хитозана и биоактивных антиоксидантов и прооксидантов
Автор: Попова Э.В., Домнина Н.С., Сокорнова С.В., Коваленко Н.М., Тютерев С.Л.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Иммунитет и защита растений
Статья в выпуске: 1 т.56, 2021 года.
Бесплатный доступ
При инфицировании растений патогенами происходит смещение равновесия между окислительными процессами и антиоксидантной активностью в сторону усиления образования активных форм кислорода (АФК), что влияет на ход развития болезни и по-разному проявляется у фитопатосистем, различающихся по типу паразитизма. В ряде случаев для защиты растений от патогенов необходима генерация АФК (биотрофы), тогда как в других (некротрофы) - наоборот, требуется присутствие антиоксидантов. Влияя определенным образом на индукцию АФК и антиоксидантов, можно регулировать восприимчивость и устойчивость растений к патогенам разной трофности. Нами впервые созданы инновационные гибридные иммуномодуляторы (Хит-Ван+СК), в структуре которых имеются фрагменты биологически активных веществ, обладающих антиоксидантным и прооксидантным действием. Основой таких систем служит хитозан (Хит), содержащий ковалентно присоединенный ванилин (Хит-Ван), который понижает количество АФК за счет стимулирования клеточной антиоксидантной активности (антиоксидантное действие), и связанную лабильной ионной связью салициловую кислоту (СК), наоборот, генерирующую АФК (прооксидантное действие). Изучено действие созданных систем при формировании иммунного ответа растениями-хозяевами ( Triticum aestivum L.) при заражении патогенами с разным типом питания: гемибиотрофом Cochliobolus sativus Drechs (темно-бурая пятнистость) и биотрофом Puccinia recondita Roberge ex Desmaz f. sp. tritici (бурая ржавчина). Показано, что хитозан, содержащий ионно-связанную СК (Хит+СК), повышает устойчивость пшеницы к биотрофу P. recondita и гемибиотрофу C. sativus , тогда как (Хит-Ван) эффективно индуцирует устойчивость только к гемибиотрофу C. sativus. Эффективность (Хит+СК) как индуктора устойчивости в 1,2-2,0 раза превышает индуцирующее действие хитозана. Установлено, что по отношению как к биотрофу, так и к гемибиотрофу гибридные иммуномодуляторы (Хит-Ван+СК) при молярном соотношении ванилина и салициловой кислоты в диапазоне 1:1-1:2 демонстрируют высокую иммуномодулирующую активность независимо от величины молекулярной массы хитозана, что выражается в снижении площади поражения листьев темно-бурой пятнистостью и бурой ржавчиной более, чем в 10 раз по сравнению с контролем. Биологическая эффективность гибридной системы как иммуномодулятора коррелирует с содержанием в ней СК, что подтверждает участие сигнальной салицилатной системы в индукции иммунитета. Установлено, что важную роль в проявлении индуцированной устойчивости гибридными иммуномодуляторами играют антиоксидантные ферменты (супероксиддисмутаза, каталаза и пероксидаза), регулирующие соотношение между окислительными процессами и антиоксидантной активностью. Результаты изучения влияния созданных гибридных систем на основе хитозана (Хит-Ван+СК) на активность антиоксидантных ферментов в системе пшеница- C. sativus показали, что повышение устойчивости растений к патогенам реализуется через контроль интенсивности окислительно-восстановительных процессов в растениях, который обусловлен присутствием в структуре гибридных иммуномодуляторов определенного про- и антиоксидантного баланса. Предложен механизм поведения гибридных иммуномодуляторов, обеспечивающий повышение болезнеустойчивости растений на начальных этапах внедрения патогена, который заключается в способности экзогенной СК, связанной с хитозаном лабильной ионной связью, ингибировать каталазу и пероксидазу, в результате чего в клетках накапливается перекись водорода, способная усиливать экспрессию генов, определяющих защиту от патогенов.
Хитозан, индуцированная устойчивость, салициловая кислота, ванилин, пшеница, темно-бурая пятнистость, бурая ржавчина
Короткий адрес: https://sciup.org/142229460
IDR: 142229460 | УДК: 633.11:632.959 | DOI: 10.15389/agrobiology.2021.1.158rus
Текст научной статьи Инновационные гибридные иммуномодуляторы растений на основе хитозана и биоактивных антиоксидантов и прооксидантов
Увеличение производства зерна яровой мягкой пшеницы остается актуальной задачей, поскольку эта культура занимает до 70 % площадей зерновых. Ежегодно в разных регионах России на зерновых культурах отмечают неблагополучную фитосанитарную обстановку, которая отрицательно сказывается на количестве и качестве урожая. К наиболее распространенным и вредоносным листовым болезням мягкой пшеницы (Triticum aestivum L.) относят бурую ржавчину (возбудитель Puccinia recondita Roberge ex Desmaz f. sp. tritici) и темно-бурую пятнистость (возбудитель Cochliobolus sativus Drechs) (1, 2). Для защиты растений от болезней в основном применяются химические методы, среди которых преобладает обработка фунгицидами, проявляющими высокую эффективность, но вместе с тем оказывающими негативное воздействие на окружающую среду (3). В этой связи особую актуальность приобретает разработка агротехнологий с использованием метода индуцированной устойчивости, основанного на активации врожденных защитных механизмов растений и формировании у растений устойчивости к возбудителям болезней. Создаваемые на указанных принципах индукторы болезнеустойчивости растений представляют собой экологически безопасную альтернативу фунгицидам, применяемым как за рубежом, так и в России (4-6).
Развитие методов молекулярной биологии привело к более полному пониманию механизмов защиты растений от воздействия патогенов и выявлению роли различных сигнальных систем в становлении защитных реакций, приводящих к координированному биохимическому и физиологическому защитному ответу на заражение возбудителем болезни (4, 7-10). Возможность контроля патологического процесса связана со способностью индукторов направлять обмен веществ в неблагоприятную для патогена сторону (11-13). При этом формирование защитного ответа обусловлено экспрессией генов под действием сигнальных молекул (10, 14-16) и экзогенных биологически активных веществ (БАВ) — иммуномодуляторов (7, 11).
Многочисленные исследования убедительно показали, что в ответ на действие факторов различной природы происходит смещение про-/ан-тиоксидантного равновесия, воздействуя на которое с помощью биологически активных веществ можно активизировать генетический потенциал защитных реакций и формировать иммунный ответ. В связи с этим в последнее время все более популярной становится гипотеза, согласно которой адаптация растений к действию стрессоров различной природы в значительной степени зависит от функционирования антиоксидантной системы. Известно, что заражение растений на первоначальном этапе сопровождается резким возрастанием интенсивности окислительных процессов, выражающимся в генерации активных форм кислорода (АФК) (окислительный взрыв), которые включают цепь последующих защитных реакций (16-19). К АФК относятся супероксидный анион-радикал, гидроксильный радикал, перекись водорода (Н 2 О 2 ), оксид азота. АФК играют двойную роль во взаимодействии хозяина с патогеном. Во-первых, они оказывают прямое антимикробное действие, укрепляют барьерные свойства клеточных стенок посредством полимеризации фенольных соединений (20, 21). Во-вторых, АФК как сигнальные молекулы участвуют в формировании приобретенной системной устойчивости к патогенам, регулируя экспрессию генов, активность защитных систем (22, 23) и включая экспрессию генов PR белков (pathogenesis-related proteins), синтез фитоалексинов и запуск реакции сверхчувствительности (hypersensitive response, HR). Следует отметить, что среди АФК наиболее изучена роль перекиси водорода — наиболее долгоживущего трансмембранного сигнала в клетках растений (18, 19).
По имеющимся в настоящее время данным (23-27), защита растений от биотрофных патогенов направлена на генерацию АФК, при этом высокое содержание АФК благоприятствует патологическому процессу, вызываемому некротрофами. В случае гемибиотрофных патогенов, характеризующихся комбинированной стратегией питания, сведения о роли АФК часто носят противоречивый характер и зависят от системы хозяин— патоген (25, 26, 28). Предполагается, что биотрофную и некротрофную фазы развития патоген проходит при разных концентрациях перекиси водорода (26). О важной роли баланса между образованием и деградацией АФК (на примере H2O2) в формировании защитных реакций растений и их выживании при стрессах различной природы сообщается во многих публикациях (26, 28, 29).
Считается, что поддержание концентрации уже образовавшихся в клетке АФК на достаточном уровне возможно за счет регуляции активности антиоксидантных ферментов (30-32). Отметим, что исследования, направленные на выявление роли антиоксидантых ферментов в формировании устойчивости растений к стрессовым факторам, ведутся достаточно интенсивно как в России, так и за рубежом (30, 31, 33). Известно, что при сильной инфекционной нагрузке собственные антиоксиданты не могут нейтрализовать перепроизводство АФК, что приводит к гибели клеток и развитию некроза. Следовательно, увеличение антиоксидантной активности растений должно повышать их толерантность к развитию некрозов, вызванных патогенами или абиотическими стрессами (31-33). Таким образом, влияя определенным образом на индукцию АФК и антиоксидантов, можно регулировать восприимчивость и устойчивость растений к патогенам. Для управления этими процессами целесообразно использовать иммуномодуляторы, способные контролировать не только генерацию АФК, но и их утилизацию. Несмотря на то, что интенсивные исследования по разработке эффективных иммуномодуляторов активно продолжаются во всем мире, нет сведений о создании с помощью БАВ различной природы (прооксидантной и антиоксидантной) препаратов с направленной регуляцией формирования индуцированного фитоиммунитета растений, в частности при инфицировании пшеницы патогенами с различным типом питания (некротрофным и ге-мибиотрофным). В связи с этим актуально получение новых индукторов, способных регулировать соотношения между окислительными процессами и антиоксидантной активностью в тканях растений при заражении пшеницы патогенами с разной трофностью.
Нами впервые созданы гибридные иммуномодуляторы на основе хитозана, в структуре которых имеются фрагменты биологически активных веществ (ванилина и салициловой кислоты), обладающих анти- и проокси-дантным действием. Полученные гибридные иммуномодуляторы эффективны в отношении возбудителей темно-бурой пятнистости и бурой ржавчины пшеницы (соответственно гемибиотроф и биотроф). Показано, что их модулирующее влияние проявляется через воздействие на активность основных антиоксидантных ферментов растений — супероксиддисмутазы, каталазы и пероксидазы в процессе развития индуцированной устойчивости.
Цель нашего исследования состояла в разработке иммуномодуляторов — производных хитозана с прооксидантной и антиоксидантной активностью и в оценке их влияния на устойчивость пшеницы к темно-бурой пятнистости (возбудитель — гемибиотроф Cochliobolus sativus Drechs) и к бурой ржавчине (возбудитель — биотроф Puccinia recondita Roberge ex Desmaz f. sp. tritici ).
Методика. Для создания иммуномодуляторов хитозаны с молекулярной массой 6,5; 60 и 100 кДа (Хит) получали методом окислительной деструкции (34) из хитозана с молекулярной массой 150 кДа и степенью деацетилирования 85 % («Биопрогресс», Россия). Производные хитозана, содержащие 25 масс.% ковалентно связанных фрагментов ванилина (Ван), — (Хит-Ван) синтезировали через основание Шиффа с последующим восстановлением избытком боргидрида натрия (35). Количество введенных фрагментов ванилина определяли по УФ-спектрам (спектрофотометр UV-2600, 160
«Shimadzu», Япония) при X = 280 нм (35). Ионную природу связи между хитозаном и салициловой кислотой (СК) в производных хитозана (Хит+СК) (образование соли) подтверждали на основании ИК-спектров (спектрометр Spectrum BX, «Perkin Elmer, Inc.», США) по наличию характеристических полос 1552,92 и 1386,12 см - 1 от карбоксилатной группы СОО - , а также широкой полосы в области 3100-2600 см - 1, отражающей валентные колебания от функциональных групп NH 3 + и OH (36).
Хитозан, содержащий одновременно ковалентно присоединенный ванилин и ионно-связанную салициловую кислоту, представляет собой гибридные системы (Хит-Ван+СК). Синтез таких систем проводили введением СК в (Хит-Ван), содержащего 25 масс.% ванилина, варьируя количество СК от 1:0,5 до 1:2 по отношению к присоединенному ванилину.
Индуцирующую активность исследуемых соединений оценивали методом отделенных листьев (37). Семисуточные проростки пшеницы ( Triticum aestivum L.) восприимчивого сорта Саратовская 29 опрыскивали 0,1 % (по хитозану) растворами иммуномодуляторов за 24 ч до инокуляции патогеном — гемибиотрофом C. sativus (4000 спор/мл) или биотрофом P. recondita (2000 пустул/мл). В каждом варианте опыта использовали 100 проростков. Пораженность листьев оценивали на 4-е сут после заражения C . sativus и на 7-е сут после заражения P. recondita по интенсивности развития болезни (степени поражения площади листа) согласно описанию (37). В контроле растения обрабатывали водой. Пораженность листьев пшеницы в виде бурых пятен при заражении C. sativus и уредопустул — при заражении P. re-condita принималась в контроле за 100 %. Иммуномодулирующую активность исследуемых веществ оценивали в процентах как степень пораженности листьев растений патогеном по отношению к контролю.
Влияние гибридных систем (Хит-Ван+СК) (1:2) и салициловой кислоты на активность ферментов оценивали при анализе проб листьев пшеницы, отобранных до заражения и на 1-е, 2-е, 3-е и 4-е сут после заражения C. sativus . Варианты включали растения без заражения и обработок (контроль) и растения, обработанные за 24 ч до заражения C . sativus 0,1 % раствором (Хит-Ван+СК) или 2 мМ раствором салициловой кислоты (опыт) . Для определения активности ферментов навеску из 20 листьев растирали в 0,05 М фосфатном буфере (pH 6,2) в соотношении 1:5, экстрагировали 30 мин при 4 °С, затем центрифугировали 10 мин при 8000 g (микроцентрифуга Eppendorf 5415R, «Eppendorf», США).
Активность каталазы (КАТ) в листьях пшеницы определяли спектрофотометрически (38) на 1-е, 2-е, 3-и и 4-е сут после заражения C. sativus , активность пероксидазы (ПО) — колориметрически по Бояркину (39). Активность супероксиддисмутазы (СОД) оценивали методом, основанным на измерении ингибирования фотохимического восстановления нитросинего тетразолия (40).
Все опыты выполняли в 3 биологических и 3 химических повторностях.
Для обработки данных использовали дисперсионный анализ (программы Statistica 6.0 («StatSoft, Inc.», США) и Excel 2016. При расчетах применили методы параметрической статистки (на основе средних Ì и их стандартных ошибок ±SEM, 95 % доверительных интервалов, наименьшей существенной разности НСР при p < 0,05).
Ðåçóëüòàòû. Анализ данных литературы дает основание полагать, что эффективность индукторов болезнеустойчивости определяется их способностью изменять на этапе внедрения патогена условия его развития в растении за счет регулирования окислительно-восстановительных процессов, которые являются основными в динамике патогенеза. В соответствии с этим подходом создаваемые индукторы болезнеустойчивости должны представлять собой соединения с разнонаправленными функциями (гибрид) и содержать в структуре два активных центра: один будет способствовать генерации АФК, другой, наоборот, их инактивации. Кроме того, необходимо знать механизм внедрения и распространения патогена в растениях. Например, для биотрофа необходимо ограничить время его распространения, тогда как для гемибиотрофа желательно увеличить продолжительность пребывания в живых растительных тканях. В связи с этим при взаимодействии с патогеном должен соблюдаться временной порядок выделения вводимых БАВ из иммуномодулятора.
Для создания инновационных гибридных иммуномодуляторов мы выбрали природный полисахарид хитозан. Хитозан и препараты на его основе широко применяется в защите растений от болезней в качестве индукторов неспецифической устойчивости (41-45). Кроме того, хитозан привлекает внимание исследователей наличием реакционноспособных функциональных групп, которые позволяют проводить разнообразные химические модификации, усиливающие или придающие новые биологические свойства этому полимеру (42, 46). В качестве БАВ с прооксидантными свойствами использовали классический индуктор устойчивости к болезням — салициловую кислоту, которая играет центральную роль в защите растений от биотроф-ных патогенов (14, 47, 48). Среди БАВ, обладающих антиоксидантными свойствами (обычно это фенольные соединения природного и синтетического происхождения, например сиреневая, коричная кислоты, ванилин и т.п.) был выбран ванилин.
Таким образом, гибридный иммуномодулятор представляет собой хитозан, в структуру которого ввели салициловую кислоту, обеспечивающую прооксидантную активность, и ванилин, обладающий антиоксидантными свойствами. Благодаря наличию лабильнойионной связи хитозана и СК (Хит+СК) в первую очередь из гибридной системы будет выделяться СК — интенсивный индуктор генерации АФК (14, 15, 49, 50). Этот эффект необходим на начальной стадии заражения, когда повышенная концентрация активных форм кислорода будет способствовать некрозообразованию и тем самым ограничивать развитие биотрофа. В случае гемибиотрофных патогенов, для которых процесс некрозообразования благоприятен, для споруляции требуется, наоборот, снижение содержания АФК за счет работы антиоксидантной системы, что приведет к увеличению продолжительности пребывания некротрофа C. sativus в живых тканях и биотрофной стадии его развития. Именно в этот более поздний по времени процесс должен включаться экзогенный антиоксидант ванилин, связанный с хитозаном прочной ковалентной связью и постепенно высвобождающийся под действием ферментов.
При создании гибридных иммуномодуляторов были приняты во внимание установленные нами ранее (51) концентрационные зависимости индуцирующей активности СК и ванилина по отношению к гемибиотроф-ному патогену C. sativus .
Из таблицы 1 видно, что исходный хитозан с молекулярной массой 6,5 кДа обладает хорошей индуцирующей активностью, снижая пораженность растений пшеницы бурой ржавчиной и темно-бурой пятнистостью до 25 % по отношению к контролю. Присутствие в хитозане ионно-связанной СК увеличивает его эффективность как индуктора по сравнению с исходным хитозаном, что согласуется с данными литературы (20). Обработка пшеницы производным (Хит-Ван) снизила пораженность листьев темно-бурой пятнистостью более чем в 6 раз по сравнению с контролем. В опыте с бурой ржавчиной пораженность листьев у растений пшеницы, обработанных этим же производным, уменьшилась в 2 раза по сравнению с контролем. Результаты изучения трехкомпонентных гибридных иммуномодуляторов (Хит-Ван+СК) показали, что их индуцирующая активность зависит от молярного соотношения ванилина и СК. Наибольшая индуцирующая активность наблюдалась для образцов, содержащих ванилин и СК в мольном соотношении 1:1 или 1:2. Дальнейшее увеличение доли СК в мольном соотношении к ванилину (1:3) в гибридном производном приводило к его фитотоксичности. Образец (Хит-Ван+СК), содержащий ванилин и СК в мольном соотношении 1:0,5, оказался даже менее эффективен в качестве иммуномодулятора, чем исходный хитозан. Полученные результаты свидетельствуют о том, что концентрация СК определяет биологическую активность гибридной системы как иммуномодулятора.
1. Устойчивость пшеницы ( Triticum aestivum L.) к темно-бурой пятнистости ( Cochliobolus sativus Drechs) и бурой ржавчине ( Puccinia recondita Roberge ex Desmaz f. sp. tritici ) при воздействии низкомолекулярного (6,5 кДа) хитозана и его производных на основе биоактивных веществ (БАВ) (метод отделенных листьев, сорт Саратовская 29)
|
Вариант |
БАВ, мМ |
Соотношение Ван:СК, мг/мг |
Пораженность листьев, % от контроля. |
|
|
темно-бурая пятнистость (НСР 05 = 4,5) |
бурая ржавчина, (НСР 05 = 9,0) |
|||
|
Контроль |
100а |
100а |
||
|
Хит |
25а |
25а |
||
|
Ван |
1,5 |
60а |
100а |
|
|
СК |
0,5 |
40а |
45а |
|
|
СК |
1,0 |
50а |
35а |
|
|
СК |
2,0 |
45а |
30а |
|
|
Хит-Ван |
1,5 |
15а |
50а |
|
|
Хит+СК |
0,5 |
20а |
10а |
|
|
Хит-Ван+СК |
2,2 |
1:0,5 |
20а |
40а |
|
Хит-Ван+СК |
3,0 |
1:1 |
10а |
15а |
|
Хит-Ван+СК |
4,5 |
1:2 |
5а |
10а |
Примечание. Молекулярная масса исходного хитозана (Хит) 6,5 кДа, БАВ: ванилин (Ван) и салициловая кислота (СК). Концентрация использованных растворов образцов — 0,1 % (по хитозану).
∆ а — достоверные различия в вариантах опыта по сравнению с контролем.
2. Пораженность (% от контроля) листьев пшеницы ( Triticum aestivum L.) темно-бурой пятнистостью ( Cochliobolus sativus Drechs) и бурой ржавчиной ( Puccinia recondita Roberge ex Desmaz f. sp. tritici ) при воздействии хитозана с разной молекулярной массой и его производных на основе биоактивных веществ (метод отделенных листьев, сорт Саратовская 29)
|
Вариант |
Хит 6,5 кДа |
Хит 60 кДа |
Хит 100 кДа |
|||
|
1 |
2 |
1 |
] 2 |
1 |
2 |
|
|
Контроль |
100 |
100 |
100 |
100 |
100 |
100 |
|
Хит |
30 |
20 |
25 |
20 |
20 |
15 |
|
Хит+СК |
20 |
10 |
20 |
10 |
15 |
5 |
|
Хит-Ван |
15 |
40 |
15 |
25 |
10 |
35 |
|
Хит-Ван+СК (Ван:СК 1:2) |
5 |
10 |
5 |
5 |
< 5 |
5 |
Примечание. 1 — темно-бурая пятнистость (НСР 05 = 5,0), 2 — бурая ржавчина (НСР 05 = 8,0). Концентрация растворов образцов в опыте 0,1 % (по хитозану).
В литературе нет однозначно признанного мнения о возможной корреляции между молекулярной массой хитозана и его индуцирующей активности. Разброс значений молекулярной массы для форм, проявляющих высокую активность в качестве индуктора болезнеустойчивости, достаточно велик — от 2 кДа до 300 кДа (4, 52). В связи с этим мы провели сравнительное изучение индуцирующей активности гибридных иммуномодуляторов, полученных на основе хитозана с разной молекулярной массой. Данные по оценке влияния хитозанов с разной молекулярной массой и их производных, содержащих ванилин и/или СК, на устойчивость пшеницы к темнобурой пятнистости и бурой ржавчине представлены в таблице 2.
Среди хитозанов с разной молекулярной массой наибольшей эффективностью в качестве индуктора болезнеустойчивости обладал хитозан с молекулярной массой 100 кДа. В этом варианте опыта площадь поражения листьев пшеницы C. sativus составила всего 20 %, P. recondita — 15 %.
Независимо от молекулярной массы хитозан, содержащий СК (Хит+СК) во всех вариантах опыта показал более высокую иммуномодулирующую активность по сравнению с немодифицированным хитозаном, снизив площадь поражения листьев C. sativus до 15-20 %, а P. Recondita — до 510 % относительно контроля. Индуцирующая активность хитозанов с разной молекулярной массой, содержащих только ванилин (Хит-Ван), была значительно ниже по сравнению с таковой у немодифицированных хитозанов при защите пшеницы от бурой ржавчины и, напротив, более высокой — в случае темно-бурой пятнистости. При этом было показано, что инновационный иммуномодулятор (Хит-Ван+СК) независимо от молекулярной массы хитозана эффективно повышает устойчивость растений пшеницы к бурой ржавчине и темно-бурой пятнистости, снижая площадь поражения листьев до 5-10 % от контроля.
Таким образом, экспериментально подтверждено, что высокая иммуномодулирующая активность гибридных систем при молярном соотношении в них ванилина и салициловой кислоты в диапазоне 1:2 не зависит от величины молекулярной массы хитозана.
Как отмечалось выше, в процессе регуляции количества АФК в клетках инфицированных патогеном растений большая роль принадлежит антиоксидантным ферментам, прежде всего каталазе, пероксидазе и су-пероксиддисмутазе (28-31). C целью оценки участия антиоксидантных ферментов в формировании индуцированной устойчивости к темно-бурой пятнистости в проростках пшеницы под действием гибридного иммуномодулятора (Хит-Ван+СК), содержащего ванилин и СК в мольном соотношении 1:2, мы изучили активность каталазы (КАТ), пероксидазы (ПО), супе-роксиддисмутазы (СОД) в модельной системе пшеница—гемибиотроф C. sativus при обработке этим препаратом .
Анализ динамики изменения активности указанных ферментов в зараженных проростках пшеницы показал, что процесс заражения растений пшеницы возбудителем темно-бурой пятнистости C. sativus сопровождался увеличением активности всех антиоксидантных ферментов относительно контрольных незараженных растений на всем протяжении опыта. Ко времени сильного развития болезни (4-е сут), когда вся ткань листа была некротизирована, их активность постепенно снижалась (рис. 1, 2).
Результаты экспериментов выявили временные различия в повышении активности антиоксидантных ферментов в процессе развития болезни (см. рис. 1). На 1-е сут в зараженных патогеном листьях пшеницы наблюдался резкий подъем активности ПО, КАТ и СОД с постепенным понижением их активности на 4-е сут. Максимальное увеличение активности ПО наблюдалось на 3-и сут после заражения, когда проявились четкие признаки заболевания в виде коричневых пятен. Как известно, начальный этап инфицирования растений сопровождается активацией системы генерации АФК, и в первую очередь генерируется супероксидный анион-ра-дикал, который СОД восстанавливает до перекиси водорода. Этот фермент составляет передовую линию защиты от АФК, катализируя дисмутацию супероксидного анион-радикала до H2O2, что ведет к значительному повышению активности фермента. Перекись водорода, будучи субстратом КАТ, в свою очередь, индуцирует рост активности этого фермента, что способствует ее возрастанию в 1-е сут заражения. На 2-е сут развития заболевания продолжающийся рост активности СОД приводил к дальнейшему накопле- нию перекиси водорода и сопровождался уже значительным повышением активности ПО (3-и сут), которая наряду с КАТ включалась в контроль за количеством образующейся перекиси водорода.
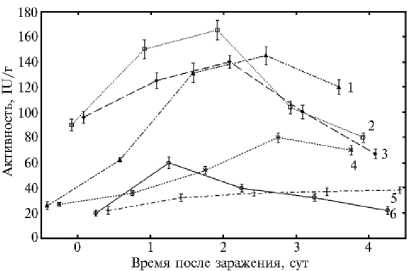
Рис. 1. Активность антиоксидантных ферментов в листьях пшеницы ( Triticum aestivum L.), инфицированных Cochliobolus sativus Drechs, при воздействии гибридного иммуномодулятора на основе хитозана (Хит) в сочетании с ванилином (Ван, ковалентная связь) и салициловой кислотой (СК, ионная связь) : 1 — пероксидаза, 2 — супероксиддисмутаза, 6 — каталаза (контроли без обработки Хит-Ван+СК); 3 — супероксиддисмутаза, 4 — пероксидаза, 5 — каталаза (с обработкой Хит-Ван+СК). M ±SEM, различия достоверны при p < 0,05 (лабораторный тест, сорт Саратовская 29).
Таким образом, повышение активности СОД, КАТ и ПО, наблюдаемое в начальный бессимптомный биотрофный период (1-2-е сут) после заражения растений C. sativus , свидетельствует о резком повышении количества АФК и о вовлечение антиоксидантных ферментов в регуляцию накопления АФК в ответ на внедрение патогена.
Постепенное снижение активности антиоксидантных ферментов по мере развития болезни (4-е сут) и переход патогена в не-кротрофную фазу приводило к возрастанию окислительных процессов, которые по интенсивности превосходили уровень активности антиоксидантной системы растения. В результате у растения инициировалось интенсивное нек-розобразование, что создавало благоприятную среду обитания для патогена C. sativus. Развитие болезни в этот период визуально проявляется в виде коричневых пятен на листьях. Следствием этого становится рост восприимчивости растений к темно-бурой пятнистости, что соответствует данным литературы (53).
Обработка растений пшеницы гибридной системой (Хит-Ван+СК) при заражении гемибиотрофом C. sativus понижала активность антиоксидантных ферментов, хотя динамика ее изменения оставалась такой же, как в контрольных (необработанных) зараженных растениях. Так, активность КАТ хотя и возрастала в 1-е сут заражения, но была значительно ниже, чем в зараженных контрольных растениях (см. рис. 1). Активность ПО на всем протяжении опыта также оказалась существенно ниже, чем у контрольных зараженных растений. Следует отметить, что (Хит-Ван+СК) незначительно снижает активность СОД в первое время (с 1-х по 3-и сут) и при этом динамика изменения активности остается такой же, как в зараженных растениях. Последнее означает, что благодаря повышенной активности СОД в течение 1-2-х сут после заражения происходит инактивация супероксидных анион-радикалов и накопление перекиси в тканях. В свою очередь, снижение каталазной и пероксидазной активности в растениях, обработанных (Хит-Ван+СК), также ведет к повышению количества перекиси, необходимой для обезвреживания фитопатогена в тканях, и к сдерживанию его распространения в период биотрофной стадии. Происходит включение защитных реакций, ведущих к развитию в растениях пшеницы индуцированной устойчивости к темно-бурой пятнистости, что и проявляется в снижении развития болезни до 5 % от контроля.
Следует отметить, что особенность созданной гибридной системы заключается в наличии в рабочем растворе иммуномодулятора легко отщепляющейся от хитозана салициловой кислоты, что дает основание предполагать ее участие в проявлении индуцирующей активности иммуномодуляторов на начальной стадии инфицирования растений.
А
В
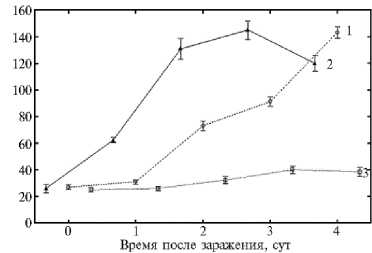
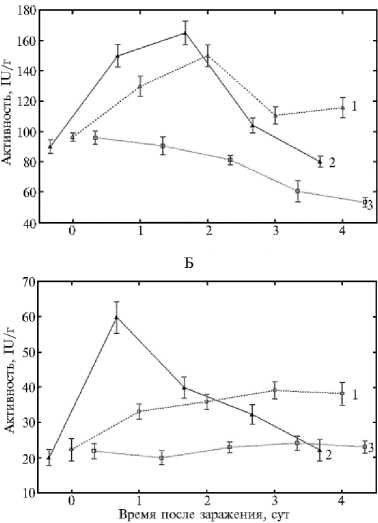
Рис. 2. Активность супероксиддисмутазы (А) , каталазы (Б) и пероксидазы (В) в листьях пшеницы ( Triticum aestivum L.), инфицированных Cochliobolus sativus Drechs, при воздействии салициловой кислотой: 1 — инфицированные обработанные листья, 2 — инфицированные необработанные листья, 3 — неинфициро-ванные необработанные листья (контроли). M ±SEM, различия достоверны при p < 0,05 (лабораторный тест, сорт Саратовская 29).
Для оценки роли СК в индуцирующей активности гибридного иммуномодулятора мы изучили ее влияние на активность антиоксидантных ферментов при заражении пшеницы гемибиотрофом C. sativus (см. рис. 2). Установлено, что активность СОД под действием СК хотя и снижается, но незначительно и остается высокой в первые сутки опыта. Аналогичным образом (как и в варианте с предобработкой пшеницы Хит-Ван+СК), в растениях, обработанных СК и зараженных возбудителем темно-бурой пятнистости, в 2 раза снижалась активность КАТ (1-е сут) и ПО (3-и сут). То есть прослеживается аналогия в динамике изменения активности ферментов у растений, обработанных гибридным иммуномодулятором и СК, при заражении гемибиотрофом C. sativus. Выявленная аналогия в изменении активности антиоксидантных ферментов (СОД, КАТ, ПО), в листьях пшеницы, предобработанных СК и (Хит-Ван+СК), указывает на участие СК в качестве индуктора устойчивости в защитных реакциях растений пшеницы, активируемых (Хит-Ван+СК). Отсюда следует, что СК посредством снижения активности антиоксидантных ферментов стимулирует накопление Н2О2 в количестве, достаточном для включения защитных механизмов индуцированного иммунитета, что подтверждают данные литературы (11, 54). Наблюдаемый индуцирующий эффект СК согласуется с данными фитопатологического анализа, которые показали, что действие экзогенной СК проявилось в супрессии симптомов болезни для гемибиотрофа C. sativus до 45 % от контроля (см. табл. 1). Согласно данным литературы, индуцирующий эффект экзогенной СК при повышении устойчивости растений к фитопатогенам обусловлен ее способностью ингибировать каталазу — фермент, детоксицирующий перекись водорода, что приводит к накоплению АФК (14, 15, 30, 54). Последние рассматриваются как важные сигнальные посредники при формировании устойчивости растений. Учитывая эти и полученные нами данные, можно допустить, что высокая индуцирующая активность гибридных систем (Хит-Ван+СК), в которых соотношение Ван:СК равно 1:1 или 1:2, связана со способностью экзогенной СК первой высвобождаться из полимерной системы и индуцировать генерацию Н2О2 до количества, которое приводит к для активации целого спектра защитных реакций растений, тормозящих развитие патогенов. Это увеличивает длительность бессимптомной биотрофной стадии развития гемибиотрофа и существенно замедляет развитие болезни (поражение до 5-10 % от контроля). Повышенное содержание перекиси в этот период также способствует формированию устойчивости к биотрофу, и развитие P. recondita снижается до 10-15 % от контроля (см. табл. 1).
Обработка растений иммуномодулятором (Хит-Ван+СК) (Ван:СК 1:0,5) с меньшим количеством экзогенной СК (см. табл. 1) индуцирует появление меньшего количества АФК. Экзогенный антиоксидант ванилин в гибриде (Хит-Ван+СК) также снижает концентрацию АФК. При этом количество Н 2 О 2 уменьшается до величины, которая не позволяет развиться устойчивости к биотрофу P. recondita , но оказывается достаточной для индуцирования устойчивости по отношению к гемибиотрофу C. s ativus в бес-симтомный биотрофный период развития патогена. Полученные результаты свидетельствуют о том, что биологическая эффективность гибридного производного на основе хитозана (Хит-Ван+СК) как иммуномодулятора коррелирует с содержанием в них СК, что подтверждает участие сигнальной салицилатной системы в индукции устойчивости и согласуются с данными E. Sari и H.R. Etebarian (55), которые на примере поражения пшеницы ас-комицетом Gaeumannomyces graminis выявили зависимость эффективности СК как индуктора устойчивости от концентрации.
Итак, результаты исследований позволяют предположить, что механизм действия новых гибридных иммуномодуляторов, имеющих в структуре хитозана ковалентно присоединенный ванилин и ионно-связанную салициловую кислоту, приводящий к повышению устойчивости растений пшеницы к патогенам с различной стратегией питания, реализуется через контроль активности антиоксидантных ферментов (в частности, каталазы, пероксидазы, супероксиддисмутазы), регулирующих интенсивность окислительного стресса, индуцированного внедрением патогена. Высокий индуцирующий эффект созданных гибридных систем, по-видимому, связан со способностью экзогенной салициловой кислоты, которая первой высвобождается из полимерной системы, ингибировать каталазу и пероксидазу. В результате в клетках накапливается перекись водорода, способная усиливать экспрессию генов, определяющих защиту от патогенов. Инновационные гибридные иммуномодуляторы как индукторы устойчивости могут представлять практический интерес в защите растений от патогенов разной трофности.
Список литературы Инновационные гибридные иммуномодуляторы растений на основе хитозана и биоактивных антиоксидантов и прооксидантов
- Гультяева Е.И., Шайдаюк Е.Л., Шипилова Н.П., Левитин М.М., Колесникова О.А., Маслова И.В., Вусатюк М.П. Фитосанитарный мониторинг болезней пшеницы в Северо-западном регионе в 2015 году. Защита и карантин растений, 2016, 4: 29-31.
- Санин С.С., Назарова Л.Н. Фитосанитарная обстановка на посевах пшеницы в Российской Федерации (1991-2008 гг.). Защита и карантин растений, 2010, 2: 20-26.
- Гришечкина Л.Д., Долженко В.И. Эффективность и экологическая безопасность современных фунгицидов для защиты зерновых культур. Агрохимия, 2013, 2: 28-33.
- Тютерев С.Л. Природные и синтетические индукторы устойчивости растений к болезням. СПб, 2014.
- Gozzo F., Faoro F. Systemic acquired resistance (50 years after discovery): moving from the lab to the field. J. Agric. Food Chem, 2013, 61(51): 12473-12491 (doi: 10.1021/jf404156x).
- Thakur M., Sohal B.S. Role of Elicitors in inducing resistance in plants against pathogen infection: a review. International Scholarly Research Notices, 2013, 2013: Article ID 762412, (doi: 10.1155/2013/762412).
- Pieterse C.M., Van Does D., Zamioudis C., Leon-Reyes A., Van Wees S.C. Hormonal modulation of plant immunity. Annual Review of Cell and Developmental Biology, 2012, 28(1): 489-521 (doi: 10.1146/annurev-cellbio-092910-154055).
- Spoel S.H., Johnson J.S., Dong X. Regulation of tradeoffs between plant defenses against pathogens with different lifestyles. PNAS, 2007, 104(47): 18842-18847 (doi: 10.1073/pnas.0708139104).
- Bhat B.S., Shahnaz E. Effectors — role in host-pathogen interaction. Journal of Agriculture and Environmental Sciences, 2014, 3(2): 265-285.
- Luna E., Bruce T.J., Roberts M.R., Flors V., Ton J. Next-generation systemic acquired resistance. Plant Physiology, 2012, 158(2): 844-853 (doi: 10.1104/pp.111.187468).
- Озерецковская О.Л., Васюкова H.H., Чаленко Г.И., Герасимова Н.Г., Ревина Т.А., Валуева Т.А. Процесс раневой репарации и индуцированная устойчивость клубней картофеля. Прикладная биохимия и микробиология, 2009, 45(2): 220-222.
- Glazebrook J. Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens. Annual Review of Phytopathology, 2005, 43: 205-227 (doi: 10.1146/annurev.phyto.43.040204.135923).
- Vargas W.A., Sanz Martin J.M., Rech G.E., Rivera L.P., Benito E.P., Diaz-Minguez J.M., Thon M.R., Sukno S.A. Plant defense mechanisms are activated during biotrophic and necrot-rophic development of Colletotricum graminicola in maize. Plant Physiology, 2012,158(3): 13421358 (doi: 10.1104/pp.111.190397).
- Dieryckx C., Gaudin V., Dupuy J-W., Bonneu M., Girard V., Job D. Beyond plant defense: insights on the potential of salicylic and methylsalicylic acid to contain growth of the phytopath-ogen Botrytis cinerea. Frontier in Plant Science, 2015, 6: 859-867 (doi: 10.3389/fpls.2015.00859).
- Zakariyya F., Wahyu Susilo A., Iman Santoso T., Susilo Addy H., Pancaningtyas S. Role of exogenous salicylic acid and benzoic acid applications to vascular streak dieback disease attack on cocoa seedlings. Pelita Perkebunan (a Coffee and Cocoa Research Journal), 2018, 34(1): 33-39 (doi: 10.22302/iccri.jur.pelitaperkebunan.v34i1.305).
- Shetty N.P., Jorgensen H.J.L., Jensen J.D., Collinge D.B., Shetty H.S. Roles of reactive oxygen species in interactions between plants and pathogens. Eur. J. Plant Pathol., 2008, 121: 267-280 (doi: 10.1007/s10658-008-9302-5).
- Zurbriggen M.D., Carrillo N., Hajirezael M.R. ROS signaling in the hypersensitive response. Plant Signaling and Behavior, 2010, 5: 393-396 (doi: 10.4161/psb.5.4.10793).
- Ahanger R.A., Bhat H.A., Ganie S.A., Lone A.A., Bhat T.A., Wani I.A., Khan O.A., Ganai S.A. Reactive oxygen species and their role in plant defense against pathogen ingress. International Journal of Pharmacy Review & Research, 2014, 4(1): 68-74.
- Ali M., Cheng Z., Ahmad H., Hayat S. Reactive oxygen species (ROS) as defenses against a broad range of plant fungal infections and case study on ROS employed by crops against Verticillium dahliae wilts. Journal of Plant Interactions, 2018, 13(1): 353-363 (doi: 10.1080/17429145.2018.1484188).
- Васюкова Н.И., Озерецковская О.Л., Чаленко Г.И., Герасимова Н.Г., Львова A.A., Ильина А.В, Левов А.Н., Варламов В.П., Тарчевский И.А. Иммунизирующая активность производных хитозана с салициловой кислотой и ее фрагментами. Прикладная биохимия и микробиология, 2010, 46(3): 379-384.
- Barna B., Fodor J., Harrach B., Pogany M., Kiraly Z. The Janus face of reactive oxygen species in resistance and susceptibility of plants to necrotrophic and biotrophic pathogens. Plant Physiology and Biochemistry, 2012, 59: 37-43 (doi: 10.1016/j.plaphy.2012.01.014).
- Galvez-Valdivieso G., Mullineaux P.M. The role of reactive oxygen species in signaling from chloroplasts to the nucleus. Physiologia Plantarum, 2010, 138(4): 430-439 (doi: 10.1111/j.1399-3054.2009.01331.x).
- Baxter A., Mittler R., Suzuki N. ROS as key players in plant stress signalling. Journal of Experimental Botany, 2014, 65: 1229-1240 (doi: 10.1093/jxb/ert375).
- Карпун Н.Н., Янушевская Э.Б., Михайлова Е.В. Механизмы формирования неспецифического индуцированного иммунитета у растений при биогенном стрессе. Сельскохозяйственная биология, 2015, 50(5): 540-549 (doi: 10.15389/agrobiology.2015.5.540rus).
- Shetty N.P., Mehrabi R., Lutken H., Haldrup A., Kema G.H.J., Collinge D.B., Jшrgensen H.J.L. Role of hydrogen peroxide during the interaction between the hemibiotrophic fungal pathogen Septoria tritici and wheat. New Phytologist, 2007, 174(3): 637-647 (doi: 10.1111/j.1469-8137.2007.02026.x).
- Eloy Y.R., Vasconcelos I.M., Barreto A.H., Freire-Filho F.R., Oliveira J.T.A. H2O2 plays an important role in the life style of Colletotrichum gloeosporioides during interaction with cowpea [Vigna unguiculata (L.) Walp.]. The British Mycological Society, 2015, 119: 747-757 (doi: 10.1016/j.funbio.2015.05.001).
- Torres M.A. ROS in biotic interactions. Physiologia Plantarum, 2010, 138: 414-429 (doi: 10.1111/j.1399-3054.2009.01326.x).
- Jindrichova B., Fodo J., Sindelarova M., Burketov L., Valentova O. Role of hydrogen peroxide and antioxidant enzymes in the interaction between a hemibiotrophic fungal pathogen, Lepto-sphaeria maculans, and oilseed rape. Environmental and Experimental Botany, 2011, 72(2): 149156 (doi: 10.1016/j.envexpbot.2011.02.018).
- Gill S.S., Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. Plant Physiology and Biochemistry, 2010, 48(12): 909-930 (doi: 10.1016/j.plaphy.2010.08.016).
- Максимов И.В., Черепанова Е.А. Про/антиоксидантная система и устойчивость растений к патогенам. Успехи современной биологии, 2006, 126: 250-261.
- Khaledi N., Taheri P., Falahati-Rastegar M. Reactive oxygen species and antioxidant system responses in wheat cultivars during interaction with Fusarium species. Australasian Plant Pathol., 2016, 45: 653-670 (doi: 10.1007/s13313-016-0455-y).
- Hanifei M., Dehghani H.R., Choukan R. The role of antioxidant enzymes and phenolic compounds in disease resistance to Fusarium oxysporum f. sp. melonis race 1.2. International Journal of Agronomy and Plant Production, 2013, 48: 1985-1996.
- Oliveira J.T.A., Barreto A.L.H., Vasconcelos I.M., Eloy Y.R.G., Gondim D.M.F., Fer-nandes C.F., Freire-Filho F.R. Role of antioxidant enzymes, hydrogen peroxide and PRproteins in the compatible and incompatible interactions of cowpea (Vigna unguiculata) genotypes with the fungus Colletotrichum gloeosporioides. J. Plant Physiol. Pathol., 2014, 2(3): 1000131 (doi: 10.4172/2329-955X.1000131).
- Muzzarelli R.A.A. Chitin. Pergamon Press, Oxford, 1977.
- Погореленко А.Б., Домнина Н.С., Попова Э.В., Тютерев С.Л. Конъюгаты хитозана и аль-дегидпроизводных фенолов. Вестник СПбГУ, серия 4, 2003, 3(20): 97-104.
- Федосеева Е.Н., Федосеев В.Б. Взаимодействие хитозана и бензойной кислоты в растворах и пленках. Высокомолекулярные соединения, серия А, 2011, 53(11): 1900-1907.
- Михайлова Л.А., Мироненко Н.В., Коваленко Н.М. Желтая пятнистость пшеницы. Методические указания по изучению популяций возбудителя желтой пятнистости Pyrenophora tritici-repentis и устойчивости сортов. СПб, 2012: 23-35.
- Величко А.К., Соловьев В.Б., Генгин М.Т. Методы лабораторного определения общей перекиси, разрушающей активности ферментов растений. Известия ПГПУ им. В.Г. Белинского, 2009, 18: 44-48.
- Ермаков А.И., Арасимович В.В., Ярош Н.П., Перуанский Ю.В., Луковникова Г.А., Иконникова М.И. Методы биохимического исследования растений. Л., 1987.
- Giannopolitis C.N., Ries S.K. Superoxide dismutase I. Occurrence in higher plants. Plant Physiology, 1977, 59: 309-314 (doi: 10.1104/pp.59.2.309).
- Варламов В.П., Немцев С.В., Тихонов В.Е. Хитин и хитозан: природа, получение и применение. М., 2010.
- Badawy M.E.I., Rabea E.I. A biopolymer chitosan and its derivatives as promising antimicrobial agents against plant pathogens and their applications in crop protection. International Journal of Carbohydrate Chemistry, 2011, 2011: 1-29 (doi: 10.1155/2011/460381).
- Iriti M., Faoro F. Chitosan as a MAMP, searching for a PRR. Plant Signaling and Behavior, 2009, 4(1): 66-68 (doi: 10.4161/psb.4.1.7408).
- Henry G., Thonart P., Ongena M. PAMPs, MAMPs, DAMPs and others: an update on the diversity of plant immunity elicitors. Biotechnology, Agronomy, Society and Environment, 2012, 16(2): 257-268
- Malerba M., Cerana R. Reactive oxygen and nitrogen species in defense/stress responses activated by chitosan in sycamore cultured cells. Int. J. Mol. Sci., 2015, 16(2): 3019-3034 (doi: 10.3390/ijms16023019).
- Yang G., Jin O., Xu C., Fan S., Wang C., Xie P. Synthesis, characterization and antifungal activity of coumarin-functionalized chitosan derivatives. Int. J. Biol. Macromol., 2018, 106: 179184 (doi: 10.1016/j.ijbiomac.2017.08.009).
- Kumaraswamy R.V., Kumari S., Choudhary R.C., Sharma S., Pal A., Raliya R., Biswas P., Saharan V. Salicylic acid functionalized chitosan nanoparticle: a sustainable biostimulant for plant. Int. J. Biol. Macromol., 2019, 123: 59-69 (doi: 10.1016/j.ijbiomac.2018.10.202).
- Liu P.P., Yang Y., Pichersky E., Klessig D.F. Altering expression of Benzoic Acid/Salicylic Acid Car-boxyl Methyltransferase 1 compromises systemic acquired resistance and PAMP-triggered immunity in Arabidopsis. Molecular Plant-Microbe Interactions, 2010, 23(1): 82-90 (doi: 10.1094/MPMI-23-1-0082).
- Васюкова Н.И., Озерецковская О.Л. Индуцированная устойчивость растений и салициловая кислота. Прикладная биохимия и микробиология, 2007, 43(4): 405-411.
- Максимов И.В., Сорокань А.В., Черепанова Е.А., Сурина О.Б., Трошина Н.Б., Яруллина Л.Г. Влияние салициловой и жасмоновой кислот на компоненты про-/антиокси-дантной системы в растениях картофеля при фитофторозе. Физиология растений, 2011, 58(2):243-251.
- Попова Э.В., Коваленко Н.М., Сокорнова C^., Домнина Н.С., Тютерев С.Л. Влияние салициловой кислоты и ванилина на устойчивость пшеницы к возбудителю темно-бурой пятнистости Cochliobolus sativus. Микология и фитопатология, 2017, 51(3): 178-182.
- El Hadrami A., Adam L.R., El Hardrami I., Daayf F. Chitosan in plant protection. Marine Drugs, 2010, 8(4): 968-987 (doi: 10.3390/md8040968).
- Озерецковская О.Л., Васюкова Н.И. Действие иммуномодуляторов на устойчивость и восприимчивость картофеля к Phytophthora infestans. Физиология растений, 2006, 53(4): 546-553.
- Яруллина Л.Г., Трошина Н.Б., Черепанова Е.Г., Заикина Е.А., Максимов И.В. Салициловая и жасмоновая кислоты в регуляции про-антиоксидантного статуса листьев пшеницы при инфицировании Septoria nodorum Berk. Прикладная биохимия и микробиология, 2011, 47(5): 602-608.
- Sari E., Etebarian H.R._Concentration-dependent effect of salicylic acid application on wheat seedling resistance to take-all fungus Gaeumannomyces graminis var. tritici. Phytoparasitica, 2008, 37(1): 67-76 (doi: 10.1007/s12600-008-0005-4).


