Инсектицидные свойства Bacillus thuringiensis var. Israelensis. Сообщение II. Сравнительный морфологический и молекулярно-генетический анализ кристаллогенных и акристаллогенных штаммов
Автор: Ермолова В.П., Гришечкина С.Д., Белоусова М.Е., Антонец К.С., Нижников А.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биопрепараты и продуценты
Статья в выпуске: 6 т.54, 2019 года.
Бесплатный доступ
Бактерии Bacillus thuringiensis var. israelensis - основной агент биологической защиты от кровососущих двукрылых насекомых, многие из которых являются переносчиками трансмиссивных болезней сельскохозяйственных животных. Штаммы-продуценты для производства инсектицидных препаратов выделяют из природных объектов, получают посредством селекции ранее использованных изолятов, скрининга генетических коллекций и генной или геномной инженерии. При этом вопрос сохранности и контроля практически ценных свойств штаммов остается ключевым. Биопрепараты представляют существенный интерес в связи с их значительными преимуществами перед химическими пестицидами и рассматриваются в современных системах сельского хозяйства в качестве экологически и социально приоритетных альтернатив агрохимикатов. В представленной работе нами выполнен первый комплексный сравнительный анализ кристаллогенных и акристаллогенных вариантов Bacillus thuringiensis var. israelensis (BtH14), выделенных после хранения штамма в разных режимах. У кристаллогенных вариантов методом полимеразной цепной реакции (ПЦР) впервые выявлены гены, кодирующие целевые инсектицидные токсины - Cry4 и Сry11, и показано, что акристаллогенные формы этих генов лишены. Установлено, что у кристаллогенных вариантов культуральная жидкость приблизительно в 7000 раз активнее в отношении личинок Aedes aegypti чем у акристаллогнных. Целью настоящего исследования было сопоставление морфологических, биохимических, технологических, ларвицидных свойств кристаллогенных и акристаллогенных штаммов бактерии (BtH14) и проверка наличия у них генов, кодирующих энтомоцидные токсины Сry, которые относятся к ключевым детерминантам вирулентности. Изучали штаммы 404, 87 (хранились 28 лет методом лиофилизации, затем 2 года в пробирках на скошенном рыбном агаре - РА с пересевом каждые 6 мес), штамм 7-1/23 (хранился 28 лет в кристаллах NaСl, затем 2 года в культуральной жидкости - КЖ при температуре 3 °С). Культуры рассевали методом истощающегося мазка на РА в чашках Петри. На 7-е сут роста при 30 °С отбирали кристаллогенные (404/14, 87/21, 7-1/23-4) и акристаллогенные (404/19, 87/33, 7-1/23-8) варианты методом световой микроскопии, используя краситель черный анилиновый. У вариантов не выявили различий по морфологии колоний на РА в чашках Петри: колонии были плоские, матовые, серовато-белые, шероховатые, округлые, структура мелкозернистая, консистенция вязкая. Изучение морфологии вегетативной культуры, основных биохимических свойств (образование ацетилметилкарбинола, лецитиназы, использование углеводов, расщепление крахмала и др.) и оценка титра на дрожже-полисахаридной среде также не показали различий. Продуктивность вариантов 404/14, 87/21, 7-1/23-4 и 404/19, 87/33, 7-1/23-8 была в пределах соответственно (3,36-4,02)×109 и (3,74-4,13)×109 КОЕ/мл. Ларвицидная активность кристаллогенных вариантов, которая выражалась в ЛК50 для L4 Aedes aegypti , составляла (0,12-0,16)×10-3 %, акристаллогенные варианты были неактивными в пределах следующих общепринятых разведений (×10-3 %): 1,0; 0,5; 0,25; 0,125 и 0,06. Их 1 % суспензия (в 7000 раз большая концентрация) вызывали гибель 22-39 % личинок комаров через 24 ч, тогда как та же концентрация активных вариантов приводила к 100 % гибели насекомых уже через 15 мин. Обнаружено, что КЖ акристаллогенных вариантов через 12 ч образовывала осадок и надосадочный слой, а кристаллогенных - оставалась в состоянии взвеси. Исследуемые варианты BtH14 были также впервые проанализированы на наличие генов, кодирующих инсектицидные токсины. Результаты амплификации с Bti-специфичными праймерами подтвердили принадлежность кристаллогенных и акристаллогенных вариантов к BtH14. Установлено, что варианты 404/14, 87/21, 7-1/23-4 несут гены, кодирующие инсектицидные токсины Cry4 и Cry11, в то время как акристаллогенные варианты 404/19, 87/33, 7-1/23-8 лишены этих генов, что согл
Культуральная жидкость, ларвицидная активность, энтомоцидные токсины
Короткий адрес: https://sciup.org/142226287
IDR: 142226287 | УДК: 579.64:632.937.15 | DOI: 10.15389/agrobiology.2019.6.1281rus
Текст научной статьи Инсектицидные свойства Bacillus thuringiensis var. Israelensis. Сообщение II. Сравнительный морфологический и молекулярно-генетический анализ кристаллогенных и акристаллогенных штаммов
Работа поддержана проектом прикладных научных исследований и экспериментальных разработок (ПНИЭР) по лоту шифр 2017-14-579-0030 по теме: «Создание микробиологических препаратов для расширения адаптационного потенциала сельскохозяйственных культур по питанию, устойчивости к стрессам и фитопатогенам» (шифр заявки 2017-14-579-0030-013), соглашение ¹ 14.607.21.0178, уникальный идентификатор работ (проекта) RFMEFI60717X0178.
Кровососущие комары и мошки из отряда Двукрылые ( Diptera ), которые являются переносчиками опасных инфекций человека и животных, наносят существенный урон животноводству. Bacillus thuringiensis subsp. israelensis (BtH14) — эффективный бактериальный агент контроля численности личинок двукрылых, используемый по всему миру. Препараты на основе этой бактерии применяются в широком диапазоне мест обитания целевых насекомых, не вызывают у них резистентности и не оказывают негативного воздействия на экосистему (1). BtH14 рассматривается в качестве приоритетного биоагента в борьбе с кровососущими комарами — паразитами животных и человека и переносчиками трансмиссивных заболеваний, в том числе анаплазмоза крупного рогатого скота. Ущерб, причиняемый животноводству кровососущими двукрылыми, может выражаться в снижении удоев на 20-30 %, прироста живой массы — на 20-40 % (2).
В защите растений, в том числе сеяных кормовых культур, важной тенденцией также становится экологизация ассортимента средств борьбы с вредными организмами за счет применения биологических препаратов на основе бактерий (3-5), актиномицетов (6), энтомофторовых грибов и эн-томопатогенных нематод (7, 8) как фактора оптимизации фитозащиты и питания сельскохозяйственных культур. Среди этих биоагентов также выделяются спорообразующие бактерии Bacillus thuringiensis (Bt) (9, 10), которые обладают комплексом полезных свойств: защищают сельскохозяйственные культуры от фитофагов (11, 12) и фитопатогенов (13-15), могут стимулировать рост растений (16, 17), при этом безопасны для человека (18) и полезной энтомофауны (19, 20). Приоритетное место на рынке занимают биопрепараты на основе Bt как наиболее эффективные и безопасные для окружающей среды (21-23). В качестве действующего вещества они содержат спорокристаллический комплекс (24, 25), некоторые из них — термостабильный экзотоксин (26, 27), а также ряд других менее изученных метаболитов и белковых факторов вирулентности (28-30).
Оптимально рентабельные препараты получают при использовании штамма-продуцента с высокой вирулентностью, технологичностью и безопасностью. Однако культура штаммов -продуцентов биопрепаратов подвержена популяционной изменчивости (31, 32). Длительное хранение, частые пересевы на плотные агаризованные среды приводят к образованию колоний различных морфотипов и ведут к некоторому снижению вирулентности (33). Так, штаммы Bt, которые хранили 28 лет в кристаллах хлорида натрия или в лиофилизированном виде, 10 лет (срок наблюдений) — в криоконсервированном состоянии, сохраняли 100 % жизнеспособности, но проявляли ларвицидную активность на уровне 78-90 % в сравнении с исходными значениями.
В представленной работе мы впервые выполнили комплексный анализ выделенных кристаллогенных и акристаллогенных вариантов Bacillus thuringiensis var. israelensis (BtH14) с использованием метода полимеразной цепной реакции (ПЦР) на ранней стадии развития культуры (18 ч). У изученных кристаллогенных вариантов выявлены гены, кодирующие целевые инсектицидные токсины Cry4 и Сry11, в то время как акристаллогенные этих генов лишены. При этом варианты не различались по основным биохимическим свойствам, морфологии вегетативной культуры и колоний на рыбном агаре (РА), а также по продуктивности. Установлено, что у кристаллогенных вариантов в отличие от акристаллогенных культуральная жидкость (КЖ) через 12 ч инкубации не образует осадка и приблизительно в 7000 раз активнее в отношении личинок Aedes aegypti.
Целью исследований было сравнение морфологические, биохими- ческие, технологические, ларвицидные свойства и наличия энтомоцидных токсинов Cry у вирулентных и авирулентных вариантов штаммов BtH14.
Методика . Штаммы BtH14 404, 87 28 лет хранили методом лиофилизации, затем 2 года в пробирках на скошенном рыбном агаре (РА) с пересевом каждые 6 мес; штамм 7-1/23 28 лет хранили в кристаллах NaCl, затем 2 года в полученной КЖ при 3 ° С. Исходная продуктивность характеризовалась следующими значениями (½109 КОЕ/мл): 3,96±0,28; 4,4±0,22; 4,25±0,30; ларвицидная активность, выраженная в ЛК50 для L4 Aedes aegypti , составляла соответственно (0,135±0,01) х 10-3 %; (0,115±0,015) х 10-3 %; (0,128±0,01)х10 г З %.
Штаммы BtH14 выращивали на скошенном РА при температуре 30 ° С до полного образования спор и кристаллов.
Морфологию колоний изучали после рассева культуры BtH14 методом истощающегося мазка на рыбный агар (РА) стандартного состава в чашках Петри на 7-е сут роста при 30 ° С. Использовали световую микроскопию (микроскоп Zeiss Axio Imager A2, «Carl Zeiss», Германия, иммерсионный объектив ½100) препаратов, окрашенных анилиновым черным («Lu-car», Россия), отбирали кристаллогенные и акристаллогенные варианты (34) для анализа на наличие генов кристаллического токсина (35).
На дрожже-полисахаридной (регламентной) среде оценивали технологичность BtH14, выращивая культуру 68 ч глубинным способом при температуре 30 ° С и аэрации 220 об/мин. Количество клеток, выросших на РА, определяли, используя стандартный способ серийных разведений. ЛК50 (ларвицидную активность) для комаров Aedes аеgypti учитывали согласно описанию (33).
Биохимические свойства (утилизация углеводов, образование аце-тилметилкарбинола, индола и др.) изучали с использованием индикаторных дисков (СИБ, «Микроген», Россия) по прилагаемой инструкции. Культуру, выращенную на среде РА в течение 1 сут при 30 ° С, отбирали микробиологической петлей и помещали в стерильный раствор хлорида натрия (0,85 %). Через 5-18 ч проводили анализ биохимических свойств штаммов.
При выделении геномной ДНК для ПЦР-анализа бактерии выращивали на стандартной среде Лурия-Бертани (ЛБ) при 30 ° С в течение 16-18 ч. Клетки суспендировали в буфере Tris-EDTA (1 M TrisHCl, pH 7,5 + 0,5 M EDTA, pH 8,0) и нагревали в течение 10 мин при 102 ° С. Остатки клеток удаляли осаждением при 15000 g в течение 3 мин. Надосадочную жидкость, содержащую геномную ДНК бактерий, переносили в эп-пендорфы и использовали для ПЦР-анализа (ДНК-амплификатор T100, Bio-Rad, США) (35, 36). Программу ПЦР-анализа подбирали, исходя из температуры отжига известных праймеров и величины амплифицируемого фрагмента ДНК. Реакционная смесь (20 мкл) содержала 1 мкл водной суспензии бактериальной ДНК (80 нг ДНК), 10 мкл смеси Fermentas DreamTaq green PCR master mix («Thermo Fisher Scientific», США), и 0,3 мкл каждого праймера (конечная концентрация 1 пмоль/мкл). Вирулентный штамм BtH10 56, относящийся к группе B. thuringiensis var. darmstadiensis , использовали в ПЦР в качестве негативного контроля. ПЦР-продукты анализировали с помощью электрофореза в 1 % агарозном геле с окрашиванием 0,002 % бромистым этидием.
Результаты обрабатывали методом дисперсионного анализа (37) с доверительным интервалом 95 %. В таблицах представлены средние ( М ) и стандартные ошибки средних (±SEM).
Результаты. Штаммы BtH14 404, 87, 7-1/23 после длительного хра- нения рассевали на РА в чашках Петри и провели целенаправленный отбор по двум критериям — образованию кристаллического эндотоксина и спор и по образованию только спор.
А Б В Г
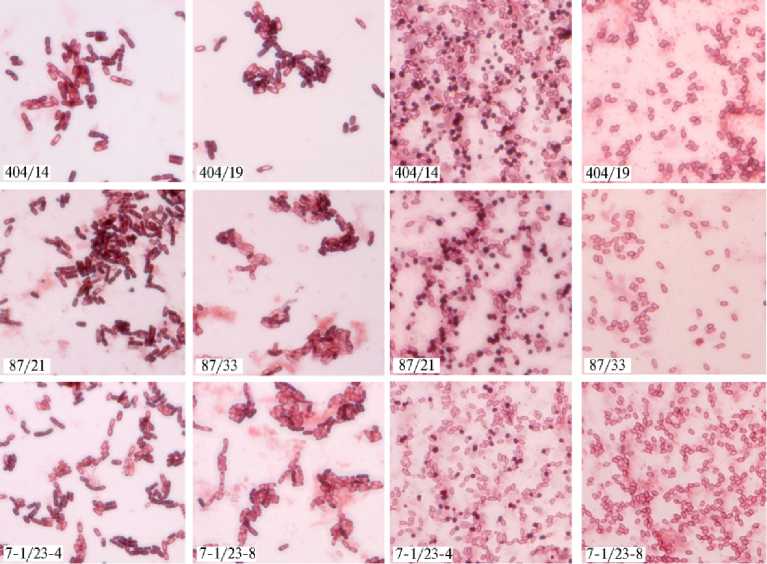
Рис. 1. Кристаллогенные (А, В) и акристаллогенные (Б, Г) варианты штаммов Bacillus thurin-giensis var. israelensis (BtH 14 ) после 16 ч (А, Б) и 7 сут (В, Г) культивирования. Световая микроскопия (микроскоп Zeiss Axio Imager A2, «Carl Zeiss», Германия, иммерсионный объектив ½100) препаратов, окрашенных анилиновым черным («Lucar», Россия).
Для изучения отобрали варианты штаммов BtH14 404/14, 87/21, 71/23-4 (кристаллогенные) и 404/19, 87/33, 7-1/23-8 (акристаллогенные).
По морфологическим признакам культуры не различались: у всех вариантов колонии были шероховатые, плоские, матовые, серовато-белые, край волнистый, структура мелкозернистая, консистенция вязкая. Методом световой микроскопии 16-часовых культур мы также не выявили различий (рис. 1, А). Вместе с тем 7-суточные культуры исследуемых штаммов BtH14 морфологически существенно различались (см. рис. 1, Б).
Результаты изучения ларвицидных свойств у различных вариантов BtH14 приведены в таблице 1. Полученные данные показали, что технологичность кристаллогенных и акристаллогенных вариантов штаммов BtH14 была практически одинаковой — соответственно (3,36±0,25-4,02±0,15)½109 и (3,74±0,19-4,13±0,15)½109 КОЕ/мл.
Ларвицидная активность кристаллогенных вариантов BtH14, выраженная в ЛК50 для L4 A. aegypti , была практически одинаковой и находилась в пределах (0,120±0,012-0,160±0,018)½10 - 3 %. Акристаллогенные варианты BtH14 были неактивными в отношении L4 A. aegypti в общепринятых разведениях (1,0; 0,5; 0,25; 0,125; 0,06)½10-3 % КЖ, лишь 1 % суспензия (концентрация в 7000 раз больше) вызывала гибель 22-39 % личинок комаров через 24 ч, в то время как у активных вариантов та же концентрация приводила к 100 % гибели уже через 15 мин.
Интересным был тот факт, что КЖ у неактивных вариантов через
12 ч разделялась на осадок и надосадочный слой, а у активных — оставалась в состоянии взвеси (рис. 2). По нашим наблюдениям, КЖ вирулентного штамма BtH14 7-1/23А во взвеси сохранялась до 3 лет.
-
1. Ларвицидные свойства изученных вариантов Bасillus thuringiensis var israelensis ( BtH14) ( M ±SEM, лабораторный опыт)
-
2. Праймеры, использованные для ПЦР-анализа кристаллогенных и акристал-лических вариантов
Праймер
Ген
Олигонуклеотидная
последовательность (5' ^ 3')
Температура отжига, ° С
Ссылка
Cry11
сry11
TTAGAAGATACGCCAGATCAAGC(f)
CATTTGTACTTGAAGTTGTAATCCC (r)
45
(38)
Bti
CAAACATTTCATTCCAATAACA (f)
59
(39)
ATACTGTGTGGGATGCTTATTA (r)
Cry4
cry4
GCATATGATGTAGCGAAACAAGCC(f)
62
(40)
ACCTGGAACATCTGACAACCAATC (r)
(35)
3. Сравнительная характеристика кристаллогенных и акристаллогенных вариантов
Bacillus thuringiensis
var.
israelensis
c использованием ПЦР

Рис. 2. Культуральная жидкость кристаллогенных вариантов Bacillus thuringiensis var. israelensis (BtH 14 ) через 12 ч инкубации при комнатной температуре образует взвесь, тогда как акристал-логенных — осадок .
Кристаллогенные (вирулентные) и акристаллогенные (авирулент-ные) вариантвы BtH14 не различались по проанализированному комплексу биохимических свойств. Так, они образовывали ацетилметилкарбинол и лецитиназу, гидролизовали крахмал, проявляли протеолитическую активность и не обладали уреазной. Штаммы метаболизировали глицерин, глюкозу, левулезу, мальтозу и маннозу, не усваивали арабинозу, галактозу, дульцит, ксилозу, лактозу, салицин, сахарозу, сорбит, целлобиозу и эску-лин. Также они не образовывали пигмент, но формировали пленку на мясопептонном бульоне.
Поскольку морфологически кристаллогенные (вирулентные) и акри-сталлогенные (авирулентные) варианты BtH14 не демонстрируют видимых различий, а формирование кристаллов происходит лишь через несколько суток инкубации, мы охарактеризовали кристаллогенные и акристалло-генные варианты штаммов BtH14 при помощи ПЦР, используя 18-часовые культуры. Использованные праймеры представлены в таблице 2.
С праймерами Bti амплифицируется последовательность нуклеотидов, которая специфична для B. thuringiensis var. israelensis и находится на хромосомной ДНК этих бактерий. Полученный положительный результат амплификации с праймерами Bti (табл. 3, рис. 3) подтвердил то, что изучаемые варианты относятся к B. thuringiensis var. israelensis. По результатам ПЦР-анализа, варианты 404/14, 87/21 и 7-1/23-4 несут гены cry4 и cry11 . В случае вариантов 404/19, 87/33, 7-1/23-8 результаты амплификации с этими праймерами были отрицательными, что подтверждает отсутствие кристаллического эндотоксина и ларвицидной активности против A. aegypti .
|
Вариант |
ПЦР с праймерами |
Кристаллогенность |
||
|
Bti |
Cry 4 |
Cry 11 |
||
|
404/14 |
+ |
+ |
+ |
+ |
|
404/19 |
+ |
- |
- |
- |
|
87/21 |
+ |
+ |
+ |
+ |
|
87/33 |
+ |
- |
- |
- |
|
7-1/23-4 |
+ |
+ |
+ |
+ |
|
7-1/23-8 |
+ |
- |
- |
- |
П р и м еч а ни е. «+» и « - » — соответственно наличие и отсутствие положительной реакции или проявления признака.
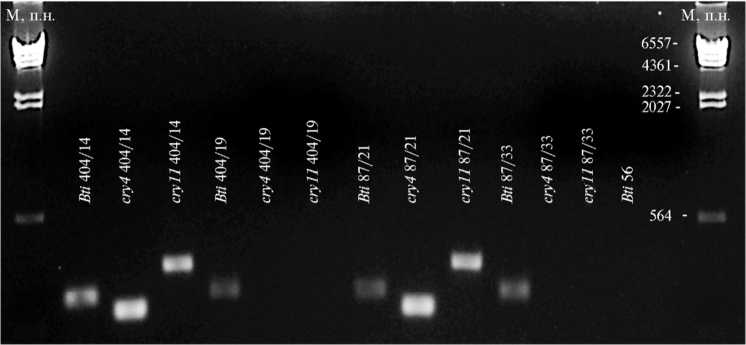
Рис. 3. Гель-электрофорез ПЦР-продуктов, полученных в результате амплификации ДНК вара-интов Bacillus thuringiensis var. israelensis с праймерами Bti, Cry4 и Cry11 для акристаллогенных и кристаллогенных штаммов. М — маркер молекулярных масс λ ДНК/HindIII («Thermo Fisher Scientific», США). Указаны названия генов (в соответствии с использованными праймерами) и номера штаммов.
Таким образом, проведенные исследования позволили заключить, что вирулентные варианты Bасillus thuringiensis var. israelensis 404/14, 87/21, 7-1/23, в отличие от авирулентных 404/19,87/21, 7-1/23-8, несут гены, кодирующие инсектицидные токсины Cry4 и Cry11, образуют кристаллические эндотоксины, обладают высокой ларвицидной активностью (1 % суспензия культуральной жидкости кристаллогенных вариантов вызывала 100 % гибели личинок A. aegypti через 15 мин, акристаллогенных — лишь 22-39 % через 24 ч) и находятся в культуральной жидкости в виде взвеси, в отличие от авирулентных вариантов, которые образуют осадок уже через 12 ч. Для оценки производственных свойств штаммов B. thuringiensis var. israelensis быстрый скрининг можно выполнять методом полимеразной цепной реакции для определения наличия генов, кодирующих главные белковые токсины B. thuringiensis. Поскольку вирулентные и авирулентные варианты этих штаммов без длительного культивирования не демонстри- руют существенных морфологических и биохимических различий, наличие или отсутствие генов cry — наиболее удобный показатель для отбора перспективных штаммов. Применение молекулярно-генетических методов в работе со штаммами-продуцентами не исключает необходимости учитывать скорость споруляции и соотношение количества спор и белковых кристаллических включений методом световой микроскопии, а также контролировать титр штаммов как показатель их технологичности.
Список литературы Инсектицидные свойства Bacillus thuringiensis var. Israelensis. Сообщение II. Сравнительный морфологический и молекулярно-генетический анализ кристаллогенных и акристаллогенных штаммов
- Ben-Dov E. Bacillus thuringiensis subsp. israelensis and its dipteran-specific toxins. toxins, 2014, 6(4): 1222-1243 ( ). DOI: 10.3390/toxins6041222
- Акбаев М.Ш., Водянов А.Н., Косминков Н.Е., Ятусевич А.И., Пашкин П.И., Василевич Ф.И. Паразитология и инвазионные болезни животных. М., 2000.
- Polanczyk R.A., Pires da Silva R.F., Fiuza L.M. Effectiveness of Bacillus thuringiensis against Spodoptera frugipera (Lepidoptera: Noctuida). Brazilian Journal of Microbiology, 2000, 31(3) 165-167 ( ). DOI: 10.1590/S1517-83822000000300003
- Sessitsch A., Reiter B., Berg G. Endophytic bacterial communities of field grown potato plants and their plant growth promoting abilities. Canadian Journal of Microbiology, 2004, 50: 239-249 ( ). DOI: 10.1139/w03-118
- Кандыбин Н.В., Патыка Т.И., Ермолова В.П., Патыка В.Ф. Микробиоконтроль численности насекомых и его доминанта Bacillus thuringiensis. СПб-Пушкин, 2009.
- Scherwinski K., Wolf A., Berg G. Assessing the risk of biological control agents on the indigenous microbial communities: Serratia plyuthica HRO-C48 and Streptomyces sp. HRO-71 as model bacteria. Biocontrol, 2006, 52: 87-112 ( ).
- DOI: 10.1007/s10526-006-9006-8
- Леднев Г.Р., Новикова И.И. Энтомофторовые грибы - перспективы и проблемы использования в биологической защите растений. В сб.: Биологические средства защиты растений, технологии их изготовления и применения. СПб, 2005: 261-272.
- Данилов Л.Г. Особенности проявления инвазионной активности энтомопатогенных нематод (Nematoda: Steinernematidae) в зависимости от абиотических и биотических факторов окружающей среды. Вестник защиты растений, 2018, 3: 38-42.
- Lacey L.A., Grzywacz D., Shapiro-Ilan D.I., Frutos R., Brownbridge M., Goettel M.S. Insect pathogens as biological control agents: back to the future. Journal of Invertebrate Pathology, 2015, 132: 1-41 ( ).
- DOI: 10.1016/j.jip.2015.07.009
- Bravo A., Gill S.S., Soberon M. Mode of action of Bacillus thuringiensis Cry and Cyt toxins and their potential for insect control. Toxicon, 2007, 49: 423-435 ( ).
- DOI: 10.1016/j.toxicon.2006.11.022
- Arglo-Filho R.C., Loguercio L.L. Bacillus thuringiensis in an environmental pathogen and host-specificity has developted as an adaptation to human-generated ecological nishes. Insects, 2014, 5(1): 62-91 ( ).
- DOI: 10.3390/insects5010062
- Mnif I., Ghribi D. Potential of bacterial derived biopesticides in pest management. Crop Protection, 2015, 77: 52-64 ( ).
- DOI: 10.1016/j.cropro.2015.07.017
- Наidar R., Deschamps A., Roudet J., Calvo-Garrido C., Bruez E., Rey P., Fermaud M. Multiorgan screening of efficient bacterial control agents against two major pathogens of grapevine. Biological Control, 2016, 92: 55-65 ( ).
- DOI: 10.1016/j.biocontrol.2015.09.003
- Heydari A., Pessaraki M. A review on biological control of fungal plant pathogens using microbial antagonists. Journal of Biological Sciences, 2010, 1(4): 273-290 ( ).
- DOI: 10.3923/jbs.2010.273.290
- Akram W., Mahboob A., Jave d A. Bacillus thuringiensis strain 199 can induce systemic resistance in tomato against Fusarium wilt. European Journal of Microbiology and Immunology, 2013, 3: 275-280 ( ).
- DOI: 10.1556/EuJMI.3.2013.4.7
- Choudhary D.K., Johri B.N. Interactions of Bacillus spp. and plants - with special reference to induced systemic resistance. Microbiological Research, 2009, 164(5): 493-513 ( ).
- DOI: 10.1016/j.micres.2008.08.007
- Kumar P., Dubey R.C., Mahshwari D.K. Bacillus strain isolated from rhizosphere showed plant growth promoting and antagonistic activity against phythopathogens. Microbiological Research, 2012, 167(8): 493-499 ( ).
- DOI: 10.1016/j.micres.2012.05.002
- Raddadi N., Cherif A., Ouzari H., Marzorati M., Brusetti L., Boudabous A., Daffonchio D. Bacillus thuringiensis beyond insect biocontrol: plant growth promotion and biosafety of polyvalent strains. Annals of Microbiology, 2007, 57(4): 481-494 ( ).
- DOI: 10.1007/BF03175344
- Raymond B., Federici B.A. In defense of Bacillus thuringiensis, the safest and most successful microbial insecticide available to humanity - a response to EFSA. FEMS Microbiology Ecology, 2017, 93(7): fix084 ( ).
- DOI: 10.1093/femsec/fix084
- Ал-Хамада А.Д. Выделение энтомопатогенов в Вacillus thuringiensis (Bt) из региона Deir Ezzor Сирии и их биотестирование. Вестник защиты растений, 2009, 4: 54-62.
- Pane C., Villecco D., Campanile F., Zaccardelli M. Novel strains of Bacillus isolated from compost and compost-amended soils as biological control agents against soil-borne phytopathogenic fungi. Biocontrol Science and Technology, 2012, 22(12): 1373-1388 ( ).
- DOI: 10.1080/09583157.2012.729143
- Tao A., Pang F., Huang S., Yu G., Li B., Wang T. Characterization of endophytic Bacillus thuringiensis strains isolated from wheat plants as biocontrol agents against wheat flagsmut. Biocontrol Science and Technology, 2014, 24(8): 901-924 ( ).
- DOI: 10.1080/09583157.2014.904502
- The manual of biocontrol agents. British Protection Council Publication, Alton, V.K., 2014.
- Al-Momani F., Obeidat M., Saasoun I., Mequam M. Serotyping of Bacillus thuringiensis isolates their distribution in different Jordanian habitats and pathogenecity in Drosophila melanogaster. World Journal of Microbiology and Biotechnology, 2004, 20: 749-753 ( ).
- DOI: 10.1007/s11274-004-4517-x
- Choi Y.S., Cho E.S., Je Y.H., Roh J.Y., Chang J.H., Li M.S., Seo S.J., Sohn H.D., Jin B.R. Isolation and characterization of a strain of Bacillus thuringiensis subsp. morrisoni PG-14 encoding δ-endotoxin Cry1Ac. Current Microbiology, 2004, 48: 47-50 ( ).
- DOI: 10.1007/s00284-003-4102-9
- Гришечкина С.Д., Ермолова В.П., Коваленко Т.К., Антонец К.С., Белоусова М.Е., Яхно В.В., Нижников А.А. Полифункциональные свойства производственного штамма Bacillus thuringiensis var. thuringiensis 800/15. Сельскохозяйственная биология, 2019, 54(3): 494-504 ( ).
- DOI: 10.15389/agrobiology.2019.3.494rus
- Гришечкина С.Д., Ермолова В.П., Романова Т.А., Нижников А.А. Поиск природных изолятов Bacillus thuringiensis для создания экологически безопасных биологических препаратов. Сельскохозяйственная биология, 2018, 53(5): 1062-1069 ( ).
- DOI: 10.15389/agrobiology.2018.5.1062rus
- Shrestha A., Sultana R., Chae J.-C., Kim K., Lee K.-J. Bacillus thuringiensis C-25 which is rich in сеll wall degrading enzymes efficiently control lettuce drop caused by Sclerotinia minor. Eur. J. Plant Pathol., 2015, 142(3): 577-589 ( ).
- DOI: 10.1007/s10658-015-0636-5
- Saber W.I.A. Ghoneem K.V., Al-Askar A.A., Rashad Y.M., Ali A.A., Rashad E.M. Chitinase production by Вacillus subtilis ATCC 11774 and its effect on biocontrol of Rhizoctonia disease of potato. Acta Biologica Hungarica, 2015, 66(4): 436-448 ( ).
- DOI: 10.1556/018.66.2015.4.8
- Malovichko Y.V., Nizhnikov A.A., Antonets K.S. Repertoire of the Bacillus thuringiensis virulence factors unrelated to major classes of protein toxins and its role in specificity of host-pathogen interactions. toxins, 2019, 11: e11060347 ( ).
- DOI: 10.3390/toxins11060347
- Zhang M.-Y., Lovgren A., Low M.G., Landen R. Characterization of an avirulent pleiotropic of the insect pathogen Bacillus thuringiensis: reduced expression of flagellin and phosphlipases. Infection and Immunity, 1993, 61(12): 4947-4954.
- Лебенко Е.В., Секерина О.А., Чемерилова В.И. Особенности хемотаксиса у диссоциативных S- и R- вариантов Bacillus thuringiensis. Микробиология, 2005, 74(1): 87-91.
- Ермолова В.П., Гришечкина С.Д., Нижников А.А. Активность энтомопатогенных штаммов Bacillus thuringiensis var. israelensis при разных методах хранения. Сельскохозяйственная биология, 2018, 53(1): 201-208 ( ).
- DOI: 10.15389/agrobiology.2018.1.201rus
- Smirnoff U.A. The formation of crystals in Bacillus thuringiensis var. thuringiensis Berliner before sporulation of temperature inculcation. J. Insect. Pathol., 1965, 2: 242-250.
- Guidi V., Patocchi N., Lüthy, P., Tonolla M. Distribution of Bacillus thuringiensis subsp. israelensis in soil of a Swiss Wetland reserve after 22 years of mosquito control. Applied and Environmental Microbiology, 2011, 77(11): 3663-3668 ( ).
- DOI: 10.1128/AEM.00132-11
- Hansen B.M., Hendriksen N.B. Detection of enterotoxic Bacillus cereus and Bacillus thuringiensis strains by PCR analysis. Applied and Environmental Microbiology, 2001, 67(1): 185-189 ( ).
- DOI: 10.1128/AEM.67.1.185-189.2001
- Доспехов Б.А. Методика полевого опыта. М., 1973.
- Ben-Dov E., Zaritsky A., Dahan E., Barak Z., Sinai R., Manasherob R., Margalith Y. Extended screening by PCR for seven cry-group genes from field-collected strains of Bacillus thuringiensis. Applied and Environmental Microbiology, 1997, 63(12): 4883-4890.
- Schneider S., Hendriksen N.B., Melin P., Lundström J.O., Sundh I. Chromosome-directed PCR-based detection and quantification of Bacillus cereus group members with focus on B. thuringiensis serovar israelensis active against nematoceran larvae. Applied and Environmental Microbiology, 2015, 81(15), 4894-4903
- DOI: 10.1128/aem.00671-15
- Bravo A., Sarabia S., Lopez L., Ontiveros H., Abarca C., Ortiz A., Quintero R. Characterization of cry genes in a Mexican Bacillus thuringiensis strain collection. Applied and Environmental Microbiology, 1998, 64(12): 4965-4972.


