Инструментально-лабораторная оценка процессов стрессового ре-моделирования костной ткани при тотальном эндопротезировании тазобедренного сустава
Автор: Карякина Е.В., Персова Е.А., Гладкова Е.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.6, 2010 года.
Бесплатный доступ
Цель: оценка особенностей стрессового ремоделирования костной ткани по данным денситометрии и уровню биохимических маркеров резорбции и формирования кости при тотальном эндопротезировании тазобедренного сустава. Материалы. У 52 больных коксартрозом 11-111 стадий с выраженным нарушением функции сустава до и после его тотального эндопротезирования определяли минеральную плотность костной ткани, состояние кальций-фосфорного обмена и биохимические маркеры формирования (остеокальцин и костный изофермент щелочной фосфатазы) и резорбции (С-концевые телопептиды коллагена I типа) кости. Контрольная группа - 24 донора. Достоверными считались данные при показателе вероятности р
Биохимические маркеры, коксартроз, ремоделирование костной ткани, эндопротезирование тазобедренного сустава
Короткий адрес: https://sciup.org/14917095
IDR: 14917095
Текст научной статьи Инструментально-лабораторная оценка процессов стрессового ре-моделирования костной ткани при тотальном эндопротезировании тазобедренного сустава
о ее функциональных особенностях. Для получения сведений, касающихся метаболизма костной ткани, все чаще используется определение биохимических маркеров ремоделирования в биологических жидкостях организма, в частности, в сыворотке крови.
Работы по оценке стрессового ремоделирования костной ткани после ТЭП ТБС с помощью биохимических маркеров, определяемых в биологических жидкостях организма, единичны и результаты их неоднозначны, поэтому основной задачей настоящего исследования было проведение инструментальнолабораторного мониторинга процессов адаптивной перестройки кости после ТЭП ТБС у больных остеоартрозом (ОА).
Цель : оценка процессов стрессового ремоделирования костной ткани по данным денситометриче-ского и биохимического методов при тотальном эндопротезировании тазобедренного сустава у больных коксартрозом.
Методы. Для решения поставленной задачи в динамике обследованы 52 больных ОА, поступивших в СарНИИТО для выполнения ТЭП ТБС (максимальный срок наблюдения – 12-15 месяцев после операции), из них мужчин – 21, женщин – 31. У обследованных пациентов имелась III стадия коксартроза, диагностированная по изменениям на рентгенограммах. Возраст больных мужского пола варьировал от 36 до 78 лет, а все обследованные женщины были в возрасте старше 50 лет. Длительность заболевания была от 5 до 17 лет. Длительность поражения тазобедренного сустава составляла более 5 лет. Контрольная группа – 24 донора.
Все больные предъявляли жалобы на боли различной интенсивности в области ТБС. У всех обследованных наблюдалось уменьшение объема движений в пораженном тазобедренном суставе. Выраженные нарушения функции тазобедренных суставов (ФНС II-ΙΙI) были у 100% больных, что и являлось показанием к тотальному эндопротезированию. Все пациенты получали в прошлом различные нестероидные противовоспалительные препараты.
Для исследования отбирались больные с наличием остеопенического синдрома, проявлявшегося как локальным (периартикулярным) остеопорозом или остеопенией, так и генерализованной остеопенией (снижение МПКТ в области L1-L4).
Всем больным выполнено бесцементное ТЭП ТБС, послеоперационный период протекал гладко, ранние и поздние инфекционные осложнения, а также осложнения, связанные с техническими погрешностями во время оперативного вмешательства, отсутствовали.
Всем больным выполнялось тщательное клиникорентгенологическое и лабораторное обследование. С целью оценки механических свойств костной ткани проксимальной трети бедра, до операции и в процессе стрессового ремоделирования при восстановлении статико–динамической функции, после ТЭП ТБС у всех больных ОА выполнялось стандартное ден-ситометрическое исследование с помощью костного денситометра Prodigy (№ DF+ 15045 1999 г.) фирмы GE LUNAR Corporati o n (США). Также использовалась специальная ортопедическая программа, позволяющая определять МПКТ в 7 зонах, описанных Т. А. Gruen и соавт. (1979) [5].
В рамках стандартного денситометрического обследования оценивали МПКТ L1-L4 позвонков в передне-задней проекции и проксимальных отделов обоих бедер (в шейке, большом вертеле и бедре в целом).
В сыворотке крови методом твердофазного им-муноферментного анализа с помощью стандартных тест-систем на анализаторе с микропланшетным ридером Anthos 2020 определяли био х имические маркеры формирования (N - mid остеокальцин – ОК и костный изофермент щелочной фосфатазы – кЩФ) и резорбции (С-концевые телопептиды зрелого коллагена I типа – Serum CrossLaps) кости для оценки особенностей процессов ее ремоделирования.
Также изучали состояние кальций-фосфорного обмена, тесно связанного с ремоделированием костной ткани, для чего в сыворотке крови определяли уровень общего кальция, неорганического фосфора и активность общей щелочной фосфатазы (ЩФ) на биохимическом анализаторе «Сапфир350» (Ирландия), ионизированного кальция – на анализаторе Rapidlab 348 фирмы «Bayer» (Великобритания) с помощью ионоселективных электродов.
Кровь для биохимических исследований получали при пункции локтевой вены до операции утром натощак.
Обследование больных выполнялось в следующие сроки: до операции и через 12-14 дней, 3, 6, 12(15) месяцев после оперативного вмешательства. У ряда пациентов биохимическое исследование проведено и через 1-1,5 месяца после операции.
Статистическая обработка проводилась с вычислением средней арифметической (М), средней ошибки средней арифметической (m), коэф ф ициента достоверности (t). Полученные данные считались достоверными при показателе вероятности р<0,05.
Результаты. До операции у 24 больных ОА в области, прилежащей к ТБС, выявлено снижение МПКТ, характерное для остеопороза (Т-критерий-2,5SD и ниже); у остальных больных ОА – снижение МПКТ, характерное для остеопении (Т-критерий от -1,1SD до -2,4SD).
Данные по МПКТ вокруг бедренного компонента эндопротеза в зонах Gruen (рис. 1) в процессе адаптивной перестройки кости при восстановлении статико-динамической функции после ТЭП ТБС у больных ОА представлены в таблице 1.
В качестве исходных значений принимали МПКТ, определяемую через 12-14 дней после ТЭП ТБС.
Как следует из материалов таблицы 1, через 3 месяца после операции определялось некоторое снижение МПКТ во всех зонах, однако эти изменения были статистически недостоверны. Достоверные изменения МПКТ обнаружены только через 6 месяцев
Таблица 1
Значения МПКТ в проксимальной трети бедренной кости в динамике после ТЭП ТБС у больных ОА, г/см (M± m)
|
Сроки исследования |
12-14 дней |
3 месяца |
6 месяца |
12 месяцев |
||||
|
Мужчины |
Женщины |
Мужчины |
Женщины |
Мужчины |
Женщины |
Мужчины |
Женщины |
|
|
Зоны исследования |
n=21 |
n=31 |
n=21 |
n=31 |
n=19 |
n=30 |
n=20 |
n=28 |
|
R1 |
0,81±0,042 |
0,79±0,049 |
0,73±0,039 |
0,72±0,059 |
0,54*±0,061 |
0,44*±0,081 |
0,56*±0,079 |
0,58±0,097 |
|
R2 |
1,66±0,064 |
1,67±0,076 |
1,64±0,094 |
1,54±0,085 |
1,50±0,103 |
1,52±0,067 |
1,01*±0,101 |
0,81*±0,104 |
|
R3 |
2,1±0,053 |
2,15±0,076 |
2,08±0,054 |
2,01±0,074 |
1,67*±0,082 |
1,71*±0,061 |
1,98±0,075 |
1,65*±0,078 |
|
R4 |
2,01±0,076 |
1,90±0,071 |
1,98±0,101 |
1,86±0,082 |
1,91±0,072 |
1,65±0,068 |
0,92*±0,059 |
1,05*±0,087 |
|
R5 |
2,61±0,081 |
2,53±0,071 |
2,56±0,082 |
2,47±0,063 |
2,01*±0,069 |
1,49*±0,092 |
2,32±0,078 |
1,57±0,079 |
|
R6 |
1,25±0,044 |
1,36±0,083 |
1,23±0,054 |
1,33±0,093 |
0,79*±0,077 |
0,84*±0,065 |
1,03±0,069 |
0,76±0,093 |
|
R7 |
1,19±0,071 |
1,39±0,049 |
1,01±0,073 |
1,35±0,053 |
1,04±0,067 |
1,11±0,077 |
1,07*±0,096 |
1,01*±0,064 |
П р и м еч а н и е : * р<0,05 достоверность разницы с исходным состоянием МПКТ
Таблица 2
Показатели Са-Р обмена в процессе стрессового ремоделирования после ТЭП ТБС у больных остеоартрозом (М ±m)
При оценке Са-Р обмена обнаружено, что изменения изученных показателей были статистически недостоверны во все сроки наблюдения как у мужчин, так и у женщин (табл. 2).
Для изучения особенностей метаболизма костной ткани в процессе ее адаптивной перестройки после ТЭП ТБС у больных ОА был проведен мониторинг маркеров резорбции и костеобразования, определяемых в сыворотке крови (рис. 2, 3, 4).
Количественные параметры биохимических маркеров метаболизма костной ткани изменялись статистически достоверно (р<0,05) по сравнению с дооперационным уровнем через 1,5-3 месяца после операции, причем уровень Serum CrossLaps и кЩФ возвращались к дооперационным показателям через год, в то время как содержание ОК и через 12-15 месяцев после операции оставалось несколько повышенным.
Среди обследованных больных выделялась группа пациентов (3 человека) с выраженным отрицательным костным балансом, обнаруженным при анализе динамики индивидуальных особенностей метаболизма костной ткани. У этих больных интенсификация об-
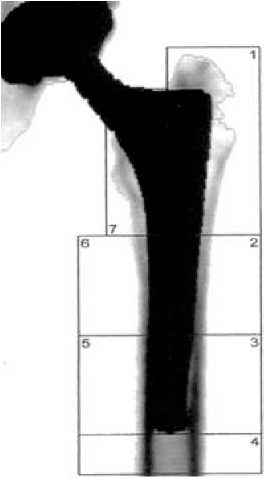
Рис. 1. Зоны Gruen при оценке МПКТ у больных ОА
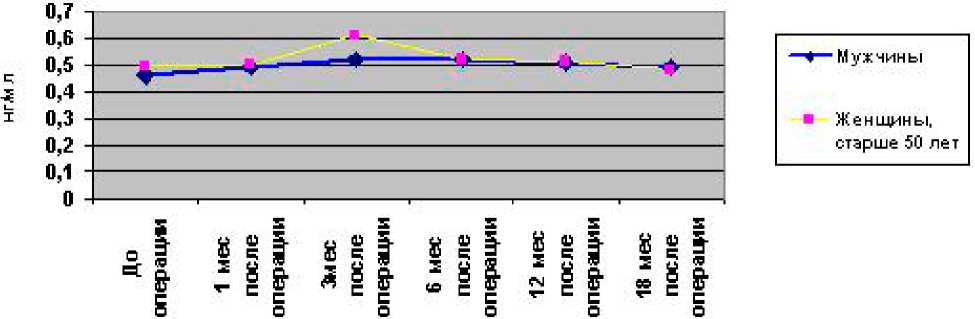
Рис. 2. Уровень Serum CrossLaps (нг/мл) у мужчин и женщин, больных ОА, в динамике
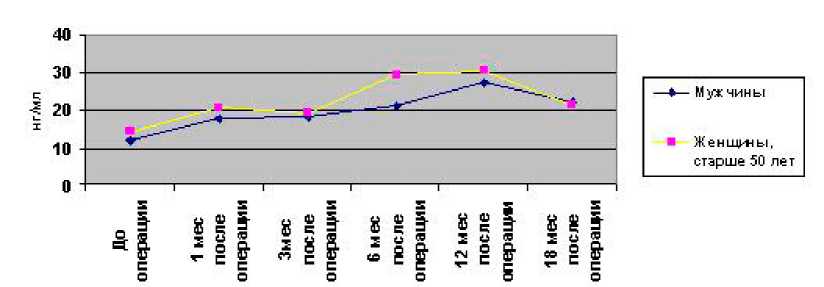
Рис. 3. Уровень остеокальцина (нг/мл) у мужчин и женщин, больных ОА, в динамике
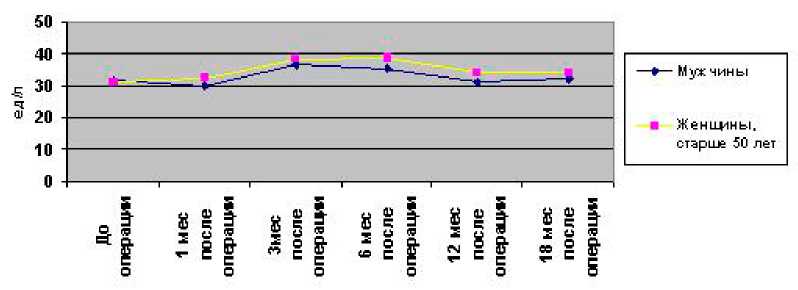
Рис. 4. Уровень костного изофермента щелочной фосфатгазы (нг/мл) у мужчин и женщин, больных ОА, в динамике
мена костной ткани проявлялась повышением уровня маркеров резорбции в сыворотке крови (р<0,05), а также существенным, но менее выраженным повышением маркеров костеобразования по сравнению с данными в целом по группе обследованных больных ОА. Интенсификация ремоделирования костной ткани с выраженным преобладанием процессов резорбции, не компенсируемым соответствующим усилением процессов костеобразования, сочеталась с характерными рентгенологическими изменениями (наличие зоны разрежения) и снижением МПКТ по данным денситометрии вокруг бедренного компонента эндопротеза (перипротезный остеопороз).
Обсуждение. В настоящее время в практике оценки состояния костной ткани, в том числе в процессе ее стрессового ремоделирования после ТЭП, помимо анализа рентгенограмм, широкое распространение получил метод рентгеновской денситометрии [6, 2]. МПКТ является одним из показателей, характеризующих механические свойства кости, во многом зависящие от ее химического состава. Данный метод особенно актуален при комплексной оценке прочности костной ткани до и после ТЭП ТБС. Методом денситометрии определяется лучевая плотность костной ткани, которая зависит от формы кости, количества ее в определенном объеме и косвенно указывает на наличие минералов в самой кости, приведенной к массе кости. При сравнительной оценке качества кости биохимическим и денситоме-трическим методами исследования обнаружено, что у больных ОА с наличием коксартроза МПКТ пропорциональна количеству неорганических ионов в костной ткани [7].
В последние годы в клинической практике все большее значение приобретает определение биохимических маркеров костного ремоделирования [8, 9, 10, 11], причем сочетанное определение содержания маркеров резорбции и костеобразования позволяет оценить функциональное состояние костной ткани, интенсивность обменных процессов в кости, особенности ремоделирования в конкретный момент времени.
Подобно другим исследователям [3, 4] мы оценивали процессы стрессового ремоделирования после ТЭП ТБС у больных ОА с помощью стандартного ден-ситометрического исследования и специальной ортопедической программы, позволяющей оценить МПКТ в зонах, прилежащих к бедренному компоненту эндопротеза (зоны Gruen). Достоверные изменения МПКТ в области бедренного компонента эндопротеза были обнаружены нами только через 6 месяцев после ТЭП и не во всех зонах, что согласуется с данными цитируемых авторов.
Нами был проведен биохимический мониторинг особенностей метаболизма костной ткани в процессе ее адаптивной перестройки после ТЭП ТБС у больных ОА с помощью маркеров резорбции и костеобразования, определяемых в сыворотке крови.
Проведение сопоставительного анализа клиникодиагностических значений денситометрической и биохимической оценок особенностей стрессового ремоделирования после ТЭП ТБС показало, что биохимические маркеры по сравнению с денситометриче-ским определением МПКТ позволяют в более ранние сроки после оперативного вмешательства (а именно, через 3 месяца, а у некоторых больных и через 1,5
месяца) объективно оценить особенности адаптивной перестройки костной ткани.
Из данных литературы известно, что через 3 и 6 месяцев после ТЭП ТБС у больных ОА имеется повышение уровня маркеров резорбции и костеобразования в биологических жидкостях организма (кровь, моча) [12], что, очевидно, свидетельствует об интенсификации метаболизма костной ткани, являющегося в раннем послеоперационном периоде одним из проявлений адаптационно – компенсаторной реакции. Наши данные полностью подтверждают это положение. Более того, исследования, проведенные нами в более ранние сроки после оперативного вмешательства (приблизительно через 1,5 месяца), и сравнение полученных результатов не с показателями практически здоровых лиц, а с дооперационным уровнем изученных маркеров у каждого конкретного больного предположительно могут дать ценную информацию о дальнейшем протекании обменных процессов в костной ткани, в том числе в области, прилежащей к эндопротезу.
Однако требует уточнения диагностическая информативность количественной оценки степени интенсификации костного метаболизма в раннем послеоперационном периоде, а также длительности сохранения высокой скорости обмена костной ткани, приводящей к ее существенному дефициту в области, прилежащей к эндопротезу.
Заключение. Инструментально-лабораторный мониторинг процессов стрессового ремоделирования после ТЭП ТБС у больных ОА свидетельствовал о развитии дефицита МПКТ, который не восстанавливался полностью через 12-15 месяцев после операции. Адаптивное усиление резорбции в процессе стрессового ремоделирования кости после ТЭП ТБС в первые 6 месяцев после операции не у всех больных сопровождается адекватным компенсаторным усилением костеобразования в сроки 6-12 (15) месяцев после операции.
Биохимические маркеры ремоделирования позволяют в более ранние сроки по сравнению с МПКТ объективно оценить особенности адаптивной пере-
стройки костной ткани после ТЭП ТБС и выделить группу больных с резкой интенсификацией метаболизма кости и выраженным отрицательным костным балансом. Диагностическая информативность определения биохимических маркеров ремоделирования костной ткани в биологических жидкостях организма в раннем послеоперационном периоде после ТЭП ТБС у больных ОА требует дальнейшего изучения.
Список литературы Инструментально-лабораторная оценка процессов стрессового ре-моделирования костной ткани при тотальном эндопротезировании тазобедренного сустава
- Загородний Н.В., Дирин В.А., Магомедов Х.М. Эндопро-тезирование тазобедренного сустава эндопротезами нового поколения//Актуальные вопросы практической медицины: сб. тр. М., 2000. С. 377-387.
- Лесняк О.М., Беневоленская Л.И. Остеопороз М.: ГЭОТАР-Медиа, 2009. 72 с. (Клин. рекомендации).
- Родионова С.С., Нуждин В.И., Морозов А.К. Остеопороз как фактор риска асептической нестабильности при эндопро-тезировании тазобедренного сустава//Вестник травматологии и ортопедии им. Н.Н. Приорова. 2007. № 2. С. 35-40.
- Клюшниченко И.В. Независимые от импланта факторы риска развития асептической нестабильности эндопротеза тазобедренного сустава: Автореф. дис.... канд. мед. наук.: М., 2008. 15 с.
- Gruen T.A., McNiece G.M., Amstutz H.C. Modes of failures of cemented stem-type femoral component: a radiographic analysis of loosening//Clin. Orthop. 1979. № 141. P. 17-27.
- Беневоленская Л.И. Руководство по остеопорозу М.: БИНОМ, 2003. 524 с.
- Лунева С.Н., Накоскин А.Н., Овчинников Е.Н., Каминский А.В. О взаимосвязи минеральной плотности и биохимических показателей костной ткани при коксартрозе//Травматология и ортопедия России. 2008. № 1. С. 49-53.
- LemsW.F, GerritsM.l., Gjacobs J.W. etal. Changes in (markers of) bone metabolism during high dose corticosteroid pulse treatment in patients with rheumatoid arthritis//Ann. Rheumat. Dis. 1996. 55. P. 288-293.
- Delmas P.D. Standardization of bone marker nomenclature//Clin. Chem. 2001. P. 1497.
- Шварц Г.Я. Фармакотерапия остеопороза М.: Мед. ин-форм. агентство, 2002. 410 с. 11. Дати Ф., Метцманн Э. Белки. Лабораторные тесты и клиническое применение М.: Лабора, 2007. 548 с.
- Schneider U., Schmidt В., Rohlfing U. et al. Effects upon Metabolism Following Total Hip and Total Knee Arthroplasty//Pathobiol. 2002/2003. Р. 26-33.