Интеграция костной ткани в пористые титановые импланты с алмазоподобными нанопокрытиями
Автор: Макарова Эмилия Борисовна, Захаров Юрий Михайлович, Рубштейн Анна Петровна, Исайкин Анатолий Иванович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2011 года.
Бесплатный доступ
Эксперимент выполнен in vitro и in vivo на 29 половозрелых кроликах. Исследовали влияние алмазоподобного углеродного нанопокрытия (а-С) титановой матрицы на жизнеспособность, адгезию, активность NADPH-оксидаз, колониеобразующую способность миелокариоцитов; на морфологию и прочность новообразованной в порах имплантов костной ткани. Выявлено увеличение жизнеспособности, клоногенной способности адгезирующей фракции миелокариоцитов в присутствии титано- вых образцов титана с а-С. Применение углеродного алмазоподобного нанопокрытия приводит к образованию более зрелой и прочной костной ткани в порах имплантов. Применение нанопокрытия замедляет процессы склерозирования вновь обра- зованной костной ткани.
Пористый титан, имплантаты, алмазоподобное покрытие, кость, стромальные клетки
Короткий адрес: https://sciup.org/142121475
IDR: 142121475 | УДК: 611.018.4:611.82:616-089.843
Текст научной статьи Интеграция костной ткани в пористые титановые импланты с алмазоподобными нанопокрытиями
Биосовместимость (биоинертность) носителей для мезенхимальных клеток обязательна при использовании клеточных технологий в восстановительной хирургии [2, 7]. Пористые металлические носители и, в частности, пористый титан, обладают способностью одновременно выполнять функцию эндофиксатора и трехмерной матрицы для остеогенной ткани [12]. Тестирование имплантов из титана в культурах тканей и на животных показало, что титан и его сплавы относятся к группе биоинертных материалов, способных к самопассивации [5]. В порах титановых имплантатов образуется зрелая костная ткань со структурой, аналогичной материнской кости [15].
Однако, по данным ряда авторов, остеоинтеграция титана с немодифицированной поверхностью со временем уменьшается, вероятно, за счет гальвано-электрических тканевых реакций. Несмотря на образование при контакте с кислородом на поверхности титана окисной пленки, концентрация ионов титана увеличивается после внедрения имплантатов в костной ткани, в крови и моче. Считается, что увеличение содержания титана в организме не оказывает аллергического или канцерогенного воздействия и не приводит к развитию металлоза. Большая его часть депони- руется в костях и легких, но также он был обнаружен и в паренхиматозных органах (почках, печени, лимфатических узлах) [5, 11].
Таким образом, титан считается одним из самых биоинертных металлов. Однако в ряде случаев тканевые реакции на титановые имплантаты приводят к формированию грануляционной ткани вокруг титановых имплантатов, подвергающейся созреванию к 30–60 суткам после операции [8]. Общеизвестно, что модификация поверхности, в том числе химическая или термическая ее обработка, обеспечивает ускорение врастания и усиление сцепления костной ткани с имплантатом [13]. С целью увеличения прочности и скорости формирования костного блока, а также максимального сохранения структуры полученного блока мы использовали алмазоподобные углеродные нанопокрытия (а-С) пористых титановых имплантатов (ПТ).
Кроме того, изменяя пористость образцов, можно подобрать образцы ПТ, имеющие величину модуля упругости, сопоставимую с модулем упругости костной ткани. Так, модуль упругости поясничных и шейных позвонков человека составляет 0,16–0,23 ГПа, большеберцовой кости — 18,1 ГПа, бедренной кости — 17,2 ГПа [1]. Образцы пористого титана, иссле- дуемые нами и полученные методом компактирования из пористых гранул (2–5 мм) титановой губки марки ТГ-ОП-1, при объемной доле пор в материале θ ≤ 45 % имеют модуль упругости в интервале 2,2–3,6 ГПа.
Использование «мягкого» материала и повышение его коррозиоустойчивости снижает вероятность развития стрессорного ремоделирования костной ткани вокруг имплантата при упругих деформациях, а, сле- довательно, и преобладания процессов деструкции над процессами остеогенеза костной ткани вокруг имплантата.
Цель исследования — теоретически-эксперимен-тальное обоснование применения насыщенных аутогенными прилипающими клетками костного мозга пористых титановых имплантатов с алмазоподобными покрытиями для стимуляции репаративного остеогенеза.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент выполнен на 29 половозрелых 6–10месячных кроликах массой 2,5-3 кг стадного разведения. Животных содержали в стандартных условиях вивария, предусмотренными «Правилами проведения работ с использованием экспериментальных животных», утвержденных Приказом МЗ СССР №755 от 12.08.1977 г. Манипуляции с экспериментальными животными выполнялись в соответствии с положениями Хельсинкской декларации о гуманном обращении с животными, методическими рекомендациями по их выведению из эксперимента и эвтаназии. Костный мозг кроликов получали под общим наркозом методом пункции из крыла подвздошной кости. Миелокариоциты однократно отмывали избытком полной культуральной среды: RPMI-1640 (ФГУ ГНЦ вирусологии и биотехнологии «Вектор»), 20 % эмбриональной телячьей сыворотки (HyClone), L/глютамин 30 мг/100 мл среды (Sigma), гентамицин — 5 мг/100 мл среды [4]. После центрифугирования удаляли супернатант с жировым костным мозгом. Клеточный осадок ресуспендировали в полной культуральной среде, до -водили клеточность суспензии до 5–6 × 106/мл живых клеток и переносили в лунки стерильных 24-луночных планшетов (SplLifeSciences) по 1 мл. Культивировали клетки в течение 7-32 суток при 37 °С, 4 % содержании СО2, абсолютной влажности. Смену 60 % среды осуществляли два раза в неделю.
Оценку жизнеспособности клеток проводили после 4-часовой инкубации миелокариоцитов в присутствии образцов титана по общепринятым тестам: активность общей лактатдегидрогеназы (ЛДГ) в супернатанте культуры оценивали на автоматическом селективном биохимическом анализаторе Sapphire-400 (Япония); активность NADPH-оксидаз по НСТ-тесту [14] проводили с автоматизированным учетом [6].
Для оценки влияния полированных титановых образцов с алмазоподобным покрытием или без него на адгезию миелокариоцитов к их поверхности, а также клоногенную способность прилипающей фракции миелокариоцитов в присутствии данных образцов, размером 0,8»0,8»0,2 мм, осуществляли по общепринятой методике культивирования клеток (см. выше) в полной культуральной среде. Использование полированных образцов позволило исключить влияние на адгезию клеток макрорельефа исследуемых образцов. Клеточность культур прилипающей фракции миелока-риоцитов оценивали после добавления в каждую лунку 0,5 мл 0,25 % трипсин-ЕДТА (Sigma) на 20 минут [4]. Затем клетки осторожно ресуспендировали в одинаковом объеме полной культуральной среды, подсчитывали их количество в камере Горяева и выражали в количестве клеток »106/мл среды. Площадь на дне лунки, занятую фибробластоподобными клетками, культивируемыми в присутствии полированных образцов, оценивали с помощью аппаратно-программного комплекса видео Тест-морфология 4,0.
Пористые титановые имплантаты без алмазоподобного покрытия (ПТ) и пористые титановые имплантаты с алмазоподобными покрытиями (ПТ с а-С) с двойной системой пор (микроканалы 2–3 мкм и макроканалы — 200–300 мкм, объемная доля пор — 40 %, из них 75 % пор сообщаются с поверхностью ) первоначально насыщали прилипающей фракцией клеток аутологичного костного мозга кроликов, внося в лунку с имплантатом 5–6 × 106 миелокариоцитов/мл на 2 часа. Клетки проникали в поры с током жидкости за счет поверхностного натяжения. Среду с неприкре-пившимися клетками удаляли, бережно отмывали имплантаты от неприлипших клеток и переносили их в лунки со свежей полной культуральной средой. Затем количество клеток увеличивали инкубированием имплантатов с клетками в порах в полной культуральной среде: 70 % McCoy,s 5A (BioWhittakerRLONZA), 30 % эмбриональная телячья отборная сыворотка (HyClone, ПанЭко), L-глютамин (Sigma, ПанЭко) 30 мг/100 мл, гентамицин 5 мг/100 мл, гепарин-натрий (Braun) в стерильных 24-луночных планшетах (SplLifeSciences) при 37 °С, 4 % содержании СО2, абсолютной влажности. Клонирование проводили в CO 2 инкубаторе CELL 48 (стандартная линия) в течение 14 суток. Смену 60 % среды осуществляли два раза в неделю.
Для изучения организации клеточного слоя методом сканирующей электронной микроскопии образцы имплантатов с клетками фиксировали в 2,5 % растворе глутарового альдегида. Полученные препараты исследовали в растровом микроскопе Philips 500.
Операции по внедрению имплантатов, насыщенных аутологичными прилипающими клетками костного мозга, под общим наркозом (рометар — 8 мг/кг, золетил 6 мг/кг — внутримышечно) выполняли на базе ГОУ ВПО УГМА Росздрава Д. Г. Близнец, к. м. н. Э. Б. Макарова, к. м. н. А. И. Исайкин. Всего внедрено 76 имплантатов 29 кроликам. Имплантаты из ПТ или из ПТ с а-С диаметром 4,5 мм и длиной 6 мм вводили в мыщелки большеберцовой и бедренных костей кроликов. С соблюдением правил асептики выполняли продольный разрез по внутренней поверхности метадиафиза кости до 1,5 см, выделяли костную площадку. Сверлом 4 мм формировали канал с проникновением в костномозговой канал, вход в него раззенковывали сверлом 4,5 мм, с помощью импактора в метадиафиз установливали титановый имплантат таким образом, чтобы поверхность торца имплантата сравнялась с плоскостью кости. Положение имплантата контролировали рентгенологически. Через 5–6 часов животные наступали на оперированную конечность, их помещали в отдельные клетки, где они могли свободно перемещаться. Через 4, 16 и 52 недели после операции животных выводили из эксперимента.
Механические испытания прочности новообразованной костной ткани проводили на универсальной испытательной машине FP 100/1 с автоматической записью диаграммы. Нагрузка увеличивалась постепенно до разрыва образца. Предел прочности о рассчитывался по формуле σ = Р/S, где Р — сила, при которой происходит разрыв образца, S — площадь, по которой произошел разрыв. Площадь определяли по увеличенным снимкам зоны разрыва. Относительный предел прочности на разрыв (σrel) определяли как отношение (оНКТ/оКТ) х 100 %, где оНКТ — предел прочности на раз- рыв новообразованной костной ткани и σКТ — предел прочности на разрыв нативной кости.
Для гистологического исследования новообразованной костной ткани костные блоки с имплантатами для удаления титановой матрицы помещали в раствор плавиковой кислоты и этиленгликоля [9]. После вытравливания титана новообразованную костную ткань изучали с помощью сканирующего электронного микроскопа QUANTA 200 или проводили декальцинацию костной ткани в растворе BiodecR (Bio-Optica), затем обезвоживали в спиртах восходящей концентрации с дальнейшей заливкой парафином. Тонкие срезы (6–7 мкм), полученные на санном микротоме МС-2, окрашенные гематоксилином и эозином или пикрофуксином по ван Гизону, изучали с использованием микроскопа «Micros». Статистическую обработку результатов выполняли с использованием непараметрического критерия (двухсторонний вариант) Манна–Уитни [3].
РЕЗУЛЬТАТЫ
Результаты культивирования миелокариоци-тов в присутствии образцов полированного титана с алмазоподобным покрытием и без покрытия. Применение образцов титана с а-С при инкубации ми-елокариоцитов кролика в течение 4 часов приводило к большей сохранности жизнеспособности клеток, о чем свидетельствовало значимое снижение (до 66,3 %,) концентрации ЛДГ в супернатанте по сравнению с культурами, инкубированными с образцами без по -крытия. При использовании в качестве подложки полированного титана с напыленной в вакууме углеродной алмазоподобной пленкой количество адгезировавших на ней клеток значимо не изменялось по сравнению с количеством клеток, адгезировавших на подложку из титана без покрытия. Не выявлено значимых отличий и в активности NADPH-оксидаз миелокариоцитов при тестировании образцов из полированного титана без покрытий и с алмазоподобными покрытиями.
При исследовании клоногенной способности костномозговых прекурсоров в присутствии титановых образцов через 7 суток была выявлена тенденция к увеличению колониеобразующей способности (КОС) адгезирующей фракции миелокариоцитов в культурах, инкубированных в присутствии титана с а-С, по сравнению с КОС костного мозга, культивированного в присутствии титана. В культурах с титаном с а-С имели тенденцию к увеличению количество кластеров фибробластоподобных клеток (колониеобразующих единиц, содержащих от 3 до 50 клеток [4]) до 126 % и количество колоний (колониеобразующих единиц, со -держащих более 50 клеток) до 180 % по сравнению с культурами с титаном без а-С. Морфологически культуры прилипающей фракции миелокариоцитов, образованные в присутствии титана с а-С или без него, не различались. К 7 суткам во всех лунках основная масса клеток имела фибробластоподобную морфологию, часть располагалась упорядоченно, к 10-18 суткам образуя многослойные тяжистые структуры.
Клеточность культур фибробластоподобных клеток, образовавшихся в присутствии образцов титана с а-С, а также площади, занятые этими культурами к
18 суткам культивирования, имели тенденцию к увеличению по сравнению с культурами, выросшими в лунках с титаном без а-С. Так, площадь фибробластоподобных культур, образовавшихся в присутствии титана к 18 суткам, составляет 19,93±11,44 мм2/лунку; в присутствии титана с а-С - 27,47±12,53 мм2/лунку. На 32 сутки культивирования клеточность культур фибробластоподобных клеток с образцами титана с а-С значимо превышала клеточность культур с титаном без а-С (15,3 ± 3,5; 9,7 ± 0,34 х 10 6 клеток/мл соответственно).
Культивирование прилипающей фракции костного мозга кролика на образцах пористого титана с алмазоподобным покрытием и без покрытия. При исследовании поверхности пористых титановых образцов с покрытием и без покрытия, насыщенных прилипающей фракцией миелокариоцитов кроликов, с помощью сканирующей электронной микроскопии уже на 3 сутки инкубации обнаруживаются расположенные преимущественно в порах титановых матриц обоих тестируемых образцов многочисленные гранулоцитомакрофагальные и ядросодержащие эритроидные клетки, стромальные элементы (фибробластоподобные, веретеновидные клетки). Часть клеток располагается в нишах морфологически однородными группами, в 80–90 % это группы по 5–10 клеток, в 5–11 % по 10–50 клеток, в 2–5 % группы представлены 50 и более клетками. Колониеподобное расположение клеток позволяет предполагать их формирование следствием дифференциации КОЕэ и КОЕгм. Заполняющие ниши в титановой матрице клетки нередко образуют отростки и контактируют между собой (рис. 1).
На некоторых препаратах в нишах пористой титановой матрицы видны образующиеся, вероятно, коллагеновые волокна, располагающиеся параллельно друг другу.
Результаты имплантации пористых титановых образцов с углеродной пленкой и без покрытия, насыщенных in vitro прилипающей фракцией аутологичных миелокариоцитов, в дефект костной ткани. Через 4 недели после операции все сквозные поры

а
б
Рис. 1. Сканирующая электронная микроскопия. 3 сутки культивирования прилипающей фракции костного мозга кролика на пористом титане: а — ув. × 1500, б — ув. × 2600. Стрелками показаны цитоплазматические выросты в местах межклеточных контактов
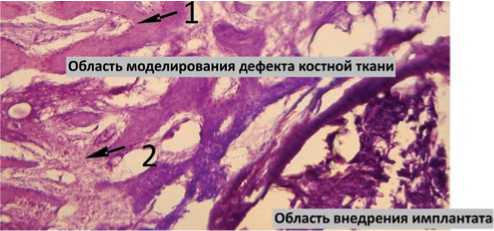
Рис. 2. 4 недели после операции. Имплантат — пористый титан. Ув. х 200, окраска гематоксилином и эозином: 1 — остеобласты, расположенные по периферии трабекул; 2 — межтрабекулярные пространства, характеризующиеся клеточностью, васкуляризацией
имплантатов при использовании обоих тестируемых образцов (ПТ, ПТ с а-С) проросли новообразованной костной тканью.
Морфологическое исследование, выполненное совместно с к. м. н. И. П. Кудрявцевой, выявило, что в области смоделированного дефекта костной ткани между внедренным имплантатом и материнским ложем образуется ткань, состоящая из молодых костных трабекул с расположенными на их поверхности остеобластами (рис. 2, 3). Межтрабекулярные пространства характери зуются высокой клеточностью, васкуляризацией. В периферических отделах области внедрения имплантата остеогенез идет за счет молодых костных трабекул, врастающих из материнского ложа, по краям трабекул располагаются остеобласты. Костеобразование в порах происходило активнее при использовании имплантатов ПТ с а-С, что проявлялось меньшей неравномерностью окраски матрикса и менее выраженной его базофилией.
Через 16 недель после операции сеть костных трабекул становится более плотной, клеточность снижа-
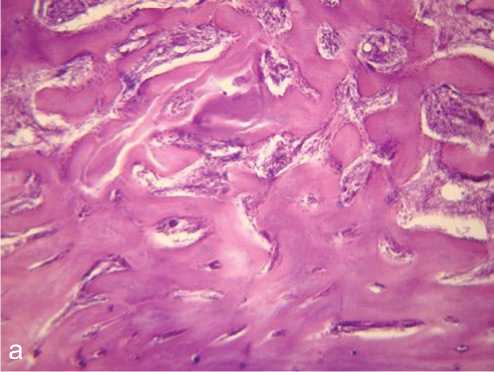
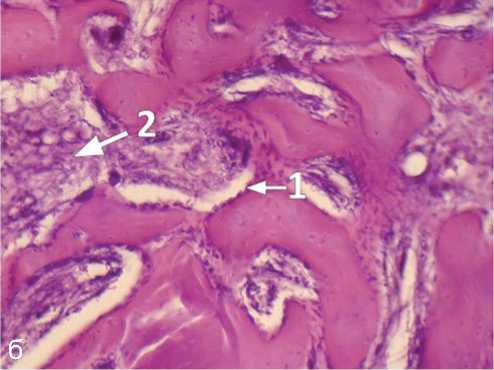
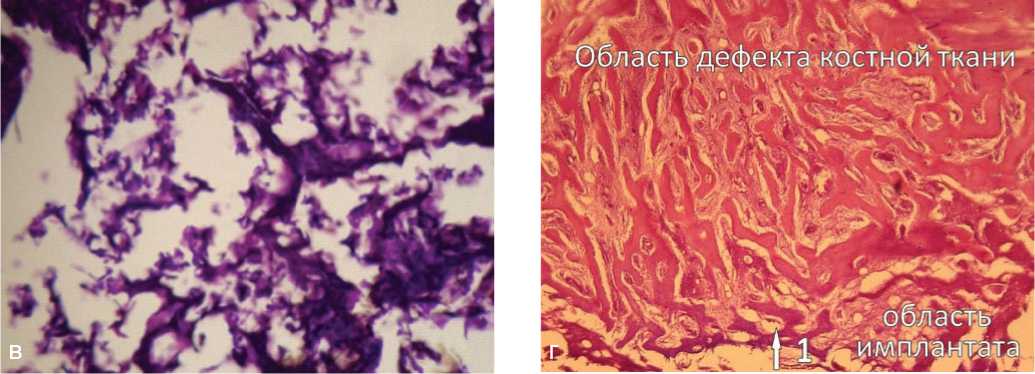
Рис. 3. Пористый титан с алмазоподобным покрытием, 4 недели после операции: а, б — новообразование костной ткани в области операционного поля; в, г — новообразование костной ткани в области имплантата (в порах имплантата). Ув. а, г — ×100, б, в — ×200; окраска гематоксилином и эозином: 1 — остеобласты, расположенные по периферии трабекул; 2 — межтрабекулярные пространства, характеризующиеся клеточностью, васкуляризацией
ется, клетки лежат в плоских лакунах, матрикс становится слабо, но более равномерно окрашенным. По периферии области внедрения имплантата наблюдаются зрелые костные трабекулы. Распространенность зрелых костных трабекул большая при использовании имплантатов с алмазоподобными пленками.
Через 52 недели после операции новообразованная в области операционного дефекта костная ткань прилежит непосредственно к имплантатам (ПТ и ПТ с а-С). Для нее характерны признаки склерозирования (сужение гаверсовых каналов, мозаичность строения), которое менее выражено при использовании имплантатов из ПТ с а-С по сравнению с имплантатами из ПТ.
Поры изучаемых имплантатов (ПТ и ПТ с а-С) заполнены по всей площади костными структурами различной степени зрелости. В области внедрения имплантатов ПТ с а-С по сравнению с ПТ зрелые трабекулы с четко выраженным остеоцитарным строением, присущим зрелой структуре, занимают большую площадь.
В течение всего срока наблюдения площадь, занимаемая новообразованной зрелой костной тканью в порах имплантатов, увеличивалась. В группе с ПТ с а-С площадь, занятая зрелой костной тканью, к 52 неделям увеличилась значимо — до 68±4 %, по сравнению с имплантатами из ПТ — 59±4 %. Возможно, это объясняется свойством алмазного покрытия связывать костный морфогенетический белок-2 (КМБ-2), являющийся истинным остеоиндуктором [10].
Относительный предел прочности новообразованной костной ткани на разрыв уже через 4 недели показал значимо большую прочность новообразованной кости на границе внедренного имплантата и материнской костной ткани при использовании ПТ с а-С, чем при использовании ПТ (табл. 1). Эта разница сохранялась до 16 недель и нивелировалась к 52 неделям после операции, когда прочность композита «новообразованная кость – имплантат – материнское ложе» приближалась к прочности нативной кости.
Таблица 1
Оценка прочности новообразованной костной ткани
|
Относительный предел прочности, % |
|||
|
4 недели |
16 недель |
52 недели |
|
|
ПТ, M±s, (n) |
39±2 (n = 3) |
46±2 (n = 3) |
94±4 (n = 3) |
|
ПТ с а-С, M±s (n) |
57±8* (n = 3) |
70±1* (n = 3) |
94±3 (n = 3) |
|
Примечание: * — р ≤ 0,05. |
|||
ВЫВОДЫ
-
1. Таким образом, при исследовании in vitro была выявлена большая жизнеспособность миелока-риоцитов, тенденция к увеличению колониеобразующей способности прилипающей фракции миелокариоцитов при использовании образцов титана с алмазоподобным углеродным (а-С) покрытием по сравнению с образцами титана без покрытия.
-
2. Применение in vivo пористых титановых имплантатов с алмазоподобным углеродным нанопокрытием (а-С) приводит к образованию более зрелой и прочной костной ткани в порах имплантов.
-
3. Применение углеродного алмазоподобного нанопокрытия (а-С) пористого трансплантата замедляет процессы склерозирования вновь образованной костной ткани.


