Интегральная оценка воспалительного процесса у больных внебольничной пневмонией методом активной радиометрии
Автор: Аржников Владимир Владимирович, Лифшиц Владимир Борисович, Парфенюк Владимир Корнеевич, Терехов Игорь Владимирович, Солодухин Константин Анатольевич, Кондратьев Антон Сергеевич
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Внутренние болезни
Статья в выпуске: 4 т.7, 2011 года.
Бесплатный доступ
Цель: изучение возможностей использования активной радиометрии в СВЧ-диапазоне для мониторинга воспаления нижних отделов респираторного тракта. Материалы и методы. Основу работы составляет анализ гуморального звена иммунитета (цитокиновый статус, состояние системы комплемента, продукция иммуноглобулинов), ангиогенеза, активности модификации внеклеточного матрикса, проведенный с использованием метода иммуноферментного анализа. В ходе исследования оценена сывороточная концентрация ИЛ-1(3, РАИЛ1, TGF-р, СЗ и С5а-компонентов системы комплемента, lg М, lg G, VEGF-A, ММП-13 и ТИММП-2. Кроме того, исследована интенсивность СВЧ-излучения органов грудной полости. Результаты. Результаты исследования свидетельствуют о синхронности динамики радиоизлучения с изменениями молекулярных маркеров ВП (ИЛ-1(3, TGF-(3, VEGF-A, С5а). Установлено, что период изменений указанных медиаторов и радиоизлучения близок к двум суткам. Показано существование ряда критических временных точек развития патологического процесса у больных пневмонией (3, 6, 8, 11 и 16-е сутки заболевания). Заключение. Полученные результаты свидетельствуют о возможности мониторинга патологических изменений у больных ВП путем анализа излучения органов грудной полости частотой 1000 МГц
Активная радиометрия, воспаление, пневмония, цитокины
Короткий адрес: https://sciup.org/14917415
IDR: 14917415
Текст научной статьи Интегральная оценка воспалительного процесса у больных внебольничной пневмонией методом активной радиометрии
Адрес: 410600, г. Саратов, Московская, 156 а.
Тел.: 89271147267.
смотря на внедрение в клинику новых химиотерапевтических средств [1, 2].
Диагностика и прогнозирование течения пневмонии составляют предмет многочисленных исследований, причем с этой целью предлагается использовать белки острой фазы, цитокины, маркеры активности биодеградации внеклеточного матрикса, факторы роста и т.п. [1, 3, 4]. Молекулярные маркеры не являются единственными носителями информации о патологическом процессе. Так, в настоящее время верификация диагноза и оценка тяжести заболевания не обходится без использования лучевой диагностики, использующей различные виды излучений для идентификации патологических изменений [1, 3]. Однако использование лучевой диагностики в режиме оперативного мониторинга ограничивается лучевой нагрузкой, экономическими соображениями, а также низким временным разрешением диагностических методик [1, 3].
Достижения фундаментальной науки и разработки в области радиоэлектроники создали предпосылки для внедрения технологических инноваций в различные сферы практической деятельности, в том числе медицину. Появление малогабаритных и недорогих сверхвысокочувствительных приемников радиоизлучения (радиометров), аналоги которых используются в радиоастрономии, космических технологиях и системах радиосвязи, обусловило возможность применения радиометрии для оценки патологических изменений внутренних органов путем регистрации исходящих от них сверхслабых радиоизлучений [5, 6].
Одной из таких технологий, позволяющей регистрировать маломощное радиоизлучение живых объектов, является активная сверхвысокочастотная (СВЧ) радиометрия, заключающаяся в регистрации сверхслабого излучения биоткани частотой 1000 МГц при одновременном воздействии на нее низкоинтенсивного зондирующего излучения более высокой частоты (65 ГГц) [6].
Цель работы: изучение возможности использования активной СВЧ-радиометрии для мониторинга воспаления нижних отделов респираторного тракта у больных с ВП.
Методы. Исследование проводилось в период с 2006 по 2010 г. на клинических базах Саратовского военно-медицинского института и госпиталя МСЧ ГУВД по Саратовской области под контролем локального этического комитета института. В указанный период в рамках лечебно-диагностического процесса обследовано 400 больных ВП в возрасте 20–50 лет (средний возраст обследованных 35±6 лет). В исследование включались больные обоего пола с нетяжелой внебольничной пневмонией без сопутствующей патологии внутренних органов, поступившие в первые сутки заболевания.
Исследуемыми образцами служила сыворотка крови больных в период разгара (1–3-и сутки заболевания — I фаза), стабилизации (4–6-е сутки — II фаза), разрешения (7–14-е сутки — III фаза) и ре-конвалесценции (15–21-е сутки — IV фаза). Группу контроля составили практически здоровые лица, обследуемые в процессе диспансеризации.
Оценка интенсивности стимулированного СВЧ-излучения органов грудной полости проводилась радиоэлектронным комплексом «Аквафон» (ООО «Телемак», Саратов). Комплекс сертифицирован и внесен в реестр медицинской техники и изделий медицинского назначения. Прибор состоит из приемника излучения биоткани и приемно-излучающего модуля, включающего источник зондирующего излучения частотой 65 ГГц и приемной аппликаторной антенны [5].
Метод активной СВЧ-радиометрии заключается в зондировании исследуемой области организма внешним низкоинтенсивным излучением частотой 65 ГГц и регистрации вторичного СВЧ-излучения тканей частотой 1000 МГц, интенсивность которого выступает в качестве информационного параметра. Методика активной радиометрии состоит в регистра- ции стимулированного радиоотклика тканей путем ручного перемещения приемно-излучающего модуля комплекса по грудной клетке в соответствии с определяемым в процессе обследования алгоритмом. При этом производится измерение интенсивности СВЧ-излучения (волновой активности тканей — ВА) в выбранных участках грудной клетки. Оценка регистрируемого излучения производится в условных единицах: за 1 условную единицу принимается уровень излучения дистиллята воды при 37º C [5].
В ходе исследования методом иммунофермент-ного анализа исследовалась сывороточная концентрация интерлейкина (ИЛ) — 1β, рецепторного антагониста (РА) ИЛ-1, сосудисто-эндотелиального фактора роста (VEGF-A), трансформирующего фактора роста β1 (TGF-β1), матриксной металлопротеиназы (ММП) — 13, тканевого ингибитора матриксной металлопротеиназы (ТИММП) — 2, иммуноглобулинов (Ig) M и G, С3 и С5а компонентов системы комплемента.
Статистическая обработка результатов исследования проводилась в программе Statistica 7,0. В процессе статистического анализа рассчитывалось среднее значение изучаемого показателя (М) и его среднеквадратическое отклонение (σ). Оценка межгрупповых различий (р) проводилась с помощью критерия W (Вилкоксона). Статистически значимыми считали различия при р<0,05.
Результаты. Результаты исследования сывороточной концентрации медиаторов воспаления, а также оценка стимулированного радиоизлучения органов грудной полости представлены в табл. 1–2.
Анализ полученных результатов показал, что в период разгара ВП имело место существенное повышение продукции медиаторов острой фазы (ИЛ-1β, компоненты системы комплемента), а также специфического иммунного ответа (TGF-β1, Ig M, Ig G), протекавшее на фоне высокой активности сосудистого эндотелия (VEGF-A). Указанные изменения сопровождались ростом сывороточной концентрации С3 компонента комплемента в 2,8 раза (р<0,001), С5а компонента в 1,9 раза (p=0,011), Ig G в 1,8 раза (p=0,015) и Ig М в 1,5 раза (p=0,022). В данный период активность ММП-13 и ТИММП-1 оставалась в пределах нормы, указывая на отсутствие процессов деструкции внеклеточного коллагенового матрикса.
Стабилизация патологического процесса проявлялась незначительным снижением сывороточной концентрации ИЛ-1в на 11,2% (р=0,059), vEgF-A на 2,2% (р=0,41) и TGF—ei на 6,0% (р=0,27), сопровождавшимся ростом концентрации РАИЛ-1 на 9,9% (р=0,071). Указанные изменения сопровождались умеренным ростом сывороточной концентрации С3 компонента системы комплемента на 35,5% (p=0,022), С5а на 58,9% (p=0,017), Ig G на 3,5% (p=0,3).
В фазу разрешения регистрировалось выраженное снижение концентрации ИЛ-1в на 27% (р=0,27), РАИЛ-1 на 35% (р=0,27), VEGF-A на 61,3% (р=0,41), TGF—ei на 46,3% (р=0,27). Проведенный анализ выявил увеличение сывороточного уровня ММП-13 и ТИММП-2 на 55,8% (р=0,03) и 46,4% (р=0,037) соответственно, указывая на активацию процессов биодеградации внеклеточного коллагенового матрикса. Выявленные изменения сопровождались повышением концентрации Ig M на 56,5% (р=0,021), и Ig G на 10,6% (р=0,37), при существенном снижении С3 и С5а компонентов комплемента в 2,0 (р=0,011) и 1,6 (р=0,024) раза соответственно.
Таблица 1
Динамика молекулярных маркеров внебольничной пневмонии (М±σ)
|
Фаза ВП |
ИЛ-1β, пг / мл |
РАИЛ-1, пг / мл |
ММП-13, пг / мл |
ТИММП-2, пг / мл |
VEGF-A, пг / мл |
TGF-β1, пг / мл |
|
I |
402,5±8,2* |
921,5±38,5* |
1,99±0,04 |
103,8±3,1 |
797,5±4,6* |
954,0±5,9* |
|
II |
357,5±4,8* |
1013,0±96,2* |
1,98±0,16 |
106,9±1,5 |
779,8±9,3* |
896,5±8,5* |
|
III |
294,5±8,2* |
600,8±59,5* |
3,1±0,31* |
152,1±7,6* |
308,3±9,9* |
512,0±4,3* |
|
IV |
39,7±9,6* |
662,0±48,4* |
1,6±0,14 |
112,5±2,4 |
60,3±9,0* |
358,0±4,6* |
|
K |
4,9±1,1 |
380,0±17,2 |
0,9±0,01 |
97,4±1,4 |
12,9±2,1 |
11,8±2,1 |
П р и м еч а н и е : * — различие статистически значимо в сравнении контролем (р<0,05).
Таблица 2
Динамика маркеров гуморального иммунного ответа и ВА при внебольничной пневмонии (М±σ)
|
Фаза ВП |
Ig M, г / л |
Ig G, г / л |
C3, г / л |
C5а, мкг / л |
ВА, ед. |
|
I |
1,99±0,2* |
25,7±1,6* |
3,1±0,23* |
44,3±3,7* |
137,6±3,7* |
|
II |
1,98±0,18* |
26,6±1,1* |
4,2±0,23* |
70,4±3,8* |
133,1±7,3* |
|
III |
3,1±0,23* |
29,4±1,3* |
2,1±0,4* |
44,8±4,9* |
122,2±4,4* |
|
IV |
1,8±0,06 |
15,5±0,4 |
1,5±0,11 |
23,9±3,6 |
117,0±5,1 |
|
К |
1,3±0,04 |
14,0±0,1 |
1,1±0,09 |
1,2±0,05* |
107,5±3,5 |
П р и м еч а н и е : * — различие статистически значимо в сравнении контролем (р<0,05).
У реконвалесцентов наблюдалось снижение концентрации ИЛ-1в на 86% (р=0,044), VEGF-A, на 80,1% (р=0,046), протекавшее на фоне нормализации уровня ММП-13 и ТИММП-2. Концентрация TGF-β1, характеризовавшаяся устойчивой тенденцией к снижению, к исходу рассматриваемой фазы все еще существенно превышала контрольные значения (р=0,0013). На фоне описанных изменений регистрировался рост сывороточной концентрации РАИЛ-1 на 10,3% (р=0,052). Проведенный анализ выявил снижение сывороточной концентрации Ig M и C3 до субнормальных значений, а также нормализацию концентрации С5а компонента комплемента и Ig G.
Результаты исследования радиофизических свойств тканей грудной полости в динамике ВП выявили статистически значимое снижение средних значений ВА от стадии разгара заболевания до ре-конвалесценции на 14,6% (р=0,031), что соответствует общему тренду динамики молекулярных маркеров патологического процесса.
Стадирование патологического процесса, сопровождаясь усреднением получаемых результатов измерений концентрации исследуемых маркеров за сравнительно длительный период времени, сопровождается так же потерей значительной доли информации о патологическом процессе, что не позволяет с достаточным временным разрешением оценить соотношения между ответом острой фазы, процессами, определяющими развитие иммунного ответа, разрешение инфильтративных изменений, репарацию повреждений.
С целью уточнения соотношения между указанными процессами в динамике заболевания, проведено детальное изучение изменений сывороточной концентрации рассматриваемых молекулярных маркеров, что позволил сделать значительный объем выборки (рис. 1, 2).
Результаты проведенного исследования свидетельствуют о периодическом колебательном характере изменений изучаемых молекулярных маркеров ВП.
Проведенный анализ показал, что в течение первых трех суток ВП имело место нарастание сы- вороточной концентрации ИЛ-1β, происходившее на фоне максимума продукции TGF-β1 и ступенчатообразного изменения уровня РАИЛ-1 и VEGF-A, которые в рассматриваемый период характеризовались синхронностью изменений. Концентрация TGF-β1, обладающего противовоспалительным эффектом, максимальная в первые сутки ВП, с течением заболевания понижалась. В разгар заболевания также от-
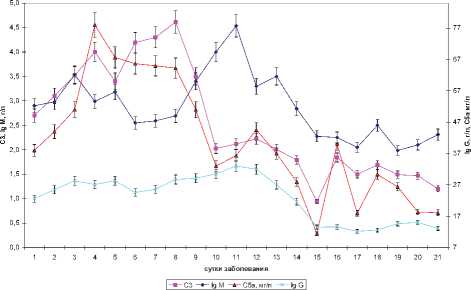
Рис. 1. Цитокиновый профиль в динамике внебольничной пневмонии
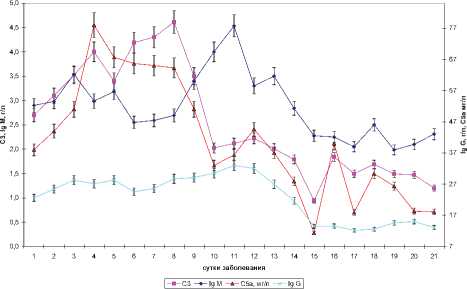
Рис. 2. Динамика гуморального иммунного ответа мечалось повышение продукции иммуноглобулинов и компонентов системы комплемента. Таким образом, в течение трех суток ВП течение патологического процесса характеризовалось нарастанием воспалительной реакции, сопровождавшимся активацией эндотелия, а также неспецифического и специфического звена иммунитета.
Снижение продукции ИЛ-1β и формирование более низкого его «фонового» уровня характеризовало фазу стабилизации, которая характеризовалась увеличением концентрации РАИЛ-1, стабильным уровнем TGF-β1 и ИЛ-1β, а в клиническом плане стабилизацией общего состояния больного. Отмечавшееся в это время увеличение концентрации VEGF-A свидетельствовало о сохранении активации эндотелия и продолжающемся развитии воспалительной реакции. Увеличение концентрации VEGF-A в данный период соответствовало высокой концентрации С5а компонента комплемента, который является мощным хемоаттрактантом для нейтрофилов и активатором эндотелия.
Относительно медленный рост концентрации Ig M и Ig G в некотором роде компенсировался более энергичным ростом концентрации С3 компонента системы комплемента, которая в этот период обеспечивала необходимую антибактериальную защиту.
Таким образом, начало фазы разрешения инфильтративных изменений (рентгенологически определяемое с шестых суток заболевания) фиксировало повышение уровня ММП-13, ТИММП-2, монотонное снижение концентрации TGF-β1, снижение уровня РАИЛ-1 и VEGF-A, с потерей синхронности их изменений, а также относительно высокий уровень ИЛ-1β.
На 8-е сутки ВП на фоне локального минимума уровня VEGF-A и снижающейся концентрации TGF-β1 и ИЛ-1β наблюдалось кратковременное возрастание концентрации РАИЛ-1 на 58,6% (р=0,033) с последующим его снижением и подъемом уровня VEGF-A до прежних значений.
В дальнейшем (на 11-е сутки ВП) имело место увеличение продукции ИЛ-1в на 20% (р=0,042), сопровождавшееся синхронным увеличением концентрации VEGF-A на 86% (р=0,012), наблюдавшееся на фоне дальнейшего снижения TGF—ei на 8,9% (р=0,051) и достижения им локального минимума концентрации. Указанному подъему ИЛ-1β соответствовал максимум концентрации Ig M и Ig G, отстоящий на сутки от минимума продукции С5а и С3 компонентов системы комплемента. Описанные изменения протекали на фоне значительного роста концентрации ТИМП-2 и ММП-13. После указанного подъема концентрации ИЛ-1β, являвшегося, очевидно, пусковым стимулом процессов модификации внеклеточного матрикса, следовало монотонное прогрессивное снижение его уровня, а также TGF-β1 и VEGF-A вплоть до 14-х суток ВП. При этом у большинства обследованных к указанному сроку инфильтративные изменения в легких претерпевали существенную положительную динамику.
Значительный рост продукции РАИЛ-1 и TGF-β1 на фоне минимальных значений ИЛ-1β и VEGF-A и снижения активности ММП-13 и ТИММП-2 являлся, очевидно, следствием завершения основных процессов разрешения инфильтративных изменений в легких, снижения активности воспаления и инициации процессов репарации поврежденных тканей.
Кроме того, в данный период отмечалась стабилизация сывороточной концентрации Ig G и Ig M, происходившая на фоне осциллирующих колебаний уровня С5а и С3 фракций комплемента, затухающих и нормализующихся по мере приближения к 20-м суткам ВП. Таким образом, активно протекающие процессы репарации сопровождались повышенным уровнем С5а компонента комплемента и TGF-β1. Проведенный анализ показал, что к исходу 3-й недели ВП уровень TGF-β1 статистически значимо (р=0,048) различался с уровнем здоровых лиц, свидетельствуя о незавершенности процессов восстановления в пораженном органе.
Устойчивый рост продукции РАИЛ-1, регистрировавшийся с 13-х суток заболевания и протекавший на фоне минимизации концентрации ИЛ-1β с изменением их соотношения от 2,3 в стадию разгара до 16,9 у реконвалесцентов, определял окончание активного воспалительного процесса.
Результаты проведенного исследования свидетельствуют о существовании «критических» временных точек динамики патологической реакции приходящихся на 3–4, 5–6, 8–9, 11–12, 14–15 и 17–18-е сутки заболевания, что позволяет говорить о периоде патологических изменений, близком к двум суткам.
Анализ волновой активности органов грудной полости, отражающей способность биоткани к преобразованию зондирующего радиоизлучения в стимулированное, выявил следующие особенности (рис. 3).
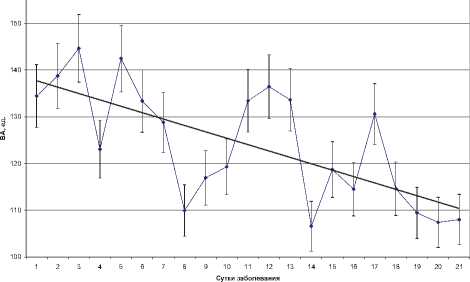
Рис. 3. Динамика ВА органов грудной полости
Так, разгар заболевания (1–3-и сутки) характеризовался ростом ВА на 11 единиц (р=0,03), при этом указанные изменения соответствовали динамике ИЛ-1β, С5а и С3 компонентов комплемента. На 4-е сутки зарегистрировано кратковременное снижение ВА на 22 ед. (р=0,013) с формированием локального минимума. Указанные изменения происходили на фоне соответствующей динамики ИЛ-1β, Ig M и Ig G. В дальнейшем отмечалось прогрессивное уменьшение ВА, составившее к 8-м суткам 32 ед. (p<0,01) и совпадавшее с началом фазы разрешения. Кроме того, было выявлено совпадение локального минимума ВА с соответствующим минимумом концентрации VEGF-A и РАИЛ-1. Последующий подъем ВА протекал на фоне увеличения сывороточной концентрации С5а компонента системы комплемента, VEGF-A, Ig M и G. Указанные изменения протекали в период разрешения инфильтративных изменений в легких на фоне повышения концентрации ММП-13 и ТИММП-2.
В дальнейшем, на 16–17-е сутки заболевания, по окончании активного разрешения воспалительноинфильтративных изменений, отмечался очередной подъем ВА, совпадавший с повышением концентрации С5а, С3 компонентов системы комплемента и РАИЛ-1, происходившим на фоне минимальных зна- чений ИЛ-1β, VEGF-A и локального минимума TGF-β1. В последующем, вплоть до окончания наблюдения, имело место снижение ВА, которое, тем не менее, не сопровождалось полной нормализацией.
В ходе анализа полученных результатов обращала на себя внимание большая синхронность динамики РАИЛ-1, TGF- β1 и ИЛ-1β в поздний период заболевания в противовес раннему периоду (1–13-е сутки). То же следует отнести к динамике С3 и С5а компонентов системы комплемента.
Обсуждение. Формирование максимумов и минимумов значений ВА, совпадающих по времени с изменениями молекулярных маркеров, очевидно, отражает фазовый характер воспалительной реакции, являясь следствием смены фаз патологического процесса в легких [1, 7].
Патологический процесс у больных с ВП, являясь в своей основе многокомпонентным и динамичным, проявляется значительными периодическими колебаниями продукции информационных молекул патологического процесса.
Известно, что в начальную фазу воспаления имеет место усиление сосудистой проницаемости и увеличение экспрессии рецепторов адгезии на эндотелии. В этот период отмечается повышение продукции VEGF-A, ИЛ-1β, С5а компонента системы комплемента и других молекул, являющихся инициаторами воспаления, а также белков, ограничивающих развивающуюся реакцию, таких, как TFG-β1. Основным событием данной фазы можно считать выход плазмы из сосудистого русла в интерстиций и формирование инфильтрата [1, 7, 8].
Формирование инфильтрации приводит к выраженному изменению радиофизических свойств биоткани, которая вследствие значительного нарушения структуры водной компоненты внутренней среды приобретает повышенную способность к преобразованию зондирующего излучения в стимулированное [5].
Формирование инфильтрации легочной ткани протекает на фоне высокой продукции хемоаттрактантов, таких, как С5а компонент комплемента, усиливающих хемотаксис и экспрессию эндотелиальных адгезинов. Благодаря изменению сосудистого тонуса и усилению адгезивных свойств эндотелия резко активизируется миграция лейкоцитов в ткань легкого, а высокий уровень цитокинов стимулирует их функциональную активность [1, 7, 8]. Хорошо известно, что миграция лейкоцитов в очаг воспаления носит фазовый характер, каждая фаза которой сопровождается изменением активности эндотелия, что в конечном итоге отражается на его проницаемости и биофизических свойствах биоткани [5, 6].
Восстановление антигенного равновесия в очаге воспаления сопровождается изменением цитокино-вого профиля очага и его клеточного состава. Происходящие изменения инициируют восстановление поврежденного эндотелия и структуры внеклеточного матрикса.
Следствием восстановления структуры биоткани является нормализация ее биофизических свойств с восстановлением волновой активности, которая в этом случае является интегральным показателем, характеризующим состояние ткани и отражающим степень модификации структуры ее водной компоненты [5].
Таким образом, выявленная динамика радиометрических изменений интегрально отражает молекулярные изменения, сопровождающие патологический процесс. Соответствие волновых изменений динамике молекулярных маркеров указывает на высокое временное разрешение активной СВЧ-радиометрии, что указывает на целесообразность ее использования для оперативного мониторинга патологических изменений у больных ВП.
Представляется необходимым проведение дальнейших исследований с целью определения операционных характеристик нового диагностического критерия — волновой активности органов грудной полости.
Выводы:
-
1. Анализ результатов исследования свидетельствует о динамическом колебательном характере патологического процесса у больных ВП, проявляющемся периодическими подъемами и снижениями сывороточной концентрации молекулярных маркеров с постепенным затуханием флуктуаций по мере выздоровления.
-
2. Динамика исследованных показателей свидетельствует о периодической активации сосудистого эндотелия и гуморального иммунного ответа, носящих рассогласованный характер в разгаре заболевания, синхронизирующихся по мере выздоровления. При этом на ранних этапах развития ВП недостаток специфической гуморальной иммунной защиты (иммуноглобулины) компенсируется активацией неспецифического ответа (система комплемента).
-
3. Патологический процесс, сопровождающийся существенными молекулярными изменениями, характеризуется значительной модификацией радиофизических свойств органов грудной полости, что проявляется синхронными с молекулярными флуктуациями интенсивности радиоизлучения. Выявленная радиометрическая динамика, являющаяся следствием молекулярных проявлений патологического процесса, позволяет говорить о возможности использования активной радиометрии органов грудной полости для оперативного мониторинга воспалительной реакции у больных ВП.
Список литературы Интегральная оценка воспалительного процесса у больных внебольничной пневмонией методом активной радиометрии
- Чучалин А. Г., Синопальников А. И., Страчун-ский Л. С. Пневмония. М.: Мед. информ. агентство (МИА), 2006. 461 с.
- Epidemiology and Aetiology of Community-acquired Pneumonia (CAP)/M.W. Pletz, G. Rohde, H. Schutte [et al.]//Dtsch. Med. Wochenschr. 2011. № 136 (15). P. 775-780.
- Попович С. E. Клинико-диагностическое значение прокальцитонина, С-реактивного белка и трансрезонансной функциональной топографии при внебольничной пневмонии: автореф. дис.... канд. мед. наук. Саратов, 2004. 22 с.
- Serum vascular endothelial growth factor in pediatric patients with community-acquired pneumonia and pleural effusion/S.H. Choi, E.Y. Park, H.L. Jung [et al.]//J. Korean. Med. Sci. 2006. № 21. P. 608-613.
- Трансрезонансная функциональная топография: биофизическое обоснование/В. И. Петросян, М.С. Громов, С. В. Власкин [и др.]//Миллиметровые волны в биологии и медицине. 2003. № 1 (29). С. 23-26.
- Бецкий О. В., Кислое В. В., Лебедева Н. Н. Миллиметровые волны и живые системы. М.: САЙНС-ПРЕСС, 2004. 272 с.
- Пальцев М.А., Иванов А. А., Северин С. Е. Межклеточные взаимодействия. М.: Медицина, 2003. 288 с.
- Кетлинский С. А., Симбирцев А.С. Цитокины. СПб.: ООО «Издательство Фолиант», 2008. 552 с.


