Интегральный анализ геномных и транскриптомных изменений при светлоклеточной почечно-клеточной карциноме в российской популяции
Автор: Солодских Сергей Алексеевич, Паневина Анна Викторовна, Новикова Анастасия Геннадьевна, Дворецкая Юлия Дмитриевна, Грязнова Мария Владимировна, Старков Анатолий Анатольевич, Маслов Александр Юрьевич, Михайлов Андрей Анатольевич, Хинопулос Кристос, Попов Василий Николаевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.18, 2019 года.
Бесплатный доступ
Почечно-клеточная карцинома (ПКК) является одной из наиболее распространенных солидных опухолей почки (90 % всех случаев рака почки), при этом светлоклеточная почечно-клеточная карцинома (скПКК) - наиболее часто встречающийся тип ПКК. Данная опухоль характеризуется множеством нарушений работы генома и транскриптома в опухоли. Молекулярные механизмы развития скПКК изучались в течение длительного времени. Установлена популяционная специфичность данных нарушений как между локальными популяциями в европейской суперпопуляции, так и между различными суперпопуляциями. В настоящий момент геномные и транскриптомные нарушения, связанные с скПКК, в западноевропейских популяциях России изучены плохо. В Центрально-Черноземном регионе России (включая Воронежскую область), охватывающем значительную часть европейской части России, таких исследований не проводилось. Также не проводилось каких-либо интегральных исследований геномных и транскриптомных данных. Мы провели целевое секвенирование ключевых онкогенов, входящих в состав панели AmpliSeq Cancer HotSpot Panel v2, и полногеномное исследование экспрессии c использованием ДНК-микроматриц Affymetrix у 58 пациентов c ППК, относящихся к популяции западной части Российской Федерации. С применением разработанного нами интегрального анализа геномных и транскриптомных данных нами впервые было установлено, что ядерный комплекс NFkp, рецептор ERBB2 и фактор транскрипции TP53 ассоциированы с наблюдаемыми изменениями экспрессии и являются ключевыми регуляторами в работе функциональных и сигнальных генных сетей. Также был проведен анализ мутационного ландшафта в ключевых генах, ассоциированных с раком. Наши наблюдения говорят о том, что молекулярные механизмы ПКК отличаются в различных популяциях, поскольку обнаруженные регуляторы экспрессии ранее не были описаны как медиаторы экспрессии при ПКК. Рецептор ERBB2 является целью большого числа различных видов таргетной терапии рака молочной железы. Помимо этого, в настоящий момент имеется несколько клинических случаев успешной терапии тубулярного рака почки, колоректального рака и рака желудка. На основе полученных нами данных возможна разработка новых способов терапии ПКК с использованием уже установленных и апробированных линий терапии, применяемых при других видах рака.
Рак, микроматрицы, мутации, геном, транскриптом, почечно-клеточная карцинома, рак почки
Короткий адрес: https://sciup.org/140254302
IDR: 140254302 | УДК: 616.61-006.6:575.224.2 | DOI: 10.21294/1814-4861-2019-18-6-39-49
Текст научной статьи Интегральный анализ геномных и транскриптомных изменений при светлоклеточной почечно-клеточной карциноме в российской популяции
Рак почки находится на 12-м месте по частоте встречаемости в мире среди злокачественных новообразований (ЗНО), составляя от 2 до 3 % всех видов ЗНО, число вновь диагностированных случаев рака почки увеличивается на 1,5–5,9 % ежегодно [1, 2]. Почечно-клеточная карцинома (ПКК) является самой распространённой солидной опухолью почки, на нее приходится 90 % всех ЗНО почки [3]. Данная опухоль встречается в 1,5 раза чаще у мужчин, чем у женщин. Однако женщины, перенесшие гистерэктомию, подвержены ПКК почти в 2 раза чаще по сравнению с неопериро-ванными женщинами [4]. Наиболее часто ПКК встречается в возрасте 60–70 лет [2]. Курение, избыточный вес, повышенное кровяное давление и хроническое воздействие мутагенных агентов (асбеста, кадмия, свинца, соединений хлора), а также полициклических ароматических соединений [5] и нестероидных противовоспалительных препа- ратов [6] являются описанными этиологическими факторами ПКК.
Почечно-клеточная карцинома является одной из основных причин смертности среди всех видов ЗНО выделительной системы. Показатели 5-летней выживаемости варьируют от 60 до 70 %, значительно снижаясь при метастатическом ПКК. В большинстве случаев ПКК демонстрирует относительную резистентность к химио- и радиотерапии, но хорошо отвечает на таргетную и иммунотерапию.
Несмотря на то, что наследственные факторы оказывают гораздо меньшее влияние на предрасположенность к ПКК по сравнению с факторами среды, у родственников пациентов риск развития данной опухоли в 2–4 раза выше, чем в общей популяции [7]. Повышенный риск возникновения ПКК также ассоциирован с наследственной папиллярной почечной карциномой, наследственным лейомиоматозом, синдромом Бёрта–Хога–Дьюба, гиперпаратиреозом, наследственным папиллярным раком щитовидной железы, синдромом фон Хиппеля–Линдау и серповидноклеточной анемией. У пациентов с приобретенной поликистозной болезнью почек ПКК развивается в 30 раз чаще, чем у здоровых людей [8].
Почечно-клетояная карцинома имеет несколько подтипов. Светлоклеточный ПКК (скПКК) составляет 60–70 % всех случаев ПКК и характеризуется клетками с прозрачной цитоплазмой, окруженной толстой цитоплазматической мембраной с округлым гладким ядром. В большинстве случаев скППК характеризуется односторонным поражением и встречается одинаково часто как в левой, так и в правой почке. Тем не менее скПКК может иметь несколько источников. В этих случаях скПКК может поражать обе почки одновременно и может сочетаться с аденомой. Этот вариант ПКК распространен среди пациентов с наследственными формами рака и сопутствующими нарушениями: кистами почек, синдромом фон Хиппеля–Линдау и первичными множественными опухолями. скПКК характеризуется перестройками 3-й хромосомы, инактивацией гена VHL вследствие мутаций или гиперметилирования промотора, амплификацией 5p и мутациями в генах KDM6A/UTX, SETD2, KDM5C/JARID1C и MLL2. В настоящее время около 25–40 % случаев скПКК диагностируются случайным образом в ходе профилактической диагностики [9].
Папиллярная (хромофильная) ПКК встречается в 10–15 % случаев ЗНО почек. Она состоит из почечных сосочков, покрытых одинарным или двойным слоем кубических или крупных эозинофильных клеток. Этот подтип ПКК в основном связан с трисомией или тетрасомией хромосом 7 и 17, потерей Y-хромосомы, амплификациями хромосом 12, 16 и 20 и мутациями в протоонкогене 4 MET.
Хромофобная ПКК составляет 3–5 % всех случаев рака почек. Она состоит из опухолевых клеток с массивной эозинофильной цитоплазмой, в основном как часть солидной опухоли. Этот подтип рака обусловлен потерей хромосом Y, 1, 2, 6, 10, 13, 17 и 21 [10].
Молекулярные механизмы развития скПКК изучались в течение длительного времени. Наиболее полное интегральное исследование проведено исследовательской группой Атласа ракового генома [11]. Используя несколько высокопроизводительных методов (экзомное и полногеномное секвенирование, микроматричное исследование экспрессии, исследование метилирования), группа проанализировала более 400 опухолевых образцов и выделила 19 наиболее часто мутирующих генов. Было показано, что, помимо дисфункции VHL, наиболее важные драйверные мутации локализованы в генах SETD2, PBRM1, ARID1A и SMARCA4.
Другое крупное исследование, проведенное в японской популяции, подтвердило представленные выше данные о роли генов в развитии скПКК, однако были обнаружены существенные отличия паттерна генной экспрессии от исследования Атласа ракового генома. В частности, были показаны нарушения работы сигналинга PI3K-AKT-mTOR и KEAP1-NRF2-CUL3, метилирования ДНК, путей, связанных с p54, и процессинга мРНК [12].
В совокупности результаты этих исследований свидетельствуют о том, что причины и механизмы развития скПКК существенно отличаются в различных популяциях. Это означает, что должны отличаться стратегии и результаты лечения.
В западноевропейских популяциях России геномные и транскриптомные нарушения, связанные с скПКК, изучены плохо. В Центрально-Черноземном регионе России (включая Воронежскую область), охватывающем значительную часть европейской части России, таких исследований не проводилось. Также не проводилось каких-либо интегральных исследований геномных и транскриптомных данных.
Известно, что одной из главных причин транс-криптомных нарушений в клетке являются полиморфизмы в кодирующих последовательностях геномной ДНК [13]. Тем не менее автоматизированные алгоритмы для исследования геномных и транскриптомных взаимодействий еще не созданы, в связи с чем исследователи вынуждены делать выводы о данных взаимодействиях, основываясь на собственных знаниях регуляторных механизмов клетки. Основным преимуществом автоматизированных систем анализа генных сетей, таких как QIAGEN Ingenuity Pathway Analysis (IPA), является возможность обнаружения скрытых регуляторных механизмов через несколько промежуточных звеньев. Данный метод позволяет выявлять генные взаимодействия, описанные ранее.
Материал и методы
Участники настоящего исследования были отобраны среди пациентов Воронежского областного клинического онкологического диспансера, проходящих лечение по поводу рака почки. Все пациенты имели диагноз: Светлоклеточная почечно-клеточная карцинома, подтвержденный иммуногистохимически. Исследование было утверждено этическим комитетом ФГБОУ ВО «ВГУ». Во всех случаях было получено информированное согласие, пациенты были проинформированы о том, что с их биологическими материалами будут проводиться генетические исследования. Всего с использованием панели AmpliSeq HotSpot Cancer Panel v2 было проведено полногенное секвенирование у 58 пациентов в возрасте от 33 до 80 лет (средний возраст – 60 ± 9,91 года).
Образцы ткани опухоли и окружающей нормальной ткани были получены в БУЗ ВО «ВОКОД» в период с 2018 по 2019 г. после выполнения нефрэктомии по поводу ПКК. После забора образцы немедленно погружались в раствор RNAlater™ (Sigma-Aldrich, США). Образцы хранились при температуре –86 °С вплоть до выделения нуклеиновых кислот. Общая РНК выделялась и очищалась с использованием набора RNeasy Mini Kit (QIAGEN, США) в соответствии с инструкцией производителя. Геномная ДНК выделялась и очищалась с использованием набора Quick-DNA Miniprep Plus Kit (Zymo Research, США) в соответствии с инструкцией производителя. Качество полученных нуклеиновых кислот подтверждалось горизонтальным электрофорезом в 2 % агарозном геле с окрашиванием бромидом этидия. Измерение концентрации ДНК и РНК проводилось при помощи флуориметрической системы Qubit (Thermo Fisher Scientific, США) в соответствии с инструкцией производителя.
Библиотеки для секвенирования с уникальными баркодами синтезировались с использованием набора Ion AmpliSeq™ Library Kit 2.0 (Thermo Fisher Scientific, США) после целевой амплификации кодирующих частей генов, входящих в панель Ion AmpliSeq HotSpot Cancer Panel v2 (Thermo Fisher Scientific, США).
Для идентификации полиморфизмов ДЕК использовалось ПО Ion Torrent Suite версии 5.10 и Torrent Variant Caller plugin версии 5.10.0.16. Все полиморфизмы с низким качеством прочтения и/ или недостаточным покрытием были отфильтрованы. Аннотация полиморфизмов проводилась с использованием ПО ENSEMBL Variant Effect Predictor версии 97 [14]. Для последующей обработки использовалось ПО VCFtools версии 0.1.13 [15].
кДНК для последующей гибридизации была получена из РНК, выделенной из биологических материалов, с применением набора Ambion® WT Expression Kit (Thermo Fisher Scientific, США). Измерение транскриптомных уровней мРНК про- водилось с использованием ДНК-микроматриц GeneChip® Human Gene 2.1 ST на платформе Affymetrix® GeneAtlas™ system (Affymetrix Inc, США). Микроматрицы сканировались, после чего изображения конвертировались в цифровой формат с использованием ПО Affymetrix® GeneAtlas™ Instrument Control Software.
Обработка сигналов, нормализация, фильтрация шумов и вычитание фоновой светимости проводились в ПО Partek Genomics Suite версии 6.6 с использованием алгоритма RMA и поправкой на содержание GC-нуклеотидов в пробе. Для всех статистических тестов значимым считалось р-значение менее 0,05.
Количественная ПЦР «в реальном времени» была проведена с использованием амплификато-ра using CFX96 Real-Time PCR Detection System (Bio-Rad, США) и полимеразы qPCRmix-HS (ООО «Евроген», Россия).
Оценка изменения экспрессии генов проводилась по методу ∆ΔCt с применением генов GAPDH и 18s для нормализации. Все ПЦР-эксперименты были проведены в соответствии с рекомендациями о минимальной информации для публикации результатов количественной ПЦР «в реальном времени» (MIQE) [16].
Анализ насыщения терминами Gene Ontology проводился с использованием Partek Genomics Suite версии 6.6. Канонические сигнальные и метаболические пути, регуляторы транскрипции, биологические эффекты и связанные заболевания, создание генных сетей и визуализация данных проводились с использованием ПО Ingenuity Pathway Analysis (QIAGEN, США).
Гены, несущие полиморфизмы ДНК, и гены с измененной экспрессией объединялись в один список для создания генных сетей, в которых вышестоящими регуляторами наблюдаемых изменений экспрессии могут выступать гены, имеющие мутации ДНК. Наборы данных геномных и транскрип-томных исследований объединялись для создания общего списка генов. Для этой цели удалялась аннотационная информация у полиморфизмов ДНК, а генам, имеющим мутации, присваивались высокие значения изменения экспрессии (равные максимальному наблюдаемому изменению экспрессии в результатах транскриптомных опытов) и низкие p-значения. Целью этой операции была унификация двух разнородных наборов данных для последующего автоматизированного анализа взаимодействий генома и транскриптома.
Результаты
Анализ транскриптомных данных методом главных компонент показал, что все образцы делятся на 2 четких кластера, состоящих из опухолевых и нормальных тканей соответственно (рис. 1). В 3528 генах в опухолевых образцах выявлены изменения экспрессии более чем в 2 раза чаще по
Таблица 1
Соматические мутации в ДНК
Секвенирование ДНК выделило 98 общих мутаций в опухолевых тканях у всех пациентов (табл. 1). 14 мутаций были локализованы в генах SDHB, TRIM33, PDE4DIP, PBX1, ABL2, MTR, VHL, ROS1, PRKDC, CSMD3, MLLT10, TRIP11, PER1, BCL2, и были опухоль-специфическими. 33 были локализованы в промоторных областях генов EGFR, PDGFRA и HNF1A.
Наиболее репрезентативными для данной выборки метаболическими и сигнальными путями в соответствии с номенклатурой базы данных Ingenuity были «FXR/RXR Activation», «Intrinistic Prothrombin Activation Pathway», «Atherosclerosis Signaling», «Coagulation System», «LXR/RXR Activation», «Production of NO and ROS in Mac-rophages», «Cell migration and adhesion».
Наиболее сильное снижение экспрессии было зафиксировано для генов CALB1 (-190.12), HPD (-134.99), SLC36A2 (-125.85), KNG1 (-124.51) и SLC22A8 (-119.61). Наиболее сильное повышение экспрессии было зафиксировано для генов TNFAIP6 (+34.09), ANGPTL4 (+24.23), ANGPT2 (+23.69), SERPINE1 (+22.12) и CP (+20.98). Изме-
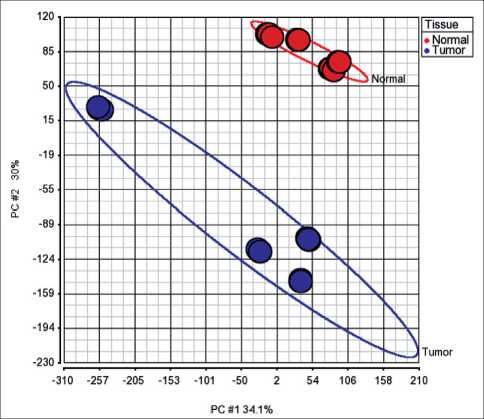
Рис. 1. Результаты анализа транскриптомных данных методом главных компонент
В базе данных IPA были найдены 350 из 351 гена с изменением экспрессии более чем в 5 раз. Анализ включал в себя прямые и непрямые взаимодействия между идентифицированными генами. Мы произвели анализ прямых и непрямых взаимодействий между генами с измененной экспрессией. Для этого был проведен основной анализ IPA, позволяющий идентифицировать сигнальные пути, генные сети, заболевания и биологические функции, представленные в списке генов для анализа. Также были сгенерированы генные сети с использованием низкомолекулярных соединений в качестве посредников передачи сигналов, что позволило описать сеть непрямых взаимодействий генов.
В результате анализа были сформированы 23 генные сети с z-оценками от 2 до 41. 4 сети с наибольшими z-оценками были ассоциированы со следующими заболеваниями и биологическими функциями:
-
1) метаболизм витаминов и минералов, молекулярный транспорт, метаболизм липидов (z-оценка=41, 25 транскриптов);
-
2) рак, морфология опухоли, заболевания скелета и мускулатуры (z-оценка=36, 23 транскрипта);
-
3) репликация, рекомбинация и репарация ДНК, метаболизм нуклеиновых кислот, биохимия низкомолекулярных соединений (z-оценка=34, 22 транскрипта);
-
4) нарушения развития, наследственные заболевания, метаболические расстройства (z-оценка=34, 23 транскрипта).
Обсуждение
Генетические причины, обусловливающие определенный фенотип заболевания, могут отличаться у различных индивидуумов, при этом наиболее существенные отличия наблюдаются при сравнении различных популяций [17]. Ранее мы показали, что степень злокачественности полиморфизмов ДНК в наследственном раке молочной железы, ассоциированном с генами BRCA, отличается в различных популяциях [18]. Имеющиеся результаты высокопроизводительного секвенирования и исследования экспрессии мРНК позволяют сделать вывод о том, что светлоклеточная почечно-клеточная карцинома относится к таким заболеваниям [19]. Показано, что фактор транскрипции VHL играет существенную роль в возникновении и развитии почечно-клеточной карциномы [9]. О его отсутствии либо инактивации говорит ряд работ, посвященных исследованию
ПКК, что также подтверждается наблюдениями настоящего исследования. Тем не менее прочие полиморфизмы ДНК, составляющие уникальный мутационный ландшафт ПКК, существенно отличаются в европейских, американских и японских популяциях [7, 19]. Результаты настоящего исследования говорят о том, что мутационный ландшафт при ПКК у вышеупомянутых популяций также отличается от мутационного ландшафта в российских популяциях.
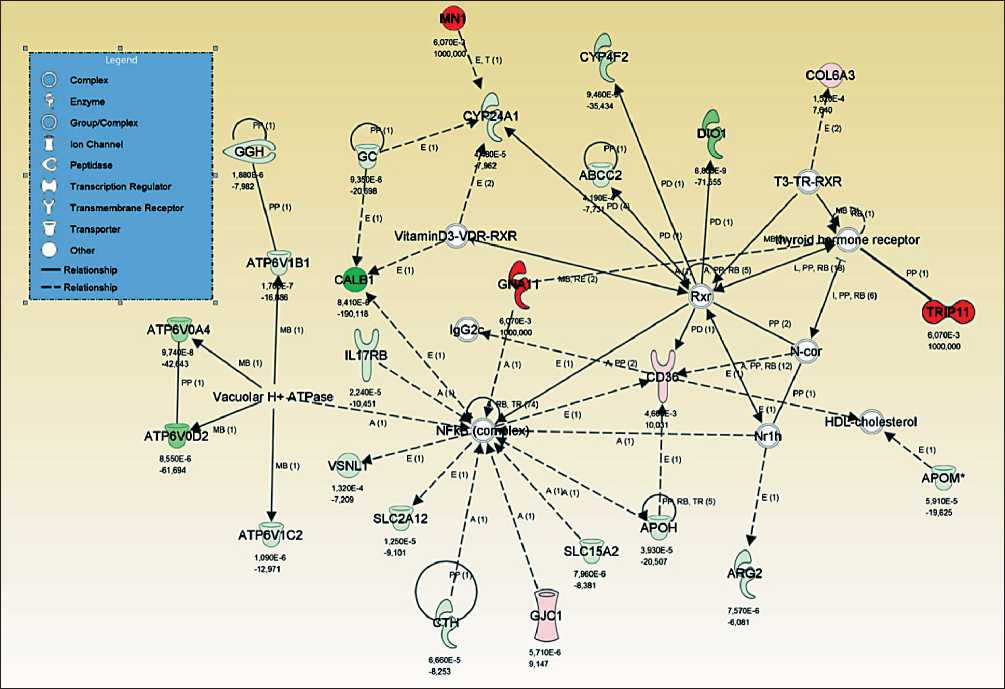
Комплекс NFkβ регулирует изменения экспрессии при ПКК
NFkβ является комплексным ядерным фактором транскрипции, играющим ключевую роль в регуляции индукции апоптоза, пролиферации, клеточной смерти, транскрипции, дифференциации клеток и активации клеточного роста [20]. Ранее было постулировано, что NFkβ может быть терапевтической мишенью при ПКК, однако экспериментально это не было подтверждено [13]. В соответствии с нашими данными, члены комплекса NFkβ не несут каких-либо мутаций и не меняют уровни экспрессии. Тем не менее генная сеть (рис. 2) показывает, что данный комплекс является одним из основных регуляторов наблюдаемых изменений генной экспрессии. Также у комплекса имеются сигнальные взаимодействия с тремя генами, несущими мутации у пациентов с ПКК. Таким образом, эти наблюдения позволяют сделать вывод о том, что комплекс NFkβ выступает фактором транскрипции, регулирующим наблюдаемые изменения генной экспрессии. Регуляторная активность комплекса может быть обусловлена белок-белковыми взаимодействиями с мутантными генами.
Ген HER2 (ERBB2) несет большое количество мутаций и ассоциирован со значительными изменениями экспрессии Наши результаты позволяют сделать вывод, что одним из основных регуляторов наблюдаемых изменений экспрессии (рис. 3) является мутантный рецептор HER2 (ERBB2). Белковый продукт этого гена представляет собой рецепторную тирозин-киназу, которая участвует в процессах клеточной пролиферации, роста, апоптоза, трансформации клеток, фосфорилирования белка, инвазии и миграции злокачественных клеток [21]. Он также ассоциирован с раком молочной железы и используется для скрининга и выбора терапии [22].
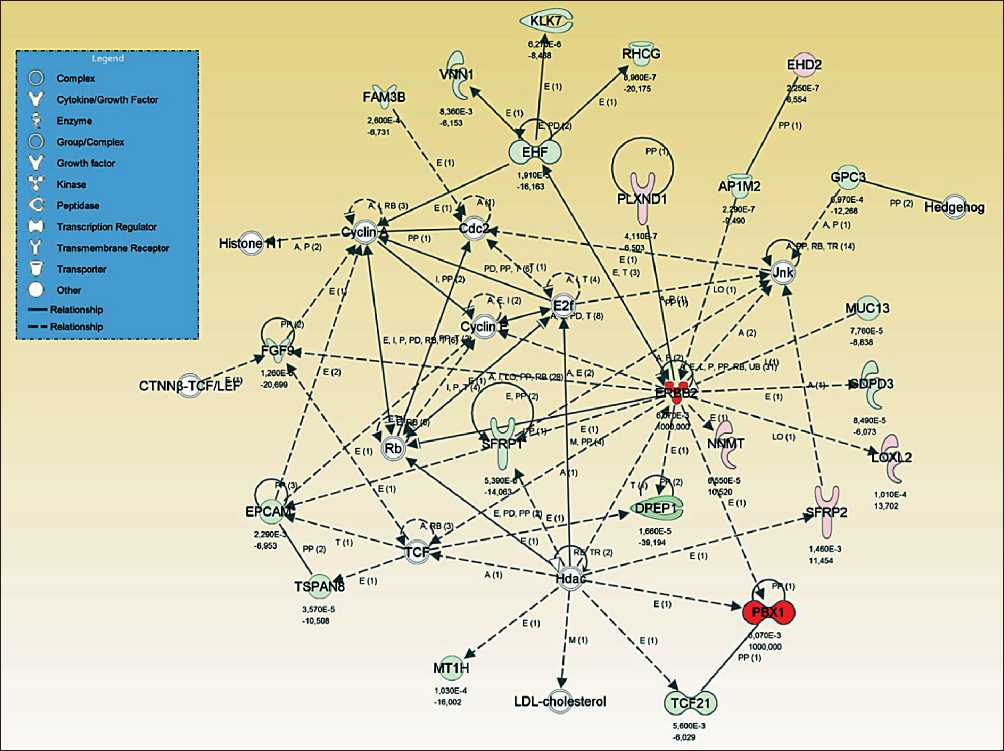
Рис. 3. Мутационный статус гена HER2 (ERBB2) и его взаимосвязь с изменениями экспрессии генов
Мутационный статус этого гена коррелирует с потенциальным прогнозом и влияет на результат лечения [23]. Ранее не было показано, что HER2 играет какую-либо значительную роль в развитии или прогрессировании ПКР.
Высокая частота встречаемости несинонимичных мутаций в гене HER2 среди исследованных нами пациентов (28 % всех пациентов имеют мутации в HER2) позволяет предположить, что его можно рассматривать как потенциальную терапевтическую мишень у пациентов с ПКР.
Насколько нам известно, есть только один зарегистрированный случай успешного лечения рака выделительной системы с помощью анти-HER2 препаратов. У пациента мужского пола с метастатической карциномой собирательного протока с большим количеством отдаленных метастазов была обнаружена мутация HER2, подходящая для терапии трастузумабом и лапатинибом. Через две недели лечения наблюдалось значительное уменьшение метастазов и уменьшение размеров основной опухоли [24]. Это позволяет сделать вывод о том, что успешное лечение ПКК может быть проведено с использованием анти-HER2-таргетной терапии.
TP53 является одним из главных факторов транскрипции, регулирующих наблюдаемые изменения экспрессии
Для того чтобы установить факторы транскрипции, обусловливающие наблюдаемые изменения экспрессии, мы произвели анализ факторов транскрипции с использованием системы IPA. Наиболее частой причиной развития ПКК является повышение концентрации факторов, индуцированных гипоксией, происходящее ввиду инактивации гена VHL [25]. Следовательно, VHL должен играть одну из наиболее важных ролей в изменениях транскрипции, происходящих в клетке, выступая в качестве фактора транскрипции.
Однако анализ геномных и транскриптомных данных, проведенный нами, показал, что ген VHL связан с 138 генами с измененной экспрессией из нашего набора данных, в то время как фактор транскрипции TP53 связан с 564 генами (рис. 4). Это наблюдение позволяет сделать вывод, что роль этих двух регуляторов в развитии ПКК в различных популяциях должна быть более тщательно исследована.

Рис. 4. Регуляция наблюдаемых изменения экспрессии фактором транскрипции TP53
Заключение
Имеющиеся методы анализа изменений профиля экспрессии и их связи с мутациям ДНК не автоматизированы и не подходят для практического клинического применения. Метод интеграции геномных и транскриптомных данных, использованный в этом исследовании, позволил нам определить возможные источники изменений экспрессии мРНК на уровне мутаций ДНК. Ряд полиморфных вариантов ДНК и генов с измененной экспрессией, обнаруженных в этом исследовании, не зарегистрированы в существующих базах данных анно- тированных мутаций, что позволяет предположить популяционную гетерогенность причин ПКК. Эти варианты ДНК и изменения уровней мРНК могут быть использованы в качестве прогностических биомаркеров почечно-клеточного рака.
Список литературы Интегральный анализ геномных и транскриптомных изменений при светлоклеточной почечно-клеточной карциноме в российской популяции
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018; 68(6): 394-424. DOI: 10.3322/caac.21492
- Bazzi W.M., Sjoberg D.D., Feuerstein M.A., Maschino A., Verma S., Bernstein M., O'Brien.F., Jang T., Lowrance W., Motzer R.J., Russo P. Long-Term Survival Rates after Resection for Locally Advanced Kidney Cancer: Memorial Sloan Kettering Cancer Center 1989 to 2012 Experience. J Urol. 2015 Jun; 193(6): 1911-6. DOI: 10.1016/j.juro.2014.12.022
- Wu X., Shu X. Epidemiology of Renal Cell Carcinoma. Renal Cell Carcinoma. Tokyo: Springer Japan; 2017: 1-18. DOI: 10.1007/978-4-431-55531-5_1
- Cheville J.C., Lohse C.M., Zincke H., Weaver A.L., Blute M.L. Comparisons of Outcome and Prognostic Features Among Histologic Subtypes of Renal Cell Carcinoma. Am J Surg Pathol. 2003; 27(5): 612-624. DOI: 10.1097/00000478-200305000-00005
- Kume H., Takahashi S., Teramoto S., Isurugi K. Risk factors for adult renal cell carcinoma: a systematic review and implications for prevention. BJU Int. 2001; 88(7): 804-804. DOI: 10.1046/j.1464-410-X.2001.2505b.x


