Интегриновый профиль циркулирующих опухолевых клеток у больных раком молочной железы
Автор: Григорьева Е.С., Таширева Л.А., Алифанов В.В., Завьялова М.В., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.23, 2024 года.
Бесплатный доступ
Интегрины как молекулы адгезии играют ключевую роль во взаимодействии клеток с базальной мембраной и межклеточным матриксом. Многочисленные исследования сообщают о повышенной экспрессии интегринов на опухолевых клетках при различных типах рака. Так, интегрины β3 и αV ассоциированы со стволовыми признаками опухолевых клеток, интегрин β4 в составе гетеродимера α6β4 обеспечивает якорь-независимое выживание злокачественных эпителиальных клеток молочной железы. Однако все описанные функции интегринов исследованы исключительно на клетках первичных опухолей, тогда как функциональное значение и характер экспрессии интегринов на циркулирующих опухолевых клетках (ЦОК) остаются неясными. Цель исследования - оценка экспрессии интегринов β3, β4 и αvβ5 на ЦОК при раке молочной железы (РМЖ) и ее связи с проявлениями опухолевой болезни. материал и методы. В исследование вошло 22 пациентки с инвазивной протоковой карциномой молочной железы T1-4N0-3M0 стадии. Венозную кровь брали у больных без неоадъювантной химиотерапии (НАХТ) (группа 1) и получивших НАХТ (группа 2) утром натощак в объеме 12 мл в вакуумные пробирки с ЭДТА. Экспрессию интегринов ЦОК с учетом признаков стволовости CD44/CD24, CD133 и ALDH1 и эпителиально-мезенхимального перехода (ЭМП) (N-cadherin) оценивали методом проточной цитофлуориметрии.
Рак молочной железы, циркулирующие опухолевые клетки, интегрины, неоадъювантная химиотерапия
Короткий адрес: https://sciup.org/140307093
IDR: 140307093 | УДК: 618.19-006.6-091.8:576.52 | DOI: 10.21294/1814-4861-2024-23-4-86-95
Текст научной статьи Интегриновый профиль циркулирующих опухолевых клеток у больных раком молочной железы
Актуальность
Интегрины представляют собой молекулы адгезии и являются гетеродимерными рецепторами для молекул базальной мембраны и межклеточного матрикса. Благодаря интегринам осуществляется взаимодействие между эпителием и межклеточным матриксом, которое необходимо для осуществления многообразных клеточных функций [1]. Из этого следует, что функции интегринов могут осуществляться благодаря взаимодействию с внешними сигналами – лигандами внеклеточного матрикса. Можно было бы ожидать, что экспрессия интегринов циркулирующими опухолевыми клетками (ЦОК), открепленными от матрикса, не имеет функционального значения для состояния самих ЦОК, однако это не так. Показано, что кроме внешней активации сигнальных путей через интегриновые рецепторы существуют внутренние пути активации. Например, имеются, данные, что стволовость опухолевых клеток может инициироваться независимо от взаимодействия с матриксом. Причем эти независимые от адгезии функции ин-тегринов запускают пути, отличные от типичного сигнального каскада [2]. Аберрантная экспрессия интегринов способствует возникновению, росту и метастазированию опухолей. Многочисленные данные показали, что экспрессия интегринов на опухолевых клетках повышается при многих типах рака [3]. Интегрин αvβ3 признан маркером стволовых клеток во многих типах солидных опухолей [4]. Интегрин β4 в составе гетеродимера α6β4 является рецептором для ламинина и может опосредовать независимое от прикрепления выживание злокачественных эпителиальных клеток молочной железы [5]. Экспрессия интегрина αv связана с фенотипом стволовости [2]. Описанные функции интегринов исследованы на клетках первичных опухолей. Исследований интегринового профиля ЦОК немного. В исследовании M. Sharifi et al. (2023) [6] у всех пациенток с наличием гематогенных метастазов при раке молочной железы (РМЖ) были выявлены ЦОК. При этом на значительной части ЦОК (61 %) обнаружена экспрессия β4. Не было обнаружено какой-либо связи экспрессии этого интегрина с другими параметрами опухолевой болезни.
Целью исследования явилась оценка экспрессии интегринов β3, β4 и αvβ5 на ЦОК при РМЖ и ее связи с проявлениями опухолевой болезни.
Материал и методы
В исследование включено 22 пациентки с инвазивной протоковой карциномой молочной железы T1-4N0-3M0, получавших лечение на базе клиники НИИ онкологии Томского НИМЦ в период с 2019 по 2022 г., у которых были обнаружены ЦОК. Венозную кровь брали у больных без неоадъювантной химиотерапии (НАХТ) (группа 1) и после НАХТ (группа 2) утром натощак в объеме 12 мл в вакуумные пробирки с ЭДТА. Из всего объема крови готовили клеточный концентрат путем отстаивания при 37 °С в течение 90 мин под углом в 45° с последующим сбором белого кольца с клетками на границе осадка эритроцитов и отделившейся плазмы крови, а также всего надосадка, согласно методике Р.А. Поспеловой [7].
Цитофлуориметрический анализ проводили следующим образом. Для лизирования эритроцитов к образцам добавляли 500 мкл буфера OptiLyse C (Beckman Coulter, Франция) и отмывали в 2 мл раствора CellWASH (BD Biosciences, США) в течение
Статистическая обработка результатов проводилась с применением пакета программ STATISTICА 10.0. Проверка нормальности распределения показателей осуществлялась с помощью критерия Шапиро–Вилка. Учитывая ненормальное распределение изучаемых признаков, оценка достоверности различий медиан для сравнения независимых выборок проводилась с использованием непараметрического критерия Манна–Уитни. Сравнение частоты выявления признаков выполнялось с использованием парного разностного теста. Различия считали статистически значимыми при р<0,05.
Результаты
Клинико-патологические параметры пациенток представлены в табл. 1. В CD45-EpCAM+ ЦОК определена коэкспрессия трех типов интегринов – β 3, β 4 и α v β 5, в каждой популяции оценены признаки стволовости по экспрессии СD44/CD24,
CD133 и ALDH1, а также проявления ЭМП по наличию экспрессии N-cadherin. Связь инте-гринового профиля с клинико-патологическими характеристиками оценивали в группе 1. Оценку влияния НАХТ проводили у больных с первично операбельным РМЖ в группах 1 и 2.
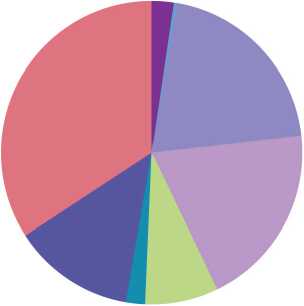
Все пациентки характеризовались наличием ЦОК с различными вариантами экспрессии трех типов исследуемых интегринов, при этом большая часть клеток экспрессировала один или более интегрин на своей поверхности (рис. 1). Наиболее редким вариантом была коэкспрессия интегринов β 3 и β 4 ( β 3+ β 4+ α v β 5-). Наиболее частым был вариант коэкспрессии интегринов β 3 и α v β 5 ( β 3+ β 4- α v β 5+) (табл. 2). Обнаружено, что 65,81 % ЦОК характеризовались экспрессией, как минимум, одного типа интегрина. При анализе доли клеток, экспрессирующих интегрины β 3, β 4 и α v β 5 без учета их коэкспрессии, оказалось, что большая часть ЦОК, экспрессировала интегрин β 3 и α v β 5 – 42,8 и 43,8 % клеток соответственно, в то время как интегрин β 4 экспрессировали только 12,6 % ЦОК.
В результате сравнения количества ЦОК с экспрессией интегринов β 3, β 4 и α v β 5 в зависимости от размера опухоли выявлено повышенное количество β 3+ β 4- α v β 5- и β 3- β 4+ α v β 5+ ЦОК у больных с большим размером опухоли (рис. 2). Так, у больных с T4 количество β 3+ β 4- α v β 5- и β 3- β 4+ α v β 5+ ЦОК составило 8,96 (0,00–17,92) и 18,30 (0,00–36,60) ЦОК/мл соответственно, тогда как у больных с T1 количество β 3+ β 4- α v β 5- и β 3- β 4+ α v β 5+ ЦОК составило 0,42 (0,00–2,75) и 0,00 (0,00–2,49) ЦОК/мл, а у больных с T2 – 0,83 (0,00–4,48) и 0,00 (0,00–0,83) ЦОК/мл соответственно.
Углубленный анализ фенотипических характеристик позволил установить наличие признаков стволовости и ЭМП у выявленных популяций клеток. Показано, что β 3- β 4+ α v β 5+ ЦОК обладали признаками стволовости по CD133 и ALDH1 и мезенхимного фенотипа ЭМП (N-cadherin+) (рис. 3). Количество β 3- β 4+ α v β 5+ ЦОК с фенотипом CD44-CD24+ CD133+ALDH1+N-cadherin+ тоже было
■ 2.36% B3+B4+AvB5+ ■ 0.37% B3+B4+AvB5-■ 20.48% B3+B4-AvB5+
19.62% B3+B4-AvB5-
7.84% B3-B4+AvB5+ ■ 2.05% B3-B4+AvB5-■ 13.08% B3-B4-AvB5+ ■ 34.19% B3-B4-AvB5-
Рис. 1. Доли экспрессии интегринов β3, β4 и αvβ5 в ЦОК у больных раком молочной железы (Me, %). Примечание: диаграмма выполнена авторами
Fig.1 Proportion of CTCs with β3, β4 and αvβ5 integrin expression in breast cancer patients (Me, %).
Note: created by the authors
Таблица 1/Table 1
Характеристика групп больных
Characteristics of the groups of patients
Частота/Frequency
|
Параметр/Parameter |
Группа 1 (без НАХТ)/ Group 1 (no NACT) |
Группа 2 (с НАХТ)/ Group 1 (NACT) |
р-value |
|
|
<35 |
5,9 % (1/17) |
0,00 % (0/5) |
||
|
Возраст/Age |
35–50 |
41,2 % (7/17) |
60,0 % (3/5) |
|
|
>50 |
52,9 % (9/17) |
40,0 % (2/5) |
||
|
Т1 |
47,1 % (8/17) |
0,0 % (0/5) |
||
|
Размер опухоли/Size of tumor |
Т2 |
41,2 % (7/17) |
100,0 % (5/5) |
0,04 |
|
Т4 |
11,8 % (2/17) |
0,0 % (0/5) |
||
|
Вовлеченность лимфоузлов/ Lymph node involvement |
N0 N1 |
70,6 % (12/17) 29,4 % (5/17) |
60,0 % (3/5) 40,0 % (2/5) |
|
|
Люминальный А/Luminal A |
47,1 % (8/17) |
40,0 % (2/5) |
||
|
Молекулярно-биологический подтип/ Molecular subtype |
Люминальный Б (HER2-)/ Luminal B (HER2-) |
17,6 % (3/17) |
20,0 % (1/5) |
|
|
Люминальный Б (HER2+)/ Luminal B (HER2+) |
17,6 % (3/17) |
0,0 % (0/5) |
||
|
ТН/Triple negative |
11,8 % (2/17) |
40,0 % (2/5) |
||
|
HER2+ |
5,9 % (1/17) |
0,0 % (0/5) |
||
|
Экспрессия ERα/ERα expression |
Да/Yes Нет/No |
82,4 % (14/17) 16,7 % (3/17) |
60,0 % (3/5) 40,0 % (2/5) |
|
|
Экспрессия PR/PR expression |
Да/Yes Нет/No |
64,7 % (11/17) 35,3 % (6/17) |
60,0 % (3/5) 40,0 % (2/5) |
|
|
HER2+ |
Да/Yes Нет/No |
23,5 % (4/17) 76,5 % (13/17) |
0,0 % (0/5) 100,0 % (5/5) |
|
Примечание: таблица составлена авторами.
Note: created by the authors.
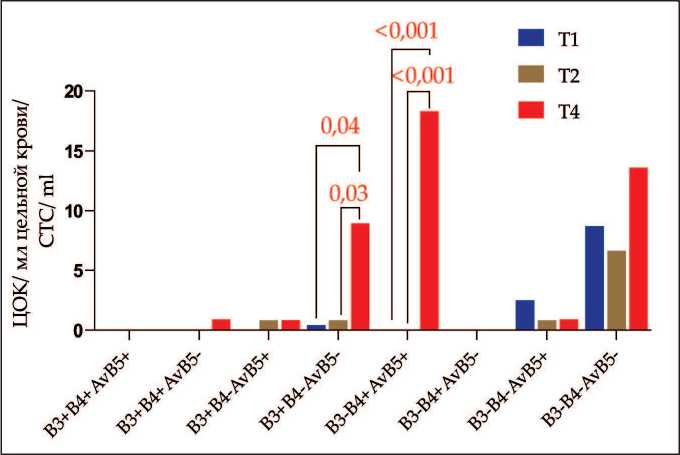
Рис. 2. Количество ЦОК с экспрессией интегринов β3, β4 и αvβ5 у больных с учетом размера первичной опухоли (критерий Т). Примечание: диаграмма выполнена авторами Fig. 2. The number of CTCs with β3, β4 and αvβ5 integrin expression in breast cancer patients in relation to stage T. Note: created by the authors
выше у пациенток с Т4 по сравнению с T1 и Т2 (p<0,0001 и p<0,0001 соответственно) и составляло 0,00 (0,00–18,30), 0,00 (0,00–0,00) и 0,00 (0,00–0,00) ЦОК/мл соответственно.
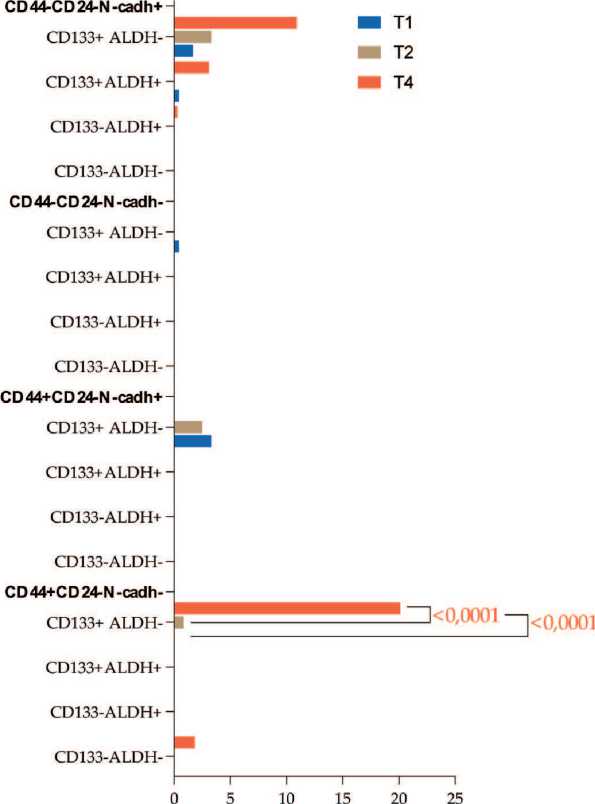
Другой субпопуляцией ЦОК, связанной с критерием Т, были клетки с интегриновым фенотипом β 3+ β 4- α v β 5-. При Т4 такие ЦОК чаще демонстрировали стволовые свойства по маркерам CD44+CD24- и CD133, а также эпителиальный фенотип ЭМП (рис. 4).
При оценке количества ЦОК с экспрессией изучаемых интегринов с учетом лимфогенной распространенности обнаружено, что количество β 3- β 4- α v β 5+ ЦОК было ниже у больных с N1 по сравнению с N0 (p=0,01) (рис. 5). Количество β 3- β 4- α v β 5+ ЦОК при N0 и N1 составляло 3,74 (1,45–9,13) и 0,0 (0,0–0,92) ЦОК/мл соответственно. Детальный анализ фенотипических характеристик β 3- β 4- α v β 5+ ЦОК выявил, что обнаруженные различия были связаны с ЦОК без признаков ство-ловости по CD44/CD24, CD133 и ALDH1 (p=0,04, p=0,03, p=0,03 соответственно) (рис. 6).
Далее мы оценили различия в количестве ЦОК с учетом интегринового профиля у больных с различными молекулярно-биологического подтипами РМЖ (табл. 3). Больные были разделены на 2 группы: первая – с люминальными (HER2-) подти-
Òàблицà 2/Table 2
Êîличåñтвî ЦÎÊ c эêñпðåññиåé интåгðинîв β 3, β 4 и α v β 5 ó бîльныõ ðàêîм мîлîчнîé æåлåзы
The number of CTCs with β 3, β 4 and α v β 5 integrin expression in breast cancer patients
|
№ |
Фенотип/Phenotype |
Me(Q1-Q3), ЦОК/мл/CTC/ml |
|
1 |
β 3+ β 4+ α v β 5+ |
0,00 (0,00–0,00) |
|
2 |
β 3+ β 4+ α v β 5- |
0,00 (0,00–0,83) |
|
3 |
β 3+ β 4- α v β 5+ |
0,00 (0,00–1,68) |
|
4 |
β 3+ β 4- α v β 5- |
0,83 (0,00–3,49) |
|
5 |
β 3- β 4+ α v β 5+ |
0,00 (0,00–0,83) |
|
6 |
β 3- β 4+ α v β 5- |
0,00 (0,00–0,83) |
|
7 |
β 3- β 4- α v β 5+ |
1,66 (0,00–5,81) |
|
8 |
β 3- β 4- α v β 5- |
8,30 (2,08–19,11) |
Примечание: таблица составлена авторами.
Note: created by the authors.
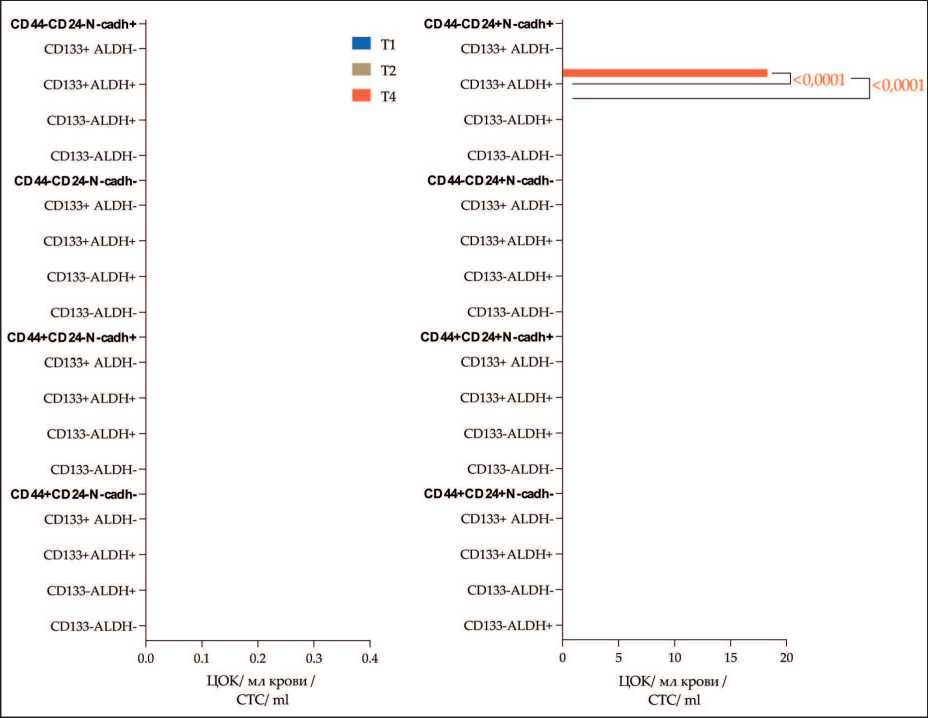
Рис. 3. Признаки стволово-сти и ЭМП в β3-β4+αvβ5+ ЦОК в зависимости от критерия T. Примечание: диаграммы выполнены авторами
Fig. 3. Features of stemness and EMT in β3-β4+αvβ5+ CTCs in breast cancer patients in relation to stage T. Note: created by the authors
пами; вторая – с HER2+ подтипами (люминальный Б (HER2+), HER2+) и трижды негативным (ТН). Оказалось, что в группе больных с молекулярнобиологическими подтипами, характеризующимися неблагоприятным течением болезни, отмечалось более высокое количество ЦОК с экспрессией β 3, без учета сочетаний с другими исследуемыми интегринами. Более глубокий анализ признаков стволовости и ЭМП в ЦОК в этих сравниваемых группах значимых различий не выявил.
У пациенток с первично операбельным РМЖ было оценено влияние НАХТ на профиль инте-гринов ЦОК. Поскольку у всех больных группы 2 опухоль соответствовала стадии T2, в анализ были включены пациентки из группы 1 только со стадией T2. При оценке интегриновых профилей ЦОК у больных в группах до и после НАХТ различий не обнаружено (табл. 4). Углубленный анализ фенотипических характеристик с учетом признаков стволовости и ЭМП каждой из популяции ЦОК также не выявил значимых различий. Таким образом, проведение НАХТ не влияло на характер экспрессии интегринов ЦОК у больных раком молочной железы.
Обсуждение
Полученные результаты свидетельствуют, что около 31 % ЦОК не экспрессируют изучаемые интегрины. Чаще других наблюдаются варианты коэкспрессии β 3+ β 4- α v β 5+ (20,5 %), β 3+ β 4- α v β 5-(19,6 %) и β 3- β 4- α v β 5+ (13,1 %). Если не учитывать коэкспрессию, то доля ЦОК, экспрессирующих β 3 и α v β 5, наиболее высока и составляет 42,8 и 43,8 % соответственно. Существенно реже выявлялась
ЦОК/ мл крови / СТС/ml

Рис. 4. Наличие признаков стволовости и ЭМП в β3+β4-αvβ5- ЦОК у пациентов в зависимости от критерия T.
Примечание: диаграммы выполнены авторами Fig. 4. Features of stem-ness and EMT in β3+β4-αvβ5- CTCs in breast cancer patients in relation to stage T. Note: created by the authors
СТС/ml
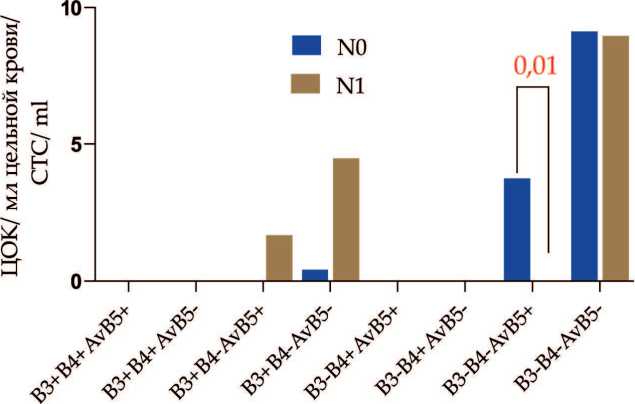
Рис. 5. Количество ЦОК с экспрессией интегринов β3, β4 и αvβ5 у больных с учетом лимфогенного метастазирования. Примечание: диаграмма выполнена авторами
Fig. 5. The number of CTCs with β3, β4 and αvβ5 integrin expression in breast cancer patients in relation to lymph node metastasis. Note: created by the authors
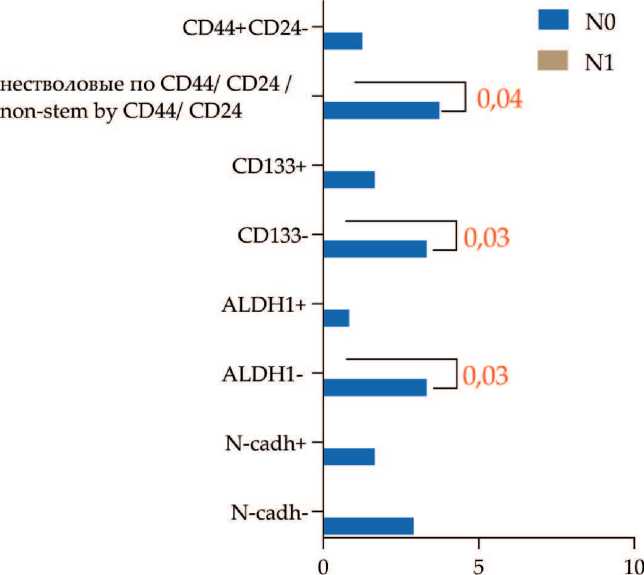
ЦОК/ мл крови / СТС/ ml
Рис. 6. Наличие признаков стволовости и ЭМП в β3-β4-αvβ5+ ЦОК у пациентов в зависимости от лимфогенного метастазирования. Примечание: диаграмма выполнена авторами Fig. 6. Features of stemness and EMT in β3-β4-αvβ5+ CTCs in breast cancer patients in relation to lymph node metastasis. Note: created by the authors
субъединица β4 (12,4 %). Столь выраженное многообразие вариантов коэкспрессии исследуемых интегринов на ЦОК позволяет предполагать, что, достигнув отдаленных органов и тканей в качестве диссеминированных или покоящихся, такие клетки уже имеют рецепторный аппарат, который способен обеспечивать адекватное для адаптации и пролиферации взаимодействие с межклеточным матриксом.
Фенотипические признаки ЦОК, включая экспрессию интегринов, формируются еще в первичной опухоли, благодаря чему ЦОК в значительной
Òàблицà 3/Table 3
Êîличåñтвî ЦÎÊ ñ óчåтîм интåгðинîвîгî пðîфилÿ ó бîльныõ ñ ðàзличными мîлåêóлÿðнî-биîлîгичåñêими пîäтипàми ÐMÆ
Number of CTCs with integrin expression in patients with different molecular subtypes of breast cancer
|
№ |
Фенотип/ Phenotype |
Me(Q1-Q3), ЦОК/мл/CTC/ml |
р-value |
|
|
Люминальный А/Б/ Luminal A/B |
HER2+, ТН |
|||
|
1 |
β 3+ β 4+ α v β 5+ |
(а) 0,00 (0,00–0,00) |
(б) 0,00 (0,00–0,28) |
|
|
2 |
β 3+ β 4+ α v β 5- |
0,00 (0,00–0,28) |
0,42 (0,00–4,69) |
|
|
3 |
β 3+ β 4- α v β 5+ |
0,42 (0,00–1,88) |
0,42 (0,00–3,13) |
|
|
4 |
β 3+ β 4- α v β 5- |
0,42 (0,00–1,74) |
0,83 (0,00–8,22) |
|
|
5 |
β 3- β 4+ α v β 5+ |
0,00 (0,00–1,45) |
0,00 (0,00–9,77) |
|
|
6 |
β 3- β 4+ α v β 5- |
0,00 (0,00–0,83) |
0,00 (0,00–2,08) |
|
|
7 |
β 3- β 4- α v β 5+ |
2,49 (0,62–5,40) |
0,92 (0,00–7,89) |
|
|
8 |
β 3- β 4- α v β 5- |
7,06 (2,63–18,68) |
13,63 (6,23–22,00) |
|
|
9 |
β 3+ |
0,83 (0,00–7,73) |
4,98 (1,79–18,60) |
pа-б=0,04 |
|
10 |
β 4+ |
0,83 (0,00–2,91) |
2,08 (0,00–22,06) |
|
|
11 |
α v β 5+ |
4,15 (1,68–10,58) |
7,89 (1,26–17,70) |
|
Примечание: таблица составлена авторами.
Note: created by the authors.
Òàблицà 4/ Table 4
Êîличåñтвî ЦÎÊ ñ óчåтîм интåгðинîвîгî пðîфилÿ ó бîльныõ ÐMÆ бåз ÍÀÕÒ (гðóппà 1) и пîлóчившиõ ÍÀÕÒ (гðóппà 2)
Number of CTCs with integrin expression in breast cancer patients without NAC (group 1) and with NAC (group 2)
степени отражают биологические особенности опухоли и могут служить объектом для жидкостной биопсии. В нашем исследовании ЦОК с двумя фенотипами β 3+ β 4- α v β 5 и β 3- β 4+ α v β 5+ были ассоциированы с большим размером опухоли (T4). По-видимому, такая ассоциация всех трех интегринов с Т4 обусловлена тем, что их экспрессия в ЦОК сочеталась с наличием признаков стволовости. ЦОК с интегриновым фенотипом β 3+ β 4- α v β 5- экспрессировали маркеры стволово-сти CD44+CD24- и CD133, ЦОК с интегриновым фенотипом β 3- β 4+ α v β 5+ имели другое сочетание маркеров стволовости, а именно CD133 и ALDH1. При этом β 3- β 4+ α v β 5+ ЦОК характеризовались мезенхимным фенотипом ЭМП (N-cadherin+), а β 3+ β 4- α v β 5- клетки не имели признаков ЭМП (N-cadherin-).
Еще одним свидетельством сопряженности экспрессии интегринов со злокачественным потенциалом опухолей было большее количество ЦОК с экспрессией интегрина β 3 при трижды негативном, люминальном Б (HER2+) и HER2+ молекулярных подтипах РМЖ. Ассоциация исследуемых интегринов с продвинутой стадией и агрессивными молекулярными подтипами РМЖ объясняется известными функциональными ассоциациями. Известно, что интегрин β3 связывается с компонентами внеклеточного матрикса, формируя контакты фокальной адгезии между опухолевыми клетками и матриксом. Интегрин αvβ3 вовлечен в процессы пролиферации, инвазии, выживания опухолевых клеток в циркуляции [4]. Кроме того, по данным литературы, повышенная экспрессия интегрина αvβ3 обладает прогностиче-
|
№ |
Фенотип/Phenotype |
Me (Q1-Q3), ЦОК/мл/ CTC/ml |
|
|
Группа 1/Group 1 (а) |
Группа 2/Group 2 (б) |
||
|
1 |
β 3+ β 4+ α v β 5+ |
0,00 (0,00–0,00) |
0,00 (0,00–0,21) |
|
2 |
β 3+ β 4+ α v β 5- |
0,00 (0,00–0,83) |
0,00 (0,00–1,94) |
|
3 |
β 3+ β 4- α v β 5+ |
0,42 (0,00–1,88) |
0,00 (0,00–2,08) |
|
4 |
β 3+ β 4- α v β 5- |
0,83 (0,00–1,74) |
2,49 (1,25–30,47) |
|
5 |
β 3- β 4+ α v β 5+ |
0,00 (0,00–0,83) |
0,00 (0,00–1,11) |
|
6 |
β 3- β 4+ α v β 5- |
0,83 (0,00–1,74) |
0,83 (0,28–1,23) |
|
7 |
β 3- β 4- α v β 5+ |
0,83 (0,00–2,49) |
0,00 (0,00–3,74) |
|
8 |
β 3- β 4- α v β 5- |
7,89 (2,63–20,13) |
9,96 (0,42–28,29) |
Примечание: таблица составлена авторами.
Note: created by the authors.
ской значимостью в отношении метастазирования в кости [8].
Феномен связи экспрессии интегрина α v β 5 c отсутствием лимфогенных метастазов может быть объяснен двумя гипотезами. Первая заключается в том, что ЦОК с экспрессией α v β 5, сопряженные с отсутствием лимфогенных метастазов, не имели признаков стволовости по CD44/CD24, CD133 и ALDH, которая крайне важна для метастазирования. Другое объяснение состоит в том, что повышенная экспрессия интегрина α v, хотя и в составе гетеродимера αvβ3, приводит к усилению в клетках трижды негативного рака эффектов TGF-β, что, в свою очередь, нарушает петлю обратной связи, которая ингибирует Zeb2, индуцируя при этом ЭМП и нарушая коллективную миграцию клеток [9]. Поскольку имеются исследования в пользу того, что именно коллективная инвазия, скорее, чем инвазия одиночными клетками опухоли, лежит в основе лимфогенного метастазирование [10], нарушение этого процесса и может быть причиной отсутствия лимфогенных метастазов при экспрессии на клетках опухоли интегрина α v β 5.
Учитывая критическое значение отдельных интегринов для опухолевого прогрессирования,
Список литературы Интегриновый профиль циркулирующих опухолевых клеток у больных раком молочной железы
- Su C.Y., Li J.Q., Zhang L.L., Wang H., Wang F.H., Tao Y.W., Wang Y.Q., Guo Q.R., Li J.J., Liu Y., Yan Y.Y., Zhang J.Y. The Biological Functions and Clinical Applications of Integrins in Cancers. Front Pharmacol. 2020; 11. https://doi.org/10.3389/fphar.2020.579068.
- Cooper J., Giancotti F.G. Integrin Signaling in Cancer: Mechanotransduction, Stemness, Epithelial Plasticity, and Therapeutic Resistance. Cancer Cell. 2019; 35(3): 347-67. https://doi.org/10.1016/j.ccell.2019.01.007.
- Liu F., Wu Q., Dong Z., Liu K. Integrins in cancer: Emerging mechanisms and therapeutic opportunities. Pharmacol Ther. 2023; 247. https://doi.org/10.1016/j.pharmthera.2023.108458.
- Seguin L., Kato S., Franovic A., Camargo M.F., Lesperance J., Elliott K.C., Yebra M., Mielgo A., Lowy A.M., Husain H., Cascone T., Diao L., Wang J., Wistuba I.I., Heymach J.V., Lippman S.M., Desgrosellier J.S., Anand S., Weis S.M., Cheresh D.A. An integrin β₃-KRAS-RalB complex drives tumour stemness and resistance to EGFR inhibition. Nat Cell Biol. 2014; 16(5): 457-68. https://doi.org/10.1038/ncb2953.
- Zahir N., Lakins J.N., Russell A., Ming W., Chatterjee C., Rozenberg G.I., Marinkovich M.P., Weaver V.M. Autocrine laminin-5 ligates a6h4 integrin and activates RAC and NFnB to mediate anchorage-independent survival of mammary tumors. J Cell Biol. 2003; 163(6): 1397-407. https://doi.org/10.1083/jcb.200302023.
- Sharifi M., Zarrin B., Bahri Najafi M., Hakimian M.R., Hosseini N., Talebi K., Javanmard S.H. Integrin α6 β4 on Circulating Tumor Cells of Metastatic Breast Cancer Patients. Adv Biomed Res. 2021; 10. https://doi.org/10.4103/abr.abr_76_21.
- Pospelova R.A. Leikokontsentratsiya v klinicheskoi praktike: diagnosticheskoe znachenie. M., 1973. 88 s.
- Kovacheva M., Zepp M., Berger S., Berger M.R. Conditional knock-down of integrin beta-3 reveals its involvement in osteolytic and soft tissue lesions of breast cancer skeletal metastasis. J Cancer Res Clin Oncol. 2021; 147(2): 361-71. https://doi.org/10.1007/s00432-020-03428-y.
- Parvani J.G., Galliher-Beckley A.J., Schiemann B.J., Schiemann W.P. Targeted inactivation of β1 integrin induces β3 integrin switching, which drives breast cancer metastasis by TGF-β. Mol Biol Cell. 2013; 24(21): 3449-59. https://doi.org/10.1091/mbc.E12-10-0776. Erratum in: Mol Biol Cell. 2014; 25(4): 548.
- Giampieri S., Manning C., Hooper S., Jones L., Hill C.S., Sahai E. Localized and reversible TGFbeta signalling switches breast cancer cells from cohesive to single cell motility. Nat Cell Biol. 2009; 11(11): 1287-96. https://doi.org/10.1038/ncb1973.
- Liu L., Yang L., Yan W., Zhai J., Pizzo D.P., Chu P., Chin A.R., Shen M., Dong C., Ruan X., Ren X., Somlo G., Wang S.E. Chemotherapy Induces Breast Cancer Stemness in Association with Dysregulated Monocytosis. Clin Cancer Res. 2018; 24(10): 2370-82. https://doi.org/10.1158/1078-0432.CCR-17-2545.


