Интенсификация процесса биодеструкции ибупрофена с использованием факторного анализа и кинетического моделирования
Автор: Бажутин Г.А., Тюмина Е.А., Селянинов А.А., Вихарева Е.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2023 года.
Бесплатный доступ
Ибупрофен - один из наиболее часто детектируемых фармполлютантов в сточных водах очистных сооружений многих стран. В ранее проведенных исследованиях подобраны условия актинобактериальной деструкции ибупрофена и разработана методика хроматографического анализа, позволяющая определять остаточные количества вещества в процессе биодеструкции. Однако влияние комплекса взаимодействующих факторов на динамику процесса биодеструкции ибупрофена изучено недостаточно. Цель настоящей работы - интенсификация этого процесса на основе многофакторного эксперимента с использованием управляемых параметров ключевых факторов, а также прогноз изменения содержания данного вещества и времени окончания оптимизированного процесса с применением кинетического моделирования. Варьирование концентраций глюкозы, н-гексадекана, инокулята и значения рН позволило уменьшить продолжительность процесса биодеструкции ибупрофена (0.1 г/л) с 10 до 2 сут. при использовании косубстратов в количестве 1.0 г/л, 10.0 мл/л и стандарта мутности БАК-5 соответственно, а также стабилизации рН на уровне 6.5. С использованием кинетического уравнения минус первого порядка dx/dt = -k x-1 определены значения параметра k скорости процесса биодеструкции ибупрофена 138.88÷146.84%2/ч, период полураспада t1/2 - 25.54÷27.00 ч и уточнено время окончания процесса t1/100 - 34.05÷36.00 ч в оптимизированных условиях.
Ибупрофен, актинобактерии, rhodococcus, биодеструкция, факторный анализ, кинетическое моделирование
Короткий адрес: https://sciup.org/147242766
IDR: 147242766 | УДК: 579.873.6:51-76:531 | DOI: 10.17072/1994-9952-2023-4-328-336
Текст научной статьи Интенсификация процесса биодеструкции ибупрофена с использованием факторного анализа и кинетического моделирования
Фармацевтические поллютанты, представляющие собой высокостабильные соединения с разнообразной химической структурой и выраженной биологической активностью, с начала 2000-х годов признаны новым классом ксенобиотиков [Patel et al., 2019]. Данные вещества оказывают неблагоприятное воздействие на окружающую среду даже в относительно невысоких, но экологически значимых концентрациях [Chopra, Kumar, 2020; Sánchez-Aceves et al., 2021]. Одними из многочисленных микроорганизмов, осуществляющих процессы естественного самоочищения окружающей среды от антропогенных ксенобиотиков, являются актинобактерии рода Rhodococcus – типичные обитатели водных и почвенных экосистем, отличающиеся наибольшим разнообразием деградируемых поллютантов [Ivshina, Kuyukina, Krivoruchko, 2017; Anteneh, Franco, 2019; Girardot et al., 2020]. Ранее нами была показана способность актинобактерий рода Rhodococcus к биологической деструкции лекарственных средств разной химической структуры и фармакологического действия, в том числе парацетамола, ацетилсалициловой кислоты, кодеина, дротаверина гидрохлорида, диклофенака натрия, мелоксикама, ибупрофена и др. [Ivshina et al., 2015, 2019, 2021].
Проведение процессов бактериальной деструкции лекарственных средств требует соблюдения многих условий, которые определяются влиянием комплекса фиксируемых на начальном этапе или регулируемых в ходе процесса факторов, основными из которых являются скорость вращения шейкера, температура процесса, концентрация бактериальных клеток, концентрация косубстратов (дополнительных источников углерода и энергии для микроорганизмов), концентрация фармпрепарата, установленная в зависимости от его минимальной подавляющей концентрации и др. Ранее в цикле исследований нами показано, что скорость уменьшения концентрации лекарственного средства в ходе процесса биодеструкции при фиксированных начальных условиях пропорциональна концентрации вещества в культуральной среде бактерий. Время окончания процесса деградации, критерием которого является полное удаление фармпрепарата из среды культивирования, составляло от нескольких часов до 30 сут. Динамика убыли количества вещества в процессе биодеструкции регистрировалась с помощью метода высокоэффективной жидкостной хроматографии (ВЭЖХ). При этом проводился подбор условий хроматографического определения фармвещества в специфической биожидкости – среде культивирования бактерий [Karpenko et al., 2014; Plotnikov et al., 2017; Khrenkov et al., 2020; Vikhareva et al., 2023].
Нами установлено, что продолжительность процесса биодеструкции ибупрофена (ИБП) клетками R . cerastii ИЭГМ 1243 в фиксированных условиях составляла более 5 сут., при этом остаточная концентрация ИБП находилась на уровне 20% [Vikhareva et al., 2023]. На основе работ [Сергиенко, Бондарева, 2000; Karpenko et al., 2014] была подтверждена случайность процесса биодеструкции ИБП с позиций стохастического анализа, и с применением кинетического моделирования осуществлен прогноз изменения содержания ИБП в процессе биодеструкции, определены период его полураспада, время окончания (10 сут.) и воспроизводимость процесса [Vikhareva et al., 2023].
Цель работы – интенсификация процесса биодеструкции ИБП и сокращение его продолжительности на основе многофакторного эксперимента с использованием управляемых параметров ключевых факторов (концентрация глюкозы, н- гексадекана, бактериальных клеток, значение рН среды), а также кинетическое моделирование оптимизированного процесса.
Материалы и методы
В работе использовали натриевую соль ИБП (C 13 H 17 NaO 2 , CAS 31121-93-4, α-метил-4-(изобутил)фенилуксусной кислоты; Sigma-Aldrich, США): белый кристаллический порошок, хорошо растворимый в воде. Химические реагенты имели квалификацию х.ч., ч.д.а. или о.с.ч. (База № 1 химреак-тивов, Россия; Криохром, Россия; Merck, Германия; Sigma-Aldrich, США).
В качестве биодеструктора ИБП использовали штамм R. cerastii ИЭГМ 1243 из Региональной профилированной коллекции алканотрофных микроорганизмов (официальный акроним коллекции ИЭГМ, , ЦКП 480868, УНУ 73559, номер 285 во Всемирной федерации коллекций культур) [Catalogue of Strains…, 2023]. В колбу Эрленмейера вместимостью 250 см3 вносили 0.01 г ИБП, 100 см3 минерально-солевой среды (г/л): K2HPO4 - 1.0; KH2PO4 - 1.0; NH4NO3 - 1.0; NaCl - 1.0; MgSO4 · 7Н2О -0.2; CaCl2 · 2Н2О - 0.02; FeСl3 · 7Н2О - 0.001, а также глюкозу (от 0.1 до 2.5 г/л) и н-гексадекан (от 0.1 до 50.0 мл/л) в качестве косубстратов (дополнительных источников углерода и энергии для бактериальных клеток). Инокулят (клетки родококков) вносили в соответствии со стандартным образцом мутности бактериальных взвесей БАК-5 (5 международных единиц мутности), при этом использовали от 10 до 200% концентрации клеток, необходимых для достижения БАК-5. Значение рН в интервале от 4.0 до 8.0 регулировали с помощью растворов HCl и NaOH, в интервале от 5.5 до 7.0 – с помощью изменения соотношения KH2PO4 и K2HPO4 в составе минеральной среды. Родококки предварительно выращивали в течение трех сут. в питательном бульоне LB (Sigma, США) и затем отмывали 10 мМ фосфатным буферным раствором (рН 7.0). Процесс биодеструкции ИБП проводили в течение 5 сут. в условиях периодического культивирования на орбитальном шейкере Certomat IS (Sartorius, Германия) при стабилизированных параметрах угловой скорости вращения шейкера (160 об/мин) и температуре 28ºС. Отбор проб в количестве 1 мл проводили с интервалом 1 сут., в заключительных экспериментах – с интервалом 6 ч. Каждый опыт при варьировании параметров исследуемых факторов проводили в 3-кратных повторностях (реализациях) в одинаковых условиях.
Приборы и оборудование. Орбитальный шейкер Certomat IS (Sartorius, Германия); хроматограф; лабораторная центрифуга (12 000 об/мин, Eppendorf, Германия), pH-метр Hanna HI2215-02 (Hanna Instruments, США). Для обеспечения оптимального качества свежеприготовленной сверхчистой воды для ВЭЖХ использовали систему очистки воды Millipore Simplicity Personal Ultrapure Water System (Millipore, США).
Убыль ИБП в процессе биодеструкции регистрировали с помощью хроматографа LC Prominence 20А (Shimadzu, Япония), оснащенного обращено-фазной колонкой Kromasil 7uC18(2) 100A (4.6 mm × 250 mm) и диодно-матричным детектором (SPD-M20A). Условия хроматографического анализа ИБП: подвижная фаза ацетонитрил – фосфатный буферный раствор (рН 3) в соотношении 60:40; скорость потока элюента – 1 мл/мин; температура колонки – 40°С; объем пробы – 10 мкл; длина волны детектирования – 220 нм. В описанных условиях время удерживания ИБП составляло 10.80 ± 0.02 мин [Vikhareva et al., 2023]. Для осуществления ВЭЖХ-анализа аликвотную часть культуральной среды (1.0 мл), содержащую ИБП и его метаболиты, бактериальные клетки и продукты их жизнедеятельности, помещали в пробирку Эппендор-фа и центрифугировали при 14 000 об/мин в течение 10 мин. Надосадочную жидкость фильтровали через мембранный шприцевой нейлоновый фильтр с размером пор 0.45 мкм (Agilent Technologies, США). В качестве контролей использовали стерильную минеральную среду с ИБП (0.01%) без внесения бактериальных клеток (абиотический контроль) и стерильную минеральную среду с бактериальными клетками без ИБП (биотический контроль). Обработку полученных хроматографических данных проводили с использованием программного обеспечения LCSolution (v/1.25 rus).
Для кинетического моделирования использовали кинетическое уравнение минус первого порядка dx/dt = – k x -1 с начальным условием x 0 = 100% при t = 0. Значения параметра скорости биодеструкции k в реализациях определяли с применением метода наименьших квадратов по полученным экспериментальным данным.
Результаты и обсуждение
Базовыми значениями варьируемых факторов были следующие: концентрация глюкозы 0.1 г/л, концентрация н- гексадекана 0.1 мл/л, концентрация клеток до соответствия стандарту мутности БАК-5, значение рН 7.0.
По нашим данным, варьирование концентраций глюкозы и н- гексадекана уменьшало продолжительность процесса до 3 сут. при использовании данных косубстратов в количестве 1.0 г/л и 10.0 мл/л соответственно (табл. 1, 2). В диапазоне концентраций глюкозы с 0.1 до 1.0 г/л и н- гексадекана с 0.1 до 10.0 мл/л наблюдалось существенное сокращение времени процесса. Увеличение концентрации глюкозы (более 1.0 г/л) и н- гексадекана (более 10.0 мл/л) не способствовало ускорению процесса биодеструкции ИБП.
Таблица 1
Динамика изменения содержания ибупрофена в процессе биодеструкции при разных концентрациях глюкозы
[Ibuprofen concentration dynamics during biodegradation at different glucose levels]
|
Концентрация глюкозы, г/л |
Экспозиция, сут. |
|||||
|
0 |
1 |
2 |
3 |
4 |
5 |
|
|
Определено ИБП*, % |
||||||
|
0.1 |
100 |
94.1 |
76.8 |
75.8 |
73.9 |
67.0 |
|
100 |
88.6 |
70.8 |
59.0 |
55.1 |
53.9 |
|
|
100 |
89.4 |
74.3 |
66.3 |
60.6 |
58.7 |
|
|
0.5 |
100 |
84.5 |
37.8 |
27.9 |
0.0 |
- |
|
100 |
76.0 |
27.8 |
24.4 |
17.7 |
0.0 |
|
|
100 |
75.5 |
28.4 |
26.9 |
11.3 |
0.0 |
|
|
1.0 |
100 |
87.3 |
9.3 |
0.0 |
- |
- |
|
100 |
86.5 |
8.5 |
0.0 |
- |
- |
|
|
100 |
85.7 |
7.1 |
0.0 |
- |
- |
|
|
2.5 |
100 |
84.3 |
4.1 |
2.1 |
0.0 |
- |
|
100 |
86.5 |
2.9 |
3.1 |
0.0 |
- |
|
|
100 |
83.6 |
3.4 |
1.2 |
0.0 |
- |
|
*Начальная концентрация ИБП принята за 100%.
Таблица 2
Динамика изменения содержания ибупрофена в процессе биодеструкции при разных концентрациях н- гексадекана
[Ibuprofen concentration dynamics during biodegradation at different n- hexadecane levels]
|
Концентрация н- гексадекана, мл/л |
Экспозиция, сут. |
|||||
|
0 |
1 |
2 |
3 |
4 |
5 |
|
|
Определено ИБП*, % |
||||||
|
0.1 |
100 |
94.1 |
76.8 |
75.8 |
73.9 |
67.0 |
|
100 |
88.6 |
70.8 |
59.0 |
55.1 |
53.9 |
|
|
100 |
88.4 |
72.5 |
61.3 |
57.6 |
54.2 |
|
|
1.0 |
100 |
87.2 |
18.0 |
0.0 |
- |
- |
|
100 |
88.4 |
32.2 |
8.6 |
0.0 |
- |
|
|
100 |
87.1 |
28.5 |
6.6 |
0.0 |
- |
|
|
10.0 |
100 |
87.3 |
9.3 |
0.0 |
- |
- |
|
100 |
86.5 |
8.5 |
0.0 |
- |
- |
|
|
100 |
85.7 |
7.1 |
0.0 |
- |
- |
|
|
50.0 |
100 |
86.3 |
2.5 |
0.0 |
- |
- |
|
100 |
81.2 |
2.1 |
0.0 |
- |
- |
|
|
100 |
83.3 |
3.6 |
0.0 |
- |
- |
|
*Начальная концентрация ИБП принята за 100%.
При варьировании рабочего объема бактериального инокулята принимали во внимание тот факт, что недостаточное его количество приводило к неспособности клеток преодолеть ингибирующее действие ИБП и к отсутствию их роста, и, как следствие, к значительному увеличению продолжительности lag-фазы. Как видно из данных табл. 3, со снижением концентрации клеток ниже 50% от концентрации по БАК-5 снижается эффективность биодеструкции ИБП. Увеличение объема инокулята выше необходимой для БАК-5 не влияет на продолжительность процесса. Следовательно, рациональным значением данного фактора можно считать концентрацию инокулята, равную стандарту мутности БАК-5.
Таблица 3
Динамика изменения содержания ибупрофена в процессе биодеструкции при разных концентрациях инокулята
[Ibuprofen concentration dynamics during biodegradation with varying inoculum concentrations]
|
Концентрация инокулята, % |
Экспозиция, сут. |
|||||
|
0 |
1 |
2 |
3 |
4 |
5 |
|
|
Определено ИБП*, % |
||||||
|
100 |
99.9 |
99.3 |
97.9 |
81.4 |
63.3 |
|
|
10 |
100 |
99.7 |
99.8 |
98.2 |
90.1 |
89.3 |
|
100 |
99.7 |
97.2 |
97.1 |
85.5 |
80.2 |
|
Окончание табл. 3
|
Концентрация инокулята, % |
Экспозиция, сут. |
|||||
|
0 |
1 |
2 |
3 |
4 |
5 |
|
|
Определено ИБП*, % |
||||||
|
50 |
100 |
96.3 |
73.3 |
71.4 |
57.6 |
55.5 |
|
100 |
96.3 |
84.0 |
75.3 |
72.6 |
58.6 |
|
|
100 |
96.2 |
80.2 |
72.5 |
60.6 |
57.5 |
|
|
100 |
100 |
94.1 |
76.8 |
75.8 |
73.9 |
67.0 |
|
100 |
88.6 |
70.8 |
59.0 |
55.1 |
53.9 |
|
|
100 |
89.7 |
73.5 |
62.6 |
60.2 |
58.9 |
|
|
200 |
100 |
90.9 |
77.7 |
75.5 |
73.9 |
73.0 |
|
100 |
91.4 |
67.3 |
64.4 |
63.3 |
62.8 |
|
|
100 |
91.4 |
69.6 |
67.5 |
65.6 |
61.8 |
|
*Начальная концентрация ИБП принята за 100%.
Наиболее значимым из исследованных факторов оказалось значение рН. При изменении показателя рН в щелочную сторону (с 6.0 до 8.0) продолжительность процесса увеличивалась (табл. 4). В кислой среде биодеструкция ИПБ практически не происходила.
Таблица 4 Динамика изменения содержания ибупрофена в процессе биодеструкции при значениях рН 4.0–8.0
[Ibuprofen concentration dynamics throughout biodegradation across pH values 4.0–8.0]
|
Значение рН |
Экспозиция, сут. |
|||||
|
0 |
1 |
2 |
3 |
4 |
5 |
|
|
Определено ИБП*, % |
||||||
|
4.0 |
100 |
100.0 |
100.0 |
99.0 |
99.0 |
97.0 |
|
100 |
99.0 |
98.0 |
98.0 |
98.0 |
98.0 |
|
|
100 |
100.0 |
100.0 |
99.0 |
98.0 |
98.0 |
|
|
5.0 |
100 |
97.0 |
92.0 |
89.0 |
87.0 |
86.8 |
|
100 |
99.0 |
89.0 |
83.0 |
79.0 |
77.0 |
|
|
100 |
99.0 |
97.0 |
91.0 |
86.0 |
79.0 |
|
|
6.0 |
100 |
93.3 |
61.6 |
30.3 |
22.9 |
18.8 |
|
100 |
93.9 |
69.9 |
50.5 |
36.4 |
33.4 |
|
|
100 |
93.6 |
62.5 |
37.6 |
29.8 |
23.5 |
|
|
7.0 |
100 |
98.4 |
92.8 |
90.9 |
88.6 |
87.5 |
|
100 |
98.5 |
94.9 |
94.6 |
87.1 |
85.9 |
|
|
100 |
98.5 |
93.0 |
91.3 |
87.0 |
86.0 |
|
|
8.0 |
100 |
99.2 |
99.1 |
98.3 |
95.4 |
92.4 |
|
100 |
99.8 |
98.0 |
97.5 |
97.4 |
96.3 |
|
|
100 |
99.2 |
99.0 |
98.0 |
97.1 |
94.8 |
|
*Начальная концентрация ИБП принята за 100%.
Следует отметить, что в процессе биодеструкции ИПБ происходило уменьшение значения рН культуральной среды, что приводило к увеличению времени процесса. В связи с этим возникла необходимость стабилизации рН. При повторении эксперимента со стабилизацией значений рН в пределах от 5.5 до 7.0 оказалось, что оптимальное значение рН равно 6.5. Время завершения процесса при этом уменьшилось до 2 сут. (табл. 5).
Таблица 5 Динамика изменения содержания ибупрофена в процессе биодеструкции при значениях рН 5.5–7.0
[Ibuprofen concentration dynamics throughout biodegradation across pH values 5.5–7.0]
|
Значение рН |
Экспозиция, сут. |
|||||
|
0 |
1 |
2 |
3 |
4 |
5 |
|
|
Определено ИБП*, % |
||||||
|
5.5 |
100 |
78.77 |
18.04 |
0 |
- |
- |
|
100 |
71.22 |
29.78 |
0 |
- |
- |
|
|
100 |
76.33 |
37.56 |
1.21 |
0 |
- |
|
|
6.0 |
100 |
67.32 |
0 |
- |
- |
- |
|
100 |
66.32 |
4.91 |
0 |
- |
- |
|
|
100 |
66.08 |
0.85 |
0 |
- |
- |
|
Окончание табл. 5
|
Значение рН |
Экспозиция, сут. |
|||||
|
0 |
1 |
2 |
3 |
4 |
5 |
|
|
Определено ИБП*, % |
||||||
|
6.5 |
100 |
56.87 |
0 |
- |
- |
- |
|
100 |
55.78 |
0 |
- |
- |
- |
|
|
100 |
58.02 |
0 |
- |
- |
- |
|
|
7.0 |
100 |
70.62 |
28.12 |
0 |
- |
- |
|
100 |
68.36 |
32.99 |
3.72 |
- |
- |
|
|
100 |
75.76 |
32.16 |
1.75 |
- |
- |
|
*Начальная концентрация ИБП принята за 100%.
При разных значениях рН визуально рост культуры значительно различался (рис. 1). При pH 5.0 на вторые сутки процесса биодеструкции ИБП биомасса была белой, оформленной в длинные рыхлые агрегаты, мутность среды высокая. При pH 6.0 наблюдались агрегаты клеток кремового цвета. Наравне с мягкими белыми тяжами начали формироваться круглые, более плотные агрегаты яркой окраски, культуральная среда при этом имела меньшую мутность. При pH 6.5 на вторые сутки вся культура была организована в яркие агрегаты оранжевого цвета. При отстаивании биомасса всплывала, подосадочная жидкость была прозрачна (рис. 1).

Рис. 1. Внешний вид биомассы R . cerastii ИЭГМ 1243 при pH культуральной среды 5.0 (а), 6.0 (б), 6.5 (в)
[Visualization of R . cerastii IEGM 1243 in culture media at pH 5.0 (a), 6.0 (б), and 6.5 (в)]
Таким образом, в результате факторного анализа определили рациональные значения концентрации глюкозы (1.0 г/л), н- гексадекана (10.0 мл/л), инокулята (БАК-5) и рН среды (6.5). Продолжительность процесса биодеструкции ИБП при этих значениях параметров находится в интервале 24 - 48 ч.
Для уточнения времени завершения процесса он был воспроизведен в 9-ти реализациях в одинаковых рациональных условиях со стабилизацией рН среды на уровне 6.5 (табл. 6). На данном этапе работы было использовано кинетическое моделирование.
Таблица 6
Динамика процесса биодеструкции ибупрофена (0.01 %) клетками R . cerastii ИЭГМ 1243 [Dynamics of ibuprofen (0.01%) biodegradation by R . cerastii IEGM 1243]
|
№ п/п |
Экспозиция, час. |
Кинетическое моделирование |
||||||
|
0 |
18 |
24 |
30 |
36 |
||||
|
Концентрация ибупрофена, % |
k , %2 /ч |
t 1/2 , ч |
t 1/100 , ч |
|||||
|
1 |
100 |
69.54 |
51.97 |
28.69 |
0 |
146.84 |
25.54 |
34.05 |
|
2 |
100 |
71.62 |
54.40 |
30.69 |
0 |
142.96 |
26.23 |
34.97 |
|
3 |
100 |
72.50 |
54.42 |
31.30 |
0 |
141.91 |
26.43 |
35.23 |
|
4 |
100 |
71.57 |
53.20 |
27.88 |
0 |
144.37 |
25.98 |
34.63 |
|
5 |
100 |
70.00 |
51.92 |
28.67 |
0 |
146.42 |
25.61 |
34.14 |
|
6 |
100 |
72.72 |
54.32 |
31.88 |
0 |
141.59 |
26.48 |
35.31 |
|
7 |
100 |
72.51 |
57.47 |
35.74 |
0 |
138.88 |
27.00 |
36.00 |
|
8 |
100 |
71.72 |
58.54 |
34.49 |
0 |
139.39 |
26.90 |
35.87 |
|
9 |
100 |
72.71 |
56.96 |
33.75 |
0 |
139.56 |
26.87 |
35.82 |
*Начальная концентрация ИБП принята за 100%.
Поскольку в условиях стабилизации рН среды на уровне 6.5 скорость уменьшения концентрации ИБП оказалась обратно пропорциональной концентрации ИПБ в процессе биодеструкции (табл. 6), для моделирования использовали кинетическое уравнение минус первого порядка dx/dt = – k x-1 с начальным условием x0 = 100% при t = 0. После интегрирования уравнение кинетической кривой приняло вид x = (x02 - 2kt)1/2. Значения параметра скорости биодеструкции k в реализациях определяли с применением метода наименьших квадратов по полученным экспериментальным данным (табл. 6). Помимо этого, согласно выражению t1/2 = 0.75 x02 /(2k) определяли период полураспада ИБП в процессе биодеструкции, а по выражению t1/100 = 0.9999 x02 /(2k) устанавливали время окончания процесса при 100-кратном уменьшении начальной концентрации исследуемого вещества (табл. 6).
Кинетические кривые, характеризующие изменение остаточной концентрации ИБП в среде культивирования родококков (рис. 2), хорошо соответствуют полученным экспериментальным данным (табл. 6).
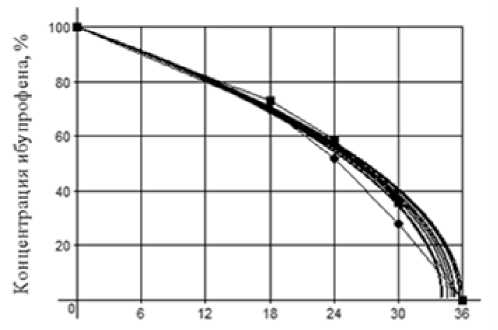
Время, ч
Рис. 2. Кинетические кривые изменения концентрации ибупрофена в процессе биодеструкции клетками R . cerastii ИЭГМ 1243 в условиях стабилизации рН среды (точками показаны экспериментальные значения пределов концентрации)
[Kinetic curves of ibuprofen concentration changes during biodegradation by R . cerastii IEGM 1243 cells with pH stabilization (experimental concentration limits marked as dots)]
Значения параметра k скорости процесса биодеструкции ИБП находятся в пределах 138.88÷146.84%2 /ч, период полураспада t 1/2 - 25.54÷27.00 ч, время окончания процесса t 1/100 - 34.05÷36.00 ч. Доверительные интервалы для выборочных средних значений параметра скорости, периода полураспада и времени окончания процесса, установленные с применением критического значения коэффициента Стьюдента для доверительной вероятности P = 95% и числа степеней свободы ( n – 1) = 8, составляют (142.44 ± 2.28) %2 /ч, (26.34 ± 0.42) ч и (35.11 ± 0.56) ч соответственно. Полученное значение относительного стандартного отклонения для данных интервалов (2.08%) свидетельствует о приемлемой воспроизводимости интенсифицированного варианта процесса биодеструкции ИБП [Сергиенко, Бондарева, 2000].
Заключение
Проведенный факторный анализ позволил выделить три варьируемых фактора, оказывающих наибольшее влияние на процесс биодеструкции ибупрофена актинобактериями рода Rhodococcus : концентрация глюкозы, концентрация н -гексадекана и параметр кислотности среды рН. Методом прямого экспериментального поиска определены их значения, позволившие сократить продолжительность процесса биодеструкции с 10 до 2 сут.
Кинетическое моделирование результатов эксперимента на повторяемость позволило с вероятностью P = 95% получить доверительный интервал для времени завершения процесса, равный (35.11 ± 0.56) ч., а также уточнить время завершения процесса (1.5 сут.). Ключевым фактором оказалось значение кислотности среды. Стабилизация рН культуральной среды родококков кардинально изменила ход процесса: при уменьшении концентрации ибупрофена скорость биодеструкции увеличивалась, в связи с чем в кинетических уравнениях вместо 1-го использовали минус 1-ый порядок, хорошо описывающий экспериментальные данные.
Полученные результаты могут быть использованы при разработке биотехнологических способов очистки сточных вод фармацевтических предприятий от опасных для окружающей природной среды фармацевтических отходов.
Список литературы Интенсификация процесса биодеструкции ибупрофена с использованием факторного анализа и кинетического моделирования
- Сергиенко В.И., Бондарева И.Б. Математическая статистика в клинических исследованиях. М: ГЭОТАР МЕДИЦИНА, 2000. 256 с.
- Anteneh Y.S., Franco C.M.M. Whole cell actinobacteria as biocatalysts // Frontiers in Microbiology. 2019. Vol. 10. P. 77. DOI: 10.3389/fmicb.2019.00077.
- Catalogue of Strains of Regional Specialized Collection of Alkanotrophic Microorganisms. URL: http://www.iegmcol.ru/strains/index.html. (Дата обращения: 01.11.2023).
- Chopra S., Kumar D. Ibuprofen as an emerging organic contaminant in environment, distribution and re-mediation // Heliyon. 2020. Vol. 6, № 6. P. e04087. DOI: 10.1016/j.heliyon.2020.e04087.
- Girardot F. et al. Bacterial diversity on an abandoned, industrial wasteland contaminated by polychlorin-ated biphenyls, dioxins, furans and trace metals // Science of the Total Environment. 2020. Vol. 748. P. 141242. DOI: 10.1016/j.scitotenv.2020.141242.
- Ivshina I.B., Kuyukina M.S., Krivoruchko A.V. Hydrocarbon-oxidizing bacteria and their potential in eco-biotechnology and bioremediation // Microbial Resources. From Functional Existence in Nature to Applications / ed. I.B. Kurtböke. Academic Press, 2017. Р. 121–148. DOI: 10.1016/B978-0-12-804765-1.00006-0
- Ivshina I.B. et al. Drotaverine hydrochloride degradation using cyst-like dormant cells of Rhodococcus ruber // Current Microbiology. 2015. Vol. 70, № 3. P. 307–314. DOI:10.1007/s00284-014-0718-1.
- Ivshina I.B. et al. Features of diclofenac biodegradation by Rhodococcus ruber IEGM 346 // Scientific Reports. 2019. Vol. 9. P. 9159. DOI: 10.1038/s41598-019-45732-9.
- Ivshina I.B. et al. Response of Rhodococcus cerastii IEGM 1278 to toxic effect of ibuprofen // PLoS ONE. 2021. Vol. 16, № 11. P. e0260032. DOI: 10.1371/journal.pone.0260032.
- Karpenko Yu.N. et al. Chromatographic determination of drotaverine hydrochloride and kinetic model-ing of the process of its biodestruction in a R. rhodochrous culture liquid // Journal of Analytical Chemistry. 2014. Vol. 69, № 7. P. 681–685. DOI: 10.1134/S1061934814070077.
- Khrenkov A.N. et al. Chromatographic analysis of acetylsalicylic acid in Rhodococcus cultural fluids // Moscow University Chemistry Bulletin. 2020. Vol. 61, № 5. P. 309–314. DOI: 10.3103/S0027131420050053
- Patel M. et al. Pharmaceuticals of emerging concern in aquatic systems: Chemistry, occurrence, effects, and removal methods // Chemical Reviews. 2019. Vol. 119, № 6. P. 3510–3673. DOI: 10.1021/acs.chemrev.8b00299.
- Plotnikov A.N. et al. Determination of codeine phosphate in the culture fluid of Rhodococcus by high-performance liquid chromatography // Moscow University Chemistry Bulletin. 2017. Vol. 72, № 6. P.328–332. DOI: 10.3103/S0027131418010054.
- Sánchez-Aceves L. et al. Long-term exposure to environmentally relevant concentrations of ibuprofen and aluminum alters oxidative stress status on Danio rerio // Comparative Biochemistry and Physiology Part C Toxicology & Pharmacology. 2021. Vol. 248. P. 109071. DOI: 10.1016/j.cbpc.2021.109071.
- Vikhareva E.V. et al. Chromatographic determination of ibuprofen in Rhodococcus culture media and kinetic modeling of its biodegradation process // Journal of Analytical Chemistry. 2023. Vol. 78, № 2. P. 241–246. DOI: 10.1134/S1061934823010136.


