Интенсификация процесса выщелачивания с применением метода гидрохлорирования
Автор: Горланов Владимир Викторович, Харламова Татьяна Андреевна
Журнал: Горные науки и технологии @gornye-nauki-tekhnologii
Статья в выпуске: 2, 2013 года.
Бесплатный доступ
Рассмотрена возможность интенсификации процесса выщелачивания меди из окисленных руды. Экспериментально показано, что степень извлечения меди методом гидрохлорирования в условиях эксперимента составило 98,4%.
Медные руды, хлорирование, гидрохлорирование
Короткий адрес: https://sciup.org/140215712
IDR: 140215712 | УДК: 622.7(075.80)
Текст научной статьи Интенсификация процесса выщелачивания с применением метода гидрохлорирования
При действии газообразного хлора при высокой температуре (800 – 900 оС) большинство минералов вскрывается и переходит в хлоридную форму. Однако из-за большого расхода хлора метод хлорирования целесообразно применять только для комплексной переработки трудновскрываемых руд, дающих многие ценные продукты [1]. Первые успешные опыты с применением хлора по извлечению драгметалла – золота выполнил в 1862 г шведский подданный Нордстрем в химической лаборатории Екатеринбурга из песков, содержащих до 1,32 г/т золота и его работа положила начало распространению химических методов извлечения золота в Росси в начале 19 века [2].
В 1886 г. инженер Е.П.Зеленков построил на Урале первый завод химического извлечения золота с помощью хлора методом Платнера. Метод включал следующие операции: обжиг руды, хлорирование в специальных чанах, выщелачивание хлорного золота и осаждение его из растворов. Позже на Урале были построено аналогичные заводы практически во всех районах, где имелось большое количество отвалов, добытых, как правило, подземным способом.
Отмечается. что активность хлора как химического реагента проявляется в раскрытии части минералов, блокирующих дисперсное золото [3]. Процесс хлорирования производился в деревянных чанах, просмоленных внутри и имеющих двойное дно с отверстиями. Хлор получали на месте химическим способом из смеси пероксида марганца, хлорида натрия и серной кислоты. Чаны заполняли предварительно обожженной рудой и подавали в них хлор. Хлорирование продолжалось до 6-ти дней, затем в чан закачивали воду для растворения образовавшегося хлорного золота, которое затем выделяли из раствора методом вытеснения.
С целью интенсификации процесса выщелачивания эффективно применение высоких температурных режимов и повышенных давлений. Поэтому после изобретения автоклавов одним из эффективных являлся способ хлоридного выщелачивания, проводимого в автоклавах под давлением. При хлоридном автоклавном выщелачивании упорной золотосодержащей арсенопиритной руды из разрушенной кристаллической решетки золото выводится в составе хлорсодержащего комплексного соединения [4]. Реакции протекают при повышенном парциальном давлении кислорода и повышенной температуре - > 90оС.
Применение автоклавного выщелачивания позволяет снижать расход реагентов и время процесса в целом. Например [1], при выщелачивании урановых руд под давлением кислорода 7 атмосфер и температуре до 150°C достигается уменьшение расхода серной кислоты втрое (до 150 кг/т) и сокращение продолжительности процесса до 6-ти часов при сохранении степени выщелачивания урана более 90%. Однако, процесс сложен, стоимость автоклавного оборудования высока, а также необходимо соблюдать высокие требования по технике безопасности при работе с аппаратами высокого давления.
Другим из перспективных в наши дни химических способов для переработки руд считается метод щелочного окислительного выщелачивания. В институте ВНИИцветмет проведены эксперименты по извлечению золота этим методом на упорных золотосодержащих рудах месторождений Казахстана с применением гипохлорита натрия или газообразного кислорода [5]. Эксперименты проводились при концентрации щелочи от 4 до 40 г/л, отношении Ж:Т = (5-10) :1, продолжительности до 20 - 24 часов и аэрации пульпы кислородом. При такой обработке происходит вскрытие золотосодержащих сульфидов (аресенопирита и пирита) и растворение всего высвобождающегося золота с дальнейшим выделением его из хлоридных растворах осаждением или сорбцией. Имеется сообщение, что использование щелочного окислительного выщелачивания как метод предобработки золотосодержащих руд Тохтаровского месторождения перед цианидным выщелачиванием позволяет повысить степень извлечения золота с 10% до 70 - 77%. Однако, образование устойчивых растворимых соединений золота в щелочных растворах наблюдается, согласно потенциалам золота и диаграмме Пурбе, в очень узком диапазоне рН и потенциалов (рис.1 и 2), поэтому процесс нестабилен и до 15% всего золота может оставаться в кеках выщелачивания.
Кислые растворы
-1.29
Аи3+
—1,68 <1,29
Au Au+ ______ Au2' ______
I___________ -1,41
1.50
AuCl 2--AuC 14
________ 1.0 AuC14”
Щелочной раствор
Au' 017 H2AuO3~ |
Рис. 1. Потенциалы золота, В.
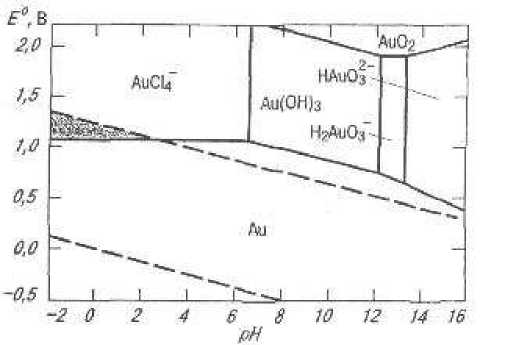
Рис. 2. Диаграмма Пурбе для системы золото-хлорид при [Au] = 10 моль/л, и [С1-]= 10-2 моль/л.
-5
Более поздними работами было показано, что хлор в момент выделения при непосредственном контакте с хлорируемым веществом более активен, чем газообразный хлор, подаваемый извне [4]. Поэтому наиболее эффективно процесс должен проходить при непосредственном получении хлора в емкости, в которой находится рудный концентрат. Такой процесс возможно реализовать при электрохимическом получении хлора в электролизерах, причем электролизер одновременно выполняет роль аппарата хлорирования. Хлор выделяется на аноде согласно реакции: Cl- - 2e ^ C12. Предварительно руду дробили до 79%-ного содержания класса 0.074 мм, в качестве электролита использовали 150 г/л NaCl, выбирали соотношение жидкого к твердому 6:1 и проводили процесс в течение не менее 2,5 часа при объемной плотности тока (3 - ?)• 10-3 А/м3. Степень извлечения Au из упорной золотосодержащей руды Родниковского месторождения при таком процессе достигала ~ 90%.
Для сульфидных минералов [5] эффективен метод электрохимического окислительного разложения в щелочной среде, который состоит в том, что кислород в систему не подается извне, а нарабатывается при анодном разложении гидроксидных ионов:
2ОН = О-2 + Н 2 О
О-2 - 2e = 0,5 О 2
Скорость выщелачивания минералов в конкретных условиях определяется конструкцией электролизера, интенсивностью наработки кислорода на единицу объема раствора, плотностью тока на аноде, гранулометрической характеристикой материала и плотностью суспензии. В оптимальных условиях электрохимического вскрытия разложилось 72..87% арсенопирита и 45...53% пирита.
В настоящее время хлорирование используют в аффинажном производстве благородных металлов, применяя смесь НС1 + C12. Этот процесс чаще называют гидрохлорированием.
Процессы гидрохлорирования, достоинство которых заключается в высокой химической активности хлора, в настоящее время используют в
ЮАР и Великобритании для переработки шламов, содержащих благородные металлы. На некоторых предприятиях (например, Карлин Майнз, США) гидрохлорирование применяется в качестве подготовительной операции перед цианированием. Кроме этого имеютмя отдельные примеры использования этого процесса и в первичной металлургии золота: на заводах “Консолидэйтен Мерчисон” (ЮАР) для переработки сурьмянистых концентратов, “Емперэ Гоулд” (Фиджи) для выщелачивания золота из теллуристой руды, на ряде заводов в Австрилии и ЮАР (применительно к переработке цинковых осадков и гравитационных концентратов), а также при обезвреживании цианидных стоков [6,7].
Однако недостатками всех предложенных до настоящего времени электрохимических методов остаются значительные затраты электроэнергии, проблема утилизации экологически опасного хлора, отсутствие надежных конструкционных материалов для изготовления оборудования, а также использование в основном для выщелачивания благородных металлов.
Целью настоящей работы является определение эффективности процесса гидрохлоридного выщелачивания меди из окисленных руд. Работа проводилась с использованием специально разработанного и изготовленного комплекса лабораторных установок, моделирующих основные стадии процесса [8]: получение хлора и раствора каустической соды из исходных веществ (поваренная соль и вода), получение раствора хлороводородной (соляной) кислоты из газообразных хлора и водорода, активирование раствора соляной кислоты (насыщение ее хлором, увеличение окислительно-восстановительного потенциала), выщелачивание целевого компонента в реакторе при перемешивании, отбор излишнего количества хлора и возвращение его в процесс.
Выщелачивание меди из окисленной руды осуществлялось в реакторе в периодическом режиме при перемешивании в стандартных условиях. Объектом исследования была окисленная руда, основными рудными минералами которой являлись малахит и азурит, а основным нерудным материалом являлся кварц.
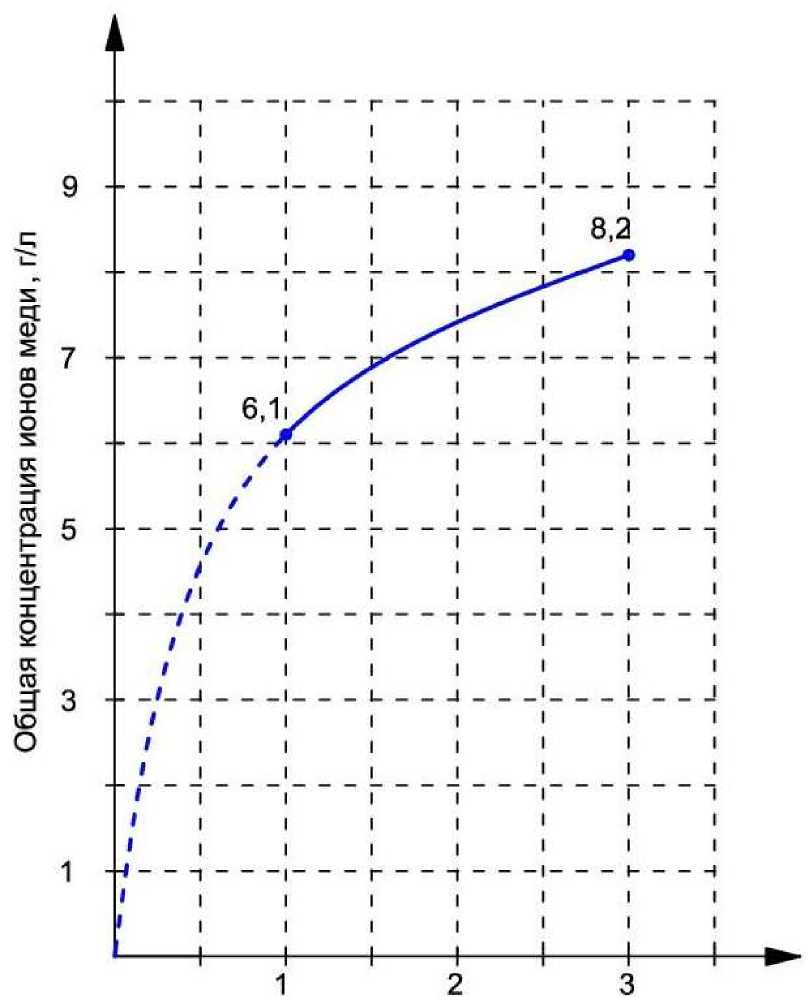
Проведено экспериментальное изучение скорости выщелачивания меди из окисленной руды крупностью - 2 мм. Анализы на содержание меди растворов выщелачивания. Выполненные по известным методикам [ 9 ] показали, что концентрация меди монотонно нарастает в первые 2 часа обработки, а затем рост ее концентрации несколько замедляется, что отражено на рис. 3.
Время, ч
Рис. 3. Зависимость общей концентрации ионов меди в растворе от времени.
Кеки после выщелачивания отмывали до нейтрального значения рН, высушивали до постоянного веса при 1200С и анализировали на содержание меди. Концентрация меди в кеках снижалась после каждого часа обработки, и степень извлечении меди составила: 94,1; 97,3 и 98,4% за 1,2 и 3 часа обработки, соответственно. Полученные зависимости изменения степени извлечения меди из руды и концентрации меди в кеках с течением времени при гидрохлоридной обработке руды с применением комплекса специального оборудования приведены на рис.4.
|
1 1 ■ |
1 -100 -I---1--- |
1 |
1 |
|||
|
0,96' |
, 1 1 |
1^— |
1 |
' 97,3 |
Г 9^,4 |
1 1 |
|
0,9 - |
-90- -V > |
94 1 1 |
1__________ 1 |
1__________________________________ 1 |
। । |
д 1 |
|
“0,8 - |
-80^- |
1 |
1 1 1 |
1 |
1 "1 |
|
|
1 |
1 |
|||||
|
СЕ |
170 2-. - |
-------------------------1---------------------------------------- 1 |
I 1 |
1 1 |
---1--- 1 |
ч 1 |
|
О. СП 0,6 " |
-„’60 §; - |
1 |
1 1— |
1 1 |
1 |
1 д || |
|
S CI ф 2 0,5 - |
1*50 г; |
1 1 |
1 1 1 |
1 1 |
1 1 1 |
1 1 г |
|
ex с; О 5 0,4 - |
I1 (X, ♦ 40 о. - |
1 1 |
1 1 1 |
1 1 -----------------1----------------------------- |
1 1 ---1--- |
1 1 ч |
|
га |
• * ф| |
1 |
1 |
1 |
1 |
1 |
|
га |
1 1 |
1 |
||||
|
о У 0,3 - |
. СП1 зЬ s* - |
■ 1 - |
t________ |
1 |
1 |
J |
|
го |
1 -О1 1 II |
1 1 |
1 1 |
1 1 |
1 1 |
|
|
0,2 - |
Г 20 й- |
1 |
1 |
1 |
||
|
1 х |
1 1 |
1 1 |
1 |
1 |
1 1 |
|
|
0,1 1 |
-10- 1 -' |
\-0.-057- |
г |
1 |
_ - - 4--- |
ч |
|
1 0 1 |
1 |
0,026 |
_____0,015 |
1 1 |
||
|
1 |
1 |
т 2 |
3 |
|||
Время, ч
Рис.4. Зависимость степени извлечения меди из руды и концентрации меди в кеках от времени (Ж:Т = 1:1).
Экспериментами, проведенными на окисленной руде крупностью -2 мм методом гидрохлоридного выщелачивания показана возможность выщелачивания меди на 98,4%. Работы в этом направлении продолжаются.
Список литературы Интенсификация процесса выщелачивания с применением метода гидрохлорирования
- Тураев Н.С. Жерин И.И. Химия и технология урана. Учеб.пособие. -М.: ЦНИИАТОМИНФОРМ. 2005. -409 с.
- Рукосуев Ю.Е. Золото и платина Урала: история добычи в конце ХIХ начале ХХ века. -Екатеринбург, 2004. -196 с.
- Парунин С.В., Куимов Д.В., Григорьев В.Д. Электрохимическое выщелачивание золотосодержащей арсенопиритной руды/Второй международный конгресс "Цветные металлы -2010". -Красноярск, 2010. -С. 319-321.
- Кушакова Л.Б. и др. Применение способа щелочного окислительного выщелачивания к переработке упорного золотосодержащего сырья/Второй международный конгресс Цветные металлы -2010. -Красноярск, 2010. -С.316-318.
- Чекушин В.С., Олейникова Н.В. Переработка золотосодержащих рудных концентратов (обзор методов)/Изв. Челябинского научного центра, 2005. -Вып. 4 (30). -С. 96-100.
- Абрамов А.А. Технология переработки и обогащения руд цветных металлов. -М.:МГГУ, 2005. -566 с.
- Букин В.И., Игумнов М.С., Сафонов В.В. Сафонов В.В. Переработка производственных отходов и вторичных сырьевых ресурсов, содержащих редкие, благородные и цветные металлы. -М.: Изд-во ООО Издательский дом Деловая столица, 2002. -224 с.
- Бахир В.М. Электрохимическая активация -2012: новые разработки и перспективы.//Водоснабжение и канализация, 2012. -Май-июнь. -С. 65.
- Семенов Ю.В., Харламова Т.А. Аналитическая химия и основы физико-химического анализа: Курс лекций по дисциплине -М.: МГГУ, 2010. -109 с.


