Интенсивность фотосинтеза и транспорт ассимилятов у Solanum tuberosum под действием 24-эпибрассинолида
Автор: Пузина Т.И., Макеева И.Ю.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Физиология, биохимия
Статья в выпуске: 1 т.57, 2022 года.
Бесплатный доступ
Брассиностероиды - уникальный класс гормонов стероидной природы. Они сочетают свойства стимуляторов роста и индукторов защитных реакций, снижающих повреждающее действие стрессоров на растительный организм, а также регулируют процессы этиоляции и синтеза других групп фитогормонов. Имеются сведения об участии брассиностероидов в экспрессии светорегулируемых фотосинтетических генов и регуляции функционирования фотосинтетического аппарата. В единичных исследованиях отмечается стимуляция поглощения СО2 и положительное влияние на продуктивность разных видов сельскохозяйственных культур. При этом практически отсутствуют данные о влиянии брассиностероидов на транспорт ассимилятов в аттрагирующие центры растений. В настоящей работе впервые показано участие 24-эпибрассинолида в регуляции транспорта ассимилятов в клубни картофеля и изменении содержания абсцизовой кислоты (АБК) в базальной зоне стебля и цитокининов в клубнях. Нашей целью было изучение влияния 24-эпибрассинолида на интенсивность процесса фотосинтеза, содержание ассимилятов в зонах стебля и выявление участия АБК и цитокининов в оттоке ассимилятов в клубни у Solanum tuberosum L . Объектом исследования служили растения картофеля сорта Скороплодный. Растения выращивали в условиях вегетационного домика в почвенной культуре. Опытные растения в фазу цветения опрыскивали 1,47½10-8 М раствором 24-эпибрассинолида (Институт биоорганической химии НАН Беларуси). Контрольные растения опрыскивали водой. Интенсивность фотосинтеза изучали с помощью радиоактивного изотопа 14С, который получали в газгольдере из смеси радиоактивной и чистой соды. В конце цветения растений интактный лист 8-го яруса экспонировали в естественных условиях в камере-прищепке, в которую вводили 10 мл 14СО2 из газгольдера. Удельная радиоактивность в атмосфере 14СО2 - 0,0334 мБк/нМ, концентрация 14СО2 - 0,6 %. Продолжительность нахождения в атмосфере 14СО2 - 10 мин. Через 48 ч после пребывания в атмосфере 14СО2 отрезки зон стебля фиксировали для оценки содержания 14С-ассимилятов. Измерение радиоактивности проводили на торцовом счетчике Т-25-БФЛ («Изотоп», Россия). Содержание сахарозы определяли рефрактометрическим методом на рефрактометре РПЛ-3 (ОАО «Киевский завод «АналитПрибор», Украина). Количество абсцизовой кислоты (АБК) в зонах стебля и содержание зеатина в клубнях определяли методом твердофазного иммуноферментного анализа. В качестве стандартных растворов фитогормонов были взяты АБК и зеатин («SERVA Electrophoresis GmbH», Германия). Содержание хлорофиллов а, b и каротиноидов определяли после экстракции 80 % раствором ацетона на фотометре КФК-3-01 (АО «ЗОМЗ», Россия). Толщину феллемы (пробки) измеряли на прижизненных поперечных срезах в средней части клубня с помощью окулярного микрометра на микроскопе Биолам («ЛОМО», Россия). Опрыскивание растений картофеля в конце цветения раствором 24-эпибрассинолида увеличило интенсивность ассимиляции 14СО2 на 23 % (р £ 0,05). В результате листья 8-го яруса, получившие 14СО2, содержали больше сахарозы по сравнению с контролем. Показано, что обработка растений 24-эпибрассинолидом приводила к повышению интенсивности ассимиляции 14СО2 и содержания сахарозы. Отмечено увеличение содержания в листьях хлорофилла а, b и каротиноидов. Выявлены различия в содержании сахарозы и 14С-ассимилятов в зонах стебля. В базальной зоне их было меньше, чем в средней. В опытном варианте увеличивался градиент 14С-ассимилятов и сахарозы между зонами стебля, что может свидетельствовать об усилении их оттока в клубни. Это происходило на фоне повышения в базальной зоне количества эндогенной абсцизовой кислоты, которая способствует разгрузке флоэмных окончаний. Под влиянием эпибрассинолида градиент АБК между зонами составил 41 % против 26 % в контроле (р £ 0,05). Выявлено увеличение содержания цитокининов, обладающих аттрагирующим эффектом, в клубнях в варианте с 24-эпибрассинолидом. Изученный брассиностероид повысил продуктивность растений картофеля на 25 % (р £ 0,05) в условиях почвенной культуры, а также стимулировал образование феллемы (пробки) в клубнях. Полученные данные позволяют заключить, что 24-эпибрассинолид регулирует интенсивность процесса фотосинтеза, а также отток ассимилятов в формирующиеся клубни через участие АБК в создании градиента ассимилятов в зонах стебля и увеличение количества цитокининов в клубнях, что в конечном итоге сказывается на продуктивности растений картофеля.
24-эпибрассинолид, фотосинтез, пигменты, сахароза, 14с-ассимиляты, абсцизовая кислота, цитокинины, зоны стебля, solanum tuberosum
Короткий адрес: https://sciup.org/142234457
IDR: 142234457 | УДК: 633.49:581.132:581.134.8:577.175.1
Текст научной статьи Интенсивность фотосинтеза и транспорт ассимилятов у Solanum tuberosum под действием 24-эпибрассинолида
Брассиностероиды — уникальный класс гормонов стероидной природы. Они обладают широкой функциональной активностью, сочетая в себе свойства стимуляторов роста (1, 2) и индукторов защитных реакций, снижающих повреждающее действие стрессоров на растительный организм (35), а также регулируют процессы этиоляции (6-8) и синтеза других групп фитогормонов (9). Имеются сведения об участии брассиностероидов в экспрессии светорегулируемых фотосинтетических генов (10) и регуляции функционирования фотосинтетического аппарата (11). В частности, показано значительное увеличение содержания хлорофиллов a, b и каротиноидов за счет активации ферментов, участвующих в биосинтезе хлорофиллов (10). В то же время в исследованиях, проведенных на проростках кукурузы (12) и растениях рододендрона (5), отмечается незначительное действие эпибрассинолида на содержание пигментов.
Установлено положительное влияние брассиностероидов на повышение фотохимической эффективности фотосистемы II (5, 10, 13), о которой судят в основном по параметрам флуоресценции хлорофилла. В некоторых работах имеются данные об активации ферментов цикла Кальвина, карбоангидразы и Рубиско (RuBisCO) (10, 13-15). По мнению Е.О. Фединой (16), эффект гормона в отношении активность Рубиско обусловлен редукцией фосфорилирования его субъединиц по тирозину.
В единичных исследованиях показана стимуляция поглощения СО 2 при обработке растений эпибрассинолидом (5, 15). Такой эффект авторы связывают с улучшением устьичной проводимости. Установлено положительное действие брассиностероидов на продуктивность разных видов сельскохозяйственных культур (17). При этом в литературе практически отсутствуют сведения о влиянии фитогормонов стероидной природы на транспорт ассимилятов в растениях. C. Wu с соавт. (18) в работе на трансгенных растениях риса с усиленным синтезом брассиностероидов выявили увеличение оттока ассимилятов в недоразвитые зерновки верхней части соцветия. Отмечается также участие брассинов в контроле транспорта сахарозы в ягоды винограда (19).
В настоящей работе впервые показано участие 24-эпибрассинолида в регуляции транспорта ассимилятов в клубни картофеля через изменение содержания абсцизовой кислоты (АБК) в базальной зоне стебля и цитокининов в клубнях.
Нашей целью было изучение влияния 24-эпибрассинолида на интенсивность процесса фотосинтеза, содержание ассимилятов в зонах стебля и выявление участия АБК и цитокининов в оттоке ассимилятов в клубни картофеля .
Методика . Растения картофеля ( Solanum tuberosum L.) сорта Скороплодный (селекция ФИЦ картофеля им. А.Г. Лорха (Россия) выращивали в условиях вегетационного домика (агробиостанция Орловского государственного университета им. И.С. Тургенева, 2018-2019 годы) в почвенной культуре. Почва — серая лесная среднесуглинистая. В период закладки опыта вносили оптимальные для картофеля количества азота, фосфора и калия — соответственно 230, 70, 310 мг/кг почвы. В сосуде с 10 кг почвы выращивали одно растение, влажность поддерживали на уровне 60 % от полной влагоемкости.
В опыте растения в фазу цветения опрыскивали 1,47*10 - 8 М раствором 24-эпибрассинолида (Институт биоорганической химии НАН Беларуси); контрольные растения опрыскивали водой.
В конце цветения для анализов отбирали средние пробы листьев 8-го яруса и зон стебля — средней (между листьями 7-8-го яруса) и базальной (между листьями 1-2-го яруса) длиной 7 см; в конце вегетации — клубней.
Интенсивность фотосинтеза изучали с помощью радиоактивного изотопа 14С (20), который получали в лабораторном газгольдере из смеси 4 мг радиоактивного и 2525 мг нерадиоактивного бикарбоната натрия. В конце цветения растений интактный лист 8-го яруса экспонировали в естественных условиях (в 1100 ч при температуре 17-19 ° С) в камере-прищепке, в которую вводили 10 мл 14СО 2 из газгольдера с помощью медицинского шприца; влажность воздуха — 49 %, освещенность — 340 мкмоль фотонов • м - 2 • с - 1. Удельная радиоактивность в атмосфере 14СО 2 — 0,0334 мБк/нМ, концентрация 14СО 2 — 0,6 %. Продолжительность нахождения в атмосфере 14СО 2 — 10 мин. Для определения скорости фотосинтеза у листа, получившего 14СО 2 , отщепляли крайнюю долю и фиксировали ее 30 мин при 105 ° С, затем высушивали при 60 ° С. Для оценки содержания 14С-ассимилятов отрезки зон стебля фиксировали через 48 ч после пребывания в атмосфере 14СО 2 . Измерение радиоактивности проводили на торцовом счетчике Т-25-БФЛ («Изотоп», Россия).
Содержание сахарозы оценивали рефрактометрическим методом на рефрактометре РПЛ-3 (ОАО «Киевский завод «АналитПрибор», Украина), учитывая показатель преломления света клеточным соком. Количество абсцизовой кислоты (АБК) в зонах стебля и содержание зеатина в клубнях определяли методом твердофазного иммуноферментного анализа (21). После сорбирования белкового конъюгата гормона в лунки полистиролового планшета вносили сыворотку с антителами, а затем экспериментальные образцы. Количество антител, специфически связанных с белковым конъюгатом гормона, определяли с помощью бараньих антител против иммуноглобулинов кролика, меченых пероксидазой. Для оценки активности связавшейся пероксидазы использовали ортофенилендиамин. Интенсивность хромофорного ответа определяли на микрофотометре Dombi plate (Латвия) при X = 492 нм. Для анализов использовали реактивы фирмы «Уралинвест» (Россия). В качестве стандартных растворов фитогормонов были взяты АБК и зеатин («SERVA Electrophoresis GmbH», Германия).
Пигменты экстрагировали из листьев 80 % раствором ацетона. Содержание хлорофиллов а, b и каротиноидов определяли на фотометре КФК-3-01 (АО «ЗОМЗ», Россия) (22).
Толщину феллемы (пробки) измеряли на прижизненных поперечных срезах в средней части клубня с помощью окулярного микрометра МОВ-1-15х на микроскопе Биолам («ЛОМО», Россия).
Статистическую обработку экспериментальных данных проводили в программе Microsoft Ехсе1 2010. На рисунках и в таблице представлены средние арифметические значения ( M) из пяти биологических повторностей и их стандартные ошибки (±SEM). Аналитическая повторность 5-кратная. Достоверность результатов оценивали с помощью t -критерия Стьюдента, считая достоверными различия при уровне доверительной вероятности выше 0,95.
Результаты . Опрыскивание растений картофеля в конце цветения раствором 24-эпибрассинолида увеличило интенсивность ассимиляции 14СО 2 (рис. 1) на 23 % (р < 0,05). В результате листья 8-го яруса, получившие 14СО 2, содержали на 34 % больше сахарозы по сравнению с контролем (р < 0,05).
Повышение интенсивности фотосинтеза происходило на фоне увеличения содержания пигментов в листьях (рис. 2). Содержание хлорофилла а и b возросло на 25 %, тогда как каротиноидов — на 14 % (р < 0,05). В работе И.Ф. Головацкой с соавт. (11) усиление фотосинтеза у растений-регенерантов картофеля при обработке корней 10 нМ раствором эпибрас-синолида связывается со значительным увеличением ассимиляционного числа. Не исключено, что действие брассиностероидов на интенсивность фотосинтеза могло быть обусловлено их влиянием на гормональный баланс в растении. Так, показано увеличение содержания цитокининов у растений пшеницы под влиянием обработки 0,4 мкМ раствором эпибрассинолида (9). Известно, что цитокинины повышают интенсивность фотосинтеза (23).
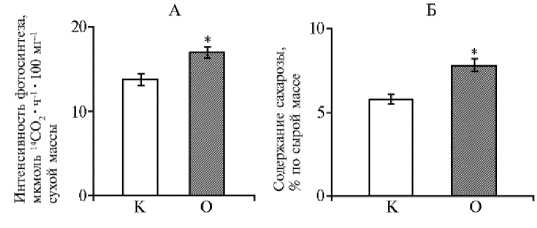
Рис. 1. Интенсивность фотосинтеза (А) и содержание сахарозы (Б) в листьях у картофеля ( Solanum tuberosum L.) сорта Скороплодный в контроле (К) и при опрыскивании растений 1,47x10 - 8 М раствором 24-эпибрассинолида (О) в фазу цветения ( M ±SEM, n = 5, N = 5) .
* Различия с контролем статистически значимы при р < 0,05.
Для формирования хозяйственно ценных органов растений важно не только образование ассимилятов в процессе фотосинтеза, но и их направленный транспорт (24). Как известно, распределение продуктов фотосинтеза в аттрагирующие центры определяется донорно-акцепторными связями. Мы изучили распределение 14С-ассимилятов и сахарозы — основной транспортной формы ассимилятов в средней и базальной зонах стебля картофеля. Были обнаружены различия в содержании сахарозы в зонах стебля через 48 ч после пребывания листа в атмосфере 14СО 2 (рис. 3). Так, в базальной зоне сахарозы было на 24 % меньше, чем в средней (р < 0,05). Величина градиента сахарозы между средней и базальной зоной стебля возросла под влиянием 24-эпибрассинолида до 44 % (р < 0,05).
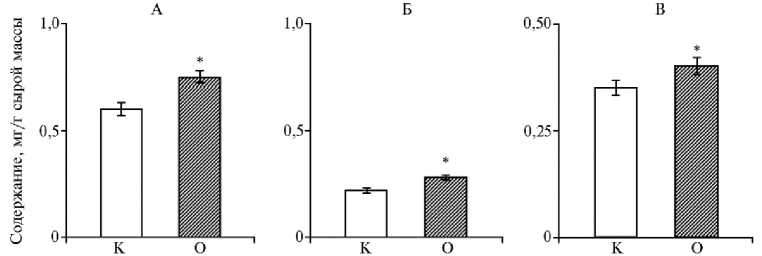
Рис. 2. Содержание хлорофилла а (А) , хлорофилла b (Б) и каротиноидов (В) в листьях у картофеля ( Solanum tuberosum L.) сорта Скороплодный в контроле (К) и при опрыскивании растений 1,47x10 - 8 М раствором 24-эпибрассинолида (О) в фазу цветения ( M ±SEM, n = 5, N = 5) .
* Различия с контролем статистически значимы при р < 0,05.
Уменьшение содержания сахарозы в базальной зоне могло свиде- тельствовать об усилении ее оттока. Распределения 14С-ассимилятов по зонам стебля оказалось аналогично градиентам сахарозы в контроле и в варианте с 24-эпибрассинолидом. То есть в стебле был выявлен базипетальный градиент сахарозы и 14С-ассимилятов.
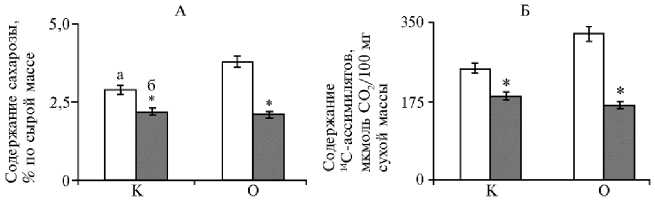
Рис. 3. Содержание сахарозы (А) и 14С-ассимилятов (Б) в средней (а) и базальной (б) зонах стебля у картофеля ( Solanum tuberosum L.) сорта Скороплодный в контроле (К) и при опрыскивании растений 1,47-10 - 8 М раствором 24-эпибрассинолида (О) в фазу цветения ( M ±SEM, n = 5, N = 5) .
* Различия с контролем статистически значимы при р < 0,05.
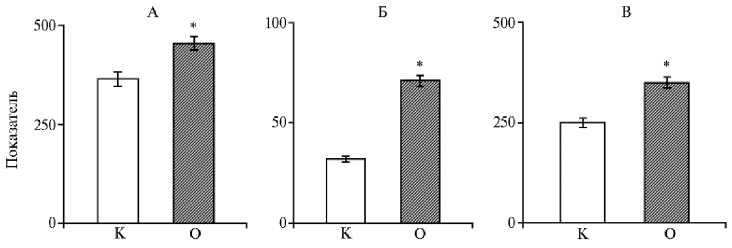
В литературе дискутируется вопрос о механизме транспорта ассимилятов. При этом уделяется внимание и фитогормонам. Прежде всего рассматривается их роль в аттрагирующих центрах (25). Меньшее внимание уделяется стеблю, хотя именно там происходит перераспределение оттока ассимилятов к разным органам. Отсутствуют сведения о влиянии брассино-стероидов на содержание фитогормонов в разных зонах стебля. В нашем эксперименте после цветения растений картофеля, когда шел интенсивный рост молодых клубней, в базальной зоне стебля накапливалась абсцизовая кислота, причем в большей степени в варианте с 24-эпибрассинолидом (рис. 4).
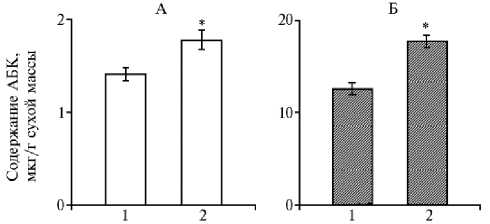
Рис. 4. Содержание абсцизовой кислоты (АБК) в средней (1) и базальной (2) зонах стебля у картофеля ( Solanum tuberosum L.) сорта Скороплодный в контроле (А) и при опрыскивании растений 1,47x10 — 8 М раствором 24-эпибрассинолида (Б) в фазу цветения ( M ±SEM, n = 5, N = 5) .
* Различия с контролем статистически значимы при р < 0,05.
Так, в контроле содержание эндогенной АБК в базальной зоне было на 26 % выше, чем в средней, а в варианте с 24-эпибрассинолидом — выше на 41 % (р < 0,05). В результате градиент содержания АБК между средней и базальной зоной почти в 2 раза превышал таковой в контроле.
По данным T.H. Thomas (26), абсцизовая кислота способствует разгрузке флоэмных окончаний и, как следствие, стимулирует процесс накопления ассимилятов в запасающем органе (27). Надо заметить, что образованию положительного градиента сахарозы в стебле во второй половине вегетации растений способствует накопление в базальной зоне не только АБК, но и ауксинов. Такие данные были получены нами ранее (28). Согласно гипотезе, выдвинутой E. Munch (29) и в настоящее время получившей при- знание, градиент осмотического давления служит движущей силой направленного транспорта ассимилятов.
Усиление оттока ассимилятов в растущие клубни под влиянием 24-эпибрассинолида повысило на 25 % (р < 0,05) продуктивность растений картофеля, выращенных в почвенной культуре (рис. 5). Увеличение массы клубней в опытном варианте, возможно, было связано не только с усилением транспорта ассимилятов, но и с содержанием в клубнях цитокининов, которые обладают, как известно, аттрагирующим эффектом. При обогащении растений 24-брассиностероидом наблюдалось значительное (более чем в 2 раза) увеличение содержания цитокинина зеатина в клубнях (см. рис. 5).
5. Масса клубней (г/куст) (А) , содержание зеатина (нг/г сухой массы) (Б) и толщина фе-
Рис.
леммы (мкм) (В) в клубнях картофеля ( Solanum tuberosum L.) сорта Скороплодный в контроле (К) и при опрыскивании растений 1,47'10 - 8 М раствором 24-эпибрассинолида (О) в фазу цветения ( M ±SEM, n = 5, N = 5) .
* Различия с контролем статистически значимы при р < 0,05.
Для клубней картофеля большое значение имеет формирование вторичной покровной ткани перидермы, прежде всего феллемы (пробки), регулирующей газообмен и защиту от патогенов. Обработка растений 24-эпи-брассинолидом увеличила толщину феллемы на 40 % по сравнению с контролем (р < 0,05). По-видимому, в этом случае влияние оказало увеличение содержания в клубнях цитокинонов, которые регулируют деление клеток феллогена — вторичной образовательной ткани, откладывающей снаружи клубня слои феллемы.
Таким образом, опрыскивание растений картофеля сорта Скороплодный 1,4?х10 " 8 М раствором 24-эпибрассинолида в фазу цветения приводило к интенсификации усвоения 14СО 2 и повышению содержания пигментов в листьях. В конце цветения на фоне увеличения содержания абсцизовой кислоты (АБК) в базальной зоне стебля по сравнению со средней зоной уменьшалось количество С14-ассимилятов и сахарозы, что свидетельствует об участии АБК в разгрузке флоэмных окончаний. Одновременно приток ассимилятов в клубни под влиянием эпибрассинолида был обусловлен увеличением содержания в них цитокининов. Полученные данные позволяют заключить, что 24-эпибрассинолид регулирует интенсивность процесса фотосинтеза, а также отток ассимилятов в формирующиеся клубни через участие АБК в создании градиента ассимилятов в зонах стебля и увеличение содержания цитокининов в клубнях, что в конечном итоге сказывается на продуктивности растений картофеля.
Список литературы Интенсивность фотосинтеза и транспорт ассимилятов у Solanum tuberosum под действием 24-эпибрассинолида
- Yin W., Dong N., Niu M., Zhang X., Li L., Liu J., Liu B., Tong H. Brassinosteroid-regulated plant growth and development and gene expression in soybean. The Crop Journal, 2019, 7(3): 411-418 (doi: 10.1016/j.cj.2018.10.003).
- Castorina G., Consonni G. The role of brassinosteroids in controlling plant height in Poaceae: a genetic perspective. International Journal of Molecular Sciences, 2020, 21(4): 1191 (doi: 10.3390/ijms21041191).
- Özdemir F., Bor M., Demiral T., Türkan 1. Effects of 24-epibrassinolide on seed germination, seedling growth, lipid peroxidation, proline content and antioxidative system of rice (Oryza sativa L.) under salinity stress. Plant Growth Regulation, 2004, 42: 203-211 (doi: 10.1023/B:GR0W.0000026509.25995.13).
- Nolan T., Chen J., Yin Y. Cross-talk of Brassinosteroid signaling in controlling growth and stress responses. Biochem. J, 2017, 474(16): 2641-2661 (doi: 10.1042/BCJ20160633).
- Cai Y.-F., Peng L.-C., Li S.-F., Zhang L., Xie W.-J., Song J., Wang J.-H. 24-epibrassionlide improves photosynthetic response of Rhododendron delavayi to drought. Nordic Journal of Botany, 2020, 38(10) (doi: 10.1111/njb.02900).
- Bai M.-Y., Shang J.-X., Oh E., Fan M., Bai Y., Zentella R., Sun T.-P., Wang Z.-Y. Brassinosteroid, gibberellin and phytochrome impinge on a common transcription module in Arabidop-sis. Nat. Cell Biol, 2012, 14: 810-817 (doi: 10.1038/ncb2546).
- Yu X., Li L., Zola J., Aluru M., Ye H., Foudree A., Guo H., Anderson S., Aluru S., Liu P., Rodermel S., Yin Y. A brassinosteroid transcriptional network revealed by genome-wide identification of BESI target genes in Arabidopsis thaliana. Plant J., 2011, 65(4): 634-646 (doi: 10.1111/j.1365-313X.2010.04449.x).
- Liang T., Mei S., Shi C., Yang Y., Peng Y., Ma L., Wang F., Li X., Huang X., Yin Y., Liu H. UVR8 interacts with BES1 and BIM1 to regulate transcription and photomorphogenesis in Arabidopsis. Dev. Cell., 2018, 44(4): 512-523 (doi: 10.1016/j.devcel.2017.12.028).
- Авальбаев А.М., Юлдашев Р.А., Фатхутдинова Р.А., Урусов Ф.А., Сафутдинова Ю.В., Ша-кирова Ф.М. Влияние 24-эпибрассинолида на гормональный статус растений пшеницы при действии хлорида натрия. Прикладная биохимия и микробиология, 2010, 46(1): 109-112.
- Hola D. Brassinosteroids and photosynthesis. In: Brassinosteroids: a class of plant hormone /S. Hayat, A. Ahmad (eds.). Springer, Dordrecht, 2011: 143-192 (doi: 10.1007/978-94-007-0189-2_6).
- Головацкая И.Ф., Бендер О. Г., Ефимова М. В., Бойко Е.В., Малофий М.К., Мурган О.К., Плюснин И.Н. Роль экзогенных стероидных фитогормонов в регуляции функционирования фотосинтетического аппарата растений. Мат. Всерос. науч.-практ. конф. «Актуальные проблемы картофелеводства: фундаментальные и прикладные аспекты». Томск, 2018: 103-107.
- Gao Y., Jiang T., Xiang Y., He X., Zhang Z., Wen S., Zhang J. Epi-brassinolide positively affects chlorophyll content and dark-reaction enzymes of maize seedlings. Phyton-International Journal of Experimental Botany, 2021, 90(5): 1465-1476 (doi: 10.32604/phyton.2021.014811).
- Xia X.-J., Huang L.-F., Zhou Y.-H., Mao W.-H., Shi K., Wu J.-X., Asami T., Chen, Z., Yu J.Q. Brassinosteroids promote photosynthesis and growth by enhancing activation of Rubisco and expression of photosynthetic genes in Cucumis sativus. Planta, 2009, 230: 1185-1196 (doi: 10.1007/s00425-009-1016-1).
- Yu J.Q., Huang L.F., Hu W.H., Zhou Y.H., Mao W.H., Ye S.F., Nogues S. A role of brassinosteroids in the regulation of photosynthesis in Cucumis sativas. Journal of Experimental Botan, 2004, 55(399): 1135-1143 (doi: 10.1093/jxb/erh124).
- Ogweno J., Song X., Shi K., Hu W., Mao W., Zhou Y., Yu J., Nogues S. Brassinosteroids alleviate heat-induced inhibition of photosynthesis by increasing carboxylation efficiency and enhancing antioxidant systems in Lycopersicon esculentum. Journal of Plant Growth Regulation, 2007, 27: 4957 (doi: 10.1007/s00344-007-9030-7).
- Федина Е.О. Влияние 24-эпибрассинолида на фосфорилирование белков по тирозину у гороха после действия засоления. Физиология растений, 2013, 60(3): 360-368 (doi: 10.7868/S0015330313020085).
- Vardhini V., Anuradha S., Rao S.S.R. Brassinosteroids — new class of plant hormones with potential to improve crop productivity. Indian Journal of Plant Physiology, 2006, 11: 1-12.
- Wu C., Trieu A., Radhakrishnan P., Kwok S.F., Harris S., Zhang K., Wang J., Wan J., Zhai H., Takatsuto S., Matsumoto S., Fujioka S., Feldmann K.A., Pennell R.I. Brassinosteroids regulate grain filling in rice. The Plant Cell, 2008, 20(8): 2130-2145 (doi: 10.1105/tpc.107.055087).
- Xu F., Xi Z.-M., Zhang H., Zhang C.-J., Zhang Z.-W. Brassinosteroids are involved in controlling sugar unloading in Vitis vinifera «Cabernet Sauvignon» berries during veraison. Plant Physiology and Biochemistry, 2015, 94: 197-208 (doi: 10.1016/j.plaphy.2015.06.005).
- Петрухин Ю.А., Константинова Л.М. Фотосинтетический метаболизм углерода в листьях хлорофитума. Биологические науки, 1982, 7: 95-99.
- Веселов С.Ю., Кудоярова Г.Р. Принципы иммуноанализа применительно к определению фитогормонов. В сб.: Иммуноферментный анализ регуляторов роста растений. Применение в физиологии растений и экологии. Уфа, 1990: 8-22.
- Гавриленко В.Ф., Жигалова Т.В. Большой практикум по фотосинтезу. М., 2003.
- Müller M., Munne-Bosch S. Hormonal impact on photosynthesis and photoprotection in plants. Plant Physiology, 185(4): 1500-1522 (doi: 10.1093/plphys/kiaa119).
- Чиков В.И. Эволюция представлений о связи фотосинтеза с продуктивностью растений. Физиология растений, 2008, 55(1): 140-154.
- Роньжина Е.С., Мокроносов А.Т. Донорно-акцепторные отношения и участие цитокини-нов в регуляции транспорта и распределения органических веществ в растениях. Физиология растений, 1994, 41(3): 448-459.
- Thomas T.H. Hormonal control of assimilate movement and compartmentation. In: Plant growth sub-stances /M. Bopp (ed). Springer-Verlag, Berlin, 1985: 350-359 (doi: 10.1007/978-3-642-71018-6_45).
- Заякин В.В., Нам И.Я. Стимуляция абсцизовой кислотой поступления ассимилятов из оболочки семени к развивающемуся зародышу люпина (Lupinus luteus L.). Физиология растений, 1998, 45(1): 100-107.
- Пузина Т.И., Кириллова И.Г., Якушкина Н.И. Динамика индолилуксусной кислоты в органах картофеля на разных этапах онтогенеза и ее роль в регуляции роста клубня. Известия Академии Наук. Серия биологическая, 2000, 2: 170-177.
- Münch E. Die Stoffbewegungen in der Pflanze. Jena, Verlag von Gustav Fischer, 1930.


