Интенсивность хемолюминесценции, состояние антиоксидантной системы и окислительная модификация белков плазмы крови при развитии рецидива рака яичников
Автор: Горошинская И.А., Неродо Г.А., Сурикова Е.И., Качесова П.С., Внуков В.В., Шалашная Е.В., Нескубина И.В., Немашкалова Л.А., Максимова Н.А., Сергеева М.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 (58), 2013 года.
Бесплатный доступ
У 61 больной раком яичников (цистаденокарцинома) III–IV стадий в состоянии ремиссии и с локальным рецидивом исследованы в плазме крови интенсивность хемилюминесценции, состояние ряда звеньев антиоксидантной системы (активность каталазы, церулоплазмина) и уровень окислительной модификации белков общепринятыми спектрофотометрическими методами. Проанализирована динамика изученных показателей в крови больных с рецидивом в зависимости от интенсивности кровотока в рецидивной опухоли. Обнаружено достоверное изменение активности некоторых звеньев антиоксидантной системы, усиление хемилюминесценции плазмы крови. Показано увеличение степени окисленности белковых молекул, наиболее выраженное для продуктов основного характера (530 нм). По мере прогрессирования онкологического процесса при формировании рецидивной опухоли, усилении ее васкуляризации и увеличении скорости кровотока наблюдается противоположно направленная динамика уровня карбонильных производных нейтрального и основного характера (370 и 530 нм).
Рецидив рака яичников, васкуляризация, антиоксидантная система, хемилюминесценция, окислительная модификация белков
Короткий адрес: https://sciup.org/14056350
IDR: 14056350 | УДК: 612.015:618.11-006.6-036.87
Текст научной статьи Интенсивность хемолюминесценции, состояние антиоксидантной системы и окислительная модификация белков плазмы крови при развитии рецидива рака яичников
Согласно современным представлениям, развитие и прогрессирование неоплазмы связано с усилением свободнорадикальных реакций, приводящих к окислительному повреждению различных биомолекул, в первую очередь белков [2, 13]. В отличие от продуктов пероксидации липидов, карбонильные производные белков плазмы крови гораздо стабильнее, более специфичны, что делает их удобным маркером интенсивности окислительного стресса и открывает возможность использования в диагностике и прогнозировании развития патологии [4, 12].
Рак яичников (РЯ) по-прежнему остается актуальной проблемой здравоохранения. На фоне про- водимого лечения РЯ является опухолью, склонной к рецидивированию в 20–30 % случаев. Несмотря на проводимую адъювантную терапию, даже при I–II стадиях рака яичников 25–30 % больных погибают в дальнейшем от прогрессирования опухолевого процесса [8]. Это указывает на актуальность изучения факторов, сопровождающих течение заболевания, а также обусловливает необходимость исследования механизмов рецидивирования и прогрессирования данной патологии.
Целью нашей работы было исследование окислительного потенциала плазмы крови и особенностей окислительной модификации белков плазмы крови больных раком яичников в состоянии ремиссии и при формировании рецидивной опухоли.
Материал и методы
В исследование была включена 61 больная раком яичников III–IV стадий (средний возраст – 54,2 ± 3,7 года) с серозной цистаденокарциномой. Все больные после неоадъювантной химиотерапии были прооперированы в объеме надвлагалищной ампутации матки с придатками с резекцией большого сальника и получили 6 курсов адъювантной химиотерапии, у всех была достигнута полная клиническая ремиссия. В процессе дальнейшего наблюдения у 50 больных в сроки от 11 до 24 мес появился локальный рецидив в полости малого таза, 11 – продолжали наблюдаться без рецидива. В стандартных режимах настройки ультразвукового сканера «IU 22 PHILIPS» и согласно разработанной в ФГБУ «РНИОИ» методики определения внутри-опухолевых параметров артериального кровотока по максимальным артериальным скоростям оценивали интенсивность васкуляризации и скорость кровотока в рецидивных опухолях в контрольном допплеровском объеме [9]. По результатам УЗ-мониторинга среди больных с рецидивом у 10 женщин была аваскулярная рецидивная опухоль, у 20 в сосудах рецидивной опухоли регистрировали гиперинтенсивный кровоток.
В плазме крови больных оценивали светосум-му быстрой вспышки перекись-индуцированной люминолзависимой хемилюминесценции (ХЛ), отражающей содержание в системе супероксид– анион радикала и гидроксильного радикала [10]. Состояние антиокислительной системы плазмы крови оценивали по активности белкового антиоксиданта плазмы церулоплазмина и активности антиоксидантного фермента каталазы [5, 6]. Интенсивность окислительной модификации белков (ОМБ) плазмы крови оценивали по содержанию карбонильных производных аминокислотных остатков. Индуцированную ОМБ стимулировали реактивом Фентона. Продукты реакции регистрировали спектрофотометрически при λ=370, 430 и 530 нм [3]. Контрольную группу составили 30 здоровых женщин без онкологической и гинекологической патологии (средний возраст – 56,3 ± ± 4,8 года).
Статистическую обработку результатов проводили с использованием пакета программ Statistika 6.0, используя критерии Стьюдента и Вилкоксона– Манна–Уитни. Различия считали статистически достоверными при p<0,05 или имеющими тенденцию к достоверности при 0,1>p>0,05.
Результаты и обсуждение
В результате исследования выявлены значительные изменения интенсивности окислительных процессов в плазме крови больных раком яичников (таблица). Во всех группах светосумма ХЛ плазмы крови значительно превышала значение в контрольной группе – в 2,1 раза (p<0,001) в группе с ремиссией и в 1,9 раза (p<0,001) в группе с рецидивом. При этом у больных с гиперинтенсивным кровотоком в рецидивной опухоли светосумма ХЛ была на 43,0 выше, чем у больных с аваскулярным рецидивом (p<0,05).
У больных в ремиссии и с рецидивом отмечено усиление активности каталазы на 34,9–41,3 % (p<0,01) по сравнению с контролем. Наиболее значительное увеличение активности наблюдалось у больных с гиперинтенсивным кровотоком в рецидивной опухоли – на 54,6 % выше уровня контроля и на 29,1 % выше, чем у больных с аваскулярным рецидивом. В противоположность этому достоверные изменения активности церулоплазмина наблюдали только у больных с аваскулярным рецидивом.
Несмотря на значительное усиление окислительного потенциала плазмы крови у больных раком яичников как в состоянии ремиссии, так и с рецидивом, содержание продуктов спонтанной ОМБ, регистрируемых при 370 и 430 нм, достоверно не отличалось от значений у здоровых женщин. При этом у больных в ремиссии достоверно увеличивалось содержание карбонильных производных при 530 нм – на 74,4 % по сравнению с контроль- ным уровнем. У больных с рецидивом отмечалось достоверное увеличение уровня карбонильных производных, регистрируемых при 370 нм, – на 30,4 % и одновременно достоверное снижение уровня производных, регистрируемых при 530 нм, – на 56,6 % по сравнению со значениями в группе с ремиссией. Наиболее выраженные изменения этих показателей были отмечены в подгруппе больных с аваскулярным рецидивом.
Более значительные изменения были выявлены нами при анализе динамики интенсивности индуцированной (металлкатализируемой) ОМБ. В группах с ремиссией и с рецидивом содержание карбониль- ных производных, регистрируемых при 370 нм, было достоверно ниже по сравнению с контрольной группой. Уровень продуктов ОМБ, регистрируемых при 430 нм, изменялся только у больных с рецидивом – возрастал на 21,0 % по сравнению с уровнем в контроле и на 31,4 % по сравнению с уровнем в группе с ремиссией. Наиболее выраженные изменения были отмечены при 530 нм, содержание карбонильных производных возрастало в группе с ремиссией на 46,6 %, в группе с рецидивом – на 27,3 %. Более значительные изменения содержания карбонильных производных были отмечены в подгруппе больных с гиперинтенсивным кровотоком.
Таблица
Интенсивность окислительных процессов в плазме крови больных раком яичников
|
Группы |
Окислительная модификация белка, 370 нм |
Окислительная модификация белка, 430 нм |
Окислительная модификация белка, 530 нм |
Светосумма хемилюминесценции, имп./6 с |
Каталаза, мкМ Н2О2/ мин |
Церулоплазмин, мкМ/л |
|||
|
Спонтанная ОМБ, мкМ/мг белка |
Индуцированная ОМБ, мкМ/мг белка |
Спонтанная ОМБ, усл. ед./мг белка |
Индуцированная ОМБ, усл. ед./мг белка |
Спонтанная ОМБ, усл. ед./мг белка |
Индуцированная ОМБ, усл. ед./мг белка |
||||
|
Контрольная группа (n=30) |
28,11 ± 2,23 |
947,97 ± 48,57 |
0,39 ± 0,044 |
9,84 ± 0,91 |
0,082 ± 0,01 |
2,64 ± 0,22 |
3247,4 ± 245,2 |
34,4 ± 2,8 |
1,38 ± 0,09 |
|
Ремиссия (n=11) |
23,31 ± 2,06 |
679,4 ± 58,6 p1<0,01 |
0,474 ± 0,034 |
9,06 ± 0,79 |
0,143 ± 0,022 p1<0,05 |
3,87 ± 0,36 p1<0,01 |
6975,7 ± 885,9 p1<0,001 |
46,4 ± 3,2 p1<0,01 |
1,36 ± 0,16 |
|
Рецидив (n=50) |
30,39 ± 2,54 p2<0,05 |
782,8 ± 38,7 p1<0,01 |
0,376 ± 0,033 |
11,91 ± 0,46 p1<0,05 p2<0,01 |
0,062 ± 0,007 p2<0,001 |
3,36 ± 0,30 0,1>p1>0,05 |
6292,3 ± 902,5 p1<0,001 |
48,6 ± 3,3 p1<0,01 |
1,64 ± 0,10 0,1>p1>0,05 |
|
Рецидив аваску-лярный (n=10) |
38,13 ± 3,13 p1<0,05 p2<0,001 |
774,9 ± 45,69 p1<0,05 |
0,503 ± 0,035 0,1>p1>0,05 |
9,61 ± 0,58 |
0,097 ± 0,008 p2<0,01 |
3,14 ± 0,47 |
5138,5 ± 500,1 p1<0,01 0,1>p2>0,05 |
41,2 ± 3,1 |
1,70 ± 0,08 p1<0,05 0,1>p2>0,05 |
|
Гипер-интенсивный кровоток в рецидивной опухоли (n=20) |
32,02 ± 2,73 p2<0,05 |
782,5 ± 56,1 p1<0,05 |
0,469 ± 0,04 |
12,61 ± 0,76 p1<0,05 p2<0,01 p3<0,01 |
0,109 ± 0,012 0,1>p1>0,05 |
3,48 ± 0,31 p1<0,05 |
7348,5 ± 891,8 p1<0,001 p3<0,05 |
53,2 ± 3,8 p1<0,001 p3<0,05 |
1,63 ± 0,14 |
Примечание: р1 – различия статистически значимы по сравнению с контрольной группой, р2 – различия статистически значимы по сравнению с группой с ремиссией, р3 – различия статистически значимы по сравнению с группой с аваскулярным рецидивом РЯ.
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 4 (58)
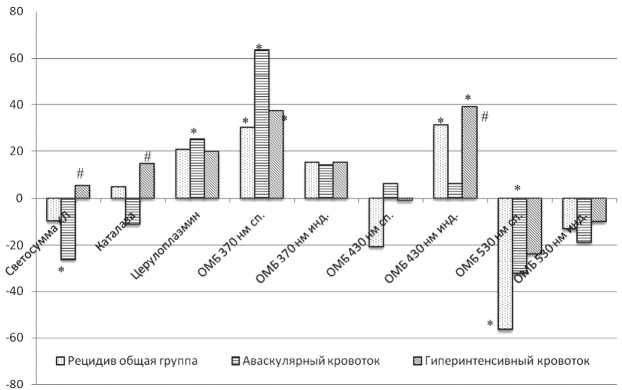
Рис. 1. Динамика окислительных процессов в плазме крови больных с рецидивом рака яичников (изменения в % по сравнению с показателями у больных в ремиссии).
Значимость различий: * – по отношению к группе с ремиссией, # – по отношению к группе с аваскулярным рецидивом
Анализ полученных результатов показал, что в состоянии ремиссии у больных раком яичников отмечается высокий уровень генерации свободных радикалов в плазме крови и некоторая активация ферментативного звена антиоксидантной системы плазмы (каталазы). В процессе прогрессирования заболевания (при формировании аваскулярной рецидивной опухоли, усилении васкуляризации в ней и интенсификации кровотока) показатели, характеризующие окислительный статус крови, изменяются однонаправленно (рис. 1). При этом закономерным является увеличение активности церулоплазмина при формировании рецидивной опухоли по сравнению с уровнем у больных в ремиссии, что свидетельствует об активации обмена меди и железа при прогрессировании злокачественного процесса, подготовке к ангиогенезу [3, 14].
В отечественных и зарубежных исследованиях показано, что усиление редоксзависимой модификации белков наблюдается при опухолевом поражении различных органов [1, 10, 11, 15]. Результаты нашего исследования свидетельствуют о том, что у больных раком яичников, находящихся в состоянии ремиссии после проведенного лечения, сохраняется состояние окислительного и карбонильного стресса, что проявляется в повышении уровня карбонильных производных, регистрируемых при 430 нм, и особенно значительно – при 530 нм.
Интенсивность окислительной модификации белковых молекул, в целом, нарастает по сравнению с уровнем у здоровых людей, при этом более выраженные изменения отмечены для продуктов основного характера, регистрируемых при 530 нм, что согласуется с данными литературы при онкологических и неонкологических заболеваниях [7, 10]. По мере прогрессирования онкологического процесса при формировании рецидивной опухоли, усилении ее васкуляризации и увеличении скорости кровотока наблюдаются неоднозначные изменения уровня карбонильных производных белков нейтрального и основного характера (370 и 530 нм). Обращает на себя внимание противоположно направленная динамика уровня данных продуктов, что, вероятно, может быть связано с различиями в условиях их образования, микроокружения, конформационными изменениями в молекуле белка и нуждается в дальнейшем изучении.
Таким образом, при прогрессировании рака яичников с формированием рецидивной опухоли, усилением ее васкуляризации и интенсификацией опухолевого кровотока в крови происходят закономерные волнообразные изменения окислительного статуса крови, приводящие к дальнейшему развитию карбонильного стресса.


