Интерферон- и опухолевый рост
Автор: Илюшин А.Л., Богдашин И.В., Алексанян А.З., Новиков В.В., Ашрафян Л.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 4 т.22, 2023 года.
Бесплатный доступ
Цель исследования - проанализировать опубликованные данные о механизмах действия интерферона гамма (IFN-γ) при опухолевом росте и оценить возможности его применения для лечения солидных опухолей. Материал и методы. По теме найдено более 200 зарубежных и российских публикаций, представленных в базах данных Scopus, Pubmed, eLibrary и других; ключевые слова поиска: интерферон гамма, опухолевый рост, терапия рака. В данный обзор включено 54 работы. Результаты. IFN-γ -плейотропный цитокин, обладающий противовирусной, противоопухолевой и иммуномодулирующей функциями и играющий важную роль в координации врожденного и адаптивного иммунного ответа. Успешность применения в лечении злокачественных опухолей иммуноонкологических препаратов и химиотерапии зависит, в том числе, от стимулирования выработки и адекватной передачи сигналов IFN-γ. Подавление и потеря рецептора IFN-γ и нижестоящих сигнальных медиаторов, амплификация молекул, ингибирующих сигнальный путь IFN-γ, являются обычными механизмами ускользания опухолевых клеток от иммунной системы. Развитие злокачественных процессов сопровождается изменением (чаще снижением), секреции IFN-γ, что привлекает внимание исследователей к его экзогенному введению. Определение сигнатуры IFN-γ может являться прогностическим маркером клинического ответа на противоопухолевую лекарственную терапию. Противоопухолевые свойства IFN-γ во многом дозозависимы, что наглядно показано в клинических и экспериментальных исследованиях. Низкие дозы препарата чаще способствуют росту опухоли, напротив, использование высоких доз обычно сопровождается противоопухолевым действием. IFN-γ или его индукторы остаются многообещающими агентами для терапии злокачественных новообразований. Комбинаторные стратегии с включением IFN-γ могут быть рациональным вариантом для преодоления резистентности опухолей к блокаде иммунных контрольных точек. Заключение. Необходимо продолжать фундаментальные и прикладные исследования по изучению возможностей применения интерферона гамма в качестве лечебного агента при опухолевом росте.
Интерферон-γ, иммунный ответ, противоопухолевая терапия, иммуноонкологические препараты, контроль опухолевого роста, иммуноредактирование опухоли, противоопухолевый иммунитет, иммунотерапия
Короткий адрес: https://sciup.org/140302015
IDR: 140302015 | УДК: 616-006:578.245:612.017 | DOI: 10.21294/1814-4861-2023-22-4-118-127
Текст научной статьи Интерферон- и опухолевый рост
Purpose of the study: to analyze published data on the mechanisms of action of interferon gamma (IFN-γ) in tumor growth and to evaluate the possibility of its use in the treatment of solid tumors. Material and Methods. More than 200 publications were found in the Scopus, Pubmed, eLibrary and other databases, the search keywords were: interferon gamma, tumor growth, cancer therapy. This review includes 54 papers. Results. IFN-γ is a pleiotropic cytokine with antiviral, antitumor, and immunomodulatory functions and plays an important role in coordinating the innate and adaptive immune response. The success of immuno-oncology drugs and chemotherapy in the treatment of malignant tumors depends on the stimulation of the production and adequate signaling of IFN-γ. Suppression and loss of IFN-γ receptor and downstream signaling mediators, and amplification of molecules that inhibit the IFN-γ signaling pathway are common mechanisms for tumor cells to escape from the immune system. The development of malignant processes is accompanied by a change, more often a decrease, in the secretion of IFN-γ, which attracts the attention of researchers to its exogenous administration. Determination of the IFN-γ signature may be a predictive marker of clinical response to anticancer drug therapy. The antitumor properties of IFN-γ are largely dose-dependent, which has been clearly shown in clinical and experimental studies. Low doses of the drug often promote tumor growth. On the contrary, the use of high doses is usually accompanied by an antitumor effect. IFN-γ or its inducers remain promising agents for cancer therapy. Combinatorial strategies involving IFN-γ may be a rational option to overcome tumor resistance to blockade of immune checkpoints. Conclusion. It is necessary to continue fundamental and applied research to study the feasibility of using interferon gamma as a therapeutic agent in tumor growth.
Общие сведения
Интерферон-γ (IFN-γ) представляет собой белок, кодируемый геном IFNG, состоящий из двух поли-пептидных цепей, связанных антипараллельно [1]. Это единственный представитель семейства интерферонов II типа. С биологической точки зрения IFN-γ – плейотропный цитокин с противовирусной, противоопухолевой и иммуномодулирующей функциями, играющий важную роль в координации врожденного и адаптивного иммунного ответа [2]. В неспецифическом иммунном ответе продукция IFN-γ в основном регулируется натуральными киллерами (NK) и натуральными киллерными Т-лимфоцитами (NKT), во время адаптивного иммунного ответа основными паракринными источниками IFN-γ являются CD8+ и CD4+ T-клетки [3]. Стимуляция этих клеток к выработке IFN-γ осуществляется некоторыми цитокинами, антигенами, секретируемыми опухолью или патогеном, и частично IFN-γ через установившуюся петлю положительной обратной связи в микроокружении опухоли (Tumor Microenvironment – ТМЕ) или очагах воспаления [4].
Рецептор IFN-γ (IFNGR) состоит из IFNGR1 (α-субъединица) и IFNGR2 (β-субъединица). Все ядросодержащие клетки экспрессируют IFNGR1, особенно клетки нелимфоидных тканей (кожи, нервов, плаценты, синцитиотрофобластов), что указывает на роль IFN-γ в эмбриональном развитии, тканевом гомеостазе и иммунной толерантности [1]. IFNGR1 играет основную роль в связывании лиганда, а IFNGR2 принадлежит преобладающая роль в передаче сигналов через киназы семейства JAK и факторы транскрипции семейства STAT, в первую очередь STAT1. Фосфорилированные гомодимеры STAT1 перемещаются в ядро, связываются со специфическими промоторными элементами и модулируют транскрипцию генов, регулируемых
IFN-γ [5, 6]. Гены, индуцированные IFN-γ, называют сигнатурными генами интерферона (ISG), они являются положительными и отрицательными регуляторами передачи сигналов воспаления [6]. Этот сигнальный путь IFN-γ отрицательно регулируется SHP-фосфатазами (Shp2) или цитоплазматическими белками из семейства супрессоров передачи сигналов цитокинов (SOCS), в основном SOCS1 и SOCS3, а также может подавляться белковым ингибитором активированных STAT (PIAS), который предотвращает транскрипцию генов, индуцируя дефосфорилирование STAT1 [4]. Сигнальный путь JAK/STAT IFN-γ, описанный выше, получил название канонического пути (рис. 1).
В неканоническом пути IFN-γ стимулирует ось STAT1-PI3K-Akt, что приводит к участию mTOR в передаче сигналов в ядро [7]. Однако вопрос о том, регулирует ли IFN-γ путь PI3K-Akt-mTOR независимо от передачи сигналов STAT, нуждается в дальнейшем изучении [8]. В литературе рассматриваются и другие пути передачи сигналов, включающие MAP-киназу, PI3K, JNK, CaMKII и NF-κB, которые регулируют многие аспекты биологического действия IFN-γ, взаимодействуя с каноническим сигнальным путем JAK-STAT или действуя параллельно с ним [9, 10].
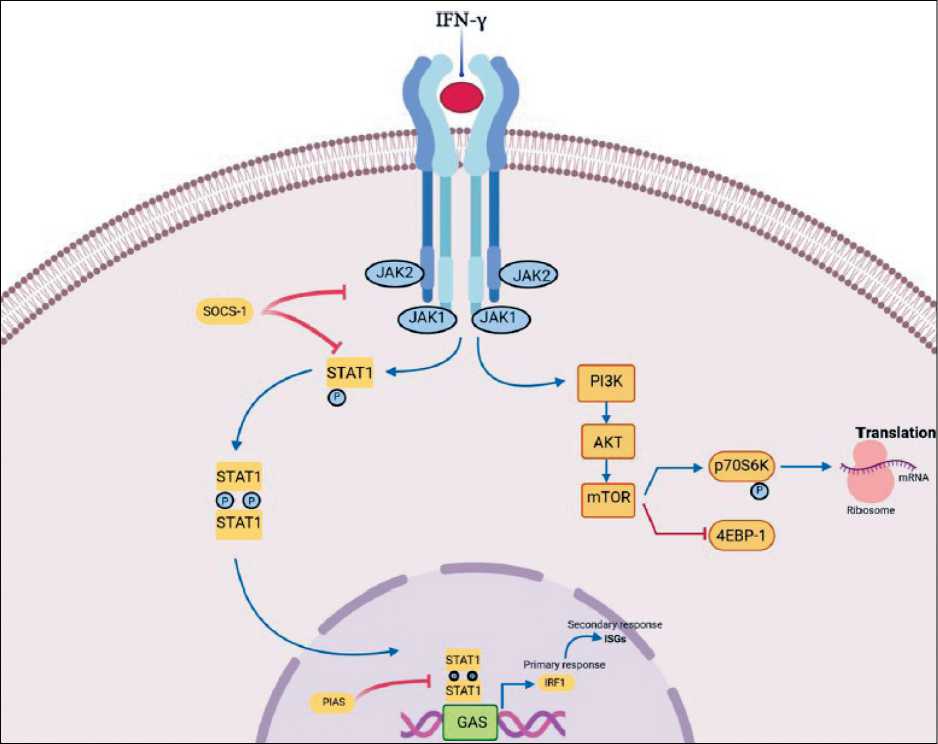
Рис. 1. Сигнальные пути IFN-γ. Канонический сигнальный путь IFN-γ требует активации его рецептора, рецептора IFN-γ (IFNGR) и, как следствие, стимуляции передачи сигналов JAK/STAT (янус-киназа/преобразователи сигналов и активаторы транскрипции). Связывание IFN-γ с комплексом IFNGR приводит к тесной ассоциации IFNGR1 и IFNGR2 и переориентации их внутриклеточных доменов. Тесная ассоциация белков JAK1 и JAK2 способствует ауто- и трансфосфорилированию и ферментативной активации. Кроме того, активированные белки JAK фосфорилируют центр связывания STAT1, активируя его димеризацию и транслокацию в ядро, где он связывается с элементами γ-активированного центра (GAS) и способствует транскрипции генов. Путь JAK-STAT отрицательно регулируется во многих местах: SOCS подавляет активацию JAK и STAT, тогда как PIAS ингибирует транскрипцию генов, индуцированную IFN-γ. В неканоническом пути IFN-γ стимулирует ось STAT1-PI3K-Akt, что приводит к участию мишени рапамицина млекопитающих (mTOR) в передаче сигналов интерферона. Кроме того, каскад киназ mTOR/ p70S6 способствует трансляции мРНК эффекторных белков [7]
Fig. 1. Signaling pathways of IFN-γ. Canonical IFN-γ signaling pathway requires activation of its receptor, IFN-γ receptor (IFNGR) and consequent, stimulation of JAK/STAT (Janus kinase/signal transducers and activators of transcription) signaling. The binding of IFN-γ to the IFNGR complex results in tight association of IFNGR1 and IFNGR2 and a reorientation of their intracellular domains. Close association of JAK1 and JAK2 proteins facilitate auto- and transphosphorylation and enzymatic activation. Furthermore, activated JAK proteins phosphorylate the STAT1 binding site, activating his dimerization and translocation to the nucleus where it binds to γ-activated site (GAS) elements and promotes gene transcription. The JAK-STAT pathway is negatively regulated at multiple sites: SOCS suppresses JAK and STAT activation, while PIAS inhibits IFN-γ induced gene transcription. In a non-canonical pathway, IFN-γ stimulates STAT1-PI3K-Akt axis what leads to implication of mammalian target of rapamycin (mTOR) in interferon signaling. Furthermore, mTOR/p70S6 kinase cascade promotes mRNA translation of effector proteins [7]
Противоопухолевые эффекты интерферона-γ
IFN-γ выступает в качестве межклеточного коммуникатора, что делает его особенно важным для поддержания иммунного гомеостаза. IFN-γ участвует в активации наивных CD4+ Т-клеток, определяя их дифференцировку в направлении Th1 (в качестве экспериментальной модели использованы мононуклеарные клетки крови человека) [11]. Он активирует собственную продукцию в клетках Th1 через петлю положительной обратной связи и ингибирует дифференцировку Th2 и Th17. IFN-γ необходим для созревания наивных Т-клеток до эффекторных CD8+ Т-клеток, может увеличивать подвижность цитотоксических Т-лимфоцитов (ЦТЛ) и их способность к разрушению клеток, несущих антиген [12]. Кроме того, он усиливает цитотоксическую активность NK-клеток [7]. В итоге IFN-γ не только инициирует иммунный ответ, стимулируя активацию Т-клеток, но и предотвращает их сверхактивацию с последующей анэргией.
Он также способен действовать на клетки в ТМЕ – макрофаги, супрессорные клетки миелоидного происхождения (MDSC), дендритные клетки (ДК) и В-клетки. IFN-γ стимулирует поляризацию макрофагов в сторону провоспалительного фенотипа M1, ингибирует их фенотип М2, повышает способность макрофагов к секреции хемокинов, что способствует эффективному противоопухолевому иммунному ответу и торможению роста опухолей у мышей C57BL/6, индуцированных путем подкожной инъекции клеточной линии меланомы B16F10 [13]. Передача сигналов IFN-γ в ДК приводит к их созреванию, высокой экспрессии костимулирующих молекул, секреции цитокинов семейства IL-12 совместно с IL-1β и последующей активации CD4+ и CD8+ Т-клеток [14]. Через фактор транскрипции IRF1 IFN-γ способствует усилению экспрессии молекул главного комплекса гистосовместимости I класса на иммунных и на неиммунных клетках и распознаванию эффекторными Т-клетками чужеродных антигенов [15–17]. Показана также способность IFN-γ повышать экспрессию молекул главного комплекса гистосовместимости II класса [4].
При различных типах опухолей (рак молочной железы, гепатоцеллюлярный рак, колоректальный рак) IFN-γ может оказывать антипролиферативное действие на опухолевые клетки за счет усиления экспрессии белков-ингибиторов клеточного цикла p27Kip, p16 или p21. В клеточных линиях колоректального рака IFN-γ вызывает апоптоз, связанный с аутофагией [18]. Более того, IFN-γ, продуцируемый Т-клетками chNKG2D, но не GM-CSF, индуцирует макрофаги к продукции оксида азота и усиливает макрофагальный лизис клеток рака яичников ID8 у мышей [19]. По данным C. Fang et al. (2021), еще одним механизмом опосредованного IFN-γ противоопухолевого действия является стресс эндоплазматического ретикулума (ER), сопрово- ждающийся быстрым синтезом белка и клеточным стресс-ответом, что способствует остановке клеточного цикла и апоптотической гибели клеток [20].
Согласно исследованию T. Kammertoens et al. (2017), IFN-γ способен индуцировать снижение количества эндотелиальных клеток, вызывать деструкцию кровеносных сосудов, а затем некроз опухолевой ткани [21]. Он также ингибирует образование опухолевых кровеносных сосудов путем подавления синтеза фактора роста эндотелия сосудов (VEGF-A).
IFN-γ-опосредованная активация пути IDO1-Kyn-AhR-p27 переводит подобные стволовым клеткам опухолевые TRC-клетки, способные повторно заселять опухоли (репопуляция опухолевых клеток), в состояние покоя [22], которое индуцируется дозой IFN-γ 200 нг/мл, но может поддерживаться и дозой 20 нг/мл. Эксперимент проводился на линиях опухолевых клеток человека А375 (меланомы), MCF7 (рака молочной железы) и HepG2 (рака печени). IFN-γ также ограничивает количество метастазов за счет увеличения экспрессии белка внеклеточного матрикса фибронектина 1 [23].
В исследовании В.Г. Исаевой и соавт. (2022) продемонстрирован отчетливый статистически значимый противоопухолевый эффект IFN-γ в отношении опухоли с мультицентричным характером роста (карцинома Эрлиха) у экспериментальных животных [24]. Авторы применяли высокие дозы IFN-γ. Препарат вводили в дозе 42 860 МЕ/кг трехкратно подкожно в область холки животного в объеме 0,1 мл 1 раз в сутки, через 3 сут после трансплантации опухолевых клеток.
IFN-γ имеет решающее значение для иммуноредактирования опухоли [10]. Эта концепция описывает переход роли иммунной системы от ограничивающей опухоль к разрешающей через три последовательные фазы: элиминацию, равновесие и ускользание, во время которых опухоли приспосабливаются к росту в иммунокомпетентном хозяине. Отсутствие передачи сигналов IFN-γ у мышей способствует инициации и росту химически индуцированных, трансплантированных или спонтанно возникающих новообразований. Кроме того, широко изучалась значимость IFN-γ в деструкции опухолей иммунной системой во время фазы элиминации и для поддержания фазы равновесия, когда скрытый рост опухоли еще контролируется [25]. Серия исследований на мышах, дефицитных по IFN-γ либо с заблокированным моноклональным антителом, эндогенным IFN-γ, ясно указала на противоопухолевую роль IFN-γ. Согласно A. Mucci et al. (2021), перенос гена IFN-γ в гемопоэтические стволовые клетки позволил контролировать прогрессирование опухоли в мышиных моделях острого B-клеточного лимфобластного лейкоза (B-ALL) и колоректальной карциномы (MC38) [26].
Проонкогенныеэффекты интерферона-γ
В некоторых экспериментальных исследованиях, проведенных на клеточных линиях или лабораторных животных с использованием IFN-γ, были продемонстрированы его проопухолевые эффекты. Однако результаты этих работ следует интерпретировать с учетом использованных доз IFN-γ. Так, длительное воздействие низких доз IFN-γ (5–100 нг/мл) способно индуцировать эпителиальномезенхимальный переход (ЭМП) в клетках рака предстательной железы и почки через сигнальный путь JAK-STAT [27, 28]. Это приводит к индукции экспрессии транскрипционных факторов, вовлеченных в ЭМП (IFIT5, ZEB1, Slug), подавлению экспрессии миРНК-101, миРНК-128 и миРНК-363, сопровождается повышением способности опухолевых клеток к миграции и инвазии.
Согласно исследованию M.Song et al. (2019), концентрация IFN-γ в TME определяет, будет ли функция данного цитокина про- или противоопухолевой [8]. По мнению исследователей, низкий уровень IFN-γ (0,072–0,152 нг/мл), генерируемый T- или NK-клетками в TME опухолей человека, может привести к неэффективности иммунотерапии, индуцируя рост опухоли через активацию передачи сигналов через ICAM1-PI3K-Akt-Notch1 в раковых клетках. Доза IFN-γ, доставляемая к злокачественным новообразованиям при использовании иммунотерапии на основе IFN-γ, должна быть высокой (≥100 нг/мл). Основным механизмом действия высоких доз IFN-γ является активация передачи сигналов по пути JAK-STAT1.
Таким образом, воздействие IFN-γ в микроокружении опухоли может как способствовать ее росту, так и подавлять его, но это воздействие является дозозависимым. Универсальность действия IFN-γ и его биологические эффекты сделали актуальными попытки терапевтического применения IFN-γ с целью достижения выраженных ответов в клинической практике.
Возможности применения интерферона-γ в терапии злокачественных опухолей
Терапия IFN-γ в настоящее время не входит в стандарты лечения солидных опухолей, однако проведены многочисленные клинические исследования, показавшие ее эффективность в виде монотерапии или в сочетании с другими лекарственными препаратами при различных злокачественных новообразованиях. J.E. Talmadge et al. (1987), проводившими доклиническую оценку эффективности и безопасности рекомбинантных цитокинов, в том числе IFN-γ, показано, что IFN-γ обладает узким окном активности с колоколообразной формой кривой терапевтического ответа и его противоопухолевые эффекты являются дозозависимыми. Оптимальная дозировка составляет 50 000 МЕ 3 раза в нед [33]. Такой режим введения сопровождается повышенной токсичностью в виде гриппоподобного синдрома, устранить который можно применением ацетилсалициловой кислоты, парацетамола или других жаропонижающих средств.
По данным A. Giannopoulos et al. (2003), профилактическое интравезикулярное введение IFN-γ (1,5×107 МЕ/инстилляция) пациентам с поверхностным переходно-клеточным раком мочевого пузыря, перенесшим трансуретральную резекцию опухоли, эффективно для предотвращения рецидивов заболевания. У 73,4 % больных в данной группе не наблюдалось развития опухоли в течение среднего периода наблюдения 26,5 мес (диапазон 3–49 мес) против 57,2 % в группе сравнения, получавшей внутрипузырно инстилляции митомицина C [34].
По данным С. Marth et al. (2006), применение IFN-γ в сочетании с карбоплатином и паклитакселом в терапии первой линии больных раком яичников III–IV стадии по FIGO безопасно и позволяет достичь полных или частичных ответов у 71 % больных, получавших сочетанное лечение. IFN-γ вводили в возрастающей дозе от 6 дней/ цикл с 0,025 мг подкожно до 9 дней/цикл с 0,1 мг подкожно [35].
У пациентов с радикально прооперированной аденокарциномой легких проведение адъювантной химиотерапии (карбоплатин AUC5/этопозид) в сочетании с рекомбинантным человеческим IFN-γ (500 тыс. МЕ/м2, но не более 1 млн МЕ на одно введение во 2, 4 и 6-й дни цикла, внутривенно, капельно) способствовало тенденции к улучшению показателей 3-летней безрецидивной выживаемости [36].
В работе А.Ю. Арджа и соавт. (2020) 93 больных раком яичников с IIIC–IV стадией были разделены на 4 группы, две из которых получали IFN-γ в сочетании с неоадъювантной химиотерапией. Авторы показали, что сочетанное лечение приводит к снижению пролиферативного потенциала опухоли и экспрессии опухолевыми клетками р53, особенно при внутрибрюшинном способе введения IFN-γ в курсах неоадъювантной химиотерапии [37]. Оба фактора могут рассматриваться в качестве критериев эффективности проводимого лечения и хорошего прогноза заболевания.
Клинические исследования с включением IFN-γ в состав противоопухолевой лекарственной терапии в настоящее время проводятся при различных новообразованиях. Так, в исследовании NCT02948426 I фазы планируется проведение внутрибрюшинных инфузий аутологичных моноцитов в сочетании с силатроном (пегинтерфероном альфа-2b) и актиммуном (интерфероном гамма-1b) у женщин с рецидивирующим или рефрактерным раком яичников, раком фаллопиевых труб или первичным раком брюшины. В исследовании NCT02614456 I фазы комбинированная иммунотерапия с использованием IFN-γ и ниволумаба, ингибитора PD-1 будет проводиться пациентам с солидными опухолями поздних стадий, у которых наблюдалось прогрессирование, по крайней мере, после одной предшествующей линии системной терапии, которая могла включать иммунотерапию. Пациентов планируется лечить в течение 1 нед (индукционной фазы) IFN-γ, затем (комбинированная фаза) IFN-γ и ниволумабом в течение трех циклов, после чего лечение будет проводиться ниволумабом в сроке до 1 года (фаза монотерапии). Ознакомиться с запланированными клиническими исследованиями IFN-γ в онкологии можно на официальном международном вебсайте www.
Таким образом, проведенные клинические исследования показывают целесообразность включения в состав противоопухолевого лечения больных с различными злокачественными новообразованиями IFN-γ, при условии его использования в высоких дозах.
Интерферон- γ – один из факторов прогнозирования успеха противоопухолевой анти-PD-1/PD-L1 терапии
IFN-γ, безусловно, играет важную роль в успехе иммунотерапии нового поколения, которая доказала свое превосходство над другими способами лечения рака. Показано, что пролонгированная активность IFN-γ имеет решающее значение для противоопухолевого иммунного ответа [38].
Процесс стимулирования выработки IFN-γ осуществляется через увеличение продукции IL-12 и усиление функции цитотоксических клеток по принципу петли положительной обратной связи [39]. Восстановление противоопухолевого иммунного ответа при терапии ингибиторами иммунных контрольных точек в значительной степени сопровождается повышением в крови уровня IFN-γ и индуцируемых IFN-γ хемокинов (CXCL-9 и CXCL-10), а также увеличением количества IFN-γ-продуцирующих Т-клеток в периферической крови и опухолевых тканях [40].
Чрезвычайно важна роль сохранения чувствительности к передаче сигналов IFN-γ для предотвращения приобретения устойчивости опухолевых клеток к иммунотерапии [10]. Ослаблять передачу сигналов IFN-γ и ограничивать эффективность иммуноонкологической терапии может старение организма-опухоленосителя, что показано для пациентов с тройным негативным РМЖ [43]. Кроме того, пролонгированная передача сигналов рецептора IFN-γ в опухолевых клетках может опосредовать устойчивость к иммуноонкологиче-ским препаратам за счет эпигеномных изменений в сигнальном пути JAK/STAT. Установлено, что опухоли, устойчивые к иммунотерапии, имеют дефекты в передаче сигналов IFN-γ, а именно потерю генов IFNGR1, IRF-1, JAK2 и IFNGR2 , а также амплификацию ингибирующих передачу сигнала генов SOCS1 и PIAS4 [44]. По данным C.S. Grasso et al. (2020), весьма перспективно сочетание терапии ингибиторами иммунных контрольных точек с методами лечения, которые усиливают передачу сигналов IFN-γ внутри опухолей [45]. Согласно исследованиям S. Zhang et al. (2020), комбинаторные стратегии с включением IFN-γ могут быть рациональным вариантом для преодоления резистентности опухоли к блокаторам иммунных контрольных точек PD - 1 путем усиления инфильтрации опухоли цитотоксическими Т-клетками, придания Т-клеткам устойчивости к анергии, опосредованной PD - 1/PD-L1, или одновременного блокирования других механизмов ускользания опухоли от иммунного ответа. В частности, такие технологии могут оказаться эффективными у больных раком поджелудочной железы [46], синовиальной саркомой и миксоидной/круглоклеточной липосаркомой [47].
Анализируя профили экспрессии генов в образцах опухолевой ткани, M. Ayers et al. (2017)
По мнению C. Cui et al. (2021), помимо биомаркеров, идентифицированных при профилировании экспрессии генов и анализе РНК, соотношение между сигнатурой IFN-γ и сигнатурой иммуносупрессии лучше предсказывает ответ на терапию анти-PD-1 у пациентов с меланомой [52]. Предложена также IFN-зависимая сигнатура генов в качестве маркера чувствительности к химиотерапии при раке молочной железы (РМЖ) [53].
Для оценки ожидаемой эффективности им-муноонкологических препаратов некоторые исследователи предлагают определять IFN-γ в периферической крови больных. Так, по данным E. Boutsikou et al. (2018), у больных немелкоклеточным раком легкого (НМРЛ) повышение уровня IFN-γ в периферической крови на момент постановки диагноза и через 3 мес после начала лечения достоверно коррелировало с улучшением ответа на иммунотерапию и более длительной выживаемостью. Этот факт потенциально может
Список литературы Интерферон- и опухолевый рост
- Mandai M., Hamanishi J., Abiko K., Matsumura N., Baba T., Konishi I. Dual Faces of IFNγ in Cancer Progression: A Role of PD-L1 Induction in the Determination of Pro- and Antitumor Immunity. Clin Cancer Res. 2016; 22(10): 2329–34. doi: 10.1158/1078-0432.CCR-16-0224.
- Mendoza J.L., Escalante N.K., Jude K.M., Sotolongo Bellon J., Su L., Horton T.M., Tsutsumi N., Berardinelli S.J., Haltiwanger R.S., Piehler J., Engleman E.G., Garcia K.C. Structure of the IFNγ receptor complex guides design of biased agonists. Nature. 2019; 567 (7746): 56–60. doi: 10.1038/s41586-019-0988-7.
- Burke J.D., Young H.A. IFN-γ: A cytokine at the right time, is in the right place. Semin Immunol. 2019; 43. doi: 10.1016/j. smim.2019.05.002.
- Alspach E., Lussier D.M., Schreiber R.D. Interferon γ and Its Important Roles in Promoting and Inhibiting Spontaneous and Therapeutic Cancer Immunity. Cold Spring Harb Perspect Biol. 2019; 11(3): 1–20. doi: 10.1101/cshperspect.a028480.
- Schmiedel B.J., Singh D., Madrigal A., Valdovino-Gonzalez A.G., White B.M., Zapardiel-Gonzalo J., Ha B., Altay G., Greenbaum J.A., McVicker G., Seumois G., Rao A., Kronenberg M., Peters B., Vijayanand P. Impact of Genetic Polymorphisms on Human Immune Cell Gene Expression. Cell. 2018; 175(6): 1701–15. doi: 10.1016/j.cell.2018.10.022.
- Negishi H., Tadatsugu T., Yanai H. The Interferon (IFN) Class of Cytokines and the IFN Regulatory Factor (IRF) Transcription Factor Family. Cold Spring Harb Perspect Biol. 2017; 10(11): 1–15. doi: 10.1101/cshperspect.a028423.
- Jorgovanovic D., Song M., Wang L., Zhang Y. Roles of IFN-γ in tumor progression and regression: a review. Biomark Res. 2020; 8; 49. doi: 10.1186/s40364-020-00228-x.
- Song M., Ping Y., Zhang K., Yang L., Li F., Zhang C., Cheng S., Yue D., Maimela N.R., Qu J., Liu S., Sun T., Li Z., Xia J., Zhang B., Wang L., Zhang Y. Low-Dose IFNγ Induces Tumor Cell Stemness in Tumor Microenvironment of Non-Small Cell Lung Cancer. Cancer Res. 2019; 79(14): 3737–48. doi: 10.1158/0008-5472.CAN-19-0596.
- Zaidi M.R. The Interferon-Gamma Paradox in Cancer. J Interferon Cytokine Res. 2019; 39(1): 30–8. doi: 10.1089/jir.2018.0087.
- Mojic M., Takeda K., Hayakawa Y. The Dark Side of IFN-γ: Its Role in Promoting Cancer Immunoevasion. Int J Mol Sci. 2018; 19(1): 89. doi: 10.3390/ijms19010089.
- Kang K., Park S.H., Chen J., Qiao Y., Giannopoulou E., Berg K., Hanidu A., Li J., Nabozny G., Kang K., Park-Min K.H., Ivashkiv L.B. Interferon-γ Represses M2 Gene Expression in Human Macrophages by Disassembling Enhancers Bound by the Transcription Factor MAF. Immunity. 2017; 47(2): 235–50. doi: 10.1016/j.immuni.2017.07.017.
- Bhat P., Leggatt G., Waterhouse N., Frazer I.H. Interferon-γ derived from cytotoxic lymphocytes directly enhances their motility and cytotoxicity. Cell Death Dis. 2017; 8(6). doi: 10.1038/cddis.2017.67.
- Paul S., Chhatar S., Mishra A., Lal G. Natural killer T cell activation increases iNOS+CD206-M1 macrophage and controls the growth of solid tumor. J Immunother Canc. 2019; 7(1): 1–13. doi: 10.1186/s40425-019-0697-7.
- Fang P., Li X., Dai J., Cole L., Camacho J.A., Zhang Y., Ji Y., Wang J., Yang X.F., Wang H. Immune cell subset differentiation and tissue inflammation. J Hematol Oncol. 2018; 11(1): 97. doi: 10.1186/s13045-018-0637-x.
- Ni L., Lu J. Interferon gamma in cancer immunotherapy. Cancer Med. 2018; 7: 4509–16. doi:10.1002/cam4.1700.
- Gocher A.M., Workman C.J., Vignali D.A.A. Interferon-γ: teammate or opponent in the tumour microenvironment? Nat Rev Immunol. 2022; 22(3): 158–72. doi: 10.1038/s41577-021-00566-3.
- Ong C., Lyons A.B., Woods G.M., Flies A.S. Inducible IFN- γ expression for MHC-I upregulation in devil facial tumor cells. Front Immunol. 2019; 9: 1–9. doi: 10.3389/fimmu.2018.03117.
- Wang Q.S., Shen S.Q., Sun H.W., Xing Z.X., Yang H.L. Interferongamma induces autophagy-associated apoptosis through in-duction of cPLA2- dependent mitochondrial ROS generation in colorectal cancer cells. Biochem Biophys Res Commun. 2018; 498(4): 1058–65. doi: 10.1016/j.bbrc.2018.03.118.
- Spear P., Barber A., Rynda-Apple A., Sentman C.L. Chimeric antigen receptor T cells shape myeloid cell function within the tumor microenvironment through IFN-gamma and GM-CSF. J Immunol. 2012; 188: 6389‐98. doi: 10.4049/jimmunol.1103019.
- Fang C., Weng T., Hu S., Yuan Z., Xiong H., Huang B., Cai Y., Li L., Fu X. IFN-γ-induced ER stress impairs autophagy and triggers apoptosis in lung cancer cells. Oncoimmunology. 2021; 10(1). doi: 10.1080/2162402X.2021.1962591.
- Kammertoens T., Friese C., Arina A., Idel C., Briesemeister D., Rothe M., Ivanov A., Szymborska A., Patone G., Kunz S., Sommermeyer D., Engels B., Leisegang M., Textor A., Fehling H.J., Fruttiger M., Lohoff M., Herrmann A., Yu H., Weichselbaum R., Uckert W., Hübner N., Gerhardt H., Beule D., Schreiber H., Blankenstein T. Tumour ischaemia by interferon-γ resembles physiological blood vessel regression. Nature. 2017; 545(7652): 98–102. doi: 10.1038/nature22311.
- Liu Y., Liang X., Yin X., Lv J., Tang K., Ma J., Ji T., Zhang H., Dong W., Jin X., Chen D., Li Y., Zhang S., Xie H.Q., Zhao B., Zhao T., Lu J., Hu Z.W., Cao X., Qin F.X., Huang B. Blockade of IDO-kynurenine- AhR metabolic circuitry abrogates IFN-γ-induced immunologic dormancy of tumor-repopulating cells. Nat Commun. 2017; 8. doi: 10.1038/ncomms15207.
- Glasner A., Levi A., Enk J., Isaacson B., Viukov S., Orlanski S., Scope A., Neuman T., Enk C.D., Hanna J.H., Sexl V., Jonjic S., Seliger B., Zitvogel L., Mandelboim O. NKp46 Receptor-Mediated Interferon-γ Production by Natural Killer Cells Increases Fibronectin 1 to Alter Tumor Architecture and Control Metastasis. Immunity. 2018; 48(1): 107–19. doi: 10.1016/j.immuni.2017.12.007. Erratum in: Immunity. 2018; 48(2): 396–8.
- Исаева В.Г., Гривцова Л.Ю., Жовтун Л.П., Самборский С.М., Фалалеева Н.А. Противоопухолевый эффект рекомбинантного интерферона гамма в экспериментальной модели билатеральной солидной карциномы Эрлиха. Успехи молекулярной онкологии. 2022; 9(2): 111–9. [Isaeva V. G., Grivtsova L. Y., Zhovtun L. P., Samborskij S.M., Falaleeva N.A. Antitumor effect of recombinant interferongamma in an experimental model of Ehrlich’s bilateral solid carcinoma. Advances in Molecular Oncology. 2022; 9(2): 111–9. (in Russian)]. doi: 10.10.17650/2313-805X-2022‑9‑2‑111‑119.
- Kaplan D.H., Shankaran V., Dighe A.S., Stockert E., Aguet M., Old L.J., Schreiber R.D. Demonstration of an interferon gamma-dependent tumor surveillance system in immunocompetent mice. Proc Natl Acad Sci USA. 1998; 95(13): 7556–61. doi: 10.1073/pnas.95.13.7556.
- Mucci A., Antonarelli G., Caserta C., Vittoria F.M., Desantis G., Pagani R., Greco Be, Casucci M., Escobar G., Passerini L., Lachmann N., Sanvito F., Barcella M., Merelli I., Naldini L., Gentner B. Myeloid cellbased delivery of IFN-γ reprograms the leukemia microenvironment and induces anti-tumoral immune responses. EMBO Mol Med. 2021; 13(10). doi: 10.15252/emmm.202013598.
- Lo U.G., Pong R.C., Yang D., Gandee L., Hernandez E., Dang A., Lin C.J., Santoyo J., Ma S., Sonavane R., Huang J., Tseng S.F., Moro L., Arbini A.A., Kapur P., Raj G.V., He D., Lai C.H., Lin H., Hsieh J.T. IFNγ-Induced IFIT5 Promotes Epithelial-to-Mesenchymal Transition in Prostate Cancer via miRNA Processing. Cancer Res. 2019; 79(6): 1098–112. doi: 10.1158/0008-5472.CAN-18-2207.
- Lo U.G., Bao J., Cen J., Yeh H.C., Luo J., Tan W., Hsieh J.T. Interferon- induced IFIT5 promotes epithelial-to-mesenchymal transition leading to renal cancer invasion. Am J Clin Exp Urol. 2019; 7(1): 31–45.
- Korentzelos D., Wells A., Clark A.M. Interferon-γ increases sensitivity to chemotherapy and provides immunotherapy targets in models of metastatic castration-resistant prostate cancer. Sci Rep. 2022; 12(1): 6657. doi: 10.1038/s41598-022-10724-9.
- Xu Y.H., Li Z.L., Qiu S.F. IFN-γ Induces Gastric Cancer Cell Proliferation and Metastasis Through Upregulation of Integrin β3-Mediated NF-κB Signaling. Transl Oncol. 2018; 11(1): 182–92. doi: 10.1016/j.tranon.2017.11.008.
- Dillinger B., Ahmadi-Erber S., Lau M., Hoelzl M.A., Erhart F., Juergens B., Fuchs D., Heitger A., Ladisch S., Dohnal A.M. IFN-γ and tumor gangliosides: implications for the tumor microenvironment. Cell Immunol. 2018; 325: 33–40. doi: 10.1016/j.cellimm.2018.01.014.
- Tong S., Cinelli M.A., El-Sayed N.S., Huang H., Patel A., Silverman R.B., Yang S. Inhibition of interferon-gamma-stimulated melanoma progression by targeting neuronal nitric oxide synthase (nNOS). Sci Rep. 2022; 12(1): 1701. doi: 10.1038/s41598-022-05394-6.
- Talmadge J.E., Black P.L., Tribble H., Pennington R., Bowersox O., Schneider M., Phillips H. Preclinical approaches to the treatment of metastatic disease: therapeutic properties of rH TNF, rM IFN-gamma, and rH IL-2. Drugs Exp Clin Res. 1987; 13(6): 327–37.
- Giannopoulos A., Constantinides C., Fokaeas E., Stravodimos C., Giannopoulou M., Kyroudi A., Gounaris A. The immunomodulating effect of interferon-gamma intravesical instillations in preventing bladder cancer recurrence. Clin Cancer Res. 2003; 9(15): 5550–8.
- Marth C., Windbichler G.H., Hausmaninger H., Petru E., Estermann K., Pelzer A., Mueller-Holzner E. Interferon-gamma in combination with carboplatin and paclitaxel as a safe and effective first-line treatment option for advanced ovarian cancer: results of a phase I/II study. Int J Gynecol Cancer. 2006; 16(4): 1522–8. doi: 10.1111/j.1525-1438.2006.00622.x.
- Пыльцин С.П., Златник Е.Ю., Лазутин Ю.Н., Сергостьянц Г.З., Закора Г.И., Лейман И.А., Анистратов П.А. Влияние ингарона на иммунный статус больных аденокарциномой легкого в процессе адъювантного лечения. Медицинская иммунология. 2014; 16(6): 559–66. [Pyltsin S.P., Zlatnik E.Yu., Lazutin Yu.N., Sergostyants G.Z., Zakora G.I., Leyman I.A., Anistratov P.A. Effect of ingaron on the immune status of patients with lung adenocarcinoma during adjuvant treatment. Medical Immunology. 2014; 16(6): 559–66. (in Russian)]. doi: 10.15789/1563-0625-2014-6-559-566.
- Арджа А.Ю., Непомнящая Е.М., Златник Е.Ю., Ульянова Е.П., Вереникина Е.В., Женило О.Е., Никитина В.П., Меньшенина А.П., Сагакянц А.Б., Черникова Е.Н., Якубова Д.Ю., Шульгина О.Г. Особенности экспрессии некоторых иммуногистохимических маркеров у больных раком яичников IIIC-IV стадии как критерий эффективности применения химиоиммунотерапии. Наука молодых. 2020; 8(4): 582–90. [Ardzha A.Yu., Nepomnyashchaya E.M., Zlatnik E.Yu., Ulianova E.P., Verenikina E.V., Zhenilo O.E., Nikitina V.P., Menshenina A.P., Sagakyants A.B., Chernikova E.N., Yakubova D.Yu., Shulgina O.G. Characteristics of expression of some immunohistochemical markers in patients with stage IIIc-IV ovarian cancer as a criterion of effectiveness of chemoimmunotherapy. Science of the Young. 2020; 8(4): 582–90. (in Russian)]. doi: 10.23888/HMJ202084582-590.
- Thibaut R., Bost P., Milo I., Cazaux M., Lemaître F., Garcia Z., Amit I., Breart B., Cornuot C., Schwikowski B., Bousso P. Bystander IFN-γ activity promotes widespread and sustained cytokine signaling altering the tumor microenvironment. Nat Cancer. 2020; 1(3): 302–14. doi: 10.1038/s43018-020-0038-2.
- Garris C.S., Arlauckas S.P., Kohler R.H., Trefny M.P., Garren S., Piot C., Engblom C., Pfirschke C., Siwicki M., Gungabeesoon J., Freeman G.J., Warren S.E., Ong S., Browning E., Twitty C.G., Pierce R.H., Le M.H., Algazi A.P., Daud A.I., Pai S.I., Zippelius A., Weissleder R., Pittet M.J. Successful Anti-PD-1 Cancer Immunotherapy Requires T Cell-Dendritic Cell Crosstalk Involving the Cytokines IFN-γ and IL-12. Immunity. 2018; 49(6): 1148–61. doi: 10.1016/j.immuni.2018.09.024.
- Park A., Yang Y., Lee Y., Kim M.S., Park Y.J., Jung H., Kim T.D., Lee H.G., Choi I., Yoon S.R. Indoleamine-2,3-Dioxygenase in Thyroid Cancer Cells Suppresses Natural Killer Cell Function by Inhibiting NKG2D and NKp46 Expression via STAT Signaling Pathways. J Clin Med. 2019; 8(6): 842. doi: 10.3390/jcm8060842.
- Xu Y.P., Lv L., Liu Y., Smith M.D., Li W.C., Tan X.M., Cheng M., Li Z., Bovino M., Aubé J., Xiong Y. Tumor suppressor TET2 promotes cancer immunity and immunotherapy efficacy. J Clin Invest. 2019; 129(10): 4316–31. doi: 10.1172/JCI129317.
- Mimura K., Teh J.L., Okayama H., Shiraishi K., Kua L.F., Koh V., Smoot D.T., Ashktorab H., Oike T., Suzuki Y., Fazreen Z., Asuncion B.R., Shabbir A., Yong W.P., So J., Soong R., Kono K. PD-L1 expression is mainly regulated by interferon gamma associated with JAK-STAT pathway in gastric cancer. Cancer Sci. 2018; 109(1): 43–53. doi: 10.1111/cas.13424.
- Sceneay J., Goreczny G.J., Wilson K., Morrow S., DeCristo M.J., Ubellacker J.M., Qin Y., Laszewski T., Stover D.G., Barrera V., Hutchinson J.N., Freedman R.A., Mittendorf E.A., McAllister S.S. Interferon Signaling Is Diminished with Age and Is Associated with Immune Checkpoint Blockade Efficacy in Triple-Negative Breast Cancer. Cancer Discov. 2019; 9(9): 1208–27. doi: 10.1158/2159-8290.CD-18-1454.
- Gao J., Shi L.Z., Zhao H., Chen J., Xiong L., He Q., Chen T., Roszik J., Bernatchez C., Woodman S.E., Chen P.L., Hwu P., Allison J.P., Futreal A., Wargo J.A., Sharma P. Loss of IFN-γ Pathway Genes in Tumor Cells as a Mechanism of Resistance to Anti-CTLA-4 Therapy. Cell. 2016; 167(2): 397–404. doi: 10.1016/j.cell.2016.08.069.
- Grasso C.S., Tsoi J., Onyshchenko M., Abril-Rodriguez G., Ross-Macdonald P., Wind-Rotolo M., Champhekar A., Medina E., Torrejon D.Y., Shin D.S., Tran P., Kim Y.J., Puig-Saus C., Campbell K., Vega-Crespo A., Quist M., Martignier C., Luke J.J., Wolchok J.D., Johnson D.B., Chmielowski B., Hodi F.S., Bhatia S., Sharfman W., Urba W.J., Slingluff C.L. Jr., Diab A., Haanen J.B.A.G., Algarra S.M., Pardoll D.M., Anagnostou V., Topalian S.L., Velculescu V.E., Speiser D.E., Kalbasi A., Ribas A. Conserved Interferon-γ Signaling Drives Clinical Response to Immune Checkpoint Blockade Therapy in Melanoma. Cancer Cell. 2020; 38(4): 500–15. doi: 10.1016/j.ccell.2020.08.005.
- Zhang M., Huang L., Ding G., Huang H., Cao G., Sun X., Lou N., Wei Q., Shen T., Xu X., Cao L., Yan Q. Interferon gamma inhibits CXCL8-CXCR2 axis mediated tumor-associated macrophages tumor trafficking and enhances anti-PD1 efficacy in pancreatic cancer. J Immunother Cancer. 2020; 8(1). doi: 10.1136/jitc-2019-000308.
- Zhang S., Kohli K., Black R.G., Yao L., Spadinger S.M., He Q., Pillarisetty V.G., Cranmer L.D., Van Tine B.A., Yee C., Pierce R.H., Riddell S.R., Jones R.L., Pollack S.M. Systemic Interferon-γ Increases MHC Class I Expression and T-cell Infiltration in Cold Tumors: Results of a Phase 0 Clinical Trial. Cancer Immunol Res. 2019; 7(8): 1237–43. doi: 10.1158/2326-6066.CIR-18-0940.
- Ayers M., Lunceford J., Nebozhyn M., Murphy E., Loboda A., Kaufman D.R., Albright A., Cheng J.D., Kang S.P., Shankaran V., Piha-Paul S.A., Yearley J., Seiwert T.Y., Ribas A., McClanahan T.K. IFN-γ-related mRNA profile predicts clinical response to PD-1 blockade. J Clin Invest. 2017; 127(8): 2930–40. doi: 10.1172/JCI91190.
- Higgs B.W., Morehouse C.A., Streicher K., Brohawn P.Z., Pilataxi F., Gupta A., Ranade K. Interferon Gamma Messenger RNA Signature in Tumor Biopsies Predicts Outcomes in Patients with Non-Small Cell Lung Carcinoma or Urothelial Cancer Treated with Durvalumab. Clin Cancer Res. 2018; 24(16): 3857–66. doi: 10.1158/1078-0432.CCR-17-3451.
- Liu L., Du X., Fang J., Zhao J., Guo Y., Zhao Y., Zou C., Yan X., Li W. Development of an Interferon Gamma Response-Related Signature for Prediction of Survival in Clear Cell Renal Cell Carcinoma. J Inflamm Res. 2021; 14: 4969–85. doi: 10.2147/JIR.S334041.
- Reijers I.L.M., Dimitriadis P., Rozeman E.A., Krijgsman O., Cornelissen S., Bosch L.J.W., Broeks A., Menzies A., van de Wiel B.A., Scolyer R.A., Long G.V., Blank C.U. The interferon-gamma (IFN-y) signature from baseline tumor material predicts pathologic response after neoadjuvant ipilimumab (IPI) + nivolumab (NIVO) in stage III melanoma. J Clin Oncol. 2022; 40(16): 9539. doi: 10.1200/JCO.2022.40.16_suppl.9539.
- Cui C., Xu C., Yang W., Chi Z., Sheng X., Si L., Xie Y., Yu J., Wang S., Yu R., Guo J., Kong Y. Ratio of the interferon-γ signature to the immunosuppression signature predicts anti-PD-1 therapy response in melanoma. NPJ Genom Med. 2021; 6(1): 7. doi: 10.1038/s41525-021-00169-w.
- Tecalco-Cruz A.C., Macías-Silva M., Ramírez-Jarquín J.O., Méndez-Ambrosio B. Identification of genes modulated by interferon gamma in breast cancer cells. Biochem Biophys Rep. 2021; 27. doi: 10.1016/j.bbrep.2021.101053.
- Boutsikou E., Domvri K., Hardavella G., Tsiouda D., Zarogoulidis K., Kontakiotis T. Tumour necrosis factor, interferon-gamma and interleukins as predictive markers of antiprogrammed cell-death protein-1 treatment in advanced non-small cell lung cancer: a pragmatic approach in clinical practice. Ther Adv Med Oncol. 2018; 10: 1–8. doi: 10.1177/1758835918768238.


