Интерлейкин-6 и диабетическая нефропатия: патогенетические связи, мишени для нефропротекции
Автор: Пчелин И.Ю., Байрашева В.К., Шишкин А.Н., Василькова О.Н., Худякова Н.В.
Журнал: Juvenis scientia @jscientia
Рубрика: Медицинские науки
Статья в выпуске: 12, 2017 года.
Бесплатный доступ
В статье представлены данные о роли интерлейкина-6 (IL-6) в развитии диабетической нефропатии (ДН) и патогенетически связанных с ней состояний. Рассмотрены эффекты, обусловленные связыванием IL-6 с мембранным рецептором (IL-6R) и растворимым рецептором (sIL-6R). Проанализированы результаты экспериментальных и клинических исследований, направленных на изучение взаимосвязи IL-6 с ожирением, инсулинорезистентностью, нефросклерозом, кардиомиопатией и анемией. Обсуждаются различные стратегии противовоспалительной терапии и нефропротекции.
Интерлейкин-6, сахарный диабет, инсулин, инсулинорезистентность, хроническая болезнь почек, диабетическая нефропатия, тоцилизумаб
Короткий адрес: https://sciup.org/14110446
IDR: 14110446 | УДК: 616.379-008.64
Текст научной статьи Интерлейкин-6 и диабетическая нефропатия: патогенетические связи, мишени для нефропротекции
Funding: The study was supported by the President Grant for Government Support of Young Russian Scientists MK-5632.2015.7 and by the Russian Foundation for Basic Research (RFBR) according to the research project № 17-54-04080.
Воспалительные механизмы осложнений сахарного диабета и, в частности, диабетической нефропатии (ДН) в последние годы стали предметом многочисленных экспериментальных и клинических исследований [1-5]. Тем не менее, до настоящего времени в реальной клинической практике выраженность и характер воспаления практически не принимаются во внимание при выборе терапевтической тактики и оценке её эффективности [6, 7], что, вероятно, обусловлено сложностью и многофакторностью эффектов провоспалительных цитокинов. В настоящем обзоре проанализированы современные данные о патофизиологической роли интерлейкина-6 (IL-6) при ДН и патогенетически связанных с ней состояниях (ожирение, www.jscientia.org инсулинорезистентность, диабетическая кардиомиопатия, анемия).
-
I L-6 – цитокин с широким спектром иммунорегулятор-ных свойств. Секреция IL-6 осуществляется преимущественно различными иммунными клетками, эндотелиоцитами и адипоцитами. В физиологических условиях 15-35% IL-6 происходит из жировой ткани, причем висцеральная жировая ткань продуцирует его более активно, чем подкожная. При ожирении доля IL-6, секретируемого адипоцитами, возрастает [8, 9].
Рецепторы IL-6 (IL-6R) обнаруживаются на поверхности лишь некоторых типов клеток, включая нейтрофилы, макрофаги, ряд субпопуляций лимфоцитов, отдельные виды эпителиальных клеток и гепатоциты, что не объясняет всего многообразия эффектов данного цитокина [10, 11]. Таким образом, классический рецепторный механизм действия IL-6 не является единственным. Альтернативный сигнальный каскад (trans signaling, транс-сигнализация) запускается при образовании комплекса IL-6 c растворимым рецептором IL-6 (sIL-6R), причем аффинность IL-6 к sIL-6R значительно выше, чем к IL-6R. Комплекс sIL-6R/IL-6 способен вызывать димеризацию субъединиц мембранного гликопротеина gp130 и последующую активацию системы JAK-STAT в клетках, не имеющих IL-6R, тем самым существенно расширяя возможный спектр мишеней цитокина [12]. sIL-6R образуется в результате альтернативного сплайсинга (10%) или отделения от IL-6R под действием металлопротеиназ, преимущественно, ADAM-10 и ADAM-17 (90%) [13]. Экспериментальные исследования показывают, что в патогенезе хронических воспалительных заболеваний ключевую роль играет именно транс-сигнализация [14]. В частности, было продемонстрировано, что активация данного сигнального пути стимулирует секрецию моноцитарного хемоаттрактантного белка 1 (MCP-1) эндотелиальными клетками [11]. Таким образом, клинически значимые эффекты могут быть обусловлены изменением продукции не только IL-6, но и sIL-6R, а ADAM-протеазы можно считать регуляторами баланса между классическим и альтернативным путями передачи сигнала IL-6 (рис. 1).
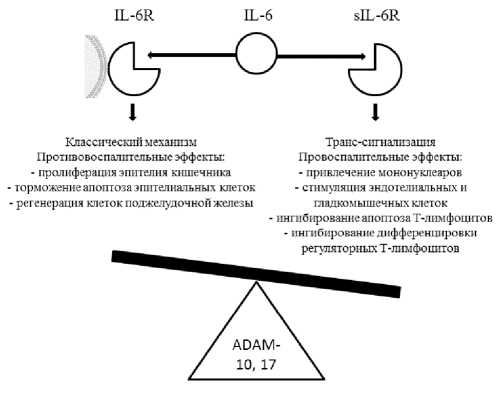
Рисунок 1. Эффекты IL-6 при связывании с IL-6R и sIL-6R (адаптировано из J. Scheller et al., [11])
Экспериментальные исследования. Результаты экспериментальных исследований свидетельствуют о том, что существуют множественные взаимосвязи между эффектами инсулина и IL-6. Воздействуя на активность STAT3 и других внутриклеточных сигнальных систем, инсулин уменьшает индуцированную IL-6 экспрессию генов провос-палительных цитокинов адипоцитами [15]. Напротив, IL-6 посредством влияния на уровне фосфатидилинозитол-3-киназы подавляет стимулированную инсулином продукцию оксида азота эндотелиоцитами [16]. При инкубации гепатоцитов с IL-6 наблюдается уменьшение их чувствительности к инсулину, что проявляется снижением синтеза гликогена [17]. IL-6 также способен оказывать стимулирующее влияние на секрецию кортизола [18] и глюкагона [19], обладающих контринсулярными свойствами. Инкубация культуры клеток панкреатических островков человека с антителами к рецепторам IL-6 увеличивает их способность к продукции инсулина в присутствии провоспалительных ци- токинов и сокращает срок, необходимый для достижения нормогликемии, при проведении их трансплантации иммунодефицитным лабораторным животным со стрептозотоцин-индуцированным сахарным диабетом [20].
Почечные эффекты IL-6 включают стимуляцию пролиферации клеток мезангия клубочков, увеличение продукции мезангиальными клетками молекул межклеточной адгезии и экстрацеллюлярного матрикса, истончение базальной мембраны клубочков и повышение экскреции альбумина с мочой [21, 22]. Экспериментальные исследования показывают, что через 8 недель после моделирования стрептозо-тоцин-индуцированного сахарного диабета у крыс наблюдается повышение уровня мРНК IL-6 в корковом веществе почек в 3,4 раза по сравнению с интактными животными (содержание мРНК интерлейкина-1 и фактора некроза опухолей альфа увеличивается в меньшей степени – в 1,2 и 2,4 раза, соответственно). Введение экспериментальным животным как эналаприла, так и пентоксифиллина (в отдельности) приводит к уменьшению экспрессии гена IL-6 в почках, снижению экскреции IL-6 и альбумина с мочой [23]. Однако влияние на экспрессию генов провоспалительных цитокинов, вероятно, не является универсальным механизмом нефропротекции. Так, например, при введении крысам со стрептозотоцин-индуцированным сахарным диабетом альфа-липоевой кислоты наблюдается уменьшение выраженности морфологических проявлений ДН и снижение экскреции белка с мочой без существенных изменений экспрессии гена IL-6 [24]. В последние годы появились экспериментальные данные о том, что инкубация мезангиальных клеток в растворе с повышенной концентрацией глюкозы приводит к up-регуляции экспрессии гена ADAM-17 на уровне транскрипции [25]. На различных моделях было также показано, что экспрессия гена этой металлопротеиназы может увеличиваться под действием ангиотензина II [26] и уменьшаться под действием инсулина [27] и синтетического аналога витамина D парикальцитола [28]. Другая металлопротеиназа, ADAM-10, участвует в образовании (отщеплении от цитоплазматической мембраны) не только sIL-6R, но и растворимого рецептора конечных продуктов гликирования [29].
Опосредованное влияние на почки могут оказывать и другие эффекты IL-6 в рамках кардиоренального анемического синдрома, который является характерным для ДН порочным кругом [30].
Кардиоваскулярными эффектами IL-6, продемонстрированными экспериментально, являются: увеличение синтеза коллагена в миокарде и развитие концентрической гипертрофии левого желудочка [31]. Установлено, что одним из звеньев в патогенезе гипертрофии миокарда, развивающейся под воздействием ангиотензина II, является повышение экспрессии гена металлопротеиназы ADAM-17 [32]. Металлопротеиназа ADAM-10, помимо регуляции баланса между классическим и альтернативным путями передачи сигнала IL-6, участвует в атерогенезе. К субстратам этого фермента относится мембранный белок DRR-1, который обеспечивает взаимодействие лейкоцитов и коллагена в процессах адгезии и миграции. В ряде исследований было показано, что активность ADAM-10 коррелирует с составом атеросклеротических бляшек, их стабильностью, риском рестеноза после стентирования и т. д. [33-35].
Доказанным механизмом влияния IL-6 на эритропоэз является стимуляция синтеза в печени гепсидина – белка, тормозящего абсорбцию железа в желудочно-кишечном тракте и его высвобождение из клеток ретикулоэндотелиальной системы [36]. Обсуждаются и другие возможные эффекты IL-6, включая down-регуляцию гена рецептора эритропоэтина в гемопоэтических клетках [9]. Примечательно, что существует и обратная взаимосвязь, подтверждённая экспериментальными исследованиями на моделях ишемии-реперфузии сердца и почек. В них было показано, что прекондиционирование с использованием эритропоэтина ассоциировано с уменьшением экспрессии генов IL-6 и других провоспалительных цитокинов в соответствующих органах после реперфузии [37, 38]. Однако возможности использования противовоспалительного и нефропротек-тивного потенциала эритропоэтина ограничены наличием у него эффектов, которые являются потенциально неблагоприятными при сахарном диабете. К ним относятся: повышение артериального давления, стимуляция пролиферации эндотелиальных и гладкомышечных клеток сосудов, влияние на тромбоциты и систему свёртывания крови [39].
Клинические исследования . Клинические исследования подтверждают наличие многочисленных связей между IL-6 и патогенетическими факторами развития осложнений сахарного диабета.
По данным S. Papaoikonomou et al., при наличии сахарного диабета 2 типа пациенты с полиморфизмом гена IL-6 174G>C имеют повышенный риск развития нефропатии, причем данный фактор остаётся значимым при исключении влияния пола, возраста, продолжительности сахарного диабета, индекса массы тела, курения, артериальной гипертензии, уровней липидов и гликированного гемоглобина [40].
Исследование M. Shikano et al. показало, что сывороточный уровень IL-6 при сахарном диабете 2 типа коррелирует с уровнем фибриногена и скоростью распространения пульсовой волны по аорте, а его повышение выявляется уже на микроальбуминурической стадии ДН [41].
В проведенном нами исследовании, комплексно оценившем взаимосвязи IL-6 c компонентами кардиоренального анемического синдрома, было продемонстрировано, что сывороточный уровень данного цитокина у пациентов с сахарным диабетом 2 типа и ранними стадиями хронической болезни почек имеет отрицательную корреляционную связь средней силы с концентрацией гемоглобина в крови и отрицательную связь слабой силы с расчетной скоростью клубочковой фильтрации. Значимых корреляций между уровнем IL-6 и эхокардиографическими показателями выявлено не было [42].
По данным 5-летнего наблюдения за больными сахарным диабетом 1 типа (M. K. Svensson, J. W. Eriksson, 2011), изменения чувствительности к инсулину в эугликемиче-ском гиперинсулинемическом клэмп-тесте коррелируют с уровнем IL-6 и содержанием жира в организме, оцененным методом биоимпедансометрии. Данная взаимосвязь выявляется как при наличии ДН, так и при её отсутствии [43].
Оценка динамики развития ДН показывает, что концентрация IL-6 в моче пациентов коррелирует с показателем экскреции белка с мочой, измеренным спустя 3 года наблюдения [44].
По данным двойного слепого рандомизированного плацебо-контролируемого исследования, проведенного N. Noori et al., назначение пациентам с ДН липоевой кислоты в суточной дозе 800 мг и пиридоксина в суточной дозе 80 мг в течение 12 недель ассоциировано со снижением уровня альбуминурии, но не приводит к изменению сыво- роточных концентраций IL-6 и растворимых молекул адгезии sICAM-1 и sVCAM-1 [45].
Моноклональные антитела к провоспалительным цитокинам и их рецепторам, включая IL-6, широко используются в ревматологии. В частности, уже более 10 лет (сначала в Японии, а затем в Европе, США и Российской Федерации) для лечения ревматологических заболеваний применяется тоцилизумаб, который представляет собой рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору IL-6 из подкласса иммуноглобулинов IgG1. Тоцилизумаб селективно связывается и подавляет как растворимые, так и мембранные рецепторы IL-6 [46-48]. Крупномасштабные исследования эффектов тоцилизума-ба у пациентов с сахарным диабетом и его осложнениями только начинаются. В настоящее время проводится клиническое исследование EXTEND, посвященное изучению эффектов тоцилизумаба у пациентов с дебютом сахарного диабета 1 типа (NCT02293837). В конце 2017 г. ожидается начало исследования READ-4, в котором планируется изучить эффективность и безопасность тоцилизумаба в качестве монотерапии и в комбинации ранибизумабом (моноклональным фрагментом антител человека к эндотелиальному фактору роста А, VEGF-A) в лечении макулярного отека при сахарном диабете (NCT02511067) [49].
Альтернативной стратегией противовоспалительной терапии и нефропротекции является воздействие на активность металлопротеиназ, которые оказывают большое количество биологических эффектов, в том числе регулируют баланс между двумя вышеописанными путями передачи сигнала IL-6. Несмотря на обнадеживающие экспериментальные данные [50], первое клиническое исследование эффективности ингибитора металлопротеиназ XL784 при ДН (NCT00312780) не продемонстрировало значимого снижения протеинурии на фоне лечения [49].
Таким образом, многочисленными исследованиями убедительно доказано наличие взаимосвязи IL-6 с развитием инсулинорезистентности, нефропатии, гипертрофии миокарда, анемии и других патологических состояний, характерных для сахарного диабета и его осложнений. Клинически значимые эффекты данного цитокина зависят не только от его концентрации в сыворотке крови и тканях, но и от баланса между классическим и альтернативным путями передачи сигнала IL-6. Множественность эффектов цитокинов затрудняет поиск противовоспалительных стратегий нефропротекции. Тем не менее, нам представляется перспективным изучение вопросов индивидуализации сахароснижающей терапии и нефропротекции при сахарном диабете с учётом цитокинового профиля.
and progression of diabetic nephropathy with overt proteinuria // Adv.
Clin. Exp. Med. 2003 . Vol. 12. Pp. 723-729. 48.
Список литературы Интерлейкин-6 и диабетическая нефропатия: патогенетические связи, мишени для нефропротекции
- Ni W.J., Tang L.Q., Wei W. Research progress in signalling pathway in diabetic nephropathy//Diabetes Metab. Res. Rev. 2015. Vol. 31. Pp. 221-233.
- Zheng Z., Zheng F. Immune Cells and Inflammation in Diabetic Nephropathy//J. Diabetes Res. 2016. ID1841690.
- Kaul K., Hodgkinson A., Tarr J.M. Is inflammation a common retinal-renal-nerve pathogenic link in diabetes?//Curr. Diab. Rev. 2010. Vol. 6. Pp. 294-303.
- Navarro-Gonzalez J.F., Mora-Fernandez C., De Fuentes M.M. et al. Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy//Nat. Rev. Nephrol. 2011. Vol. 7. Pp. 327-340.
- Wada J., Makino H. Inflammation and the pathogenesis of diabetic nephropathy//Clin. Sci. (London). 2013 Vol. 124. Pp. 139-152.
- National Kidney Foundation. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 Update//Am. J. Kidney Dis. 2012. Vol. 60. Pp. 850-886.
- ERBP Clinical Practice Guideline on management of patients with diabetes and chronic kidney disease stage 3b or higher (eGFR №45 mL/min)//Nephrol. Dial. Transplant. 2015. Vol. 30. Suppl. 2. Pp. ii1-ii142.
- Eder K., Baffy N., Falus A., Fulop A.K. The major inflammatory mediator interleukin-6 and obesity//Inflamm. Res. 2009. Vol. 58. Pp. 727-736.
- Maggio M., Guralnik J.M., Longo D.L., Ferrucci L. Interleukin-6 in Aging and Chronic Disease: A Magnificent Pathway//J. Gerontol. A. Biol. Sci. Med. Sci. 2006. Vol. 61. Pp. 575-584.
- Rincon M. Interleukin-6: from an inflammatory marker to a target for inflammatory diseases//Trends Immunol. 2012 Vol. 33. Pp. 571-577.
- Scheller J., Garbers C., Rose-John S. Interleukin-6: from basic biology to selective blockade of pro-inflammatory activities//Semin. Immunol. 2014. Vol. 26. Pp. 2-12.
- Друцкая М.С., Носенко М.А, Атретханы К.-С.Н. и соавт. Интерлейкин-6 -от молекулярных механизмов передачи сигнала к физиологическим функциям и терапевтическим мишеням//Молекулярная биология. 2015. Т. 49. №6. С. 937-943.
- Chalaris A., Garbers C., Rabe B. et al. The soluble interleukin 6 receptor: generation and role in inflammation and cancer//Eur. J. Cell. Biol. 2011. Vol. 90. Pp. 484-494.
- Scheller J., Chalaris A., Schmidt-Arras D., Rose-John S. The pro-and anti-inflammatory properties of the cytokine interleukin-6//Biochim. Biophys. Acta. 2011. Vol. 1813. Pp. 878-888.
- Andersson C.X., Sopasakis V.R., Wallerstedt E., Smith U. Insulin antagonizes interleukin-6 signaling and is anti-inflammatory in 3T3-L1 adipocytes//J. Biol. Chem. 2007. Vol. 282. Pp. 9430-9435.
- Andreozzi F., Laratta E., Procopio C. et al. Interleukin-6 impairs the insulin signaling pathway, promoting production of nitric oxide in human umbilical vein endothelial cells//Mol. Cell. Biol. 2007. Vol. 27. Pp. 2372-2383.
- Senn J.J., Klover P.J., Nowak I.A., Mooney R.A. Interleukin-6 induces cellular insulin resistance in hepatocytes//Diabetes. 2002. Vol. 51. Pp. 3391-3399.
- Weber M.M., Michl P., Auernhammer C.J., Engelhardt D. Interleukin-3 and interleukin-6 stimulate cortisol secretion from adult human adrenocortical cells//Endocrinology. 1997. Vol. 138. Pp. 2207-2210.
- Barnes T.M., Otero Y.F., Elliott A.D. et al. Interleukin-6 amplifies glucagon secretion: Coordinated control via the brain and pancreas//Am. J. Physiol. Endocrinol. Metab. 2014. Vol. 307. Pp. E896-E905.
- Sahraoui A., Kloster-Jensen K., Ueland T. et al. Anakinra and tocilizumab enhance survival and function of human islets during culture: implications for clinical islet transplantation//Cell Transplant. 2014. Vol. 23. Pp. 1199-1211.
- Navarro-Gonzalez J. F., Mora-Fernandez C. The Role of Inflammatory Cytokines in Diabetic Nephropathy//J. Am. Soc. Nephrol. 2008. Vol. 19. P. 433-442.
- Fornoni A., Ijaz A., Tejada T. et al. Role of Inflammation in Diabetic Nephropathy//Curr. Diab. Rev. 2008. Vol. 4. Pp. 10-17.
- Navarro J.F., Milena F.J., Mora C. et al. Renal pro-inflammatory cytokine gene expression in diabetic nephropathy: Effect of angiotensin-converting enzyme inhibition and pentoxifylline administration//Am. J. Nephrol. 2007. Vol. 26. Pp. 562-570.
- Ayhan M., Guney E., Soysalatile N. et al. Preventive effects of alpha-lipoic acid on diabetic nephropathy in a rat model//Acta Med. Mediterr. 2014. Vol. 30. Pp. 1221-1225.
- Li R., Uttarwar L., Gao B. et al. High Glucose Up-regulates ADAM17 through HIF-1α in Mesangial Cells//J. Biol. Chem. 2015. Vol. 290. Pp. 21603-21614.
- Obama T., Takayanagi T., Kobayashi T. et al. Vascular induction of a disintegrin and metalloprotease 17 by angiotensin II through hypoxia inducible factor 1α//Am. J. Hypertens. 2015. Vol. 28. Pp. 10-14.
- Salem E.S., Grobe N., Elased K.M. Insulin treatment attenuates renal ADAM17 and ACE2 shedding in diabetic Akita mice//Am. J. Physiol. Renal. Physiol. 2014. Vol. 306. Pp. F629-F639.
- Riera M., Anguiano L., Clotet S. et al. Paricalcitol modulates ACE2 shedding and renal ADAM17 in NOD diabetic mice beyond proteinuria//Am. J. Physiol. Renal Physiol. 2015. Vol. 310. Pp. F534-F546.
- Raucci A., Cugusi S., Antonelli A. et al. A soluble form of the receptor for advanced glycation endproducts (RAGE) is produced by proteolytic cleavage of the membrane-bound form by the sheddase a disintegrin and metalloprotease 10 (ADAM10)//FASEB J. 2008. Vol. 22. Pp. 3716-3727.
- Худякова Н.В., Пчелин И.Ю., Шишкин А.Н. Иванов Н.В., Василькова О.Н. Гипергомоцистеинемия и кардиоренальный анемический синдром при сахарном диабете//Нефрология. 2015. Т. 19. №6. С. 20-27.
- Ray A., Huisman M.V., Tamsma J.T. et al. The role of inflammation on atherosclerosis, intermediate and clinical cardiovascular endpoints in type 2 diabetes mellitus//Eur. J. Int. Med. 2009. Vol. 20. Pp. 253-260.
- Zeng S.Y., Chen X., Chen S.R. et al. Upregulation of Nox4 promotes angiotensin II-induced epidermal growth factor receptor activation and subsequent cardiac hypertrophy by increasing ADAM17 expression//Can. J. Cardiol. 2013. Vol. 29. Pp. 1310-1319.
- Van der Vorst E.P., Jeurissen M., Wolfs I.M. et al. Myeloid A disintegrin and metalloproteinase domain 10 deficiency modulates atherosclerotic plaque composition by shifting the balance from inflammation toward fibrosis//Am. J. Pathol. 2015. Vol. 185. Pp. 1145-1155.
- Shitomi Y., Thøgersen I.B., Ito N. et al. ADAM10 controls collagen signaling and cell migration on collagen by shedding the ectodomain of discoidin domain receptor 1 (DDR1)//Mol. Biol. Cell. 2015. Vol. 26. Pp. 659-673.
- Newby A.C. Proteinases and plaque rupture: unblocking the road to translation//Curr Opin Lipidol. 2014. Vol. 25. Pp. 358-366.
- Yang L.N., Zhang P., Tang F. et al. Correlation between hepcidin level and renal anemia//Genet. Mol. Res. 2014. Vol. 13. Pp. 7407-7410.
- Quin C., Xiao Y., Zhong Q. et al. Anti-inflammatory effect of erythropoietin pretreatment on cardiomyocytes with hypoxia/reoxygenation injury and the possible mechanism//Chin. J. Traumatol. 2008. Vol. 11. Pp. 352-358.
- Zhang J., Zou Y.R., Zhong X. et al. Erythropoietin pretreatment ameliorates renal ischaemia-reperfusion injury by activating PI3K/Akt signalling//Nephrology (Carlton). 2015. Vol. 20. Pp. 266-272.
- Пчелин И.Ю., Шишкин А.Н., Коробицын Л.П. Проблема соотношения пользы и риска терапии средствами, стимулирующими эритропоэз, при диабетической нефропатии//Нефрология. 2010. Т. 14. № 3. С. 32-36.
- Papaoikonomou S., Tentolouris N., Tousoulis D. et al. The association of the 174G>C polymorphism of interleukin 6 gene with diabetic nephropathy in patients with type 2 diabetes mellitus//J. Diabetes Complications. 2013. Vol. 27. Pp. 576-579.
- Shikano M., Sobajima H., Yoshikawa H. Usefulness of a highly sensitive urinary and serum IL-6 assay in patients with diabetic nephropathy//Nephron. 2000. Vol. 85. Pp. 81-85.
- Пчелин И.Ю., Худякова Н.В., Шишкин А.Н. Взаимосвязь интерлейкина-6 и компонентов кардиоренального анемического синдрома при диабетической нефропатии//Вестник Санкт-Петербургского университета. Серия 11. Медицина. 2016. Вып. 2. С. 4-12.
- Svensson M.K., Eriksson J.W. Change in the amount of body fat and IL-6 levels is related to altered insulin sensitivity in type 1 diabetes patients with or without diabetic nephropathy//Horm. Metab. Res. 2011. Vol. 43. Pp. 209-215.
- Hruby Z., Sowiński D. Urinary excretion of growth factors/cytokines and progression of diabetic nephropathy with overt proteinuria//Adv. Clin. Exp. Med. 2003. Vol. 12. Pp. 723-729.
- Noori N., Tabibi H., Hosseinpanah F. et al. Effects of combined administration of lipoic acid and pyridoxine on serum systemic and vascular inflammatory factors in patients with diabetic nephropathy //Iran. J. Endocrinol. Metab. 2010. Vol. 12. Pp. 194.
- Nakahara H., Nishimoto N. Anti-interleukin-6 receptor antibody therapy in rheumatic diseases//Endocr. Metab. Immune Disord. Drug Targets. 2006. Vol. 6. Pp. 373-381.
- Kang S., Tanaka T., Kishimoto T. Therapeutic uses of anti-interleukin-6 receptor antibody//Int. Immunol. 2015. Vol. 27. Pp. 21-29.
- Насонов Е.Л. Новые направления фармакотерапии ревматических заболеваний -ингибиция интерлейкина 6 и интерлейкина 17//Современная ревматология. 2013. №3. С. 5-14.
- U.S. National Library of Medicine Clinical Trials Database. URL: https://clinicaltrials.gov.
- Williams J.M., Zhang J., North P. et al. Evaluation of metalloprotease inhibitors on hypertension and diabetic nephropathy//Am. J. Physiol. Renal Physiol. 2011. Vol. 300. Pp. F983-F998.


