Интраоперационная лучевая терапия в комбинированном лечении больных раком легкого и раком желудка
Автор: Зырянов Б.Н., Афанасьев С.Г., Завьялов А.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (1), 2002 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14053873
IDR: 14053873
Текст статьи Интраоперационная лучевая терапия в комбинированном лечении больных раком легкого и раком желудка
Применение интраоперационной лучевой терапии (ИОЛТ) в комбинированном лечении злокачественных новообразований различных локализаций становится одной из наиболее актуаль-
Рис. 1. Малогабаритный бетатрон МИБ – 6Э ных проблем современной клинической онкологии [1, 4–6]. В Томском НИИ онкологии РАМН интраоперационное облучение проводится с 1989 г. [2, 3]. Источником излучения служит малогабаритный бетатрон МИБ-6Э, разработанный в Томском НИИ интроскопии. Аппарат смонтирован непосредственно в операционном блоке (рис. 1). Конструкция потолочной подвески позволяет перемещать установку в трех взаимно перпендикулярных плоскостях. Во время 15-минутного сеанса облучения персонал покидает операционную, дистанционный контроль за состоянием пациента осуществляется при помощи телевизионной и телеметрической аппаратуры. Опыт десятилетнего применения разработанной методики проведения ИОЛТ выявил следующие преимущества новой врачебной технологии:
-
- устраняется необходимость транспортировки больного в радиологическое отделение;
-
- не требуется дорогостоящих строительных работ по переоборудованию операционного блока для обеспечения радиационной безопасности;
-
- конструкция бетатрона исключает неравномерность в распределении дозы на входе электронного пучка в облучаемую ткань;
-
- малая масса и компактность аппарата делают его чрезвычайно удобным в использовании;
-
- низкая стоимость бетатрона делает его доступным для медицинского учреждения.
Таблица 1
Больные, получившие ИОЛТ на малогабаритном бетатроне
Интраоперационная лучевая терапия применялась в качестве единственного компонента лучевого воздействия, с дополнительным послеоперационным облучением, а также в комплексе с полихимиотерапией.
Интраоперационное облучение проводится после удаления основного патологического очага. Выбор поля облучения осуществляется с учетом объема операции, наличия увеличенных лимфоузлов в бассейнах регионарного метастазирования, а также анатомических особенностей пациента.
После удаления легкого в поле облучения включаются трахео-бронхиальный угол, зона нижних бифуркационных лимфоузлов, паратра-хеальная и паравенозная клетчатка. При лобэктомии интраоперационное облучение дополнительно проводится на прикорневую часть оставшейся доли с находящимися в ней бронхопульмональными лимфоузлами при верхней лобэктомии и ретроперикардиальную зону при локализации опухоли в нижней доле.
Защита критических органов осуществляется удалением их за пределы поля облучения и дополнительным экранированием алюминиевыми пластинами толщиной 7 мм, которые снижают лучевую нагрузку на 96%. В большинстве случаев разовая доза ИОЛТ составляет 15–20 Гр, используется одно поле облучения. Во время сеанса облучения осуществляется дистанционный телевизионный и телеметрический контроль за состоянием пациента. Осложнений наркоза при проведении ИОЛТ не наблюдалось.
Больные раком легкого были разделены на две репрезентативные группы. Больным основной группы осуществлено комбинированное лечение с ИОЛТ, контрольная группа представлена пациентами, которым выполнена только радикальная операция. По основным прогностическим признакам группы больных сопоставимы. Для анализа отдаленных результатов прослежены исходы лечения в течение пяти лет после выписки из стационара. Все пациенты находились на диспансерном учете в поликлиническом отделении института и обследовались каждые 3 мес в первые два года после проведенного лечения и 1 раз в 6–12 мес в последующие 3 года. Изучение проводилось по следующим критериям: жив, умер, жив с рецидивами и/или отдаленными метастазами. Анализ отдаленной выживаемости проведен без учета послеоперационной летальности.
В исследование включены 85 больных немелкоклеточным раком легкого III стадии. Изучаемую группу составил 41 пациент, 44 – контрольную группу. По морфологическому строению опухоли преобладал плоскоклеточный рак и аденокарцинома легкого различной степени дифференцировки.
Чаще всего в качестве оперативного этапа лечения выполнялись резекции легких в объеме лобэктомий или билобэктомий, они выполнены 50 пациентам – 58,8% (табл. 2). В эту группу включены также больные, которым выполнены реконструктивные бронхопластические операции в сочетании с ИОЛТ.
Наиболее часто встречающимся осложнением явилась послеоперационная пневмония оставшейся доли легкого. При использовании ИОЛТ пневмония развилась у 4 пациентов (9,8%), в контрольной группе у 1 больного (2,2 %) (табл. 3). Основную роль в развитии пневмонии, вероятно, играет вовлечение прикорневой зоны оставшейся доли легкого в поле облучения. Лучевое воздействие приводит к развитию реактивного воспаления в раннем послеоперационном периоде, подтвержденного морфологическим исследованием .
Таблица 3
|
Характер осложнений, возникших у больных раком легкого III стадии в послеоперационном периоде |
||
|
Осложнения |
Метод лечения |
|
|
ИОЛТ |
Операция |
|
|
(n=41) |
(n=45) |
|
|
Острая пневмония |
4 (9,8%) |
1 (2,2%) |
|
Эмпиема плевры |
2 (4,9%) |
1 (2,2%) |
|
Бронхиальный свищ |
4 (9,8%) |
4 (8,9%) |
|
Гематоракс |
2 (4,9%) |
– |
|
Кровотечение |
1 (2,4%) |
3 (6,7%) |
|
Нагноение раны |
3 (7,3%) |
3 (6,7%) |
Обращают на себя внимание 2 случая свернувшегося гемоторакса после пневмонэктомии в группе больных с ИОЛТ. Вероятно, причиной этого является повышенная экссудация секрета в плевральную полость, длительно сохраняющийся геморрагический характер плеврального содержимого. Кроме того, существенно повышается содержание общего фибриногена в сыворотке крови, зафиксированное при изучении показателей свертывающей системы.
Послеоперационная летальность при комбинированном лечении рака легкого составила 7,1%, в группе контроля – 6,8%. Уровень послеоперационной летальности в основном зависел от объема выполненных операций.
При использовании интраоперационного облучения через 5 лет после лечения без признаков прогрессирования опухолевого процесса живы 13 из 38 больного раком легкого (34,2%), в контрольной группе 5-летний срок пережили 10 из 41
пациентов, что составило 24,4%. После комбинированного лечения 13 пациентов погибли в течение первых двух лет наблюдения, 12 больных умерли в последующие три года (рис. 2). Основной причиной гибели явилось отдаленное метастазирование. Двое больных умерли от сопутствующей патологии, в одном случае при секционном исследовании обнаружено метастатическое поражение печени.
Важнейшим критерием эффективности проведенного лечения являются длительность без-рецидивного периода, частота и сроки появления метастазов. Проведение интраоперационной лучевой терапии в СОД 15 Гр при раке легкого существенно уменьшает количество местных рецидивов. Так, при комбинированном лечении рецидивы обнаружены в 5 случаях (13,1%), в контрольной группе – в 11 (26,8%). В то же время сроки возникновения рецидивов существенно не отличались и составили 13,6 ± 1,2 мес. В группе больных с облучением метастазы выявлены у 24 человек (63,1%), в контрольной группе – у 30 больных, что составило 73,1%. Сочетание отдаленных метастазов и рецидива отмечено у 3 пациентов основной группы (7,8%) и у 7 больных контрольной группы (17,2%).
В дальнейшем нами разработана и внедрена в клиническую практику новая схема комбинированного лечения немелкоклеточного рака легкого III стадии, включающая радикальную операцию с ИОЛТ 15 Гр в сочетании с курсом послеоперационной дистанционной гамма-терапии и системной полихимиотерапии.
В зону послеоперационного облучения включается культя резецированного бронха и область средостения на стороне операции. В случае прорастания опухоли анатомических структур грудной полости предпринимается локальное облучение "сомнительных зон". Дистанционная гамматерапия (ДГТ) проводилась с 2 противоположных полей размерами от 10 х 15 до 14 х 18 см, в режиме обычного фракционирования: по 2 Гр 5 фракций в неделю, до суммарной очаговой дозы 30-40 Гр. Суммарная курсовая доза составила 55-66 Гр в зоне "очага-мишени". Для дозиметрического планирования сочетанного курса ИОЛТ и ДГТ создана компьютерная программа, которая обеспечивает возможность расчета суммарного распределения поглощенной дозы электронов и гамма-излучения, фактора ВДФ и той суммарной поглощенной дозы стандартного курса фотонной терапии, которая соответствует сочетанному курсу ИОЛТ и ДГТ. Послеоперационная полихимиотерапия проводилась по схеме РСМ:
-
- проспидин по 200 мг/м2 в/в через день № 8;
-
- циклофосфан по 750 мг/м2 в/в №2;
-
- метотрексат по 20 мг/м2 в/в № 2.
Полихимиотерапию начинали через 3-4 нед после завершения дистанционной гамма-терапии. Проводилось 5 курсов лечения в течение одного года с интервалом 6-8 нед.
Из числа общих лучевых реакций следует отметить появление слабости, снижение работоспособности и аппетита у 11 из 45 пациентов (24,4%). У двух больных развились явления лучевого эзофагита, что составило 4,4%. В этих случаях дистанционная лучевая терапия была прервана на дозе 25-30 Гр. Применение внутривенной химиотерапии по схеме РСМ в послеоперационном периоде у 45 пациентов с местнораспространенным немелкоклеточным раком легкого сопровождалось рядом общеизвестных осложнений, обусловленных токсическим действием цитостатиков на организм больного.
За двухлетний период наблюдения в группе больных, получивших комбинированное лечение с применением ИОЛТ и послеоперационной хи-миолучевой терапии, живы без рецидивов и метастазов 35 из 45 больных, или 77,7%, показатели двухлетней выживаемости в контрольной группе составили 62,3%. Прогрессирование процесса в виде отдаленного метастазирования отмечено у 9 пациентов (20,1%), из которых 8 умерло за истекший период (17,7%). В контрольной группе метастазы выявлены у 6 больных.
Предложенная схема комбинированного лечения значительно увеличивает продолжительность безрецидивного периода (19/10 мес) и существенно уменьшает количество рецидивов
(2 /13) по отношению к данным контрольной группы за период двухлетнего наблюдения (p<0,05).
Таблица 4
|
Осложнения |
Метод лечения |
|
|
ИОЛТ (n=42) |
Операция (n=67) |
|
|
Перитонит |
2 (4,8%) |
6 (8,9%) |
|
Острый панкреатит |
3 (7,1%) |
4 (5,9%) |
|
Нагноение раны |
2 (4,8%) |
4 (5,9%) |
|
Абсцесс брюшной полости |
- |
2 (2,9%) |
|
Спаечная непроходимость Послеоперационная |
1 (2,4%) |
1 (1,5%) |
|
пневмония Острая сердечно- |
2 (4,8%) |
5 (7,5%) |
|
сосудистая недостаточность |
1 (2,4%) |
1 (1,5%) |
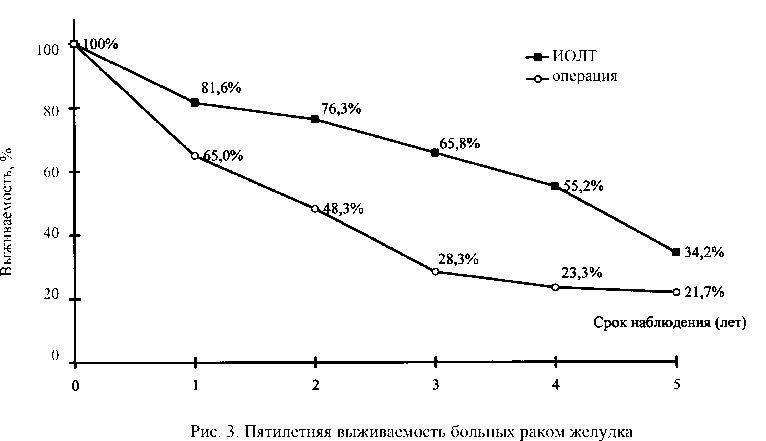
В настоящее время разработана программа комбинированного лечения с использованием интраоперационного облучения на фоне введения радиосенсибилизаторов 2 типов. Лечение проведено 51 больному, полученные предварительные результаты позволяют положительно оценить предложенный метод лечения.
Выводы


