Интраоперационная радиотерапия фотонной радио-хирургической системой в лечении местнораспространенного рака прямой кишки
Автор: Потемин С.Н., Уваров И.Б., Потемин Д.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.21, 2022 года.
Бесплатный доступ
Цель исследования - оценка результатов применения интраоперационной радиотерапии (ИОРТ) фотонной радиохирургической системой у пациентов с местнораспространенным раком прямой кишки (мРПК). Материал и методы. Проведен ретроспективный анализ результатов лечения 172 пациентов с гистологически подтвержденным РПК ii-iii стадии (pt3-4 или pN+), которым выполнена хирургическая операция и ИОРТ (n=92) или неоадъювантная дистанционная лучевая терапия (ДЛТ), операция и ИОРТ (n=80). ИОРТ проводилась фотонной радиохирургической системой intrabeam® (carl Zeiss meditec ag, oberkochen, Германия) с использованием сферических аппликаторов диаметром 4,5 см или 5,0 см. Процедура проводилась непосредственно после хирургического удаления опухоли. Разовая доза составляла 10-20 Гр. Средний период наблюдения для группы ИОРТ составил 25 мес, для группы ДЛТ/ИОРТ - 22 мес (p=0,52). результаты. Течение послеоперационного периода при использовании ИОРТ не имело специфических особенностей, профиль токсичности был низкий в обеих группах с общей частотой осложнений 5,4 %. Не отмечено значимых различий между обеими группами в показателях 4-летней общей выживаемости (59,1 % в группе ИОРТ против 67,4 % в группе ДЛТ/ИОРТ, р=0,66), выживаемости без прогрессирования (53,6 против 55,1 %, p=0,51) и выживаемости без местного рецидива (59,4 против 65,4 %, p=0,70). При дополнительном анализе подгрупп с РПК ii и iii стадии не обнаружено значимых различий в общей выживаемости между группами ИОРТ и ДЛТ/ИОРТ (p=0,63 и p=0,98 соответственно). Значимых различий в местном и отдаленном прогрессировании между обеими группами у пациентов ii стадии (р=0,5 и р=0,19 соответственно) и iii стадии (р=0,23 и р=0,75 соответственно) также не получено. заключение. ИОРТ при мРПК является безопасным методом, обеспечивающим достижение адекватного локального контроля, и может рассматриваться как эффективный метод лечения как в изолированном варианте, так и в интеграции в алгоритм мультимодального лечения в условиях специализированного онкологического учреждения.
Иорт, дистанционная лучевая терапия, рак прямой кишки
Короткий адрес: https://sciup.org/140290553
IDR: 140290553 | УДК: 616.351-006.6-08:615.849 | DOI: 10.21294/1814-4861-2022-21-1-20-28
Текст научной статьи Интраоперационная радиотерапия фотонной радио-хирургической системой в лечении местнораспространенного рака прямой кишки
Стандартной тактикой лечения местнораспространенного рака прямой кишки (мРПК) является неоадъювантная химиолучевая терапия с последующей операцией [1–4]. Предоперационная химио-лучевая терапия позволяет снизить риск местного рецидивирования, уменьшить объем опухоли и улучшить результат хирургического лечения [5]. Вместе с тем в реальной клинической практике существуют проблемы с доступностью современной технической базы для выполнения дистанционной лучевой терапии (ДЛТ), проблемы низкого комплаенса больных при «длительных» сроках курсового лечения, отказ или прерывание курса по различным причинам, сложности организационного характера во время длительного курса терапии и длительного постлучевого перерыва, в результате чего пациент не во всех случаях получает полный курс лечения и доходит до хирургического этапа. В этой связи большую актуальность имеют исследования, направленные на изучение менее ресурсоемких альтернатив традиционной химиолучевой терапии. Одним из таких подходов является ИОРТ, которая обеспечивает точную доставку однократной крупной фракции излучения (обычно 8–20 Гр) к зоне высокого риска рецидивирования непосредственно во время оперативного вмешательства, позволяя вывести за пределы поля облучения либо экранировать радиочувствительные структуры [6, 7].
Значительный опыт применения ИОРТ при различных злокачественных новообразованиях
накоплен отечественными онкологами [8–10]. За последние десятилетия опубликовано небольшое количество работ, сообщающих об использования ИОРТ при колоректальном раке в изолированном варианте [7, 9] либо в сочетании с неоадъювантной ДЛТ или химиолучевой терапией [11–14]. В связи с этим представляет интерес оценка результатов хирургического лечения мРПК с ИОРТ в сочетании с неоадъювантной ДЛТ (с химиотерапией (ХТ) или без нее) либо в самостоятельном варианте.
Цель исследования – оценка результатов применения интраоперационной радиотерапии (ИОРТ) фотонной радиохирургической системой у пациентов с местнораспространенным раком прямой кишки.
Материал и методы
Проведен ретроспективный анализ результатов лечения 172 пациентов (табл. 1) с гистологически подтвержденным диагнозом мРПК (II–III стадии, pT3–4 или pN+), перенесших радикальную операцию с ИОРТ с декабря 2012 по октябрь 2016 г. Больным выполнялись следующие операции: передняя резекция прямой кишки (ПРПК) с тотальной мезоректумэктомией, брюшно-промежностная экстирпация прямой кишки (БПЭПК), обструктивная резекция (операция Гартмана).
ИОРТ проводилась фотонной радиохирургической системой Intrabeam® (Carl Zeiss Meditec AG, Oberkochen, Германия) с использованием
таблица 1/table 1
характеристика групп пациентовgeneral characteristics of patients
|
Параметры/Parameters |
ИОРТ/IORT (n=92) |
ИОРТ+ДЛТ/ IORT+EBRT (n=80) |
p |
|
Медиана наблюдения, мес/Follow-up – median, months |
25 (0,9–62,5) |
22 (0–57,7) |
0,52 |
|
Возраст, лет/Age – median, years |
65,5 (38,0–83,0) |
65 (33,0–85,0) |
0,67 |
|
Мужской пол/Male |
49 (53,3 %) |
39 (48,8 %) |
0,55 |
|
Локализация опухоли/Tumor localization |
|||
|
Верхнеампулярная/Upper ampullar |
17 (18,5 %) |
5 (6,3 %) |
|
|
Среднеампулярная/Medium ampullar |
53 (57,6 %) |
19 (23,8 %) |
<0,0001 |
|
Нижнеампулярная/Lower ampullar |
22 (23,9 %) |
56 (70,0 %) |
|
|
T-стадия/T-stage |
|||
|
Т2 |
2 (2,2 %) |
2 (2,5 %) |
|
|
Т3 |
82 (89,1 %) |
59 (73,8 %) |
0,047 |
|
Т4a |
7 (7,6 %) |
14 (17,5 %) |
|
|
T4b |
1 (1,1 %) |
5 (6,3 %) |
|
|
N-стадия/N-stage |
|||
|
N0 |
78 (84,8 %) |
41 (51,3 %) |
|
|
N1 |
11 (12,0 %) |
25 (31,3 %) |
0,0001 |
|
N2 |
3 (3,3 %) |
14 (17,5 %) |
|
|
Стадии опухоли/Tumor stage |
|||
|
II |
77 (83,7 %) |
41 (51,3 %) |
|
|
IIА |
72 (87,3 %) |
32 (40,0 %) |
|
|
IIB |
5 (5,4 %) |
8 (10,0 %) |
|
|
IIC |
- |
1 (1,3 %) |
0,0001 |
|
III |
15 (16,3 %) |
39 (48,8 %) |
|
|
IIIA |
8 (8,7 %) |
13 (16,25 %) |
|
|
IIIB |
7 (7,6 %) |
24 (30,6 %) |
|
|
IIIC |
- |
2 (2,5 %) |
|
|
Гистология/Histology |
|||
|
Аденокарцинома/Adenocarcinoma |
91 (98,9 %) |
78 (97,5 %) |
|
|
Эпидермоидный рак/Epidermoid cancer |
1 (1,1 %) |
1 (1,2 %) |
0,5 |
|
Муцинозная карцинома с перстневидноклеточным |
1 (1,2 %) |
||
|
компонентом/Mucinous carcinoma with a signet ring |
|||
|
Дифференцировка/Differention |
|||
|
G1 |
4 (4,3 %) |
– |
|
|
G2 |
79 (85,9 %) |
72 (90,0 %) |
0,25 |
|
G3 |
8 (8,7 %) |
6 (7,5 %) |
|
|
Gx |
1 (1,1 %) |
6 (7,5 %) |
|
|
Размер опухоли, см/Tumor size,cm |
|||
|
Медиана/Median |
4,0 (1,5–9) |
5,0 (2,0–8,0) |
0,02 |
|
<2,5 |
5 (5,4 %) |
2 (2,6 %) |
|
|
2,5–4,0 |
43 (46,7 %) |
29 (36,3 %) |
|
|
> 4,0 |
44 (47,8 %) |
49 (61,3 %) |
|
|
Операция/Surgery |
|||
|
Высокая передняя резекция/High anterior resection |
15 (16,3 %) |
4 (5,0 %) |
|
|
Низкая передняя резекция/Low anterior resection |
63 (68,5 %) |
15 (18,8 %) |
|
|
Ультранизкая передняя резекция/Ultra-low anterior resection |
3 (3,3 %) |
1 (1,3 %) |
0,0001 |
|
Брюшно-промежностная экстирпация/ Abdomino-perineal resection |
8 (7,9 %) |
63 (75,0 %) |
|
|
Операция Гартмана/Hartmann's operation |
3 (3,3 %) |
1 (1,3 %) |
Окончание таблицы 1/end of table 1
Статистическую обработку проводили с использованием критерия ранговых сумм Вилкоксона, критерия Краскела–Уоллиса или t-теста для независимых групп. Для сравнения качественных дан- ных в пределах каждой когорты и межгрупповых различий использовали критерий χ2. Показатели общей выживаемости и выживаемости без прогрессирования определяли методом Каплана–Майера. Сравнение кривых выживаемости проводили с помощью лог-рангового критерия (log-rank-тест) или критерия Бреслоу (Breslow). Статистически значимой считалась разница переменных с соответствующими р-значениями ниже 0,05.
Результаты
В группе ИОРТ у 83,7 % пациентов имел место РПК II стадии, у 16,3 % – III стадии. В группе ИОРТ/ ДЛТ – 51,3 и 48,8 % соответственно (р<0,0001). В группе ИОРТ у большинства пациентов (57,6 %) выявлена среднеампулярная локализация опухоли, тогда как большинство пациентов (70,0 %) в группе ИОРТ/ДЛТ имели нижнеампулярный рак (p<0,0001). У 169 (98,2 %) пациентов опухоль была верифицирована как аденокарцинома, у 2 пациентов – эпидермоидный рак, у 1 – муцинозный рак. В большинстве случаев опухоли отнесены к G2 (85,9 % в группе ИОРТ и 90 % в группе ИОРТ/ ДЛТ). ИОРТ со средней дозой на поверхности аппликатора 15 Гр получили 92 (53,5 %) пациента. Среднее время сеанса ИОРТ составило 34,0 мин. Неоадъювантную ДЛТ получили 80 (46,5 %) пациентов (средняя доза 50,4 Гр) и ИОРТ. Только 2 (2,6 %) пациента получили менее 50,4 Гр. В группе ИОРТ/ДЛТ 20 (24,7 %) пациентов из 81 получили неоадъювантную ХТ. Адъювантную ХТ получали 10,9 % пациентов группы ИОРТ и 42,5 % из группы ДЛТ/ИОРТ. При анализе сравниваемых групп выявлены различия по характеру хирургического вмешательства – большинству пациентов (68,5 %) в группе ИОРТ была выполнена низкая передняя резекция, в то время как в группе ИОРТ/ДЛТ чаще (n=63, 75 %) выполнялась БПЭПК (p<0,0001).
Позитивные края резекции имели место у 10 пациентов, в группе ИОРТ частота выполнения R1-операции составила 3,3 %; в группе ДЛТ/ ИОРТ частота выполнения R1-операции – 6,3 %, R2 – 2,5 %. Течение послеоперационного периода не имело специфических особенностей и осложнений, связанных с ИОРТ. Общая частота осложнений в целом по группе (n=172) составила 5,4 %. Послеоперационные инфекционные осложнения наблюдались у 9 пациентов: инфекция раны брюшной стенки – у 3 (1,7 %), инфекция промежностной раны – у 6 (3,5 %), атония мочевого пузыря – у 1 больного. Зафиксирован один случай несостоятельности колоректального анастомоза (1/109 пациентов с анастомозом). Средняя длительность послеоперационного периода в стационаре составила 16,0 сут (от 5,0 до 42 сут), что не превышало соответствующий показатель для аналогичных операций без ИОРТ.
Средний период динамического наблюдения для группы ИОРТ составил 25 мес, для группы ДЛТ/ИОРТ – 22 мес (p=0,52). Прогрессирование опухолевого процесса наблюдалось у 25 больных. У 3 пациентов отмечен местный рецидив, у 23 – отдаленные метастазы. Между группами ИОРТ и ДЛТ/ИОРТ не было значимых различий во времени возникновения местного рецидива (p=0,68) либо прогрессирования (p=0,26). Не отмечено значимых различий между показателями общей выживаемости в сравниваемых группах – 59,1 против 67,4 % (р=0,66). Выживаемость без прогрессирования через 4 года в группе ИОРТ составила 53,6 мес; в группе ДЛТ/ИОРТ – 55,1 мес (p=0,51). Выживаемость без местного прогрессирования через 4 года – 59,4 и 65,4 % соответственно (p=0,70) (рис. 1).
Кроме того, мы отдельно проанализировали подгруппы пациентов с раком прямой кишки II и III стадии (рис. 2) и не обнаружили значимых различий в показателях общей выживаемости между группами ИОРТ и ДЛТ/ИОРТ (p=0,63 и p=0,98 соответственно). Значимых различий в местном и отдаленном прогрессировании между обеими группами у пациентов II стадии (р=0,5 и р=0,19 соответственно) и III стадии (р=0,23 и р=0,75 соответственно) также не получено (рис. 2).
Обсуждение
В последние годы ИОРТ становится все более популярной в онкохирургии. Во многих мультимодальных лечебных программах методика введена в качестве дополнительного к ДЛТ прицельного облучения ложа опухоли (буст – boost) либо самостоятельного метода лечения [15]. ДЛТ в адъювантном режиме обычно не применяется по меньшей мере в течение 2 нед после операции из-за процессов заживления ран. В течение этого периода остаточные опухолевые клетки могут продолжить пролиферировать и в конечном итоге стать причиной местного рецидива. При данных обстоятельствах ИОРТ имеет преимущество незамедлительного противоопухолевого воздействия на ложе опухоли, являясь эффективной методикой при опухолях торакоабдоминальной локализации, рецидивном колоректальном и гинекологическом раке, саркомах мягких тканей, опухолях головы и шеи, раке молочной железы, опухолях головного мозга [16–19].
В ряде одноцентровых исследований продемонстрировано, что ИОРТ эффективна в плане локального контроля при раке прямой кишки, в том числе
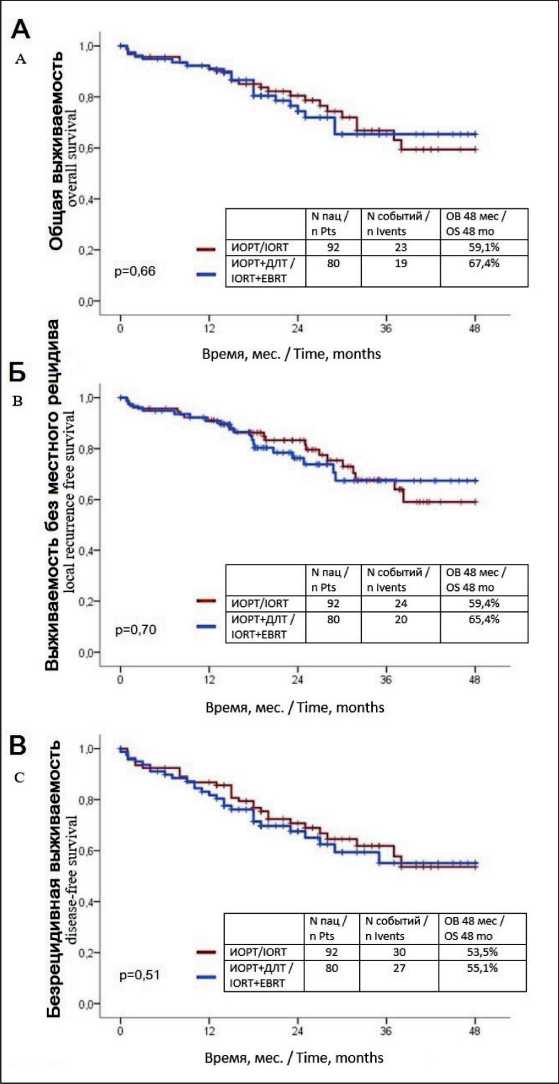
Рис. 1. Отдаленные результаты лечения с применение ИОРТ, анализ выживаемости по Каплан – Майеру:
А – общая выживаемость; Б – выживаемость без местного рецидива; В – безрецидивная выживаемость (без местного и общего прогрессирования)
Fig. 1. Long-term results of treatment with the use of IORT, survival rate according to Kaplan – Meier: A – Overall survival;
B – Local recurrence free survival; C – Disease-free survival (without local and general progression)
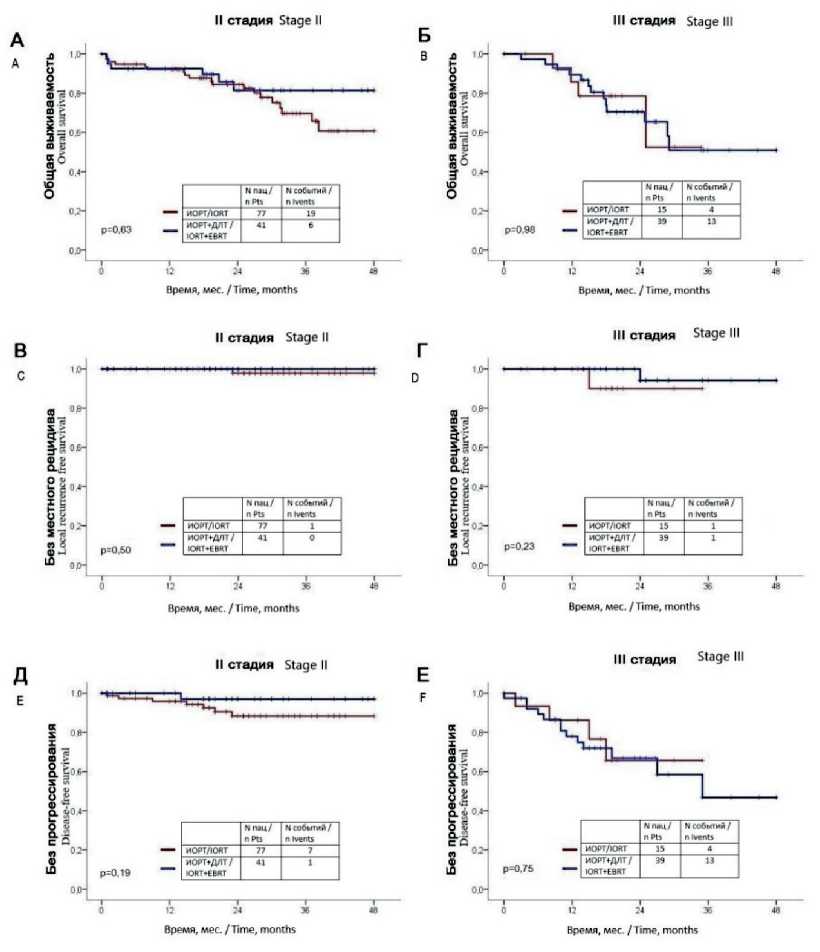
Рис. 2. Отдаленные результаты лечения с применение ИОРТ в зависимости от стадии заболевания, анализ выживаемости по Каплан–Майеру: А – общая выживаемость при II стадии; Б – общая выживаемость при III стадии; В – выживаемость без местного рецидива при II стадии; Г – выживаемость без местного рецидива при III стадии; Д – безрецидивная выживаемость (без местного и общего прогрессирования) при II стадии; Е – безрецидивная выживаемость (без местного и общего прогрессирования) при III стадии
Fig. 2. Long-term results of treatment with the use of IORT depending on the stage of the disease, survival rate according to Kaplan – Meier: A – overall survival at stage II; B – overall survival at stage III; C – survival without local recurrence at stage II; D – survival without local recurrence at stage III; E – disease-free survival (without local and general progression) at stage II; F – disease-free survival (without local and general progression) at stage III
и в сочетании с неоадъювантной химиолучевой терапией, причем наибольший эффект метод дает у пациентов с положительной циркулярной границей резекции [20–22]. В систематическом обзоре 29 исследований, включающих более 3000 пациентов с местнораспространенным первичным или рецидивным колоректальным раком, ИОРТ показал улучшение локального контроля, безрецидивной и общей выживаемости без увеличения частоты урологических и анастомотических осложнений
-
[23] . W.J. Alberda et al. показали, что пациенты с микроскопически положительными краями резекции, получавшие ИОРТ, имели значительно лучшую совокупную 5-летнюю безрецидивную выживаемость по сравнению с пациентами без ИОРТ (84 против 41 %, p=0,01) [12]. При многофакторном анализе было показано, что ИОРТ является независимым фактором, снижающим частоту местных рецидивов. Эти данные предполагают, что ИОРТ может найти свое место в алго-
- ритме лечения рака прямой кишки при опухолях с близкими или микроскопически положительными краями резекции.
В большинстве опубликованных работ ИОРТ при РПК проводилась с использованием устройств, генерирующих пучки электронов [24–26], или, реже, методом высокодозной брахитерапии, либо путем сочетания обеих технологий [27, 28]. Облучение электронным пучком требовало наличия специальной операционной с соответствующей радиационной защитой, оснащенной стационарным линейным ускорителем, либо транспортировки пациента на ИВЛ под наркозом из операционной в специально оборудованное помещение для лучевой терапии. Кроме того, коллиматор излучателя, установленный в ложе опухоли, обеспечивал доставку пучка электронов только в одном направлении, чем можно объяснить недостаточную эффективность метода в некоторых исследованиях [24].
В нашем исследовании мы использовали мобильную фотонную радиохирургическую систему Intrabeam PRS 500 (Carl Zeiss), представляющую собой миниатюрный линейный ускоритель, в котором пучок электронов направляется на золотую пластинку, находящуюся внутри сферического аппликатора для создания вторичного низкоэнергетического (30–50 кВ) рентгеновского излучения. Особенностью этой системы является то, что излучение доставляется через сферический аппликатор, обеспечивающий циркулярное распределение изотропной дозы, чем достигается более равномерный и эффективный охват целевого объема по сравнению с однонаправленными излучателями. Система генерирует низкоэнергетическое (не более 50 кВ) рентгеновское излучение, которое обладает высокой эффективностью воздействия на опухолевые клетки и в то же время, благодаря экспоненциальному затуханию, проникает в ткань всего на несколько миллиметров, что позволяет достигать высоких доз в ложе опухоли при малых дозах в окружающих органах. Низкоэнергетические рентгеновские лучи обладают более высокой относительной биологической эффективностью из-за увеличенного линейного переноса энергии (т.е. происходит больше разрывов двухцепочечной ДНК в облучаемых тканях), чем высокоэнергетические фотоны или электронные пучки. [29].
Представленное исследование носит ретроспективный характер и, таким образом, имеет некоторые ограничения. Во-первых, 5-летняя общая и безрецидивная выживаемость при мРПК, по данным зарубежных исследований, составляют 70–80 и 10–20 % соответственно [30, 31]. Уровень выживаемости в течение 4 лет в нашем исследовании был несколько ниже – около 60 %, однако частота местных рецидивов составила примерно 3 %, что может указывать на то, что было больше смертей, не связанных с прогрессированием опухоли, что может определяться демографическими особенностями популяции пациентов [32, 33]. Во-вторых, дисбаланс между группами по количеству пациентов с III стадией несколько ограничивал интерпретацию влияния ИОРТ в монорежиме. Эта проблема решена путем субанализа в подгруппах больных со II и III стадиями, где мы также не обнаружили значимых различий в общей выживаемости, локальном и общем прогрессировании, что свидетельствует о том, что ИОРТ оказывает положительное влияние при применении в монорежиме. Некоторое влияние на результаты мог оказать дисбаланс между группами по локализации опухоли (в группе ИОРТ частота опухоли в средней трети прямой кишки составила 58 %, в группе ИОРТ/ДЛТ, в нижней трети прямой кишки – 70 %) и, как следствие, различия по объему операций. Тем не менее результаты нашего исследования однозначно свидетельствуют о возможности обеспечения адекватного локального контроля у пациентов с РПК II стадии за счет применения ИОРТ без неоадъювантной ДЛТ.
Наши результаты подтверждают заключение о достаточно высокой безопасности ИОРТ фотонной радиохирургической системой Intrabeam®. Мы не наблюдали серьезных осложнений после ИОРТ, хотя средний период наблюдения в течение 5 лет может быть недостаточным, чтобы дать обоснованное заключение, особенно о поздней токсичности (такой как нейропатия). Тем не менее профиль токсичности ИОРТ очень низок, что согласуется с результатами предыдущих рандомизированных исследований [7, 24]. Не наблюдалось значимых различий в частоте хирургических осложнений и в сроках пребывания в стационаре.
Заключение
Использования фотонной радиохирургической системы является безопасной технологией ИОРТ при раке прямой кишки, не приводящей к критическому увеличению длительности операции, продолжительности госпитализации и не имеющей специфических осложнений. Данная медицинская технология обеспечивает адекватный локальный контроль при РПК II и III стадии как в самостоятельном варианте, так и в сочетании с дистанционным облучением и лекарственным лечением. Показатели общей и безрецидивной выживаемости при изолированном применении ИОРТ сопоставимы с ее использованием в комбинации с ДЛТ. ИОРТ может рассматриваться как эффективный метод лечения рака прямой кишки II и III стадии как в монорежиме, так и в интеграции в алгоритм мультимодального лечения РПК в условиях специализированного онкологического учреждения.
Список литературы Интраоперационная радиотерапия фотонной радио-хирургической системой в лечении местнораспространенного рака прямой кишки
- Petersen S.H., Harling H., Kirkeby L.T., Wille-Jørgensen P., Mocellin S. Postoperative adjuvant chemotherapy in rectal cancer operated for cure. Cochrane Database Syst Rev. 2012; 2012(3). doi: 10.1002/14651858.CD004078.pub2.
- Rodriguez-Bigas M.A., Chang G.J., Skibber J.M. Multidisciplinary approach to recurrent/unresectable rectal cancer: how to prepare for the extent of resection. Surg Oncol Clin N Am. 2010; 19(4): 847–59. https://doi.org/10.1016/j.soc.2010.07.001.
- Wong R.K., Tandan V., De Silva S., Figueredo A. Pre-operative radiotherapy and curative surgery for the management of localized rectal carcinoma. Cochrane Database Syst Rev. 2007; 2. doi: 10.1002/14651858. CD002102.pub2.
- Афанасьев С.Г., Старцева Ж.А., Тарасова А.С., Усова А.В., Самцов Е.Н. Результаты комбинированного лечения рака прямой кишки с применением пролонгированной предоперационной химиолучевой терапии. Сибирский онкологический журнал. 2012; 6: 5–12. [Afanasyev S.G., Startseva Zh.А., Tarasova А.S., Usova А.V., Samtsov Е.N. Results of combined modality treatment including preoperative plolonged chemotherary for rectal cancer. Siberian Journal of Oncology. 2012. 6: 5–12. (in Russian)].
- Li Y., Wang J., Ma X., Tan L., Yan Y., Xue C., Hui B., Liu R., Ma H.,Ren J. A review of Neoadjuvant Chemoradiotherapy for locally advanced rectal Cancer. Int J Biol Sci. 2016; 12(8): 1022–31. doi: 10.7150/ijbs.15438.
- Gunderson L.L. Rationale for and results of intraoperative radiation therapy. Cancer. 1994; 74(2): 537–41.
- Guo S., Reddy C.A., Kolar M., Woody N., Mahadevan A., Deibel F.C., Dietz D.W., Remzi F.H., Suh J.H. Intraoperative radiation therapy with the photon radiosurgery system in locally advanced and recurrent rectal cancer: retrospective review of the Cleveland clinic experience. Radiat Oncol. 2012; 7: 110. doi: 10.1186/1748-717X-7-110.
- Завьялов А А., Мусабаева Л.И., Лисин В.А., Чойнзонов Е.Л., Новиков В.А., Коломиец Л.А., Тузиков С.А., Афанасьев С.Г., Дубский С.В., Анисеня И.И., Тюкалов Ю.И., Миллер С.В., Добродеев А.Ю., Чивчиш Л.Н., Нечитайло М.Н., Жеравин А.А. Пятнадцатилетний опыт применения интраоперационной лучевой терапии. Сибирский онкологический журнал. 2004; 2–3: 75–84. [Zavyalov A.A., Musabaeva L.I., Lisin V.A., Choinzonov E.L., Novikov V.A., Kolomiets L.A., Tuzikov S.A., Afanasiev S.G., Dubsky S. V., Anisenya I.I., Tyukalov Yu.I., Miller S.V., Dobrodeev A.Yu., Chivchish L.N., Nechitailo M.N., Zheravin A.A. Fifteen years of experience in the use of intraoperative radiation therapy. Siberian Journal of Oncology. 2004; 2–3: 75–84. (in Russian)].
- Бердов Б.А., Скоропад В.Ю., Евдокимов Л.В., Титова Л.Н. Интраоперационная лучевая терапия в комбинированном лечении рака желудка и ободочной кишки. Онкохирургия. 2010; 2(3): 10–18. [Berdov B.A., Skoropad V.Yu., Evdokimov L.V., Titova L.N. Intraoperative radiotherapy in multimodal treatment of gastric and colon cancer. Oncosurgery. 2010; 2(3): 10–18. (in Russian)].
- Чойнзонов Е.Л., Мусабаева Л.И., Лисин В.А., Тюкалов Ю.И., Новиков В.А. Новая технология интраоперационной лучевой терапии в сочетании с дистанционной гамма-терапией при комбинированном лечении онкологических больных. Онкохирургия. 2010; 2(3): 26–36. [Choynzonov E.L., Musabaeva L.I., Lisin V.A., Tyukalov Yu.I., Novikov V.A. Novel technique of intraoperative electron radiation therapy with external radiation therapy for combined modality treatment in cancer patients. Oncosurgery. 2010; 2(3): 26–36. (in Russian)].
- Alberda W.J., Verhoef C., Nuyttens J.J., Rothbarth J., van Meerten E., de Wilt J.H., Burger J.W. Outcome in patients with resectable locally recurrent rectal cancer after total mesorectal excision with and without previous neoadjuvant radiotherapy for the primary rectal tumor. Ann Surg Oncol. 2014; 21(2): 520–6. doi: 10.1245/s10434-013-3306-x.
- Alberda W.J., Verhoef C., Nuyttens J.J., van Meerten E., Rothbarth J., de Wilt J.H., Burger J.W. Intraoperative radiation therapy reduces local recurrence rates in patients with microscopically involved circumferential resection margins after resection of locally advanced rectal cancer. Int J Radiat Oncol Biol Phys. 2014; 88(5): 1032–40. doi: 10.1016/j.ijrobp.2014.01.014.
- Haddock M.G. Intraoperative radiation therapy for colon and rectal cancers: a clinical review. Radiat Oncol. 2017; 12(1): 11. doi: 10.1186/s13014-016-0752-1.
- Schild S.E., Gunderson L.L., Haddock M.G., Wong W.W., Nelson H. The treatment of locally advanced colon cancer. Int J Radiat Oncol Biol Phys. 1997; 37(1): 51–8.
- Debenham B.J., Hu K.S., Harrison L.B. Present status and future directions of intraoperative radiotherapy. Lancet Oncol. 2013; 14(11). doi: 10.1016/S1470-2045(13)70270-5.
- Roeder F., Krempien R. Intraoperative radiation therapy (IORT) in soft-tissue sarcoma. Radiat Oncol. 2017; 12(1): 20. doi: 10.1186/s13014-016-0751-2.
- Weil R.J., Mavinkurve G.G., Chao S.T., Vogelbaum M.A., Suh J.H., Kolar M., Toms S.A. Intraoperative radiotherapy to treat newly diagnosed solitary brain metastasis: initial experience and long-term outcomes. J Neurosurg. 2015; 122(4): 825–32. doi: 10.3171/2014.11.JNS1449.
- Veronesi U., Orecchia R., Maisonneuve P., Viale G., Rotmensz N., Sangalli C., Luini A., Veronesi P., Galimberti V., Zurrida S., Leonardi M.C., Lazzari R., Cattani F., Gentilini O., Intra M., Caldarella P., Ballardini B. Intraoperative radiotherapy versus external radiotherapy for early breast cancer (ELIOT): a randomised controlled equivalence trial. Lancet Oncol. 2013; 14(13): 1269–77. doi: 10.1016/S1470-2045(13)70497-2.
- Pilar A., Gupta M., Ghosh Laskar S., Laskar S. Intraoperative radiotherapy: review of techniques and results. Ecancermedicalscience. 2017; 11: 750. doi: 10.3332/ecancer.2017.750.
- Ferenschild F.T., Vermaas M., Nuyttens J.J., Graveland W.J., Marinelli A.W., van der Sijp J.R., Wiggers T., Verhoef C., Eggermont A., de Wilt J. Value of intraoperative radiotherapy in locally advanced rectal cancer. Dis Colon Rectum. 2006; 49(9): 1257–65. doi: 10.1007/s10350-006-0651-x.
- Valentini V., Coco C., Rizzo G., Manno A., Crucitti A., Mattana C., Ratto C., Verbo A., Vecchio F.M., Barbaro B., Gambacorta M.A., Montoro C., Barba M.C., Sofo L., Papa V., Menghi R., D’Ugo D.M., Doglietto G. Outcomes of clinical T4M0 extra-peritoneal rectal cancer treated with preoperative radiochemotherapy and surgery: a prospective evaluation of a single institutional experience. Surgery. 2009; 145(5): 486–94. doi: 10.1016/j.surg.2009.01.007.
- Ratto C., Valentini V., Morganti A.G., Barbaro B., Coco C., Sofo L., Balducci M., Gentile P.C., Pacelli F., Doglietto G.B., Picciocchi A., Cellini N. Combined-modality therapy in locally advanced primary rectal cancer. Dis Colon Rectum. 2003; 46(1): 59–67. doi: 10.1007/s10350-004-6497-1.
- Mirnezami R., Chang G.J., Das P., Chandrakumaran K., Tekkis P., Darzi A., Mirnezami A.H. Intraoperative radiotherapy in colorectal cancer: systematic review and meta-analysis of techniques, long-term outcomes, and complications. Surg Oncol. 2013; 22(1): 22–35. doi: 10.1016/j.suronc.2012.11.001.
- Dubois J.B., Bussieres E.,. Richaud P., Rouanet P., Becouarn Y., Mathoulin-Pélissier S., Saint-Aubert B., Ychou M. Intra-operative radiotherapy of rectal cancer: results of the French multi-institutional randomized study. Radiother Oncol. 2011; 98(3): 298–303. doi: 10.1016/j.radonc.2011.01.017.
- Kusters M., Valentini V., Calvo F.A., Krempien R., Nieuwenhuijzen G.A., Martijn H., Doglietto G.B., del Valle E., Roeder F., Buchler M.W., van de Velde C.J.H., Rutten H.J.T. Results of European pooled analysis of IORT-containing multimodality treatment for locally advanced rectal cancer: adjuvant chemotherapy prevents local recurrence rather than distant metastases. Ann Oncol. 2010; 21(6): 1279–84. doi: 10.1093/annonc/mdp501.
- Masaki T., Takayama M., Matsuoka H., Abe N., Ueki H., Sugiyama M., Tonari A., Kusuda J., Mizumoto Sh., Atomi Yu. Intraoperative radiotherapy for oncological and function-preserving surgery in patients with advanced lower rectal cancer. Langenbecks Arch Surg. 2008; 173–80. doi: 10.1007/s00423-007-0260-8.
- Martinez-Monge R., Nag S., Martin E.W. Three different intraoperative radiation modalities (electron beam, high-dose-rate brachytherapy, and iodine-125 brachytherapy) in the adjuvant treatment of patients with recurrent colorectal adenocarcinoma. Cancer. 1999; 86(2): 236–47.
- Vermaas M., Nuyttens J.J., Ferenschild F.T., Verhoef C., Eggermont A.M., de Wilt J.H. Reirradiation, surgery and IORT for recurrent rectal cancer in previously irradiated patients. Radiother Oncol. 2008; 87(3): 357–60. doi: 10.1016/j.radonc.2008.02.021.
- Herskind C., Steil V., Kraus-Tiefenbacher U., Wenz F. Radiobiological aspects of intraoperative radiotherapy (IORT) with isotropic low-energy X rays for early-stage breast cancer. Radiat Res. 2005; 163(2): 208–15. doi: 10.1667/RR3292.
- Sauer R., Liersch T., Merkel S., Fietkau R., Hohenberger W., Hess C., Becker H., Raab H.R., Villanueva M.T., Witzigmann H., Wittekind C., Beissbarth T., Rödel C. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol. 2012; 30(16): 1926–33. doi: 10.1200/JCO.2011.40.1836.
- Guillem J.G., Chessin D.B., Cohen A.M., Shia J., Mazumdar M., Enker W., Paty P.B., Weiser M.R., Klimstra D., Saltz L., Minsky B.D., Wong W.D. Long-term oncologic outcome following preoperative combined modality therapy and total mesorectal excision of locally advanced rectal cancer. Ann Surg. 2005; 241(5): 829–36. doi: 10.1097/01.sla.0000161980.46459.96.
- Timonin S., Danilova I., Andreev E., Shkolnikov V.M. Recent Mortality Trend Reversal in Russia: Are Regions Following the Same Tempo? Eur J Popul. 2017; 33(5): 733–63. doi: 10.1007/s10680-017-9451-3.
- Poppe F., Annuss R., Kuhn J. Regional life expectancy rankings: methodological artefacts in population updates. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2017; 60(12): 1422–8. doi: 10.1007/s00103-017-2648-0.


