Интраоперационное цитологическое исследование сторожевых лимфатических узлов при гинекологическом раке: диагностическая точность и ограничения
Автор: Панкова О.В., Вторушин С.В., Климова М.В., Письменный Д.С., Очиров М.О., Коломиец Л.А., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 т.24, 2025 года.
Бесплатный доступ
Введение. Интраоперационная оценка состояния сторожевых лимфатических узлов у пациенток с гинекологическим раком играет ключевую роль в стадировании и определении объема хирургического вмешательства. Цитологический метод как альтернатива замороженным срезам представляет интерес с точки зрения доступности и оперативности. Цель исследования – оценить чувствительность, специфичность и диагностическую точность интраоперационного цитологического исследования сторожевых лимфатических узлов (СЛУ) у пациенток с ранними стадиями рака эндометрия и шейки матки. Материал и методы. В исследование включены 172 пациентки с I клинической стадией рака эндометрия (n=120) и шейки матки (n=52), прооперированные в условиях онкогинекологического отделения НИИ онкологии Томского НИМЦ. Всем пациенткам во время операции выполнялось интраоперационное цитологическое исследование мазков-отпечатков с поверхности СЛУ. Результаты сравнивались с данными последующего стандартного гистологического и иммуногистохимического анализа. Результаты. У пациенток с раком эндометрия чувствительность и специфичность интраоперационного цитологического метода составили 93,4 и 99,1 % соответственно. При раке шейки матки – 50 и 98 %. Общая диагностическая точность интраоперационного цитологического метода в исследуемой когорте составила 88 %. Основными причинами ложноотрицательных и ложноположительных результатов явились микрометастазы, эндосальпингоз и гистиоцитарная инфильтрация синусов лимфатических узлов. Выводы. Интраоперационное цитологическое исследование СЛУ – простой, быстрый и высокоспецифичный метод диагностики макрометастазов при гинекологическом раке. Несмотря на ограниченную чувствительность в выявлении микрометастатического поражения, метод может использоваться для принятия интраоперационных решений, особенно в условиях ограниченных ресурсов.
Интраоперационное цитологическое исследование, сторожевой лимфатический узел, рак эндометрия, рак шейки матки, диагностическая точность
Короткий адрес: https://sciup.org/140312765
IDR: 140312765 | УДК: 618.1-006.6:616.428-076.5 | DOI: 10.21294/1814-4861-2025-24-5-72-80
Текст научной статьи Интраоперационное цитологическое исследование сторожевых лимфатических узлов при гинекологическом раке: диагностическая точность и ограничения
Сторожевой лимфатический узел (СЛУ) представляет собой первый лимфатический коллектор, на который распространяется лимфогенный отток от первичной опухоли. Морфологическое исследование СЛУ стало стандартом стадирования злокачественных новообразований различных локализаций, включая опухоли молочной железы, кожи, головы и шеи, а также органов малого таза. При гинекологических опухолях интраоперационная оценка СЛУ позволяет уточнить объем необходимого хирургического вмешательства, избежать необоснованной лимфодиссекции и разработать персонализированную лечебную тактику. Наиболее распространенным методом интраоперационного анализа лимфатических узлов остается гистологическое исследование замороженных срезов, окрашенных по методу Diff–Quik. Однако этот подход имеет ряд ограничений, включая длительное время подготовки препаратов, возможность тканевых артефактов, потерю материала и снижение точности морфологической интерпретации. Учитывая эти ограничения, в ряде руководств данный метод не рекомендуется для рутинного применения при интраоперационном стадировании гинекологических опухолей [1, 2]. Тем не менее исследователи подчеркивают клиническую значимость интраоперационного выявления метастазов в СЛУ, особенно при наличии факторов высокого риска прогрессирования. Своевременная диагностика позволяет избежать повторных операций [3–5]. В этой связи альтернативным подходом, получившим распространение в клинической практике, стало интраоперационное цитологическое исследование мазков-отпечатков и соскобов с поверхности лимфатических узлов. Метод отличается относительной простотой, экономической эффективностью и, как показывают данные литературы, сопоставимой с гистологией диагностической ценностью [6–7]. В настоящем исследовании предпринята попытка комплексной оценки диагностических возможностей интраоперационной цитологии сторожевых лимфатических узлов у пациенток с ранними стадиями рака эндометрия и шейки матки.
Цель исследования – оценка возможностей интраоперационного цитологического исследования сторожевых лимфатических узлов у больных ранним раком эндометрия и шейки матки.
Материал и методы
В исследование включены 172 пациентки с ранними стадиями злокачественных опухолей тела матки и шейки матки, получавшие лечение в отделении онкогинекологии НИИ онкологии Томского НИМЦ. В общей группе преобладали пациентки с раком эндометрия (РЭ) I клинической стадии – 120 (69,8 %) случаев. Рак шейки матки (РШМ) Iв–IIа стадии диагностирован у 52 (30,2 %) пациенток, в этой группе проводилось органосохраняющее лечение в объеме радикальной трахелэктомии. Возраст пациенток варьировал от 33 до 72 лет (средний возраст – 52,5 года).
Сторожевые лимфатические узлы определяли радионуклидным методом с использованием радиофармацевтического лекарственного препарата (РФЛП) на основе меченного технецием-99m гамма-оксида алюминия (Сентискан). За сутки до операции больным РШМ проводилась инъекция РФЛП, отступая 5–10 мм от видимого края опухоли, остальным пациенткам инъекция выполнялась в строму шейки матки в суммарной дозе 80 MBq. Перед операцией проводилась однофотонная эмиссионная компьютерная томография, совмещенная с рентгеновским компьютерным томографом (ОФЭКТ/КТ) для определения дооперационной локализации СЛУ в анатомических областях. Интраоперационный поиск СЛУ проводился портативным гамма-сканером. «Сторожевым» считался узел, радиоактивность которого превышает радиоактивность окружающих тканей более чем в 3 раза или составляет не менее 10 % от уровня накопления РФП в месте инъекции. Выявленные СЛУ удалялись из брюшной полости, после чего проводилось повторное измерение уровня накопления РФЛП в проекции клетчатки для того, чтобы убедиться в удалении именно СЛУ. У больных РШМ проводилась тазовая лимфаденкэтомия
(ЛАЭ), в случае поражения СЛУ или при наличии опухолевых клеток по линии резекции проводилась конверсия на расширенную экстирпацию матки. При выявлении метастазов в СЛУ у больных РЭ проводится тазовая и поясничная ЛАЭ.
Во время оперативного вмешательства всем пациенткам выполнялось срочное интраоперационное цитологическое исследование сторожевых лимфатических узлов. Биоматериал доставлялся в патологоанатомическое отделение, где проводились его макроскопическое исследование и последующая пробоподготовка.
Объем и способ разреза СЛУ определяли в зависимости от размеров и конфигурации узла. При размере более 5 мм лимфатический узел рассекали на секции толщиной 2 мм. При размере ≤5 мм – делили пополам. При продолговатой конфигурации разрез проводили перпендикулярно длинной оси, при овальной или сферической – по экваториальной плоскости. С каждой стороны разреза изготавливалось не менее 2–4 мазков-отпечатков (рис. 1). При наличии плотных включений или участков в толще СЛУ дополнительно выполнялся соскоб с поверхности разреза.
Цитологические препараты окрашивали по ускоренному протоколу с использованием набора реагентов «Лейкодиф 200» (Чехия) в течение 15 с. Микроскопия осуществлялась на микроскопе «Zeiss Axio Scope.A1». Заключение выносилось при участии не менее двух врачей-цитологов.
Критериями метастатического поражения СЛУ считали наличие множественных комплексов опухолевых клеток, комплексов из 5–7 клеток либо дискретных опухолевых клеток числом от 2 до 5.
После завершения интраоперационного цитологического анализа ткань сторожевых лимфатических узлов фиксировали в 10 % нейтральном формалине, заливали в парафин и направляли на
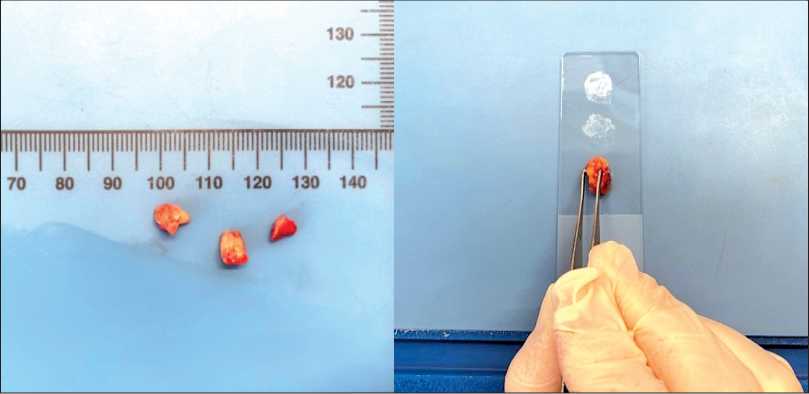
Рис. 1. Цитологическое интраоперационное исследование сторожевого лимфатического узла. Приготовление мазков-отпечатков с поверхности свежесрезанного СЛУ. Примечание: рисунок выполнен авторами
Fig. 1. Intraoperative cytological examination of the sentinel lymph node. Preparation of imprint smears from the cut surface of freshly excised SLN. Note: created by the authors
стандартное гистологическое и, при необходимости, на иммуногистохимическое исследование. Иммуногистохимическое окрашивание проводилось на автоматизированной платформе Bond RX (Leica Biosystems) с использованием антитела к панцитокератинам AE1/AE3 (клон AE1/AE3, Leica Biosystems), с применением системы полимерной детекции Bond Polymer Refine Detection.
Результаты
У пациенток с ранним раком эндометрия (n=120) в большинстве случаев (n=89; 74,2 %) на интраоперационное цитологическое исследование направлялись два сторожевых лимфатических узла, в 10 (8,4 %) наблюдениях исследовался один лимфоузел, в 18 (15,0 %) – три, в 3 (2,5 %) – четыре лимфоузла. Всего проанализировано 254 сторожевых лимфатических узла. Метастатическое поражение лимфоузлов при экспресс-цитологическом анализе диагностировано у 15 (12,5 %) пациенток. В большинстве случаев (13 из 15; 86,6 %) метастазы обнаружены при исследовании двух СЛУ, в одном случае – при анализе одного лимфоузла и в одном – трех лимфоузлов. У 105 (87,5 %) пациенток цитологическое исследование не выявило опухолевых клеток в сторожевых лимфатических узлах.
Сопоставление с результатами планового гистологического и иммуногистохимического (ИГХ) исследования показало, что в 14 из 15 случаев (93,4 %) диагноз метастатического поражения СЛУ был подтвержден – истинно положительный результат (рис. 2). В 1 (6,6 %) случае цитологическое заключение оказалось ложноположительным: гистологическое и ИГХ исследования не выявили опухолевого поражения лимфоузла. Среди 105 наблюдений с отрицательным цитологическим заключением морфологическое исследование подтвердило отсутствие опухолевых клеток в 104 (99 %) случаях – истинно отрицательный результат. В одном (1 %)
случае зарегистрирован ложноотрицательный результат: гистологически выявлен метастаз, не обнаруженный при цитологическом исследовании. Таким образом, чувствительность интраоперационного цитологического метода при раке эндометрия составила 93,4 %, специфичность – 99,1 %.
У пациенток с ранним раком шейки матки (n=52) в 46 (88,5 %) случаях на исследование направлялись два СЛУ, в 6 (11,5 %) – три лимфоузла. Всего было изучено 110 лимфатических узлов. Метастатическое поражение выявлено цитологически у 2 (3,9 %) пациенток. В обоих случаях метастазы обнаружены в одном из двух исследуемых лимфоузлов. У 50 (96,1 %) больных признаков метастазов по данным экспресс-цитологии не выявлено.
По результатам планового гистологического и ИГХ анализа у одной из двух пациенток метастатическое поражение лимфоузла подтвердилось (истинно положительный результат), во втором случае диагноз был опровергнут (ложноположительный результат). Из 50 пациенток с отрицательным цитологическим заключением у 49 (98 %) оно совпало с данными морфологического исследования (истинно отрицательный результат). В 1 (2 %) наблюдении цитологический анализ не позволил выявить метастаз, который был обнаружен гистологически – ложноотрицательный результат. Чувствительность цитологического метода при раке шейки матки составила 50 %, специфичность – 98 %.
В целом, при интраоперационном цитологическом исследовании СЛУ метастазы были выявлены у 17 (9,9 %) из 172 пациенток, в то время как у 155 (90,1 %) экспресс-цитология показала отсутствие опухолевого поражения. Плановые гистологическое и ИГХ исследования подтвердили наличие метастазов в 15 (88,2 %) из 17 случаев – истинно положительный результат. В двух наблюдениях (11,8 %) диагноз не подтвердился – ложноположительный результат. В одном случае причиной
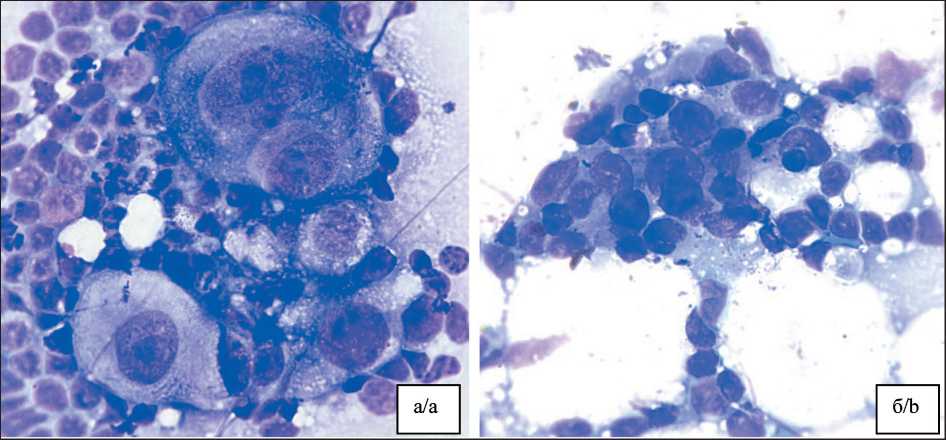
Рис. 2. Микрофото. Цитологические препараты сторожевых лимфатических узлов: а) метастазы эндометриоидной аденокарцинома; б) метастазы плоскоклеточного рака шейки матки. Окраска Лейкодиф, ×1000.
Примечание: рисунок выполнен авторами
Fig. 2. Microphoto. Cytological specimens of sentinel lymph nodes: a) metastases of ndometrioid adenocarcinoma, b) metastases of cervical squamous cell carcinoma. Leukodiff stain, ×1000. Note: created by the authors
гипердиагностики стала выраженная синусоидальная гистиоцитарная реакция, ошибочно интерпретированная как опухолевая инфильтрация (рис. 3). В другом случае железистоподобные клеточные комплексы, обусловленные эндосальпингозом, при цитологическом исследовании ошибочно были расценены как метастаз (рис. 4).
Среди 155 пациенток с отрицательным цитологическим заключением в 2 (1,3 %) случаях гистологически выявлены микрометастазы – ложноположительные результаты. В одном из них метастаз был менее 5 мм и не выходил за пределы капсулы узла. Пересмотр мазков показал наличие дискретных клеток с невыраженной атипией, расцененных как гистиоциты (рис. 5). Во втором случае метастаз имел размер менее 2 мм и, вероятно, не попал в срез, с которого готовились мазки.
Таким образом, суммарные показатели диагностической эффективности метода составили: чувствительность – 88,2 %, специфичность – 98,7 %, диагностическая точность – 88 %.
Обсуждение
Интраоперационное цитологическое исследование сторожевых лимфатических узлов у пациенток с раком эндометрия и шейки матки продемонстрировало высокую специфичность метода (98,7 %) и приемлемую чувствительность (88,2 %) при общей диагностической точности 88 %. Наибольшая эффективность была достигнута в подгруппе больных раком эндометрия, где чувствительность составила 93,4 %, что сопоставимо с результатами, представленными в литературе [1, 8, 9]. При раке шейки матки чувствительность метода была существенно ниже – 50 %, что, вероятно, обусловлено малым числом метастатических случаев в данной когорте (n=2) и ограниченным объемом выборки.
Полученные результаты подтверждают данные о высокой диагностической ценности интраоперационной экспресс-цитологии для выявления макрометастазов в лимфатических узлах. При этом на точность метода существенное влияние оказывают как морфологические особенности поражения, так
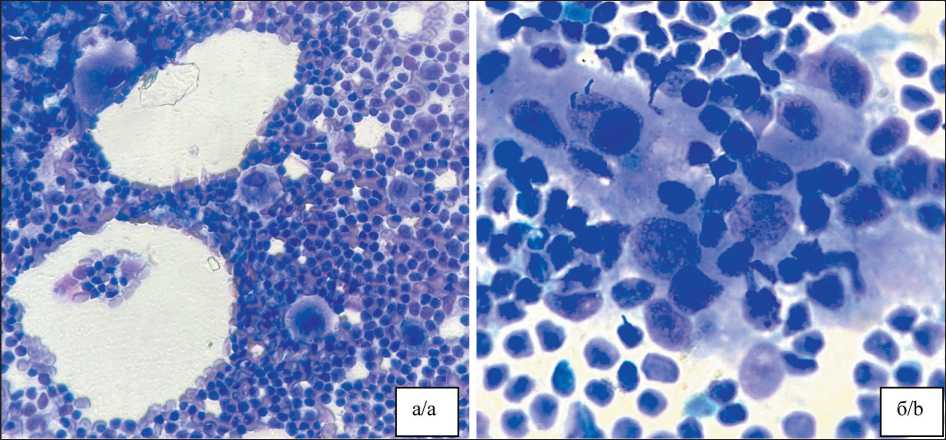
Рис. 3. Микрофото. Цитологический мазок: гистиоцитарная реакция синусов лимфоузла, ошибочно интерпретированная как метастаз рака эндометрия (ложноположительный результат). Окраска Лейкодиф: а) ×400; б) ×1000.
Примечание: рисунок выполнен авторами
Fig. 3. Microphoto. Cytological smear: sinus histiocytosis in a lymph node misdiagnosed as metastasis endometrial cancer (false-positive result). Leukodiff stain: a) ×400, b) ×1000. Note: created by the authors
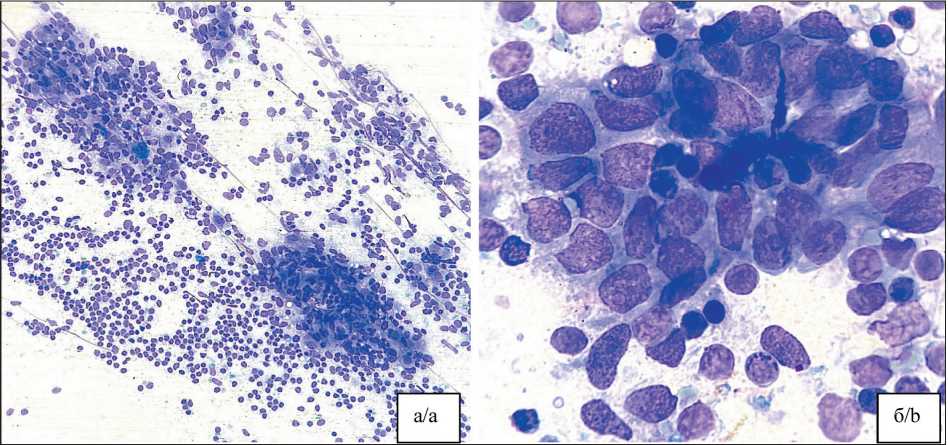
Рис. 4. Микрофото. Цитологический препарат: эндосальпингоз в лимфоузле, ошибочно расцененный как метастаз рака шейки матки (ложноположительный результат). Окраска Лейкодиф: а) ×100; б) ×1000. Примечание: рисунок выполнен авторами Fig. 4. Microphoto. Cytological specimen: endosalpingiosis in a lymph node misdiagnosed as metastasis of cervical cancer (false-positive result). Leukodiff stain: a) ×100, b) ×1000. Note: created by the authors
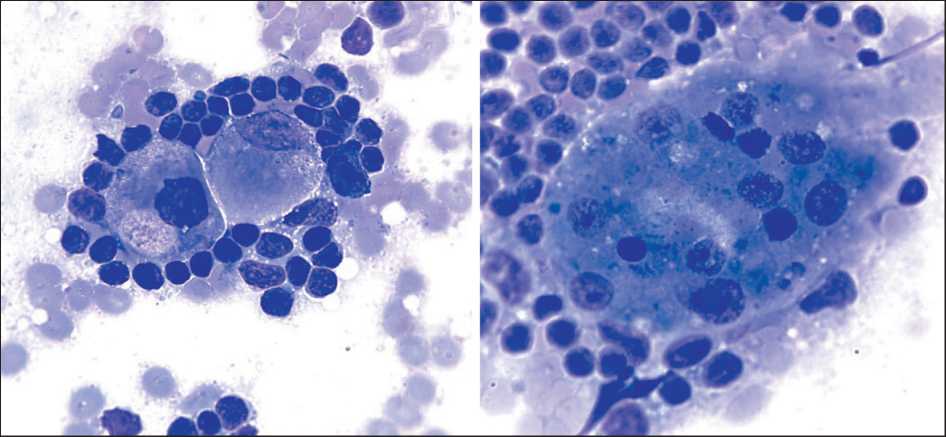
Рис. 5. Микрофото. Цитологический препарат: метастаз эндометриоидной аденокарциномы, ошибочно интерпретированный как гистиоцитарная инфильтрация (ложноотрицательный результат). Окраска Лейкодиф, ×1000.
Примечание: рисунок выполнен авторами
Fig. 5. Microphoto. Cytological specimen: metastasis of endometrioid adenocarcinoma misinterpreted as sinus histiocytosis (false-negative result). Leukodiff stain, ×1000. Note: created by the authors
и организационные факторы, включая технику забора материала, качество мазков и уровень подготовки цитологов.
Наиболее частой причиной ложноотрицательных результатов явилось наличие микрометастазов, размер которых не превышал 2–5 мм. В одном из наблюдений (рак эндометрия) при гистологическом и ИГХ исследованиях был выявлен метастаз размером менее 5 мм без признаков экстракапсулярной инвазии. Повторный анализ цитологических препаратов позволил обнаружить на фоне лимфоидного фона единичные клетки с невыраженными признаками атипии, расцененные как гистиоциты (рис. 5). В другом случае (рак шейки матки) микрометастаз не был выявлен при цитологическом исследовании, вероятно, из-за того, что соответствующий участок лимфоузла не попал в зону разреза, с которой готовились мазки.
Ложноположительные заключения также обусловлены определенными диагностическими ловушками. В одном случае причиной гипердиагностики стала выраженная синусоидальная гистиоцитарная инфильтрация, ошибочно интерпретированная как опухолевое поражение (рис. 3), что ранее также отмечалось в публикациях [10–11]. В другом случае – клетки эндосальпингоза, формировавшие железистоподобные скопления, были ошибочно приняты за опухолевые (рис. 4). Эти наблюдения подчеркивают необходимость осторожной интерпретации подозрительных клеточных структур и, при возможности, дополнительного применения экспресс-иммуномаркировки. По данным ряда авторов, экспресс-цитология обладает более высокой чувствительностью по сравнению с анализом замороженных срезов – 68–98 против 56–74 % соответственно [1, 9, 12, 13]. Особенно подчеркивается ее ценность в диагностике макрометастазов, тогда как выявление микрометаста-тического поражения остается затруднительным
[14–16]. По данным литературы, большинство ложноотрицательных случаев интраоперационного цитологического анализа при раке молочной железы были связаны именно с микрометастазами, размер которых не позволял клеткам попасть в мазки или соскобы [6, 9, 17].
Таким образом, наши результаты подтверждают, что основным ограничением интраоперационного цитологического метода остаются невозможность достоверной дифференциации микрометастазов и макрометастазов, а также риск пропуска метастатического очага при недостаточном объеме мазков. Тем не менее высокая специфичность метода и его простота делают его ценным инструментом для оперативного принятия клинических решений, особенно в учреждениях, где нет технической возможности выполнения срочной криостатной гистологии.
Заключение
Интраоперационное цитологическое исследование сторожевых лимфатических узлов при раке эндометрия и шейки матки является простым и высокоспецифичным методом диагностики метастатического поражения лимфоузлов. Наибольшая эффективность метода достигнута при выявлении макрометастазов, особенно у пациенток с ранними формами рака эндометрия, где чувствительность составила 93,4 %. Основными преимуществами цитологического подхода являются его техническая доступность, возможность выполнения в условиях ограниченных ресурсов и сокращение необходимости повторных операций у больных с высоким риском лимфогенного метастазирования. Метод особенно актуален в клиниках, не располагающих криостатным оборудованием для срочной гистологии. В то же время чувствительность метода ограничена при наличии микрометастазов, что связано как с объемом материала, так и с мор- фологическими особенностями метастатических клеток. Кроме того, цитологическая диагностика сопряжена с риском гипердиагностики при наличии гистиоцитарных реакций и доброкачественных железистоподобных структур, таких как эндосаль-пингоз. Увеличение количества мазков-отпечатков, мультифокальный соскоб с поверхности СЛУ, а также использование экспресс-иммунного окрашивания в сомнительных случаях могут повысить чувствительность и надежность метода. Несмотря на отдельные ограничения, интраоперационная цитология может рассматриваться как ценное дополнение к алгоритму хирургического стадирова-ния гинекологических опухолей.


