Интраперитонеальное химиоперфузионное лечение диссеминированного рака яичника диоксадэтом в сравнении с цисплатином в эксперименте
Автор: Беспалов В.Г., Беляева О.А., Киреева Г.С., Сенчик К.Ю., Стуков А.Н., Беляев А.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (62), 2014 года.
Бесплатный доступ
Проведено сравнительное изучение противоопухолевой активности цисплатина и диоксадэта в химиоперфузионном лечении на модели асцитной опухоли яичника (ОЯ) у 172 самок крыс линии Вистар. Асцитная ОЯ перевивалась внутрибрюшинно по 0,5 мл асцитической жидкости каждой крысе в концентрации 2×10 7 опухолевых клеток/мл. Препараты вводили однократно через 48 ч после перевивки ОЯ в максимально переносимых дозах (МПД). Нормотермическую интраперитонеальную химиоперфузию (НИПХ) и гипертермическую интраперитонеальную химиоперфузию (ГИПХ) с цисплатином и диоксадэтом осуществляли в дозах, в 5−20 раз превышающих дозы этих препаратов при их обычном интраперитонеальном введении. Противоопухолевые эффекты препаратов оценивали по увеличению продолжительности жизни животных. При нормо- и гипертермической химиоперфузии цисплатин увеличивал МПЖ на 317 % и 183 % (р
Нормо-и гипертермическая интраперитонеальная химиоперфузия, опухоль яичников, диоксадэт, цисплатин
Короткий адрес: https://sciup.org/14056413
IDR: 14056413 | УДК: 618.11-006:615.28]-092.9
Текст научной статьи Интраперитонеальное химиоперфузионное лечение диссеминированного рака яичника диоксадэтом в сравнении с цисплатином в эксперименте
Заболеваемость раком яичника (РЯ) в России составляет 2,5 % в общей структуре заболеваемости злокачественными новообразованиями и 4,6 % среди гинекологических опухолей (3-е место после рака тела и шейки матки). Согласно данным попу- ляционных регистров, 5-летняя выживаемость при РЯ варьирует в пределах от 12 до 42 % [4]. Прогрессирование РЯ происходит преимущественно в виде диссеминации по брюшине с развитием карциноматоза [1]. Для лечения перитонеального карцино- матоза и асцита используется внутрибрюшинная (в/б) химиотерапия цитостатиками, позволяющая увеличить концентрацию лекарственного вещества в брюшной полости, усилить его проникновение в опухолевую ткань и уменьшить системное токсическое действие [8].
Одним из вариантов в/б химиотерапии является высокотехнологичный метод интраперитонеальной химиоперфузии. Сочетание данного метода лечения с локальной гипертермией рассматривается как перспективный вариант лечения карциноматоза брюшной полости, позволяющий значительно увеличить выживаемость больных диссеминированным РЯ. Согласно данным одного из последних метаанализов гипертермическая интраперитонеальная химиоперфузия (ГИПХ) с цисплатином или другими цитостатиками после циторедуктивной операции обеспечивает среднюю продолжительность жизни пациентов с РЯ до 64 мес, тогда как при стандартной внутривенной химиотерапии цисплатином этот показатель составляет около 30 мес. Однако результаты этого же исследоваия свидетельствуют о том, что токсичность химиотерапии III степени регистрировалась у 40 % больных, IV степени – у 15 % больных [6]. Для улучшения результатов лечения больных с диссеминированным РЯ и снижения токсичности в/б химиотерапии необходим поиск новых противоопухолевых препаратов [2].
В «НИИ онкологии им. Н.Н. Петрова» был разработан отечественный противоопухолевый препарат из группы алкилирующих соединений этиленими-нов – диоксадэт, обладающий высоким контактным противоопухолевым действием [5]. Ранее нами было показано, что при обычном в/б введении в максимально переносимых дозах (МПД) диоксадэт проявил противоопухолевую активность, сравнимую с цисплатином [3]. В то же время диоксадэт отличается меньшей системной токсичностью и не вызывает спаек в брюшной полости, что характерно для цисплатина [5].
Цель исследования – изучить противоопухолевое действие диоксадэта в сравнении с цисплатином в химиоперфузионном лечении РЯ в эксперименте.
Материал и методы
Исследование проведено на 172 самках крыс линии Вистар с массой тела 200–260 г из питомника «Рапполово» РАМН. Животные получали стандартный полнорационный брикетированный комбикорм (рецепт ПК-120) производства компании «Лабора- торкорм» (Москва) и водопроводную питьевую воду без ограничений.
Использован штамм ОЯ, созданный в 1958 г. перевивкой ОЯ от крысы, подвергшейся трансплацентарному воздействию 7,12-диметилбенз(а)антрацена. Штамм ОЯ был получен из РОНЦ им. Н.Н. Блохина РАМН. При проведении эксперимента штамм ОЯ постоянно перевивали в/б нескольким крысам: всего для поддержания штамма были использованы 44 крысы. От одной крысы на 5–7-й день после перевивки ОЯ брали асцит, разбавляли его стерильным физиологическим раствором и вводили в/б точное количество опухолевых клеток (1×107) всем крысам, включенным в эксперимент.
После перевивки ОЯ крысы рандомизировались на 9 групп: I группа (n=19) – контроль (0,5 мл физиологического раствора в/б); II группа (n=11) – нормотермическая интраперитонеальная перфузия физиологическим раствором (НИПП); III группа (n=14) – гипертермическая интраперитонеальная перфузия физиологическим раствором (ГИПП); IV группа (n=12) – цисплатин, растворенный в физиологическом растворе в дозе 4 мг/кг массы тела в/б; V группа (n=12) – цисплатин при НИПХ (нормотермическая интраперитонеальная химиоперфузия) в дозе 40 мг/кг; VI группа (n=14) – цисплатин при ГИПХ в дозе 20 мг/кг; VI группа (n=19) – диоксадэт, растворенный в физиологическом растворе в дозе 1,5 мг/кг массы тела в/б; VII группа (n=14) – диокса-дэт при НИПХ в дозе 30 мг/кг; VIII группа (n=13) – диоксадэт при ГИПХ в дозе 15 мг/кг. Все описанные манипуляции проводились однократно через 48 ч после перевивки ОЯ.
США). Использованы лекарственные препараты: ди-оксадэт, цисплатин (Фармахеми Б.В., Нидерланды) в виде раствора для инъекций (0,5 мг/мл), гемобаланс (Nature Vet, Австралия), кетопрофен (Фламакс, ЗАО «ФармФирма «Сотекс», Россия), тиопентал натрия (ОАО «Акционерное Курганское общество медицинских препаратов и изделий «Синтез», Россия), цефтриаксон (Медокеми Лтд., Кипр). Диоксадэт в виде порошка для приготовления раствора для инфузий был синтезирован компанией «Кемконсалт» (Россия) в соответствии с лабораторным технологическим регламентом синтеза данного препарата.
Перед проведением перфузии в брюшную полость помещали цифровой термометр и катетеры на приток (в левой подвздошной области) и на отток (в правой подвздошной области) жидкости и затем зашивали в 2 слоя абдоминальную стенку с использованием стерильного рассасывающегося шовного материала для мышечной ткани и плетеного нерассасывающегося стерильного шовного материала для кожи. Температура перфузата, поступавшего в брюшную полость, составляла 36–37°С при НИПХ и 40,5–41,5°С при ГИПХ. Время перфузии составляло 45 мин, объем перфузата - 200 мл. После химиоперфузии проводилась промывка брюшной полости 0,9 % раствором натрия хлорида (20 мин), катетеры и термометры вынимались, и стенка брюшной полости зашивалась таким же образом. На протяжении операции крыса лежала на теплой грелке для предотвращения гипотермии организма. В день после операции и через
24 ч животному внутримышечно вводили цефтриаксон (Медаксон, «Медокеми Лтд.», Кипр) в дозе 93 мг/кг, гемобаланс подкожно 0,1 мл и 10 мл 0,9 % раствора натрия хлорида подкожно.
Результаты оценивали по продолжительности жизни крыс. День перевивки ОЯ был принят за нулевой. Противоопухолевые эффекты препаратов оценивали по увеличению продолжительности жизни (УПЖ) по сравнению с контрольными животными, не получавшими лечения.
УПЖ в % рассчитывали по формуле:
МПЖО – МПЖК
УПЖ = ———————— × 100, МПЖК где МПЖО и МПЖК –, медиана продолжительности жизни крыс опытной и контрольной группы соответственно.
Результаты эксперимента подвергали статистической обработке на персональном компьютере с помощью программ GraphPad Prism 6, SPSS Statistics 17.0. Статистический анализ показателей выживаемости проводили с использованием критерия Лиллиефорса, показателей МПЖ в группах – с помощью непараметрического критерия U (Манна – Уитни), кривых выживаемости – по тесту Мантел – Кокса (Long-rank test). Различия считали статистически значимыми при p<0,05.
Результаты исследования
Статистически значимые различия от контроля по кривым выживаемости в результате лечения ци-
Влияние диоксадэта и цисплатина при обычном и химиоперфузионном введении на продолжительность жизни у крыс самок с асцитной опухолью яичника
Таблица
|
Группа |
Показатель |
||
|
СПЖ, сут |
МПЖ, сут |
УПЖ по сравнению с I группой |
|
|
I. Контроль (n=19) |
14,4 ± 2,28 |
9 |
- |
|
II. НИПП (n=11) |
14,8 ± 1,52 |
16 |
78 % |
|
III. ГИПП (n=14) |
29,6 ± 6,13 |
22,5 I |
150 % |
|
IV. Цисплатин в/б (n=12) |
22,8 ± 2,41 |
19,5 I, II |
117 % |
|
V. Цисплатин НИПХ (n=12) |
39,3 ± 5,67 |
37,5 I, II, IV |
317 % |
|
VI. Цисплатин ГИПХ (n=14) |
34,6 ± 6,48 |
25,5 I |
183 % |
|
VII. Диоксадэт в/б (n=19) |
28,5 ± 3,24 |
28 I, II |
211 % |
|
VIII. Диоксадэт НИПХ (n=14) |
30,14 ± 3,95 |
31 I, II |
244 % |
|
IX. Диоксадэт ГИПХ (n=13) |
46,2 ± 6,44 |
49 I, III, VII |
444 % |
Примечание: разница статистически значима: I – по сравнению с I группой, II – по сравнению со II группой, III – по сравнению с III группой,IV - по сравнению с IV группой, VII – по сравнению с VII группой. СПЖ – средняя продолжительность жизни.
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2014. № 2 (62)
сплатином и диоксадэтом наблюдались с 9-х сут и до конца эксперимента. По тесту Мантела – Кокса статистически значимые различия наблюдались между кривыми выживаемости нормотермической химиоперфузии цисплатином (р=0,0002), диокса-дэтом (р=0,0005) и физиологическим раствором и отсутствовали между кривыми выживаемости гипертермической химиоперфузии цисплатином (р=0,6117), диоксадэтом (р=0,0958) и физиологическим раствором (таблица, рис. 1).
Как видно из таблицы, при НИПХ с цисплатином (V группа) и диоксадэтом (VIII группа) по сравнению с I группой наблюдали увеличение МПЖ соответственно на 317 % (p<0,001) и 244 % (p=0,001), причем при НИПХ цисплатин (V группа) по сравнению с его обычным в/б введением (IV группа) увеличивал МПЖ на 92 % (p=0,039), а диоксадэт (VIII группа) – лишь на 11 % (p>0,05). При ГИПХ с цисплатином (VI группа) и диоксадэ-том (IX группа) по сравнению с I группой наблюдали увеличение МПЖ соответственно на 183 % (p=0,002) и 444 % (p<0,001). Причем для цисплатина статистически значимой разницы по сравнению с его обычным в/б введением (IV группа) и ГИПП с физиологическим раствором (III группа), не было, тогда как диоксадэт при ГИПХ (IX группа) по сравнению с его обычным в/б введением (VII группа) и ГИПП с физиологическим раствором (III группа) увеличивал МПЖ соответственно на 75 % (p=0,002) и 118 % (p=0,038) (таблица).
Обсуждение
Применение цисплатина и диоксадэта в виде НИПХ и ГИПХ увеличивает их противоопухолевую активность, причем усиление противоопухолевых эффектов цисплатина проявляется больше при НИПХ, а диоксадэта при ГИПХ. Следовательно, технология химиоперфузионного лечения позволяет вводить цитостатики в значительно более высоких дозах по сравнению с обычным в/б введением, без сопутствующего увеличения токсичности за счет фиксированного уровня всасывания химиопрепаратов в системный кровоток из брюшной полости [7]. Так, в данном исследовании НИПХ с цисплатином и диоксадэтом осуществлялась в дозах 40 и 30 мг/кг массы тела соответственно, что в 10 и 20 раз превышает МПД препаратов при их обычном внутрибрюшинном введении, тогда как ГИПХ – в дозах 20 и 15 мг/кг массы тела соответственно, что в 5 и 10 раз превышает
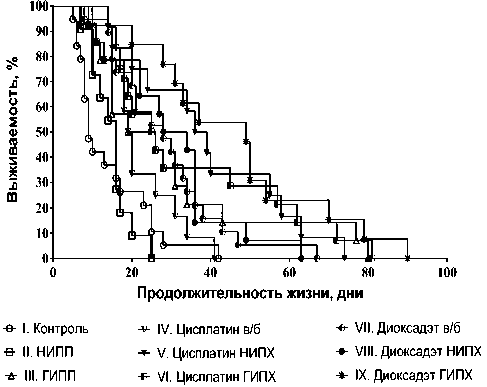
Рис. 1. Влияние диоксадэта и цисплатина при нормо- и гипертермической химиоперфузии на выживаемость животных с опухолью яичников.
Примечание: НИПП – нормотермическая интраперитонеальная перфузия; ГИПП – гипертермическая интраперитонеальная перфузия; НИПХ – нормотермическая интраперитонеальная химиоперфузия; ГИПХ – гипертермическая интраперитонеальная химиоперфузия
МПД препаратов при их обычном интраперитонеальном введении.
Полученные в ходе эксперимента результаты позволяют говорить о том, что химиоперфузионное лечение диссеминированного РЯ является более эффективным, чем стандартная интраперитонеальная химиотерапия. Наибольшее увеличение выживаемости экспериментальных животных было выявлено в группе, получавшей ГИПХ с диокса-дэтом. На основании этого данный режим может быть рекомендован для внедрения в клиническую практику для лечения карциноматоза брюшины у больных с далеко зашедшими стадиями РЯ.
Заключение
В эксперименте на самках крыс линии Вистар с перевиваемой асцитной ОЯ показано, что интраперитонеальная нормо- и гипертермическая химиоперфузии позволяют вводить цитостатические препараты в значительно более высоких дозах, чем при обычном внутрибрюшинном введении, что увеличивает выживаемость животных. НИПХ или ГИПХ с диоксадэтом или цисплатином увеличивают МПЖ на 75–92 % по сравнению с их обычным в/б введением. В условиях НИПХ противоопухолевое действие цисплатина проявляется сильнее действия диоксадэта. С другой стороны, диоксадэт при ГИПХ более эффективен в лечении диссеминированного РЯ, чем цисплатин. У крыс с перевитой ОЯ по сравнению с нелеченными животными УПЖ при ГИПХ с цисплатином составило 183 %, при ГИПХ с диоксадэтом – 444 %.
Работа выполнена при поддержке гранта Минобрнауки России «Разработка инновационной технологии лечения диссеминированного рака яичника», Соглашение 8305, и стипендии Президента Российской Федерации молодым ученым и аспирантам, осуществляющим перспективные научные исследования и разработки по приоритетным направлениям модернизации российской экономики, на 2012–2014 годы «Разработка инновационного противоопухолевого лекарственного препарата для химиоперфузионного лечения канцероматоза брюшины».


