Ионообменное концентрирование неорганических анионов из водных растворов
Автор: Бондарева Л.П., Кунахова Е.Н., Никулина А.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Фундаментальная и прикладная химия, химическая технология
Статья в выпуске: 4 (70), 2016 года.
Бесплатный доступ
Мониторинг природных вод в настоящее время - трудоемкий процесс, на точность которого влияет множество факторов: состав воды, наличие примесей и «мешающих» компонентов - поэтому процесс пробоподготовки воды достаточно часто включает в себя стадию концентрирования и выделения определяемых ионов. Наиболее универсальным, эффективным и по-этому часто применяемым методом концентрирования неорганических анионов из водных растворов является ионообменное сорбционное концентрирование, которое при различном исходном составе природных вод приводит к требуемому для иден-тификации и количественного определения содержанию анионов в элюате. В работе сравнены сорбционные характеристики высокоосновных анионообменных смол АВ-17 и Purolite А430 по отношению к хлорид-, нитрат- и сульфат-ионам. Значения констант протолиза обоих ионообменников АВ 17 и Purolite A430 совпадают и равны 0,037 ± 0,002. Величина полной обмен-ной емкости (ПОЕ) Purolite A430 составила 4,3 ммоль/г, АВ 17 - 3,4 ммоль/г. Изучаемые ионообменники имеют одинаковый тип ионогенных групп - четвертичные аммониевые, но их количество различается и выше в Purolite A430, соответственно количество поглощенных анионов для этого ионита выше. Значения динамической обменной емкости (ДОЕ) ионита Purolite A430 выше, чем у АВ-17 и равны 1,48 ± 0,03 ммоль/дм3 для хлорид-иона, 1,50 ± 0,03 ммоль/дм3 для нитрат-иона,1,62 ± 0,03 ммоль/дм3 сульфат-иона. Полученные значения ПОЕ и ДОЕ анионообменных смол Purolite А430 и АВ-17 и характеристики индивидуальной сорбции хлорид-, нитрат-, сульфат-ионов показали преимущество Purolite в концентрировании анионов. Уста-новлено, что при сорбции анионов из тройных растворов на Purolite A430 времена сорбции существенно различаются, а на анионообменнике АВ-17 близки, что доказывает возможность количественного разделения и концентрирования рассмотрен-ных анионов на смоле Purolite A430..
Анионы, ионообменная смола, полная обменная емкость, динамическая обменная емкость, выходная кривая сорбции, концентрирование, количественное определение
Короткий адрес: https://sciup.org/140229654
IDR: 140229654 | DOI: 10.20914/2310-1202-2016-4-222-227
Текст научной статьи Ионообменное концентрирование неорганических анионов из водных растворов
Анализ природных вод – это одно из наиболее развивающихся направлений химического анализа, проводимого лабораториями. От качества природной воды зависит не только здоровье живых организмов, населяющих ее, но и людей, а также деятельность предприятий, которые используют природную воду в технологических процессах. Эффективный количественный химический анализ природных и сточных вод на сегодняшний день является актуальным
направлением аналитической химии, позволяет оперативно и достаточно точно проводить оценку не только качества природных и технологических вод, но и являться несомненно важным критерием при оценке состояния экосистемы данной местности в целом.
Мониторинг природных вод в настоящее время – трудоемкий процесс, на точность которого влияет множество факторов, в том числе и входящие в состав воды примеси – «мешающие» компоненты. Еще одной проблемой при проведении
анализа воды является малое содержание определяемых ионов при одновременном присутствии значительных количеств макропримесей. Поэтому процесс пробоподготовки воды достаточно часто включает в себя стадию концентрирования и выделения определяемых ионов. Наиболее универсальным, эффективным и поэтому часто применяемым методом концентрирования неорганических анионов из водных растворов является ионообменное сорбционное концентрирование, которое при различном исходном составе природных вод приводит к требуемому для идентификации и количественного определения содержанию анионов в элюате.
Таким образом, целью работы стало установление эффективных условий концентрирования и разделения анионов из водных растворов на анионообменных смолах.
Объекты и методы исследования
Концентрирование хлорид-, нитрат-, сульфат-ионов из водных сред проводили на ионообменных смолах АВ-17 и Purolite А430. Анионит АВ-17 является монофункциональным высокоосновным сорбентом полимериза-ционного типа, обладает хорошей осмотической стабильностью, высокой химической стойкостью к воздействию щелочей, кислот, окислителей; нерастворим в воде и органических растворителях. Широко применяется для умягчения и обессоливания воды, а также очистки оборотных и сточных вод [1]. Анионит Purolite А430 – гелевый сорбент с полистироль-ной матрицей и функциональными группами четвертичного аммония [2] – является новым промышленным сорбентом, применяемым для снижения уровня желчных кислот и уменьшения содержания холестерина в крови.
Кондиционирование и перевод в рабочую форму анионообменников проводили последовательной обработкой раствором гидроксида натрия с концентрацией 0,5 моль/дм3, затем дистиллированной водой, затем раствором соляной кислоты с концентрацией 0,5 моль/дм3, и снова дистиллированной водой. Каждый реагент брался в двух-, трехкратном избытке по сравнению с содержанием обменных групп в обрабатываемом образце . Таким образом, получали анионообменники в рабочей ОН-форме.
Для определения констант кислотно-основного равновесия и полной обменной емкости (ПОЕ) анионообменников применяли титрование образцов OH-формы методом отдельных навесок в статических условиях. В мерные колбы вводили возрастающие объемы 0,05 моль/дм3 раствора НСl и по 0,100 г. исследуемого сорбента
(в расчете на сухое вещество). Равновесие в растворе устанавливалось в течение 20 дней при условии неизменного рН внешнего раствора. При расчете обменной емкости положение скачка титрования устанавливали в дифференциальных координатных осях.
Для проведения сорбции в динамических условиях 10,00 г. ионообменника в рабочей форме помещали в колонку с внутренним диаметром 13 мм и высотой 30 см и оставляли на несколько часов для набухания. После этого через колонку пропускали раствор каждого из определяемых ионов с концентрацией 0,03 моль/дм3 со скоростью 0,033 см3/с или смесь анионов с суммарной концентрацией 0,1 моль/дм3 и получали выходные кривые ионного обмена. Для этого через определенные промежутки времени проводили отбор проб фильтрата на выходе из колонки и определяли в них концентрацию определяемых ионов.
Определение концентраций хлорид-ионов проводили методом аргентометрического титрования, нитрат-ионов – потенциометрического титрования с ион-селективным электродом. Концентрацию сульфат-ионов определяли осаждением слаборастворимого сульфата бария с последующим растворением осадка в растворе трилона Б в аммиачной среде и титровании избытка трилона Б раствором, содержащим ионы магния, с эриохромовым черным Т в качестве индикатора [3]. Фильтрацию раствора через сорбент прекращали, когда содержание насыщающего иона в фильтрате становилось равным его содержанию в исходном растворе.
Динамическую обменную емкость (ДОЕ) анионообменников по исследуемым ионам рассчитывали по формуле:
Z ( С о -С ) V
ДОЕ= , m где Со – исходная концентрация хлорид-ионов, моль/дм3; С– концентрация хлорид-ионов в каждой пробе фильтрата, моль/дм3; V – объем раствора хлорида натрия, пропущенного через слой сорбента до «проскока» поглощаемого иона, дм3; m– масса анионобменника в слое, г.
Для исследования сорбции анионов из раствора, содержащего NaCl, NaNO 3 , Na 2 SO 4 с концентрацией каждого компонента 0,033 моль/дм3, смесь пропускали через колонку со скоростью, равной 0,015 см3/с, отбирали пробы фильтрата и определяли в них концентрации анионов описанными выше методами.
Определение концентрации анионов в фильтрате и элюате многокомпонентного раствора проводили методом капиллярного электрофореза. Система капиллярного электрофореза «КАПЕЛЬ-104Т» управляется с лицевой панели с помощью встроенной клавиатуры и дисплея через систему меню, результат анализа выводится на внешний компьютер. Обработка результатов проводится с помощью программного обеспечения «МультиХром», которое, кроме управления прибором, позволяет собирать и обрабатывать электрофоретические данные.
Обсуждение результатов
-
1.1 Определение полной обменной емкости и констант кислотно-основного равновесия анионообмеников
Анионообменник АВ-17 давно и широко применяется, поэтому его характеристики описаны в литературе. Purolite A430 только начинает выходить на рынок, поэтому в работе определены некоторые его характеристики экспериментально. Кривая кислотно-основного титрования, приведенная на рисунке 1, имеет типичный для сильнокислотного сорбента вид и позволяет рассчитать показатель константы кислотно-основного равновесия (р К а) и параметр n , связанный с электростатическим взаимодействием функциональных групп. Для этого применяли уравнение Гендерсона-Хассельбаха [4]:
рКа = рН + n lg .
1 - а
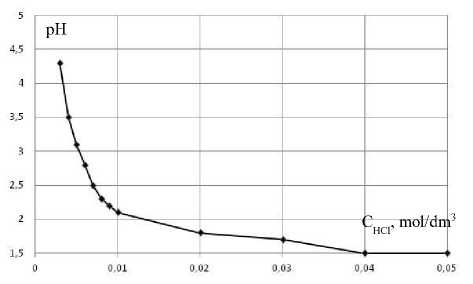
Рисунок 1. Кривая кислотно-основного титрования ионообменника PuroliteA430 в ОН-форме
Figure1. The curve of the acid-base titration, ion exchanger Purolite A430 in the form of OH
Значения констант протолиза обоих ионообменников АВ 17 и Purolite A430 совпадают и равны 0,037 ± 0,002. Величина ПОЕ Purolite A430 составила 4,3 ммоль/г, АВ 17 – 3,4 ммоль/г. Таким образом, изучаемые ионообменник имеют одинаковый тип ионогенных групп – четвертичные аммоние-вые, но их количество выше в Purolite A430.
-
1.2 Сорбция индивидуальных ионов
По результатам исследования сорбции индивидуальных анионов в динамических условиях построены выходные кривые, отражающие зависимость концентрации ионов в фильтрате от объема попущенного очищаемого раствора, примеры которых показаны на рисунках 2 и 3.
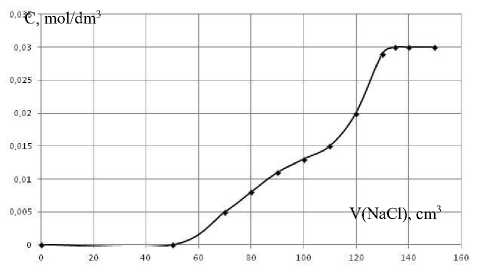
Рисунок 2. Выходная кривая сорбции хлорид-ионовна АВ-17
Figure2. Output curve of sorptionchloride ions on AB-17
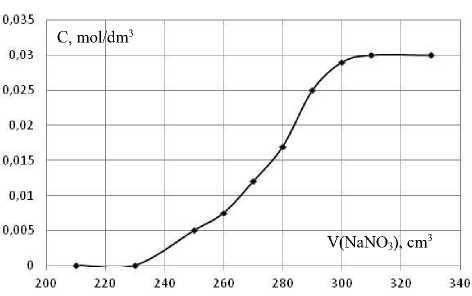
Рисунок 3. Выходная кривая сорбции нитрат-ионовна Purolite А 430
-
Figure3. Output curve of sorption nitrate ions to Purolite A 430
Полученные в работе выходные кривые сорбции анионов на обоих ионообменниках имеют вид «полуволн». Начальный участок для нитрат- и хлорид-ионов размыт, а конечный заострен, что может свидетельствовать о преобладании внешнедиффузионного лимитирования в кинетике процесса, то есть реализации «пленочного механизма» [5,6]. При сорбции сульфат-ионов кривые имеют размытые начальный и конечный фронты, что характеризует смешанно-диффузионную кинетику, то есть обмен достаточно большого аниона контролируется внутренней и внешней диффузией.
Изучение сорбции индивидуальных анионов позволило установить и сравнить времена «проскока» и рассчитать динамические обменные емкости анионообменников по каждому определяемому иону.
Таблица 1.
Характеристики сорбции анионов в динамических условиях
Table 1.
Anions sorption characteristics under dynamic conditions
|
Характеристика / Characteristic |
Аноны / Annonas |
||
|
Cl- |
NO 3 - |
SO 4 2- |
|
|
АВ-17 AV-17 |
|||
|
Динамическая обменная емкость, ммоль/дм3 Dynamic exchange capacity, mmol/dm3 |
1,06 ± 0,02 |
0,95 ± 0,01 |
1,42 ± 0,03 |
|
Время проскока (мин) при скорости пропускания 0,033 см3/с Breakthrough time (min) at a flow rate of 0.033 cm3/s |
10 |
40 |
50 |
|
Максимальное время концентрирования, мин Maximum concentration, min |
112 |
142 |
178 |
|
Purolite A430 |
|||
|
Динамическая обменная емкость, ммоль/дм3 Dynamic exchange capacity, mmol/dm3 |
1,48 ± 0,03 |
1,50 ± 0,03 |
1,62 ± 0,03 |
|
Время проскока (мин) при скорости пропускания 0,033 см3/с Breakthrough time (min) at a flow rate of 0.033 cm3/s |
120 |
||
|
Максимальное время концентрирования, мин Maximum concentration, min |
178 |
222 |
355 |
Результаты изучения индивидуальной сорбции анионов показывают, что ионообменная смола Purolite А430 является более эффективным сорбентом, чем АВ-17, для концентрирования хлорид-, нитрат- и сульфат-ионов из водных растворов за счет большей проницаемости и значения ДОЕ. Причины повышенной эффективности сорбции на Purolite А430 по сравнению с АВ-17 заключаются в более высокой полной обменной емкости и улучшенных гидродинамических характеристиках ионообменника.
-
1.3 Сорбция анионов из многокомпонент-ныхрастворов
Солевой состав природных вод определяется макрокомпонентами: катионами и анионами НСO3-, Сl-, SO 4 2-. Остальные анионы присутствуют в значительно меньших количествах и называются микрокомпонентами; они не определяют химический тип воды, к ним относятся гидроксид-, нитрит-, нитрат-, силикат-, фосфат- и фторид-ионы. В работе была приготовлена смесь, состоящая из двух макрокомпонентов хлорид- и сульфат-ионов, а также одного микрокомпонента нитрат-ионов. В работе проведено концентрирование анионов из трехкомпонентных растворов высокоосновными анионообменниками в динамических условиях.
Поскольку при использованной скорости пропускания индивидуальных ионов обменная емкость реализуется не полностью, то при исследовании тройных систем скорость пропускания уменьшили в 2 раза, и она составила 0,015 см3/с.
Изучение тройных растворов вели по методике, описанной выше. По полученным результатам строили выходные кривые сорбции, представленные на рисунках 4 и 5.
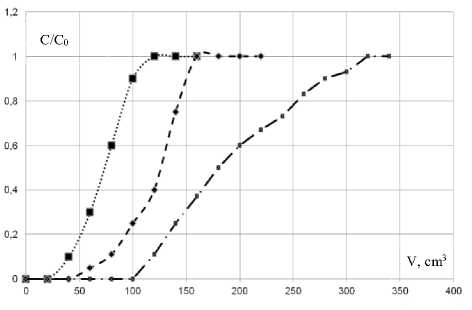
Рисунок 4. Выходные кривые сорбции:∙∙∙ – хлорид-ионов, – нитрат-ионов, -∙-∙ – сульфат-ионов на ионообменной смоле АВ-17измногокомпонентных растворов
-
Figure4. Sorptioncurves:∙∙∙ – chloride ions, nitrate ions –, – ∙ – ∙ – sulfate ions on the ion exchange resin AB-17 of a multi-component solution
Насыщение сорбентов хлорид-, нитрат- и сульфат-ионами происходит при разных объемах очищаемых растворов. На ионообменной смоле АВ-17 хлорид- и нитрат-ионы выходят при близких объемах, последним в фильтрате появляется сульфат-ион. Из смолы Purolite A430 хлорид-ионы выходят первыми, вторыми – нитрат-ионы и третьми – сульфат-ионы. Насыщение сульфат-ионами протекает полнее, чем другими ионами. Подтверждением данного предположения являются максимальные времена сорбции для каждого иона на обоих ионообменниках, представленные в таблице 1.
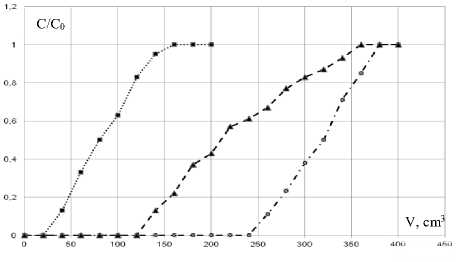
Рисунок 5. Выходные кривые сорбции: ∙∙∙ – хлорид-ионов, – нитрат-ионов, -∙-∙ – сульфат-ионов на ионообменной смоле PuroliteA430 из многокомпонентных растворов
-
Figure5. Sorption curves: ∙∙∙ – chloride ions, nitrate ions –, – ∙ – ∙ – sulfate ions on the ion exchange resin is Purolite A430 from multicomponent solutions
Установлено, что при сорбции анионов из тройных растворов на анионообменнике Purolite A430 времена сорбции различаются, а на анионообменнике АВ-17 близки и отсутствуют приемлемые области и индивидуальной идентификации ионов, что доказывает возможность количественного разделения изученных анионов на смоле Purolite A430.
Для подтверждения полученных результатов проведено сравнение определяемых концентраций в модельных смесях, содержащих три вида анионов. В качестве метода сравнения выбран капиллярный электрофорез. Результаты концентрирования и определения представлены в таблице 2.
Таблица 2.
Характеристики концентрирования анионов на Purolite A430
Table 2.
Characteristics of the concentrating of anions on Purolite A430
|
Анион Anion |
Концентрация в исходном растворе, мг/дм3 The concentration in the initial solution, mg/dm3 |
Концентрация в элюате, мг/дм3 The concentration in the eluate, mg/dm3 |
Коэффициент концентрирования The ratio of concentrationing |
Степень извлечения, % Recovery rate, % |
|
Cl- |
81 ±4 |
280 ±20 |
3,5 |
94 |
|
NO 3 - |
28 ±2 |
160 ±10 |
5,8 |
96 |
|
SО4 -2 |
130 ±10 |
1300 ±100 |
10,2 |
91 |
Согласно данным рисунка 5 и таблицы 2 более эффективно использовать сильноосновный анионообменник Purolite A430 в OH-форме для концентрирования анионов из водных растворов. Его применение на стадии подготовки пробы воды различного генезиса для анализа может решать одновременно как задачу концентрирования компонентов, так и их разделения.
Заключение
Полученные в работе значения полной обменной емкости и динамической обменной емкости анионообменных смол Purolite А430 и АВ-17 и характеристики индивидуальной сорбции
Список литературы Ионообменное концентрирование неорганических анионов из водных растворов
- Режим доступа: http://smoly.ru/anionit-av-17-8-harakteristiki.html Свободный. -Заглавие с экрана. -Яз.англ.
- Режим доступа: http://www.purolite.com/index Свободный. -Заглавие с экрана. -Яз.англ.
- ГОСТ 31940-2012. Вода питьевая. Методы определения содержания сульфатов. Введен 01.01.2014. М.: Межгосударственный стандарт: ИПК изд-во стандартов, 2014. 16 с.
- Математическая модель динамики сорбции в слое ионообменника/Т. С. Корниенко, Е. А.,Загорулько, Л. П. Бондарева//Сорбционные и хроматографические процессы. 2011. Т. 11, вып. 6. C.895-899.
- Риман В., Уолтон Х.Ф. Ионный обмен в аналитической химии: Международная серия монографий в аналитической химии. -Elsevier, 2013.
- Ганесан П., Камарадж Р., Васудеван С. Применение изотермы, кинетические и термодинамические модели для адсорбции ионов нитрата на графене из водного раствора//Журнал Тайваньского института инженеров-химиков. -2013. -Т. 44. -№. 5. -С. 808-814.


