Исходные морфогенетические особенности протеома супраструктур межфазного хроматина для прорастания зрелых ростков в условиях адаптации к зиме в пшенице
Автор: Иванова Е.А., Вафина Г.Г., Иванов Р.С.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Исследование морфогенетических процессов формирования растения для взаимодействия с окружающей средой необходимо для понимания фундаментальных проблем супрамолекулярной биохимии стресса биологии развития. Современная биология установила, что молекулярный морфогенез относится к числу морфологических процессов. Молекулярный морфогенез основан на хорошо изученных силах межмолекулярных взаимодействий. От прогресса понимания морфогенеза ожидаются не только чисто познавательные, но и практические результаты биотехнологии. Целью работы был анализ экранирования морфогенетических супраструктур межфазной хроматиновой матрицы с локализацией чувствительности регуляторного протеолиза в условиях адаптации вегетативной фазы пшеницы к стрессовым факторам окружающей среды. Было показано, что в условиях долговременной адаптации к холодному шоку пшеницы на уровне супраструктур, упакованных в ядерную матрицу генома, проводится полная защита зон аргинина-X для регуляторной протеазы- обработка. Возможно, эти зоны представляют собой один из элементов LCR (области управления локусом), которые связаны с кодом гистонов и влияют на архитектурную организацию ядра клетки, которая формируется для облегчения жизни организма в сложных условиях окружающей среды. Эти данные будут полезны для тех, кто участвует в разработке математико-логических схем теории и практики биологической специфики и могут быть включены в онтологию этапов роста и развития растений.
Короткий адрес: https://sciup.org/14323975
IDR: 14323975
Текст научной статьи Исходные морфогенетические особенности протеома супраструктур межфазного хроматина для прорастания зрелых ростков в условиях адаптации к зиме в пшенице
Вопрос о том, как растения могут запомнить прошлые стресс условия окружающей среды и передать их по наследству, глубоко интересует исследователей. Мы подошли к анализу этих событий с позиции реализации молекулярных морфогенетических систем развития. В данной работе клеточные ядра используются как модельная система биологического покоя зрелых зародышей и в процессе их активного водопоглощения в период формирования группы координированно экспрессирующихся генов. В предыдущей работе (Ivanov et al., 2015), мы подробно остановились на природе яровости и озимости у пшеницы. Наше внимание было сфокусировано на протеолитический процессинг хроматиновой матрицы, как филогенетически древней специфической системы регуляции. Подобной эволюционной стабильностью характеризуются аргининбогатые гистоны как растительного, так и животного происхождения (Smith et al., 1970; Bauer, 1971). В своей структуре аргинин имеет гуанидиновую группу, которая выступает относительно других аминокислот в виде «антенны» из нуклеосом, воспринимающей и передающей сигналы окружающей среды на хроматиновую матрицу. Сама молекула аргинина способна метаболизироваться до биогенного агматина и оксида водорода.
Известно, что физическую связь между хромосомами может осуществлять межхромосомная нить, которая разрывается под действием ДНК-азы, но под действием трипсина или РНК-азы она становится менее упругой (Podgornaja et al., 2005). До сих пор межхромосомная нить не стала признанной структурой, возможно потому, что её строение слабо изучено. Однако есть данные, что она состоит из сателлитной ДНК и сателлит-связывающих белков – CENPB и РНК-геликазы р68. Характер РНК-компонента межхромосомной нити является предметом дальнейших исследований (Podgornaja et al., 2005). Ранее в работе (Ivanov et al., 2015) были представлены результаты по выделению (на колонках с иммобилизованным ингибитором трипсина) трипсиноподобных белков (ТПБ) из негистоновых (НГБ) и гистоновых (НI; Н2А+Н2В; Н3+Н4) белков супраструктур хроматина 21ч зародышей яровой и озимой пшениц, где четко выражено физиологическое различие семян по массе и их всхожести. В работе (Ivanov et al., 2015) сделан вывод, что 21ч период хроматиновой матрицы характеризуется активацией трипсиноподобных белков, выделенных из НГБ и коровых гистонов (Н2А+Н2В) у озимой пшеницы в супраструктуре хроматина прочносвязанного (Хр II) с ядерным матриксом (ЯМ).
Целью данной работы был анализ локализации Арг-Х протеазочувствительных сайтов в негистоновых и гистоновых блоках супраструктур (нуклеоплазмы, хроматина, ядерного матрикса), как возможных зон, влияющих на конформационные перестройки тотального интерфазного хроматина в течение биологического покоя и инициации активного водопоглощения при индукции вегетативной фазы ростового морфогенеза зрелых зародышей яровой и озимой пшениц.
MATERIALS AND METHODS
Подробное описание сортов Артемовки (яровой), выведенной из нее Мироновской 808 (озимой) и выведенной из последней Мироновской Яровой представлено в работе (Ivanov et al., 2015). Состояние воздушно-сухого семени и зародыша (находящиеся в состоянии биологического покоя), мы условно приняли за 0ч. Из воздушно-сухих семян (0ч), набухающих под водой в течение 3ч, а далее высеянных для прорастания (6ч) (рис. 1) отделяли от эндосперма зародыши (рис. 2), из которых выделяли клеточные ядра, их надмолекулярные супраструктуры: нуклеоплазму (Нп) – лабильный хроматин (Konarev, 2001), хроматин непрочно- (Хр-I) и прочно- (Хр-II) связанный с ядерным матриксом (ЯМ) и собственно ЯМ (рис.2) по способу подробно описанному в работах (Ivanova, Vafina, 1992; Ivanova, Vafina, 2011). Отделение негистоновых белков (НГБ) от гистонов из выделенных супраструктур клеточных ядер проводили по способу (Ivanova, 1972; Ivanova, Vafina, 2011). Арг-Х протеазоактивность в негистоновых и гистоновых блоках супраструктур клеточных ядер, оценивали по расщеплению Арг-Х связей в аргинин-обогащенном белке – протамине- Salmine-A-I («Merk» ).
RESULTS
Динамика (рис. 3) распределения Арг-Х протеолитической активности в супраструктурах представлена в виде схемы (рис 4). Показано, что Арг-Х активность усиливается у зародышей озимого сорта на уровне ядерного матрикса (рис 4; 6ч) относительно исходного сорта Артемовки (рис 4; 6ч). У сорта Мироновской Яровой, выведенной из Мироновской озимой, Арг-Х активность переключается на супраструктуры прочносвязанные с ядерным матриксом (рис 4; 3ч, 6ч). Следующий этап работы заключался в выявлении конкретно ядерных белковых комплексов, которые экранируются к протеазочувствительности для восприятия позиционной информации (рис 5, 6). На рисунке 5 представлено графическое выражение Арг-Х процессинга в негистоновых и гистоновых блоках супраструктур тотального хроматина. Для более наглядного восприятия экспериментальных данных представлено их схематическое изображение (рис 6). В графическом представлении экспериментальных данных рисунка (рис 5) зона нмоль аргинина от 0-2 принята за фоновую активность. Поэтому в схеме (рис 6) представлены только данные, которые были выше фона. Экспериментальные данные схемы (рис 6) показывают, что в протеоме супраструктур тотальной хроматиновой матрицы зрелых зародышей клеточных ядер озимой пшеницы в процессе набухания семян (3ч) происходит сначала экранирование Арг-Х протеазочувствительных зон в линкерном гистоне НI ядерного матрикса (ЯМ) и в негистоновых белках (НГБ) хроматина непрочносвязанного (Хр I)
с ЯМ. В период активации морфогенетических процессов супраструктур тотального хроматина (рис 6, 6ч) усиливается экранируемость НГБ в Хр I, Хр II, ЯМ, а также в коровых гистонах Н2А+Н2В ядерного матрикса в отличие от ярового сорта Артёмовки, где происходит относительно равномерная экранируемость Арг-Х активности гистонового кора Н3+Н4 лабильного хроматина (Нп) (рис 6: 0ч, 3ч ,6ч). Что касается Мироновской Яровой выведенной из озимого сорта, то в этом случае в состоянии биологического покоя (0ч) в арсенале тотального хроматина готовы к экранируемости Арг-Х протеолиза НГБ: лабильного хроматина, Хр II-прочносвязанного с ЯМ и ЯМ. В процессе набухания семян (3ч) экранируемость Арг-Х активности распространяется по этим же структурам тотального хроматина, но с привлечением линкерного гистона НI ядерного матрикса и коровых гистонов Н3+Н4 хроматина прочносвязанного (Хр II) с ЯМ совместно с НГБ; а также коровых гистонов Н2А+Н2В лабильного хроматина (Нп). В период активной инициации морфогенетических процессов тотального хроматина (рис 6, 6ч) в клеточных ядрах зрелых зародышей Мироновской Яровой происходит дальнейшее усиление экранируемости Арг-Х активности: супраструктур нуклеоплазмы, но с переключением на линкерный гистон НI; ядерного матрикса (с дополнительным вовлечением экранируемости коровых гистонов Н3+Н4) и переключения экранируемости протеазочувствительности участков гистонового кора Н2А+Н2В на хроматин ХрI-непрочносвязанный с ЯМ.
Воздушносухое семя (биологический покой)
Набухание семени в воде в течение 3 ч при + 22°С
После 3-х часов набухания семена поместили для проращивания во влажную среду при + 22 С
Figure 1. Схема работы с зародышами семян.
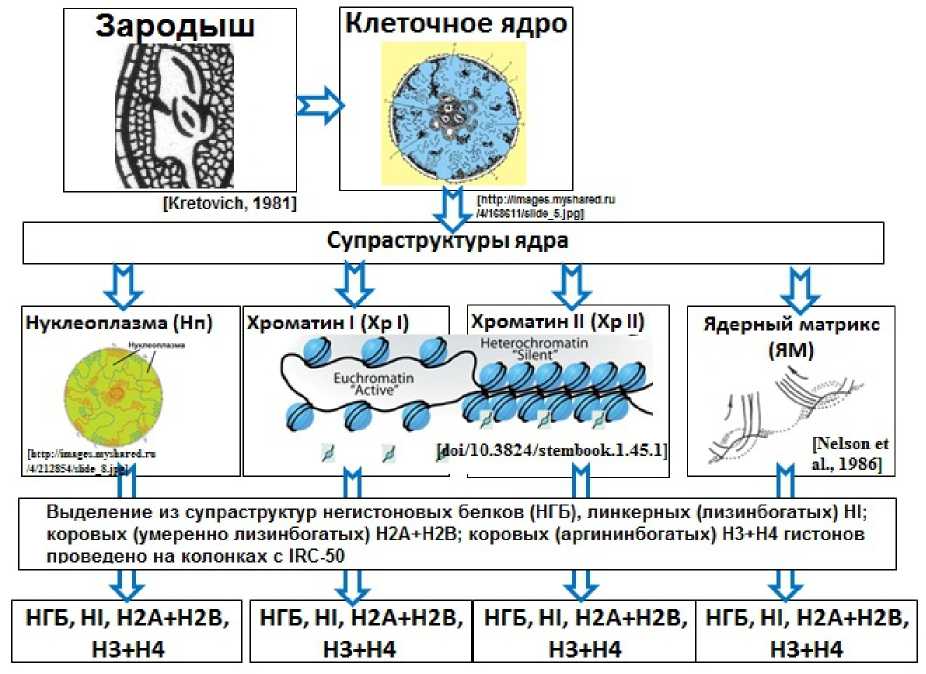
Зародыш
Euchromatin "Active"
Клеточное ядро
[Kretovich, 1981
Нуклеоплазма(Нп)
[Nelson et al., 1986]
Ядерный матрикс (ЯМ)
Хроматин I (Хр I) | | Хроматин II (Xp II)
2) 2) Heterochromatin
"Silent"
|4oV10.3824/stembook.l.45.1]
[nttp:^imag86 mysnarea ru J L wi6®611/tik»e_5J|>g]
Супраструктуры ядра
Выделение из супраструктур негистоновых белков (НГБ), линкерных (лизинбогатых) HI; коровых (умеренно лизинбогатых) Н2А+Н2В; коровых (аргининбогатых) НЗ+Н4 гистонов проведено на колонках с IRC-50
НГБ, HI, Н2А+Н2В,
НЗ+Н4
|
НГБ, HI, Н2А+Н2В, |
НГБ, HI, Н2А+Н2В, |
НГБ, HI, Н2А+Н2В, |
НГБ, HI, Н2А+Н2В, |
|
НЗ+Н4 |
НЗ+Н4 |
НЗ+Н4 |
НЗ+Н4 |
Figure 2. Схема выделения негистоновых и гистоновых белков из супраструктур клеточных ядер
зародышей пшениц.
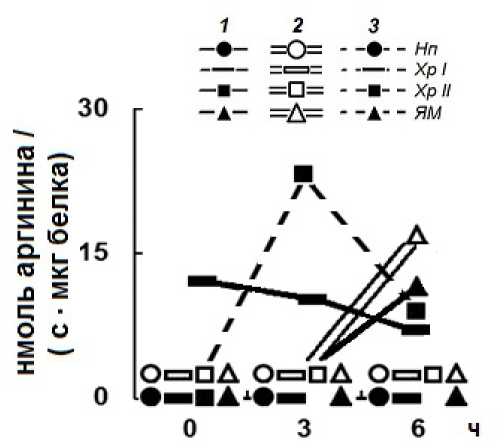
Figure 3. Динамика Арг-Х протеолиза в супраструктурах тотальной интерфазной хроматиновой матрицы клеточных ядер зрелых зародышей пшениц сортов Артёмовки (яровая) (1), выведенной из неё Мироновской 808 (озимая) (2) и выведенной из последней Мироновской Яровой (3); Супраструктуры: Нп – нуклеоплазма (лабильный хроматин), Хр-–хроматин непрочносвязанный с ЯМ, Хр-II -хроматин прочносвязанный с ЯМ, ЯМ – ядерный матрикс. Примечание: 0ч – воздушно-сухое семя (биологический покой); 3ч – период набухания семени; 6ч – активирование супрамолекулярной инициации морфогенетических процессов.
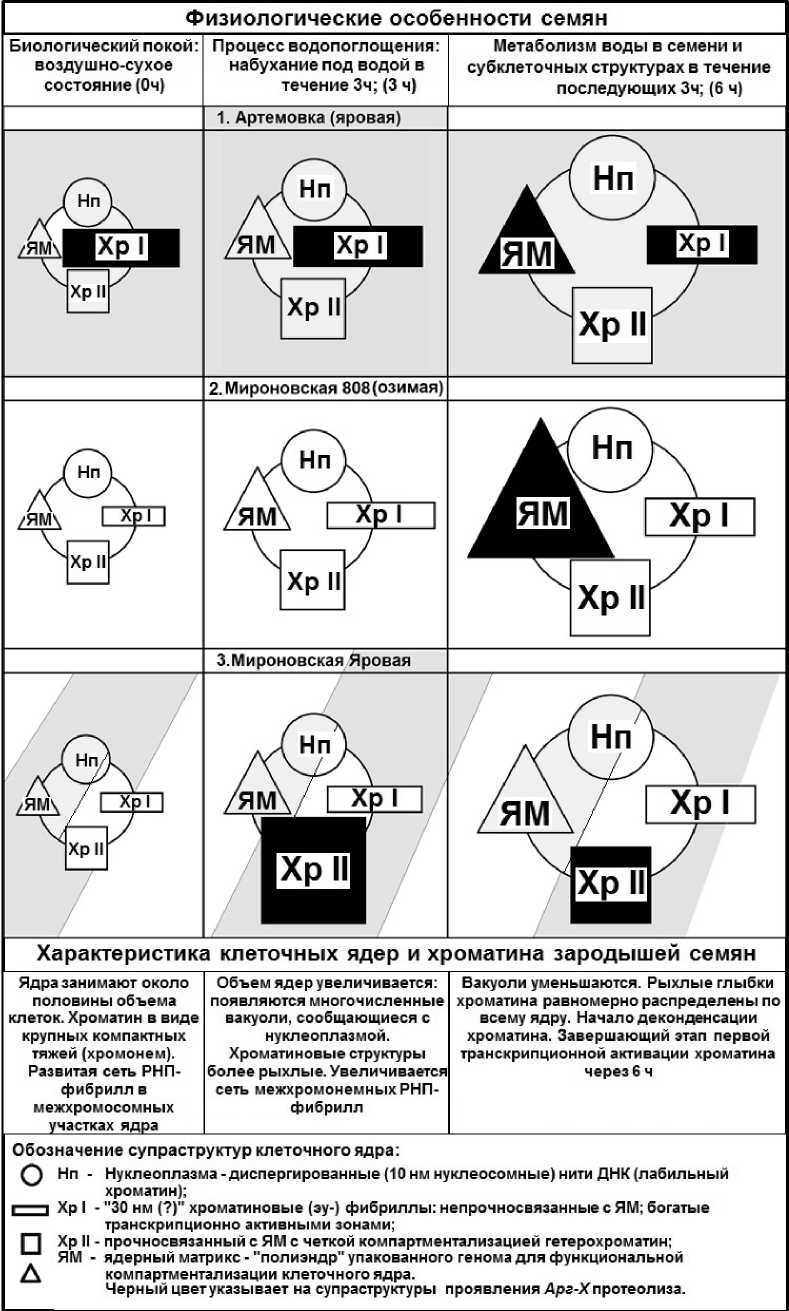
Figure 4. Схема распространения Арг-Х протеолитической системы в супраструктурах
интерфазных клеточных ядер зрелых зародышей пшениц.

Figure 5. Протеолитический Арг-Х процессинг белков в НГБ и гистоновых блоках супраструктур тотального хроматина клеточных ядер зрелых зародышей пшеницы сорта Артёмовки (яровая) (1), выведенной из неё Мироновской 808 (озимой) (2) и выведенной из последней Мироновской яровой (3). Супраструктуры: Нп - нуклеоплазма, Хр-I - хроматин непрочносвязанный с ЯМ, Хр-II - хроматин прочносвязанный с ЯМ, ЯМ - ядерный матрикс.
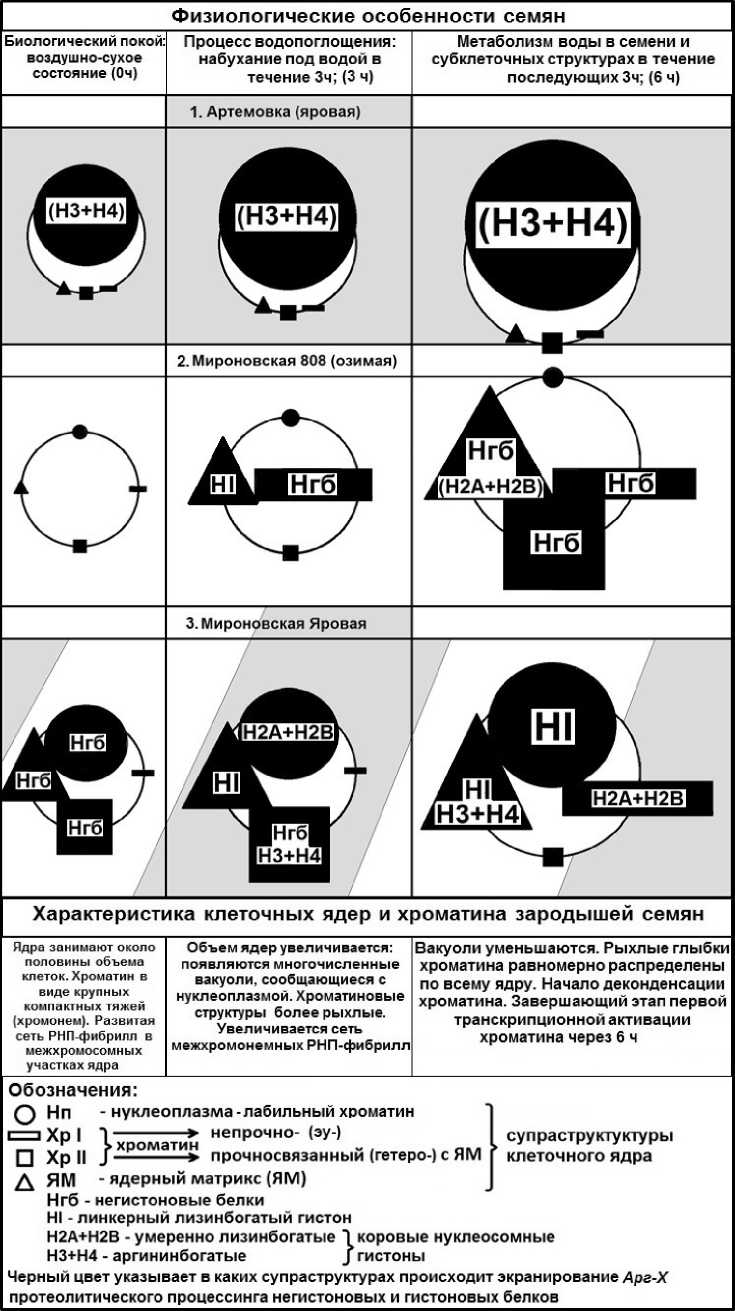
Figure 6. Схема распространения Арг-Х протеолитической системы в негистоновых и гистоновых блоках супраструктур интерфазных клеточных ядер зрелых зародышей пшениц.
DISCUSSION
Зрелые зародыши злаков, находящиеся в состоянии биологического покоя (0ч) представляют собой высокодифференцированную систему со сложной морфологией, несущей начало взрослого растения, где пространственная и временная координация инициации физиологического роста различных дифференцированных тканей находится под контролем межклеточных-тканевых регуляторных систем зрелого зародыша пшеницы. Только влияние извне способно заставить зародыш семени начать ростовые движения и вызвать к реализации генетические инструкции, которые заложены заранее. Известно, что в G1 фазе клеточного цикла крупные ядра апикальной и латеральной меристем зрелого зародыша пшеницы занимают более половины клеток (Avetisova et al., 1988). Процесс водопоглощения (то есть, поглощение тепловой энергии воды семенем) происходит ступенчато: 1) набухание. Методом ядерно-магнитного резонанса (ЯМР) показано, что свободная вода способна подойти к структурным белкам зародыша через 15 мин- 2ч; 2) лаг-период; 3) проклевывание зародыша – свойственно только живым семенам. Первый и второй периоды обратимы, то есть чередование внешних условий, например - подсушивание семян, сохраняет им жизнеспособность. Третий этап полностью необратим (Askochenskaya, 1982). Результатом инициации гидратационных процессов является изменение подвижности протонов (Askochenskaya, 1982). Каждая аминокислота в белковой молекуле способна связывать 2,6 молекул воды (Robertis et al., 1973). При термическом расширении жидкости ≥40 С, изгибание водородных связей приводит в сближению соседних молекул (Vol'kenshtejn, 1981). Считают, что вода, в большей степени, играет роль теплового буфера и в меньшей степени рН (Foks, 1992). Способность к образованию водородных связей у молекул воды наиболее ярко выражена и имеет резко направленный характер, обеспечивающий комплементарность поверхностей (то есть, ориентацию) взаимодействующих макромолекул (Metzler, 1980). В цитоплазме клеток вода находится, главным образом, в связанном гелеобразном состоянии, что касается клеточных ядер, то в них больше свободной воды и она активна в качестве растворителя, поэтому в клеточном ядре может работать «водная» биохимия (Albrecht-Buhler, 1990). Вода, в виде водородноводных, катион-водных мостов также вносит значительный вклад в формирование и стабилизацию двухспиральной и биополимерной структуры ДНК (Novikov et al., 1985). Многочисленные представления о пространственной организации эукариотического генома базируются, прежде всего, на результатах, полученных с использованием метода 3С. То есть, выводы об укладке хроматиновой фибриллы, полученные с помощью метода 3С, отражают лишь закономерности, характерные для гетерогенной популяции клеток, а не для отдельно взятой клетки (Guschanskaya et al., 2014). Значительное место в исследовании механизмов экспрессии генов продолжает занимать изучение свойств тотальной хроматиновой матрицы, блоки которой могут быть представлены эу- (лабильный, непрочносвязанный с ЯМ), и гетерохроматином (прочносвязанный с ЯМ). Из литературы известно, что адаптивная эволюция происходила у белков контролирующих фазу роста G1 и G1/S-переход – наиболее вариабельных фаз клеточного цикла эукариот (Caldis, 2006), которые находятся под управлением внешних ростовых факторов (Turnaev et al., 2009). В G1 фазе клеточного цикла 42 хромосомы апикальной и латеральной меристем зрелого зародыша пшеницы развернуты в виде хромонемной нити (Avetisova et al., 1988), конденсированные тяжи, которой равномерно распределены по всему объему ядра, а в межхромонемных участках присутствует довольно развитая сеть РНП-фибрилл (Avetisova et al., 1988). За последнее время появились работы, которые считают, что физическую связь между хромосомами может осуществлять межхромосомная нить, которая разрывается под действием ДНК-азы, но под действием трипсина и РНК-азы она становится менее упругой. Межхромосомная нить состоит из сателлитной ДНК и сателлитсвязывающих белков - CENPB (Podgornaja et al., 2005). К самым значительным открытиям в настоящее время принадлежит выяснение расположения хромосом в интерфазных ядрах и то, что их структура контролируется как генетическими, так и экологическими факторами (Pawlowski, 2010; Tiang et al., 2012). Считают, что имеются морфологические ограничения и эпигенетические воздействия на ядерную архитектуру, эволюционную стабильность механизмов хромосомных территорий и изменения ядерной архитектуры (Schubert, Shaw, 2011). В свою очередь, «хроматиновая матрица – это физиологически важный субстрат, на котором развертываются ремоделинг и механизм транскрипции» (Allis et al., 2010). Предполагают, что протеолитический процессинг является одним из способов необратимой посттрансляционной модификации, осуществляемой в процессе ремоделирования хроматина (Purohit et al., 2012). В гипотезе гистонового кода протеолиз рассматривается как новый вид необратимых пост трансляционных модификаций гистонов. Однако экспериментального подтверждения удаления эпигенетических меток с гистоновых хвостов с помощью протеазы все еще не доказано (Purohit et al., 2012). Тем не менее, поиск такой протеазы продолжается. Фактически наша экспериментальная задача заключалась в том, чтобы выявить в надмолекулярных структурах клеточного ядра участки чувствительные к Арг-Х протеолизу. То есть, мы предположили, что молекулярный морфогенез в интерфазном клеточном ядре может быть связан с ослаблением межмолекулярных белковых связей надмолекулярных комплексных супраструктур: нуклеоплазмы, хроматина непрочно- и прочносвязанных с ядерным матриксом и собственно ядерного матрикса. Вопросы самоорганизации биологических систем находятся в центре внимания специалистов по высокомолекулярным соединениям, а именно биополимерам. Как известно, взаимодействующие в клетке молекулы иммобилизованы на полимерных структурах (Albrecht-Buhler, 1990). То есть, они входят в какие-то определенные надмолекулярные комплексы, где уже интегрированы взаимодействия многих макромолекул. Эти особенности взаимодействующих молекул приводят к тому, что в настоящее время вопросы биохимии переходят в разряд рассмотрения супрамолекулярной химии, то есть «химии запрограммированных несущих информацию молекул» (Len, 1998). Именно во власти хроматиновой матрицы, как сложного биогетерополимерного центра управления, сосредоточены запрограммированные супрамолекулярные системы развития молекулярного и супрамолекулярного морфогенеза, которые представлены на схемах (рис. 4,6). Биохимически нуклеоплазма выделяется из клеточного ядра при низкой ионной силе раствора. Ранее в работах В.Г. Конарева (2001, C.91) в этой фракции, которую он назвал «лабильным хроматином», были выявлены 10 нм диспергированные нити ДНК. В последние годы появилось ряд работ, результаты которых ставят под сомнение существование 30 нм хроматиновой фибриллы в ядрах живых клеток (Razin et al., 2014; Grigoryev, Woodcock, 2012). В нашем случае это хроматин непрочносвязанный (Хр I -эухроматин) с ЯМ (рис 4,6). И все же эта фракция компактизации хроматина богата транскрипционно-активными зонами, присутствием белков группы HMG (Ivanova, Ahmetov, 1987) и большого количества гистонацетилтрансфераз (Lobanenkov et al., 1982;
Mironov, 1987). Внутри хромосомной территории и в ядре эухроматиновые и гетерохроматиновые компартменты разделены в пространстве. Но и гетерохроматиновые компартменты разных типов пространственно сегрегированы. Области активного хроматина характеризуются активным транскрипционным статусом, присутствием гиперчувствительных сайтов к ДНКазе I, в то время как зоны неактивного хроматина обладают полностью противоположными свойствами (Guschanskaya et al., 2014). В свое время, демонстрация того, что репликация и транскрипция происходят на ядерном матриксе (скелете), дала мощный импульс работам по изучению пространственной организации различных процессов в клеточном ядре (Razin et al., 2014). Авторы статьи (Razin et al., 2014) считают, что упакованный геном является платформой для функциональной компартментализации клеточного ядра и, что концепция ядерного матрикса, как скелетной основы клеточного ядра, полностью себя исчерпала. Не пытаясь вернуть к жизни концепцию ядерного матрикса, авторы (Razin et al., 2014), тем не менее, считают важным сказать, что вопрос о существовании в клеточном ядре различных динамических архитектурных элементов, поддерживающих внутриядерную организацию на локальных уровнях, заслуживает дальнейшего изучения. Возможно ЯМ, следуя терминологии Р. Тома, представляет собой динамический эпигенетический полиэндр, где формировались последовательные этапы биологического развития.
Литературный анализ показывает, что имеются морфологические ограничения и эпигенетические воздействия на ядерную архитектуру, а также эволюционную стабильность механизмов хромосомных территорий и изменения ядерной архитектуры (Schubert, Shaw, 2011). Последовательное описание зон экранируемости к Арг-Х протеазо-процессингу супраструктур (рис. 4), а также негистоновых и гистоновых белков (рис. 6) нуклеосомной организации хроматиновой матрицы показывает, что в клеточных ядрах функционирует протеазо-процессинг, характер специфичности действия, которого, возможно, связан с пространственной координацией инициации регуляторных систем зрелых зародышей пшениц, сформировавшихся в условиях экологического стресса. То есть, молекулярный морфогенез на уровне супраструктур клеточного ядра может быть связан с ослаблением межнадмолекулярных белковых связей. По всей вероятности, Арг-Х гиперчувствительные зоны хроматина могут представлять собой один из этапов траектории последовательности процессинга, имеющих отношение к гистоновому или нуклеосомному коду. Возможно, наши экспериментальные данные будут полезны для тех, кто занимается разработкой логикоматематических схем теории биологической специфичности, о которых писали Ж-М Лен (1998), Р.Том (2002), в области сложной проблемы динамики молекулярного и супрамолекулярного морфогенеза в условиях взаимодействия генотипа и среды.
ACKNOWLEDGMENT
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 14-04-31243.
Список литературы Исходные морфогенетические особенности протеома супраструктур межфазного хроматина для прорастания зрелых ростков в условиях адаптации к зиме в пшенице
- Albrecht-Buhler G. (1990) In defense of non-molecular' cell biology. Int. Rev. of cytology, 120, 191-241
- Allis S.D., Dzhenjuvejn T., Rejnberg D. (2010) Jepigenetika. Per. s angl. M.: Tehnosfera, 496
- Askochenskaja N.A. (1982) Vodnyj rezhim semjan. Fiziologija semjan. M.: Nauka, 184-222
- Avetisova L.V., Shaposhnikov Ja.D., Kadykov V.A. (1988) Izmenenija ul'trastruktury jader kletok apeksa pobega pshenicy v processe prorastanija. Ontogenez (In Russian), 19(2), 181-190
- Bauer K. (1971) Homology of partial sequence of cal thymus histone IV with several non-histone proteins. Int. Protein Res., 3, 165-172
- Caldis P. (2006) Cell Cycle Regulation. B. Heidelberg: Springer, 374
- Foks R. (1992) Jenergija i jevoljucija zhizni na Zemle. M.: Mir, 216
- Grigoryev S.A., Woodcock C.L. (2012) Chromatin organization -The 30 nm fiber. Experimental cell research, 318, 1448-1455
- Gushhanskaja E.S., Artemov A.A., Ul'janov S.V., Penin A.A., Logacheva M.D., Razin S.V., Gavrilov A.A. (2014) Prostranstvennaja organizacija genov domashnego hozjajstva v interfaznyh jadrah. Molekuljarnaja biologija, 48(6), 1008-1018
- Ivanov R.S., Tereshchenko L.M., Vafina G.H., Ivanova E.A. (2015) Molecular Mechanisms of Processing Proteome Reorganization of Interphase Chromatin During Stress and Adaptation to Winter in Wheat. Journal of Stress Physiology & Biochemistry, 11(2), 5-15
- Ivanova E.A., Ahmetov R.R. (1987) Modifikacija negistonovyh belkov v prorostkah rastenij. Fiziologija rastenij., 34(3), 507-512
- Ivanova E.A., Vafina G.H. (1992) Sposob poluchenija jadernyh frakcij, obladajushhih proteinaznoj i ingibirujushhej aktivnost'ju. Avtorskoe svidetel'stvo № 1733471
- Ivanova E.A., Vafina G.H. (2011) Sposob preparativnogo vydelenija osnovnyh belkov iz suprastruktur kletochnyh jader rastenij. Patent № 2408602
- Ivanova E.A. (1972) Frakcionirovanie rastitel'nyh gistonov na kolonkah s amberlitom IRC-50. Materialy III-j nauchnoj konferencii molodyh uchenyh. Ufa, 54-55
- Konarev V.G. (2001) Morfogenez i molekuljarno-biologicheskij analiz rastenij. SPb.: VIR, 417
- Kretovich V.L. (1981) Biohimija zerna. M.: «Nauka», 136
- Len Zh-M. (1998) Supramolekuljarnaja himija: Koncepcii i perspektivy: Per. s angl. Novosibirsk: Nauka, 334
- Lobanenkov V.V., Mironov N.M., Shapot V.S. (1982) Belki i funkcional'nye svojstva hromatina iz jader normal'noj pecheni i jeksperimental'nyh gepatom. Bjulleten' jeksperimental'noj biologii, 23, 60-63. Metzler D. (1980) Biohimija. M.: Mir, 2, 426
- Mironov N.M. (1987) Soderzhanie nekotoryh aktivnyh i neaktivnyh genov vo frakcijah hromatina, razlichajushhihsja dostupnost'ju DNKkdejstviju policiklicheskih aromaticheskih uglevodorodov. Biohimija (In Russian), 52(3), 503-511
- Nelson W.G., Pienta K.L., Barrack E.R., Coffey D.S. (1986) The role of the nuclear matrix in the organization and function of DNA. Annual Review of Biophysics and Biophysical Chemistry 15, 457-475
- Novikov I.A., Ivannikov A.I., Kobelev V.S., Volkov V.Ja. (1985) Issledovanie metodom JaMR strukturnogo perehoda v sisteme DNK-svjazannaja voda v oblasti fiziologicheskih temperatur. Molekuljarnaja biologija, 19(4), 1029-1033
- Pawlowski W.P. (2010) Chromosome organization and dynamics in plants. Current Opinion in Plant Biology, 13, 640-645
- Podgornaja O.I., Kuznecov I.S., Enukashvili N.I., Shatrova A.N., Aksenov N.D., Zenin V.V., Noniashvili E.N., Dyban A.P. (2005) Issledovanie «niti», svjazyvajushhej hromosomy. Citologija, 47(9), 825
- Purohit J.S., Chaturvedi M.M., Panda P. (2012) Histone proteases: the tale of tail clippers. Int. J. Int sci. Inn. Tech., 1(1), 51-60
- Razin S.V., Borunova V.V., Jarovaja O.V., Vaseckij E.S. (2014) Jadernyj matriks i strukturno-funkcional'naja kompartmentalizacija jadra jeukarioticheskoj kletki. Biohimija, 79(7), 770-781
- Robertis Je., Novinskij V., Sajes F. (1973) Biologija kletki. M.: Mir, 33-53
- Schubert I., Shaw P. (2011) Organization and dynamics of plant interphase chromosomes. Trends in Plant Science, 16(5), 273-281
- Smith E.L., De Lange R.J., Bonner J. (1970) Chemistry and biology of histones. Physiol. Revs., 50(2), 159-170
- Tiang C.L., He Y., Pawlowski W.P. (2012) Chromosome Organization and Dynamics during Interphase, Mitosis, and Meiosis in Plants. Plant Physiol, 158, 26-34
- Tom R. (2002) Strukturnaja ustojchivost' i morfogenez. M.: Logos, 280
- Turnaev I.I., Gunbin K.V., Kolchanov N.A. (2009) Jevoljucija kljuchevyh belkov kletochnogo cikla korreliruet s uvelicheniem slozhnosti jeukarioticheskih organizmov. Doklady Akademii nauk, 426(2), 265-269
- Vol'kenshtejn M.V. (1981) Biofizika. M.: Nauka, 421


