Искусственная ассоциативная симбиотическая система рапса с ризобиями для защиты от фитопатогенов
Автор: Вершинина Зиля Рифовна, Благова Дарья Константиновна, Нигматуллина Лилия Ралисовна, Оркодашвили Анна Михайловна, Баймиев Алексей Ханифович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
Данная статья посвящена созданию искусственного ассоциативного симбиоза между рапсом, трансгенным по гену лектина гороха и штаммом ризобий Rhizobium leguminosarum, обладающим фунгистатической активностью, и оценке эффективности полученной системы против фитопатогена Fusarium oxysporum.
Лектин, ризобии, "бородатые корни", искусственные симбиотические системы, рапс, фитопатоген
Короткий адрес: https://sciup.org/148202048
IDR: 148202048 | УДК: 579.262:
Текст научной статьи Искусственная ассоциативная симбиотическая система рапса с ризобиями для защиты от фитопатогенов
Рапс ( Brassica napus L.) является одной из наиболее ценных и перспективных сельскохозяйственных культур. Однако он подвержен множеству болезней, в том числе и вызываемых фитопатогенными грибами (например, Fusarium sp. ). Использование химических средств защиты может привести к нарушению устойчивости агроэкосистем, поэтому необходимо искать альтернативные экологически безопасные способы борьбы с патогенами.
Ризобии, вступающие в природе в азотфиксирую-щий симбиоз с бобовыми растениями, могут выступать в качестве ассоциативных микросимбионтов для многих небобовых культур, в том числе и для рапса [1]. Эти бактерии способны колонизировать корневую систему и повышать урожайность растений, выделяя ростостимулирующие вещества и защищая от фитопатогенов. Например, было показано, что некоторые штаммы Rhizobium leguminosarum могут стимулировать рост молодых проростков рапса [2] и повышать урожайность этой культуры [3]. К сожалению, в природе полезные бактерии зачастую не выдерживают конкуренции с менее эффективными дикими штаммами, поэтому одним из важнейших факторов при образовании ассоциативных взаимоотношений является способность ризобий колонизировать корневые системы растений. Так, ранее было обнаружено, что некоторые штаммы ризобий могут колонизировать [4, 5] и даже формировать биопленки на корнях рапса [6]. Однако важнейшей задачей исследователей всегда являлось придание способности растениям узнавать и прикреплять к своей поверхности определенные полезные для них штаммы бактерий. И в качестве специфического, узнаваемого ризобиями вещества для инженерии корневых ассоциаций могут выступать лектины бобовых растений, которые индуцирует у ризобий синтез ряда факторов, которые могут специфично агглютинировать бактерии к корням [7].
В данной работе был использован ген лектина гороха посевного psl , так как этот лектин является наиболее изученным по сравнению с лектинами других бобовых растений, и узнающий данный лектин природный микросимбионт гороха посевного R. leguminosarum . Именно лектин гороха был использован в ряде работ по изменению специфичности симбиоза бобовых растений [8] и, более того, экспрессия этого гена позволила значительно повысить количество ризобий, колонизирующих трансгенный рис [9], табак, томат и рапс [10, 11].
В качестве модельной корневой системы для получения симбиотических ассоциаций служили трансгенные по гену лектина гороха «бородатые корни», которые являются удобным объектом на начальных этапах экспериментов, направленных на повышение эффективности симбиоза, а также в создании новых симбиотических комплексов, обладающих ростостимулирующей и фунгицидной активностями [12, 13]. Целью данной работы являлось исследование возможности создания искусственных ассоциаций Rhizobium leguminosarum с корнями рапса для защиты этого растения от фитопатогенных грибов рода Fusarium .
МАТЕРИАЛ И МЕТОДЫ
Для получения трансгенных «бородатых корней» был использован штамм Agrobacterium rhizogenes A4, трансформированый вектором pCambia 1301 со встроенным в область Т-ДНК геном лектина гороха посевного psl [11]. В эксперименте использовали суточные культуры A.rhizogenes (pCambia 1301- psl ) и A.rhizogenes (исходный), выращенные при 28 ° С на шейкере (150 об/мин) в минимальной среде Min A [14], с добавлением 100 мг/л рифампицина и 50 мг/л канамицина. Перед инокуляцией культуру агробактерий центрифугировали (3500 об/мин, 10 мин) и ресус-пендировали в жидкой среде Min A. Пло8 тность суспензии агробактерий была доведена до 10 КОЭ/мл.
Объектом исследований являлся рапс ( Brassica napus var. napus ) сорта Ратник. Поверхность семян стерилизовали в течение 2 мин в 70% спирте и затем 15 мин в 15% растворе гипохлорита натрия с добавлением нескольких капель Tween-20. Для получения композитных растений семена проращивали в течение
2 недель на стерильной MS среде. Затем у проростков отрезали настоящий корень, срез 15 сек инокулировали в суспензии A. rhizogenes, после чего растения ко-культивировали на агаризованной среде MS с ацето-сериногоном (10 мг/л) в течение 3 дней. Далее их пересаживали на MS среду с цефотаксимом (200 мг/л), для подавления роста агробактерий. Через месяц после кокультивации растения с развитой корневой системой пересаживали в автоклавированную смесь почвы и песка.
Гистохимический анализ корней на gus-активность проводили по Jefferson [15]. ДНК выделяли фенольнохлороформным методом. Выделение тотальной РНК и проведение ревертазной реакции осуществляли с использованием наборов TRizol Reagents («Invitrogen», США) и GenePak RT Core НПФ («Галарт-Диагностикум», Россия).
Наличие гена лектина psl в препаратах ДНК и кДНК проверяли с помощью ПЦР с использованием праймеров, фланкирующих участок гена лектина, и стандартных наборов в амплификаторе Терцик МС2 («ДНК-технология», Россия) при оптимальной для каждой пары праймеров температуре отжига.
В качестве микросимбионтов в полученных симбиотических системах был использован штамм R. leguminosarum 116 , выделенный из клубеньков гороха посевного ( Pisum sativum L.) и обладающий фунги-статической активностью. Степень агглютинации данного штамма семенным лектином гороха посевного проверялась согласно методике, описанной в статье [11]. В качестве фитопатогена был выбран штамм Fusarium oxysporum , выделенный из корней рапса, пораженных фузариозом. Антагонистическую активность R. leguminosarum 116 по отношению к грибу оценивали, используя метод двойной культуры [16].
Для инокуляции композитных растений использовали бактерии R. leguminosarum , которые наращивали при 28°С в течение суток в жидкой среде YM до концентрации 107 КОЕ/мл. Далее в течение суток в инокуляте выдерживали корни растений. После чего корни отмывали стерильной водой, растения пересаживали в почву, содержащую 10 мл суспензии спор гриба F. oxysporum с концентрацией 105/мл, и выращивали в течение трех суток. Затем корни растений отмывали и окрашивали толуидиновым синим в течение часа. При этом гифы грибов приобретали фиолетовую окраску, а клетки растений – голубую. После отмывания в цитратном буфере корни рассматривали и фотографировали с помощью микроскопа Axio Imager M1 (Zeiss, Oberkochen, Germany).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
После инокуляции суспензией A.rhizogenes «бородатые корни» начинали образовываться через 10-12 дней на 98% растений (рис. 1). Gus-окрашивающиеся корни были обнаружены у 90% проростков, обработанных A.rhizogenes (pCambia 1301- psl ). ПЦР-анализ этих корней показал присутствие гена лектина и на уровне мРНК его конститутивную экспрессию (рис. 2). У контрольных композитных растений (полученных с помощью исходного штамма A. rhizogenes ), ПЦР и gus-окрашивание дали отрицательный результат.

Рис. 1. Полученные трехнедельные композитные растения рапса
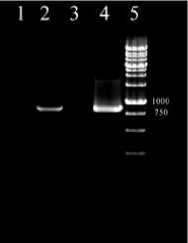
Рис. 2. Электрофореграмма ОТ-ПЦР-анализа экспрессии гена лектина в «бородатых корнях». 1 – контроль на наличие ДНК в препарате мРНК; 2 – «бородатые корни», в которых идет экспрессия гена лектина; 3 – отрицательный контроль без генетического материала; 4 – продукт ПЦР на наличие гена лектина в «бородатых корнях»; 5 – 1 Kb ДНК маркер (250-10000 п.н.)
Ранее были получены полностью трансгенные растения табака, а также химерные растения рапса и томатов, экспрессирующие ген лектина гороха [10, 11]. На данных растениях было обнаружено увеличение количества бактерий R. leguminosarum 1078 на порядок и более по сравнению с нетрансгенными растениями. Этот факт подтверждал взаимодействие ризо-бий с лектином на поверхности трансгенных корней. Аналогичные результаты были получены и для штамма R. leguminosarum 116 (рис. 3а,б). Определенная методом двойной культуры антагонистическая активность этого микросимбионта по отношению к F. oxysporum составила около 70% (рис. 3в).
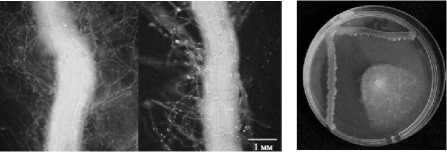
а б в
Рис. 3. Колонизация фунгицидным штаммом R. leguminosa-rum 116 , маркированным TurboGFP, не трансгенных (а) и трансгенных (б) по гену лектина гороха посевного корней рапса; (в) ингибирование R. leguminosarum 116 роста колоний F. oxysporum
Таким образом, экспериментально были получены все предпосылки для создания искусственной симбиотической системы, повышающей устойчивость растений рапса к фитопатогену F. oxysporum. Для достижения данной цели композитные растения рапса с трансгенными по гену лектина корнями и обычны- ми, инкулировали суспензией штамма R. leguminosarum 116, пересаживали в почву, содержащую споры гриба F. oxysporum и выращивали в течение трех суток. После окрашивания корней растений толуидиновым синим, проводили их микроскопический анализ (рис. 4 а,д). В результате проведенных экспериментов было выяснено, что обработка транс- генных по гену psl корней штаммом R. leguminosarum 116 уменьшает количество гиф патогена F.oxysporum в ризосфере рапса (рис. 4д). Такой же эффект, но в гораздо меньшей степени, наблюдается на корнях контрольных растений, на которых адсорбция Rhizobium происходит менее эффективно (рис. 4в).

а б в г д
Рис. 4 . Заражение растений рапса F. oxysporum: а – неинокулированные контрольные растения; – контрольные растения + F. Oxysporum; в – контрольные растения + F. oxysporum+R. leguminosarum 116; г - растения с трансгенными по psl корнями + F. oxysporum; д – растения с трансгенными по psl корнями + F. oxysporum+ R. leguminosarum 116
Через неделю после инокуляции F. oxysporum преимущественно выживали лишь растения с трансгенной ризосферой, обработанные R. leguminosarum 116 (рис. 5).
Ранее в ряде работ была показана способность ри-зобий ингибировать рост различных штаммов грибов in vivo и возможность использования данных бактерий для защиты небобовых растений от фитопатогенов. Так, B. japonicum KUMH 569, R. meliloti KUMH 139 и R. leguminosarum KUMH 551 были способны замедлять рост F. solani в опытах с подсолнечником и бамией [17], а также стимулировать рост этих растений. Отдельные штаммы S. meliloti и R. trifolii могут использоваться для биоконтроля F. oxysporum , заражающего подсолнечник и томат [18, 19]. В работе
Chandra с соавт. [20] было показано, что штамм M. loti MP6 способен ингибировать in vitro рост патогена Sclerotinia sclerotiorum и защищать от заражения корни рапса.
Существует ряд статей, подтверждающий фунги-статические свойства лектинов выделенных из семян бобовых, в том числе, и из гороха посевного [21, 22]. Однако, трансгенные корни рапса, обработанные исключительно F. oxysporum , по степени заражения практически ничем не отличались от контрольных корней, обработанных этим же штаммом грибов. Данный факт говорит об отсутствии фунгистатиче-ских свойств у лектина гороха посевного, который мы использовали в качестве фактора модификации симбиотических взаимодействий.

а б в г
Рис. 5. Растения рапса через неделю после заражения F. oxysporum: а - контрольное без бактерий, б - контрольное, инокулированное R. leguminosarum 116, в - с трансгенной корневой системой без бактерий, г - с трансгенной корневой системой, инокулированное R. leguminosarum 116
На основании полученных результатов можно утверждать, что колонизация трансгенных по гену лектина гороха посевного psl корней рапса микросимбионтом гороха посевного R. leguminosarum 116, обладающим фунгистатической активностью, способствует получению стабильной ассоциации микроорганизмов с растениями и защите от фитопатогенных грибов F. oxysporum . Проведенные эксперименты подтверждают принципиальную возможность получения таким способом искусственных симбиотических ассоциаций рапса с ризобиями, обладающих повышенной устойчивостью к грибным фитопатогенам.
Лектины бобовых растений, отвечающие за распознавание и прикрепление ризобий к корням, являются одним из инструментов для расширения круга сим- биотических партнеров у бобовых и получения ассоциативных симбиозов c клубеньковыми бактериями у небобовых растений. Использование лектинов в качестве трансгенов позволяет получать искусственные корневые ассоциации с ризобиями у несимбиотроф-ных растений, таких как рапс, что в сочетании с использованием микроорганизмов с фунгистатической активностью может более эффективно защищать корневую систему растений от патогенов. Это расширяет возможности использования биологических средств защиты растений, что в перспективе позволит сократить использование химических пестицидов.
Данная работа проводилась при финансовой поддержке ФЦП «Научные и научно-педагогические кадры инновационной России" на 2009-2013 годы» (Гос- контракт 16.740.11.0671, Соглашения 8115, 8046), РФФИ (Соглашения 12-04-31277, 12-04-31284).
Список литературы Искусственная ассоциативная симбиотическая система рапса с ризобиями для защиты от фитопатогенов
- Mehboob I., Naveed M., Zahir A.Z. Ashraf M. Potential of Rhizobia for Sustainable Production of Non-legumes//Crop Production for Agricultural Improvement. Springer, 2012. P. 659-704.
- Noel T.C., Sheng C., Yost C.K., Pharis R.P., Hynes M.F. Rhizobium leguminosarum as a plant growth-promoting rhizobacterium: direct growth promotion of canola and lettuce//Can. J. Microbiol. 1996. V. 42. P. 279-283.
- Lupwayi N.Z., Clayton G.W., Hanson K.G., Rice W.A., Biederbeck V.O. Endophytic rhizobia in barley, wheat and canola roots//Can. J. Plant Sci. 2004. V. 84. P. 37-45.
- Hoflich G., Wiehe W., Buchholz C.H. Rhizosphere colonization of different crops with growth promoting Pseudomonas and Rhizobium bacteria//Microbiol. Res. 1995. V. 150. P. 139-147.
- Chabot R.H., Antoun H., Kloepper J., Beauchamp C. Root colonization of maize and lettuce by bioluminescent Rhizobium leguminosarum biovar phaseolus//Appl. Environ. Microbiol. 1996. V. 62. P. 2767-2772.
- Santaella C., Schue M., Berge O., Heulin T., Achouak W. The exopolysaccharide of Rhizobium sp. YAS34 is not necessary for biofilm formation on Arabidopsis thaliana and Brassica napus roots but contributes to root colonization//Environ Microbiol. 2008. V. 10. P. 2150-2163.
- Kijne J.W., Diaz C.L., Pater S. Lectins in the symbiosis between Rhizobia and leguminous plants//Adv. Lectin Res./Eds Franz H. et al. Berlin: Ullstein Mosby, 1992. P. 15-50.
- Díaz C.L., Spaink H.P., Wijffelman C.A., Kijne J.W. Genomic requirements of Rhizobium for nodulation of white clover hairy roots transformed with the pea lectin gene//Mol. Plant-Microbe Interact. 1995. V. 8. P. 348-356.
- Sreevidya V.S., Hernandez-Oane R.J., So R.B., Sullia S.B., Stacey G., Ladha J.K., Reddy P.M. Expression of the legume symbiotic lectin genes psl and gs52 promotes rhizobial colonization of roots in rice//Plant Science. 2005. V. 169. P. 726-736.
- Вершинина З.Р., Баймиев Ан.Х., Благова Д.К., Князев А.В., Баймиев Ал.Х., Чемерис А.В. Биоинженерия симбиотических систем: создание новых ассоциативных симбиозов с помощью лектинов на примере табака и рапса//Прикладная биохимия и микробиология. 2011. № 3. С. 336-342.
- Vershinina Z.R., Baymiev An.Kh., Blagova D.K., Chubukova O.V., Baymiev Al.Kh., Chemeris A.V. Artificial colonization of non-symbiotic plants roots with the use of lectins//Symbiosis. 2012. V. 56. N. 1. P. 25-33.
- Akasaka Y., Mii M., Daimon H. Morphological alterations and root nodule formation in Agrobacterium rhizogenes-mediated transgenic hairy roots of peanut (Arachis hypogaea L.)//Ann. Bot. 1998. V. 81. P. 355-362.
- Diaz C.L., Spaink H.P., Kijne J.W. Heterologous rhizobal lipochitin oligosaccharides and chitin oligomers induce cortical cell divisions in red clover root, transformed with the pea lectin gene//Mol. Plant Microbe Interact. 2000. V. 13. P. 268-276.
- Miller J.H Experiments in Molecular Genetics. Cold Spring Harbor: Cold Spring Harbor Lab., 1972. 432 р.
- Jefferson R.A. Assaying Chimeric Genes in Plants: The GUS Gene Fusion System//Plant Mol. Biol. Rep. 1987. V. 5. P. 387-405.
- Whipps J.M. Effect of media on growth and interactions between a range of soil-borne glasshouse pathogens and antagonistic fungi//New Phytologyst. 1987. V. 107. P. 127-142.
- Ehteshamul-Haque S., Ghaffar A. Use of rhizobia in the control of root rot diseases of sunflower, okra, soybean and mungbean//J. Phytopathol. 1993. V. 138. P. 157-163.
- Perveen S., Ehteshamul-haque S., Ghaffar A. Biological control of soilborne root infecting fungi in tomato and okra//Pak. J. Bot. 1994. V. 26. N. 1. P. 181-186.
- Siddiqui I. A., Ehteshamul-Haque S., Ghaffar A. Effect of Rhizobia and fungal antagonists in the control of root infecting fungi on sunflower and chickpea//Pak. J. Bot. 1998. V. 30. P. 279-286.
- Chandra S., Choure K., Dubey R.C., Maheshwari D.K. Rhizosphere competent Mesorhizobium loti MP6 induces root hair curling, inhibits Sclerotinia sclerotiorum and enhances growth of Indian mustard (Brassica campestris)//Braz. J. Microbiol. 2007. V. 38. P. 128-130.
- Sitohy M., Doheim M., Badr H. Isolation and characterization of a lectinwith antifungal activity from Egyptian Pisum sativum seeds//Food Chemistry. 2007. V. 104. P. 971-979.
- Charungchitrak S., Petsom A., Sangvanich P., Karnchanatat A. Antifungal and antibacterial activities of lectin from the seeds of Archidendron jiringa Nielsen//Food Chemistry. 2011. V. 126. P. 1025-1032.


