Искусственные ассоциативные симбиозы между томатом и ризобиями, обладающими фунгистатической активностью
Автор: Благова Д.К., Вершинина З.Р., Нигматуллина Л.Р., Лавина А.М., Баймиев аН.Х., Баймиев аЛ.Х.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микробные биопрепараты в защите и оздоровлении растений
Статья в выпуске: 1 т.50, 2015 года.
Бесплатный доступ
Биологические способы защиты растений применяются в аграрном производстве как альтернатива химическим приемам, использование которых приводит к загрязнению почвы и воды, а также опасно для человека. В настоящей работе рассматривается возможность создания искусственной направленной ассоциации клубеньковых бактерий с растениями для защиты от неблагоприятного воздействия патогенных грибов. Для этого был использован один из механизмов специфичного прикрепления клубеньковых бактерий к корням бобовых растений за счет растительных белков-лектинов, которые способны узнавать и избирательно связываться с разнообразными углеводами, в частности с полисахаридами на клеточных стенках ризобий. Объектами исследования служили композитные растения томата ( Lycopersicon esculentum ) сорта Дубок и изоляты бактерий, ассоциированных с корнями дикорастущих бобовых растений. «Бородатые корни», трансгенные по гену лектина гороха, получали на растениях томата после обработки штаммом Agrobacterium rhizogenes ATCC 15834, несущим вектор pCambia 1305.1 со встроенным геном лектина гороха посевного psl под контролем 35S-промотора вируса мозаики цветной капусты. Проверку антагонистической активности бактерий по отношению к фитопатогенам проводили методом двойной культуры. Проанализирована способность исследуемых микроорганизмов выделять сидерофоры и цианид. Проведена идентификация некоторых изолятов секвенированием фрагментов гена 16S-рРНК. В процессе скрининга имеющейся коллекции изолятов из клубеньков дикорастущих бобовых растений трибы Viceae обнаружены штаммы Rhizobium leguminosarum, Pseudomonas sp. и Stenotrophomonas rhizophila, обладающие фунгистатической активностью в отношении Fusarium solani, F. oxysporum, Fusarium sp. и F. oxysporum f. sp. lycopersici. Способность синтезировать сидерофоры выявили у двух представителей рода Pseudomonas, у S. rhizophila и R. leguminosarum. Цианид выделяли два штамма Pseudomonas (14M и 103) и S. rhizophila. Также было установлено, что обработка трансгенных по гену psl корней штаммом R. leguminosarum 116 уменьшает количество гиф патогена F. oxysporum f. sp. lycopersici в ризосфере томата. Следовательно, использование лектинов в качестве трансгенов позволяет получать искусственные корневые ассоциации с ризобиями у несимбиотрофных растений, что в сочетании с использованием микроорганизмов с фунгистатической активностью может более эффективно защищать корневую систему растений от патогенов
Ризобии, фитопатогенные грибы, трансгенные растения, лектины, ассоциативный симбиоз
Короткий адрес: https://sciup.org/142133561
IDR: 142133561 | УДК: 635.64:632.4:631.46:579.262:579.64 | DOI: 10.15389/agrobiology.2015.1.107rus
Текст научной статьи Искусственные ассоциативные симбиозы между томатом и ризобиями, обладающими фунгистатической активностью
Работа проводилась при финансовой поддержке ФЦП «Научные и научно-педагогические кадры инновационной России на 2009-2013 годы» (Госконтракт 16.740.11.0671, Соглашение 8115), РФФИ (Соглашения 12-04-31277, 12-04-31284).
выявлен их потенциал в качестве ассоциативных микросимбионтов для небобовых культур (9), в том числе для томата (10, 11). Для улучшения колонизации корней небобовых растений ризобиями применяются различные методы, в том числе используются трансгенные растения, синтезирующие вещества, которые участвуют в сигналинге на ранних этапах бобово-ризобиального симбиоза. К таким веществам относятся лектины — секретируемые белки, способные узнавать и избирательно связываться с разнообразными углеводами (12), в частности с полисахаридами на клеточных стенках ризобий, тем самым фиксируя микроорганизмы на поверхности корневых волосков (13). Ранее несколькими группами ученых проводились работы по изменению специфичности симбиоза с использованием лектинов бобовых растений (14-16). При этом бактерии обнаруживались как на внешней поверхности корней, так и во внутри- и межклеточном пространстве. Таким образом, корни растений, трансгенных по генам лектинов, потенциально будут специфично колонизироваться только ризобиями, которые выполняют полезные для растений функции, например защищают от фитопатогенов.
Почвенные бактерии Agrobacterium rhizogenes , несущие Ri-плазмиды, способны вызывать образование трансгенных «бородатых корней» у многих видов двудольных растений. «Композитные» растения с такими корнями, несущие целевые гены, используются для изучения взаимодействий растений с микроорганизмами, грибами и нематодами (17). В частности, «бородатые корни» томатов, в которых экспрессируется ген лектина гороха (18), могут стать хорошей моделью для изучения возможности защиты растений от патогенов через повышение эффективности ассоциативного симбиоза с ризобиями.
Цель настоящей работы заключалась в изучении возможности создания искусственных направленных ассоциаций бактерий с корнями сельскохозяйственных несимбиотрофных растений для их защиты от фитопа-тогенных грибов на примере томата ( Lycopersicon esculentum ) и клубеньковых бактерий Rhizobium leguminosarum .
Методика . Объектом исследований был томат ( Lycopersicon esculentum ) сорта Дубок. Растения трансформировали с помощью штамма Agrobacterium rhizogenes ATCC 15834, полученного из коллекции Всероссийского НИИ сельскохозяйственной микробиологии (г. Санкт-Петербург), с ранее введенным вектором pCambia 1305.1, в который встроили ген лектина гороха посевного psl под контролем 358-промотора вируса мозаики цветной капусты (19). В работе также использовали штаммы бактерий, ассоциированных с корнями дикорастущих бобовых растений на территории Республики Башкортостан (коллекция Института биохимии и генетики Уфимского НЦ РАН).
Композитные растения томата получали способом, описанным в работе R. Collier с соавт. (17). Поверхность семян стерилизовали в течение 2 мин в 70 % спирте и затем 15 мин в 15 % растворе гипохлорита натрия с добавлением нескольких капель Tween 20. В эксперименте по трансформации растений использовали 2-суточные культуры A . rhizogenes (pCambia 1305.1- psl) и A . rhizogenes (исходный штамм), выращенные при 28 ° С в жидкой среде TY (дрожжевой экстракт — 0,1 %, бактотриптон — 1,0 %, CaCl2 — 0,1 %) с добавлением канамицина (100 мг/л) и ацетосирингона 200 (мкМ) в первом случае и только ацетосирингона — во втором.
Перед пересадкой растений с «бородатыми корнями» в субстрат (простерилизованная смесь почвы и песка) и через 1 нед после пересадки проводили гистохимический анализ корней на gus-активность (20). Фраг- менты инкубировали в X-Gluc реактиве, содержащем 5-бром-4-хлор-3-ин-долил-р-П-глюкуронид (1 мг/мл), 0,5 % Тритон X-100, Na2EDTA (100 мМ), метанол (20 %), K3Fe(CN)6 (0,5 мМ), K4Fe(CN)6 (0,5 мМ) и Na-фосфатный буфер (50 мМ, pH 7,0) («Sigma-Aldrich», США). Корни выдерживали при 37 °С в течение ночи и выявляли наличие синего окрашивания.
При ПЦР-анализе ДНК из «бородатых корней» выделяли фенольно-хлороформным методом. Для обнаружения гена лектина psl в препаратах использовали праймеры (5 ' -ATAATGGCTTCTCTTCAA-ACCC-3 ‘ и 5 ' -GCAAAAAAACTATGCATCTGCA-3 ' ), фланкирующие участок этого гена, и стандартные наборы реактивов для амплификации («Helicon», Россия). ПЦР проводили на амплификаторе Терцик МС2 («ДНК-технология», Россия) по протоколу согласно рекомендациям производителя при оптимальной для указанной пары праймеров температуре отжига. Положительным контролем служила плазмида pCambia 1305.1- psl.
Для выявления бактерий-симбионтов с фунгистатической активностью провели скрининг изолятов с использованием в качестве тест-культур грибов Fusarium solan , F . oxysporum и Fusarium sp. из коллекции Уфимского государственного нефтяного технического университета, а также F . oxysporum f. sp. lycopersici (F-140) из Всероссийской коллекции микроорганизмов (ВКМ, Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, г. Пущино). Фунгистатическую активность микроорганизмов оценивали методом двойной культуры. Бактерии высаживали крестом в центр чашки Петри, разделяя ее на четыре сектора. В середину каждого помещали кусочек агаризованной питательной среды с мицелием гриба. Чашки ставили в термостат и инкубировали при 27 ° С. Через 3 сут измеряли радиус колоний грибов в направлениях к бактериям (R 1 ) и к краю чашки (R2) и вычисляли степень подавления роста грибов (T) по формуле T = (R2 - R 1 )/R2 х 100 % (21).
Видовую принадлежность бактерий определяли на основании анализа последовательности гена 16S-рРHК (22).
При проверке штаммов бактерий на синтез сидерофоров минимальную среду с CAS-реактивом (синий агар) готовили согласно описанию (23). Бактерии, выросшие на среде YM, пересаживали на синий агар и выращивали в течение 5 сут. Изменение окраски агара на желтую, оранжевую или розовую указывало на выделение сидерофоров. Для выявления синтеза цианида бактерии выращивали в чашках Петри в течение 1 сут на среде YM с добавлением глицина (4,4 г/л). После этого фильтровальную бумагу, пропитанную водным раствором 0,5 % пикриновой кислоты с 2 % Na2CO3, клали на крышки чашек Петри. Чашки обматывали пленкой Parafilm и инкубировали в течение 4 сут при 28 ° С. При выделении цианида окраска бумаги изменялась с желтой на оранжевую или коричневую из-за образования соли пикриновой кислоты (24).
Для совместной инокуляции растений бактериями и грибами получали суспензию спор F. oxysporum f. sp. lycopersici. Гриб выращивали в чашке Петри со средой YM в течение 5 сут. Затем его заливали 20 мл стерильной воды и ставили на ночь в холодильник. Число смытых спор подсчитывали в камере Горяева. Бактерии R. leguminosarum накапливали при 28 °С в течение 1 сут в жидкой среде YM до титра 107 КОЕ/мл. Корни растений помещали в полученную бактериальную суспензию на 1 сут. Затем их отмывали в стерильной воде, растения пересаживали в почву, содержащую 10 мл суспензии спор гриба (плотность — 105 шт/мл), и выращивали в течение 3 сут. После этого корни растений отмывали и окрашивали толуидиновым синим в течение 1 ч (гифы грибов приобретали фиоле- товую окраску, клетки растений — голубую), затем еще раз отмывали в цитратном буфере (25) и изучали с использованием микроскопа Axio Imager Ml («Carl Zeiss AG», Германия).
Результаты . После обработки растений A . rhizogenes «бородатые корни» начинали образовываться через 10-12 сут на 90 % растений (рис. 1). В течение 1-й нед появлялись придаточные корни, которые удаляли скальпелем.
А Б В

Рис. 1. Получение композитных растений томата ( Lycopersicon esculentum ) сорта Дубок после трансформации с помощью штамма Agrobacterium rhizogenes ATCC 15834, несущего вектор pCambia 1305.1 со встроенным геном лектина гороха посевного psl под контролем 358-промотора вируса мозаики цветной капусты: А — растения в минеральной вате, Б — «бородатые корни» после 10 сут выращивания, В — «бородатые корни» после 3 нед выращивания.
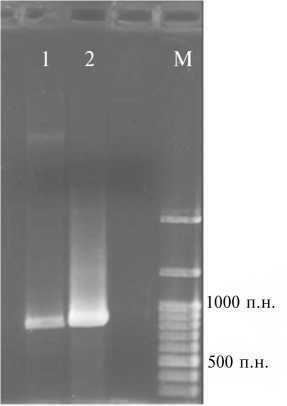
Рис 2. ПЦР-анализ ДНК из «бородатых корней» композитных растений томата ( Lycopersicon esculentum ) сорта Дубок, полученных с использованием вектора pCambia 1305.1, на наличие гена лектина гороха посевного psl : 1 — ПЦР-продукт гена psl из «бородатых корней», 2 — ПЦР-продукт гена psl плазмиды pCambia 1305.1; М — маркер молекулярных масс 100 bp + 1.5 Kb + 3 Kb («Si-benzyme», Россия).
Через 2 нед корни проверяли на gus-активность, растения пересаживали в стерильную смесь почвы и песка и выращивали еще 1 нед. Gus-окрашивающиеся корни были обнаружены у 53 % растений. ПЦР-анализ ДНК из этих корней показал присутствие гена лектина (рис. 2).
Ранее нами были получены полностью трансгенные растения табака, а также химерные растения рапса и томатов, экспрессирующие ген лектина гороха (26-28). На таких растениях было обнаружено увеличение численности бактерий R. legumino-sarum 1078 соответственно в 37, 14 и 10 раз по сравнению с нетрансгенными растениями. Этот факт подтверждал взаимодействие ризобий с лектином на поверхности трансгенных корней. Колонизация корней бактериями с фунгистатической активностью при увеличении численности последних потенциально могла бы защитить растения от патогенов. В природе с R. leguminosarum наиболее часто вступают в симбиоз растения, относящиеся к трибе Vicea. Поскольку ранее в клубеньках у ряда дикорастущих растений были обнаружены ризобии с фунгистатической активностью (29), мы провели скри нинг коллекции бактерий, собранной на дикой растительности, которая относится к указанной трибе (30), для выявления штаммов, обладающих
подобными свойствами. Всего было исследовано 568 изолятов. Фунгиста-тическую активность в отношении исследуемых грибов обнаружили у семи штаммов (табл.).
Коэффициент торможения роста колоний (Т, %) у грибов рода Fusarium в присутствии природных изолятов бактерий-симбионтов диких растений из трибы Vicea
|
Микросимбионт |
Fusarium sp. |
F. oxysporum f. sp. lycopersici |
F. solani |
F. oxysporum |
|
Rhizobium leguminosarum 116 |
17 |
41 |
65 |
70 |
|
Pseudomonas sp. 2 |
0 |
0 |
25 |
0 |
|
Pseudomonas sp. 102 |
40 |
29 |
53 |
53 |
|
Pseudomonas sp. 103 |
0 |
21 |
22 |
33 |
|
Pseudomonas sp. 15.2 |
0 |
13 |
17 |
19 |
|
Pseudomonas sp. 14M |
0 |
25 |
19 |
25 |
|
Stenotrophomonas rhizophila |
40 |
0 |
33 |
18 |
Видовую принадлежность штаммов бактерий подтвердил анализ последовательности гена 168-рРНК (данные не приведены).
Фунгистатическая активность бактерий может быть обусловлена секрецией сидерофоров — белков, способных образовывать комплекс с ионами железа, делая их недоступными для грибов, а некоторые штаммы ризобий выделяют цианид водорода (HCN), что оказывает отрицательное воздействие на рост грибов (2, 5). У изученных нами микросимбионтов способность синтезировать эти фунгистатические метаболиты была следующей (сидерофоры/цианиды): Rhizobium leguminosarum 116 — «+»/« - », Pseudomonas sp. 2 — «+»/« - », Pseudomonas sp. 102 — «+»/« - », Pseudomonas sp. 103 — « - »/«+», Pseudomonas sp. 14M — « - /+», Stenotrophomonas rhizophila — «+»/«+». То есть среди исследованных штаммов способность синтезировать сидерофоры была обнаружена у двух представителей рода Pseudomonas , у S. rhizophila и R. leguminosarum , а цианид выделяли два штамма Pseudomonas (14M и 103) и S. rhizophila . Таким образом, штаммы, обладающие наибольшей фунгистатической активностью ( R. leguminosarum 116 и Pseudomonas sp. 102), синтезировали сидерофоры, но не цианид. Следует, однако, отметить, что S. rhizophila, секретирующий оба этих вещества, имел не самые высокие показатели. Возможно, что фунгистатическая активность штаммов связана еще с какими-то механизмами (например, с синтезом антибиотиков).
Найденный в результате исследований штамм R. leguminosarum 116 с максимальной фунгистатической активностью в отношении F . oxysporum f. sp. lycopersici был использован в качестве микросимбионта в дальнейших экспериментах по созданию искусственных симбиотических ассоциаций.
После инокуляции композитных растений томата с трансгенными по гену лектина корнями (контроль — нетрансгенные растения) суспензией штамма R . leguminosarum 116 и их пересадки в почву, содержащую споры гриба F. oxysporum f. sp. lycopersici , световая микроскопия подтвердила (рис. 3, а-д), что обработка трансгенных по гену psl корней штаммом R . leguminosarum 116 уменьшает количество гиф патогена F . oxysporum f. sp. lycopersici в ризосфере (см. рис. 3, г). Такой же эффект, но в гораздо меньшей степени, наблюдался у контрольных растений, на корнях которых адсорбция ризобий происходила менее эффективно (см. рис. 3, в).
Ранее в ряде работ было показано, что Bradyrhizobium japonicum , Si-norhizobium meliloti и R. leguminosarum способны замедлять рост F . solani в опытах с подсолнечником и бамией (1), а S. meliloti и R . trifolii могут использоваться для биоконтроля F . oxysporum, заражающего подсолнечник и томат (31).
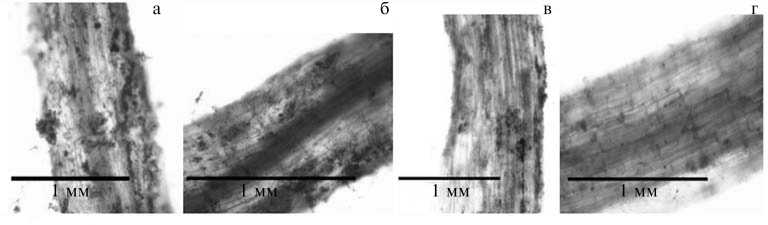
1 Рис. 3. Совместная обработка растений томата (Lycopersicon esculentum) сорта Дубок бактериями-симбионтами с фунгистатическими свойствами (Rhizobium leguminosarum) и патогенными грибами (Fusarium oxysporum f. sp. lycopersici): а — нетрансгенные растения + F. oxysporum f. sp. lycopersici; б — растения с корнями, трансгенными по гену ^ лектина гороха посевного psl + F. oxysporum f. sp. lycopersici; в — нен трансгенные растения + F. oxysporum f. sp. lycopersici + R. legumi-——————• nosarum; г — растения с корнями, трансгенными по гену лектина го' мм роха посевного psl + F. oxysporum f. sp. lycopersici + R. legumino sarum ; д — незараженные нетрансгенные растения (световая микроскопия (Axio Imager M1, «Carl Zeiss AG», Германия; окрашивание толуидиновым синим).
Итак, использование генов лектинов бобовых растений в качестве трансгенов позволяет создавать у несимбиотрофных растений, таких как томат, искусственные корневые ассоциации с ризобиями, обладающими фунгистатической активностью. Полученные результаты могут найти применение при создании искусственных ассоциативных симбиозов для биоконтроля фитопатогенов.
Список литературы Искусственные ассоциативные симбиозы между томатом и ризобиями, обладающими фунгистатической активностью
- Ehteshamul-Haque S., Ghaffar A. Use of rhizobia in the control of root rot diseases of sunflower, okra, soybean and mungbean. J. Phytopathol., 1993, 138: 157-163 ( ) DOI: 10.1111/j.1439-0434.1993.tb01372.x
- Chandra S., Choure K., Dubey R.C., Maheshwari D.K. Rhizosphere competent Mesorhizobium loti MP6 induces root hair curling, inhibits Sclerotinia sclerotiorum and enhances growth of Indian mustard (Brassica campestris). Braz. J. Microbiol., 2007, 38: 128-130 ( ) DOI: 10.1590/s1517-83822007000100026
- Arfaoui B., Sifi A., Boudabous I., Hadrami El., Cherif M. Identification of Rhizobium isolates possessing antagonistic activity against Fusarium oxysporum f. sp. ciceris, the causal agent of Fusarium wilt of chickpea. J. Plant Pathol., 2006, 88: 67-75.
- Deshwal V.K., Pandey P., Kang S.C., Maheshwari D.K. Rhizobia as a biological control agent against soil borne plant pathogenic fungi. Indian J. Exp. Biol., 2003, 41: 1160-1164.
- Antoun H., Beauchamp C.J., Goussard N., Chabot R., Lalande R. Potential of Rhizobium and Bradyrhizobium species as plant growth promoting rhizobacteria on non-legumes: effect on radishes (Raphanus sativus L.). Plant Soil, 1998, 204: 57-68 ( ) DOI: 10.1007/978-94-017-2321-3_5
- Arfaoui A., Sifi B., El Hassni M., El Hadrami I., Boudabous A., Cherif M. Biochemical analysis of chickpea protection against Fusarium wilt afforded by two Rhizobium isolates. Plant Pathol. J., 2005, 4: 35-42 ( ) DOI: 10.3923/ppj.2005.35.42
- Essalmani H., Lahlou H. Bioprotection mechanisms of the lentil plant by Rhizobium leguminosarum against Fusarium oxysporum f. sp. lentis. C. R. Biol., 2003, 326: 1163-1173. ( ) DOI: 10.1016/j.crvi.2003.10.003
- Handelsman J., Stabb E.V. Biocontrol of soilborne plant pathogens. The Plant Cell, 1996, 8: 1855-1869 ( ) DOI: 10.2307/3870235
- Mehboob I., Naveed M., Zahir A.Z., Ashraf M. Potential of Rhizobia for sustainable production of non-legumes. Crop Production for Agricultural Improvement, 2012: 659-704 ( ) DOI: 10.1007/978-94-007-4116-4_26
- Santillana N., Arellano C., Zúñiga D. PGPR capacity of Rhizobium on Lycopersicon esculentum Miller. (tomato). Ecología Aplicada, 2005, 4: 47-51.
- García-Fraile P., Carro L., Robledo M., Ramírez-Bahena M.-H., Flores-Félix J.-D., Fernandez M.T., Mateos P.F., Rivas R., Igual J.M., Martínez-Molina E., Peix Á., Velázquez E. Rhizobium promotes non-legumes growth and quality in several production steps: towards a biofertilization of edible raw vegetables healthy for humans. PLoS ONE, 2012, 7: e38122 ( ) DOI: 10.1371/journal.pone.0038122
- Peumans W.J., van Damme E.J.M. Lectins as plant defense proteins. Plant Physiol., 1995, 109: 347-353 ( ) DOI: 10.1104/pp.109.2.347
- Hirsch A.M. Role of lectins (and rhizobial exopolysaccharides) in legume nodulation. Curr. Opin. Plant Biol., 1999, 2: 320-326 ( ) DOI: 10.1016/s1369-5266(99)80056-9
- Van Rhijn P., Fujishige N.A., Lim P.O., Hirsch A.M. Sugar-binding activity of pea lectin is essential for heterologous infection of transgenic alfalfa plants by Rhizobium leguminosarum biovar viciae. Plant Physiol., 2001, 126: 133-144 ( ) DOI: 10.1104/pp.126.1.133
- Van Rhijn P., Goldberg R.B., Hirsch A.M. Lotus corniculatus nodulation specificity is changed by the presence of a soybean lectin gene. Plant Cell, 1998, 10: 1233-1250 ( ) DOI: 10.1105/tpc.10.8.1233
- Sreevidya V.S., Hernandez-Oane R.J., So R.B., Sullia S.B., Stacey G., Ladha J.K., Reddy P.M. Expression of the legume symbiotic lectin genes psl and gs52 promotes rhizobial colonization of roots in rice. Plant Sci., 2005, 169: 726-736 ( ) DOI: 10.1016/j.plantsci.2005.05.024
- Collier R., Fuchs B., Walter N., Kevin L.W., Taylor C.G. Ex vitro composite plants: an inexpensive, rapid method for root biology. Plant J., 2005, 43: 449-457 ( ) DOI: 10.1111/j.1365-313x.2005.02454.x
- Gatehouse J.A., Bown D., Evans I.M., Gatehouse L.N., Jobes D., Preston P., Croy R.R.D. Sequence of the seed lectin from pea (Pisum sativum L.). Nucl. Acids Res., 1987, 15: 7642 ( ) DOI: 10.1093/nar/15.18.7642
- Вершинина З.Р., Баймиев А.Х., Чемерис А.В. Симбиотические реакции корней облепихи, трансгенных по гену лектина гороха посевного. Физиология растений, 2010, 57(1): 108-116 ( ) DOI: 10.1134/S1021443710010140
- Jefferson R.A. Assaying chimeric genes in plants: the gus gene fusion system. Plant Mol. Biol. Rep., 1987, 5: 387-405 ( ) DOI: 10.1007/bf02667740
- Whipps J.M. Effect of media on growth and interactions between a range of soil-borne glasshouse pathogens and antagonistic fungi. New Phytologist, 1987, 107: 127-142 ( ) DOI: 10.1111/j.1469-8137.1987.tb04887.x
- Pace N.R., Stahl D.A., Lane D.J., Olsen G.J. The analysis of natural microbial populations by ribosomal RNA sequences. Adv. Microbiol. Ecol., 1986, 9: 1-55 ( ) DOI: 10.1007/978-1-4757-0611-6_1
- Schwyn B., Neilands J.B. Universal chemical assay for the detection and determination of siderophores. Analytical Biochemistry, 1987, 160: 47-56 ( ) DOI: 10.1016/0003-2697(87)90612-9
- Bakker A.W., Schippers B. Microbial cyanide production in the rhizosphere in relation to potato yield reduction and Pseudomonas spp-mediated plant growth-stimulation. Soil Biol. Biochem., 1987, 19: 451-457 ( ) DOI: 10.1016/0038-0717(87)90037-x
- Пермяков А.И. Микротехника: Учебно-методическое пособие для слушателей ФПК и студентов биологического факультета МГУ. М., 1988.
- Баймиев Ан.Х., Ямиданов Р.С., Матниязов Р.Т., Благова Д.К., Баймиев Ал.Х., Чемерис А.В. Получение флуоресцентно меченых штаммов клубеньковых бактерий дикорастущих бобовых для их детекции in vivo и in vitro. Молекулярная биология, 2011, 45(6): 984-991 ( ) DOI: 10.1134/S0026893311060033
- Vershinina Z.R., Baymiev An.K., Blagova D.K., Chubukova O.V., Baymiev Al.K., Chemeris A.V. Artificial colonization of non-symbiotic plants roots with the use of lectins. Symbiosis, 2012, 56: 25-33 ( ) DOI: 10.1007/s13199-012-0156-4
- Вершинина З.Р., Баймиев А.Х., Благова Д.К., Князев А.В., Баймиев А.Х., Чемерис А.В. Биоинженерия симбиотических систем: создание новых ассоциативных симбиозов с помощью лектинов на примере табака и рапса. Прикладная биохимия и микробиология, 2011, 47(3): 336-342 ( ) DOI: 10.1134/S0003683811030173
- El-Batanony N.H., Massoud O.N., Mazen M.M., Abd El-Monium M.M. The inhibitory effects of cultural filtrates of some wild Rhizobium spp. On some faba bean root rot pathogens and their antimicrobial synergetic effect when combined with Arbusclar Mycorrhiza (AM). World J. Agric. Sci., 2007, 3: 721-730.
- Баймиев Ан.Х., Птицын К.Г., Мулдашев А.А., Баймиев Ал.Х. Генетическая характеристика клубеньковых бактерий бобовых рода Lathyrus L. (Fabaceae), произрастающих на территории Республики Башкортостан. Экологическая генетика, 2011, 2: 3-8.
- Siddiqui I.A., Ehteshamul-Haque S., Ghaffar A. Effect of Rhizobia and fungal antagonists in the control of root infecting fungi on sun flower and chickpea. Pak. J. Bot., 1998, 30: 279-286.


