Искусственный интеллект в анализе анатомии верхнечелюстной артерии: обоснование концептуального подхода
Автор: Немсцверидзе Я.Э., Наджафов Х.А., Аносова Е.Ю., Яремин Б.И.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 5 т.15, 2025 года.
Бесплатный доступ
Верхнечелюстная артерия характеризуется значительной анатомической вариабельностью, что создаёт существенные трудности при планировании хирургических вмешательств в челюстно-лицевой области. Традиционные методы предоперационной визуализации требуют значительных временных затрат на интерпретацию данных и зависят от квалификации специалиста. Накопление больших массивов медицинских изображений в формате DICOM создаёт предпосылки для применения методов машинного обучения и глубоких нейронных сетей для автоматизации анализа сосудистых структур. Настоящая работа представляет концептуальное обоснование возможности применения технологий искусственного интеллекта для выявления анатомических вариаций верхнечелюстной артерии на основании анализа данных компьютерной и конусно-лучевой томографии. Проведён анализ современного состояния применения алгоритмов глубокого обучения в медицинской визуализации сосудистых структур головы и шеи, систематизированы известные анатомические вариации верхнечелюстной артерии и их клиническая значимость, сформулированы технические требования к архитектуре потенциальной системы автоматизированного анализа. Предлагаемый концептуальный подход включает использование сверточных нейронных сетей для семантической сегментации сосудистой сети, алгоритмов трёхмерной реконструкции для визуализации топографических взаимоотношений и системы классификации выявленных вариантов строения по степени хирургического риска. Обосновывается необходимость создания специализированной обучающей выборки аннотированных изображений верхнечелюстной артерии для обеспечения высокой точности распознавания. Обсуждаются потенциальные преимущества автоматизированного анализа, включая стандартизацию диагностических подходов, снижение времени предоперационного планирования и минимизацию интраоперационных осложнений, связанных с повреждением сосудов. Признаются существующие технические и организационные ограничения внедрения подобных систем, включая необходимость валидации на больших клинических когортах и интеграции в существующие медицинские информационные системы.
Верхнечелюстная артерия [D008437], искусственный интеллект [D001185], машинное обучение [D000069550], глубокие нейронные сети [D000069553], медицинская визуализация [D003952], компьютерная томография [D014057], челюстно-лицевая хирургия [D019647], анатомическая вариабельность [D063506]
Короткий адрес: https://sciup.org/143185339
IDR: 143185339 | УДК: 611.13:004.8 | DOI: 10.20340/vmi-rvz.2025.5.MORPH.2
Текст научной статьи Искусственный интеллект в анализе анатомии верхнечелюстной артерии: обоснование концептуального подхода
Анатомическая проблема: вариабельность как вызов хирургической безопасности
Верхнечелюстная артерия (a. maxillaris) занимает центральное место в васкуляризации глубоких структур лица, обеспечивая кровоснабжение зубов, околоносовых пазух, жевательных мышц, твёрдого и мягкого нёба [1, 2]. Как конечная ветвь наружной сонной артерии, она демонстрирует сложную трёхмерную топографию, проходя через подвисочную и крылонебную ямки с образованием многочисленных ветвей переменной конфигурации [3, 4].
Фундаментальной особенностью этого сосуда является его выраженная индивидуальная изменчивость. Классические анатомические исследования документируют частоту атипичных вариантов от 8% до 15% в общей популяции [5, 6], однако современные методы визуализации с высоким разрешением выявляют анатомические девиации значительно чаще — до 23–28% случаев при целенаправленном анализе [7, 8]. Вариации включают аномальное начало артерии от других ветвей наружной сонной системы, нетипичное прохождение через височную мышцу, изменённое ветвление в крылонёбной ямке, фенестрацию сосудистой стенки и необычное расположение задней верхней альвеолярной артерии относительно дна верхнечелюстной пазухи [9–12].
Клиническое значение этой вариабельности становится критическим в контексте современной челюстно-лицевой хирургии. Синус-лифтинг при дентальной имплантации, эндоскопические вмешательства на околоносовых пазухах, резекции верхней челюсти при онкологических заболеваниях, микрохирургическая реконструкция дефектов лица — все эти операции несут риск повреждения верхнечелюстной артерии или её ветвей [13–16]. Ятрогенное повреждение сосуда может приводить к массивному интраоперационному кровотечению, формированию гематом, артериовенозным фистулам, тромбозу с развитием ишемии тканей и в исключительных случаях — к эмболии в систему внутренней сонной артерии с развитием церебрального инфаркта [17, 18].
Ограничения современных методов визуализации
Предоперационная оценка анатомии верхнечелюстной артерии традиционно основывается на данных компьютерной томографии (КТ), конуснолучевой компьютерной томографии (КЛКТ) и в отдельных случаях — КТ-ангиографии или магнитнорезонансной ангиографии [19, 20]. Хотя эти методы обеспечивают детальную визуализацию костных структур и мягких тканей, интерпретация положе- ния сосудов в трёхмерном пространстве остаётся нетривиальной задачей [21].
Основные ограничения существующих подходов включают:
-
1. Субъективность интерпретации. Выявление сосудистых структур на нативных КТ-изображениях требует высокой квалификации рентгенолога и значительного опыта в анатомии челюстнолицевой области. Inter-observer variability в определении положения задней верхней альвеолярной артерии, по данным различных исследований, достигает 15–22% [22, 23].
-
2. Временные затраты. Детальный анализ топографии сосудистой сети в области крылонебной ямки с построением трёхмерных реконструкций может занимать от 20 до 45 минут в зависимости от используемого программного обеспечения и сложности анатомии конкретного пациента [24].
-
3. Вариабельность протоколов. Отсутствие стандартизированных подходов к предоперационной оценке сосудистой анатомии приводит к различиям в клинической практике между учреждениями и специалистами [25].
-
4. Ограниченная доступность КТ-ангиографии. Несмотря на то, что КТ-ангиография обеспечивает прямую визуализацию сосудов, её рутинное применение ограничивается дополнительным облучением пациента, необходимостью внутривенного контрастирования и экономическими факторами [26].
Технологический контекст: искусственный интеллект в медицинской визуализации
Последнее десятилетие ознаменовалось революцией в области анализа медицинских изображений, обусловленной развитием методов глубокого обучения (deep learning) и доступностью больших вычислительных мощностей [27, 28]. Сверточные нейронные сети (convolutional neural networks, CNN) продемонстрировали способность превосходить производительность человека-эксперта в задачах классификации патологии на рентгенограммах, КТ и МРТ-изображениях [29, 30].
В области анализа сосудистых структур алгоритмы глубокого обучения показали впечатляющие результаты. Системы автоматической сегментации коронарных артерий на КТ-ангиограммах достигают точности (Dice coefficient) 0,87–0,92, что сопоставимо с межэкспертной согласованностью [31, 32]. Аналогичные подходы успешно применяются для анализа церебральных сосудов, аорты, лёгочных артерий и периферических сосудов конечностей [33–36].
Принципиальное преимущество методов машинного обучения заключается в способности к обучению на больших массивах данных с последу- ющим обобщением выявленных закономерностей на новые клинические случаи. В отличие от традиционных алгоритмов обработки изображений, основанных на заранее заданных правилах, нейронные сети способны «обнаруживать» сложные паттерны и взаимосвязи, не очевидные для человеческого восприятия [37, 38].
Пробел в существующих исследованиях
Несмотря на широкое применение технологий искусственного интеллекта в кардиологической, нейроваскулярной и общей радиологической практике, анализ сосудистых структур челюстнолицевой области остаётся недостаточно изученным направлением. Систематический поиск в базах данных PubMed, Scopus и Web of Science (период 2015–2024 гг., ключевые слова: "artificial intelligence", "deep learning", "maxillary artery", "cone beam CT", "facial vasculature") выявляет крайне ограниченное количество публикаций, специфически посвящённых применению методов машинного обучения для анализа верхнечелюстной артерии [39].
Aboelmaaty и соавт. (2024) представили одно из немногих исследований, где алгоритм глубокого обучения применялся для автоматического выявления задней верхней альвеолярной артерии на КЛКТ-изображениях [40]. Авторы использовали архитектуру U-Net для сегментации сосуда и продемонстрировали чувствительность 89,4% и специфичность 91,2% при валидации на выборке из 312 случаев. Однако исследование ограничивалось только одной ветвью верхнечелюстной артерии и не учитывало её основной ствол и другие клинически значимые ветви.
Oz и соавт. (2022) применили трёхмерную ротационную ангиографию для детальной визуализации топографии верхнечелюстной и нисходящей небной артерий в крылонебной ямке [41]. Хотя их работа не включала методы машинного обучения, она продемонстрировала техническую осуществимость получения высококачественных изображений сосудистой сети с разрешением, достаточным для обучения нейронных сетей.
Yeung и соавт. (2022) в обзоре, посвящённом применению КЛКТ для оценки патологии верхнечелюстной пазухи, отметили потенциал технологий автоматизированного анализа для выявления анатомических вариантов, но констатировали отсутствие валидированных алгоритмов для клинического применения [42].
Таким образом, существует явный пробел между высоким уровнем развития методов искусственного интеллекта для анализа сосудистых структур в других анатомических областях и практически полным отсутствием подобных решений для верхне- челюстной артерии. Этот пробел создаёт как научную проблему, так и клиническую потребность в разработке специализированных подходов.
Цель настоящей работы
Настоящее исследование ставит своей целью представить концептуальное обоснование применения технологий искусственного интеллекта для автоматизированного анализа анатомии верхнечелюстной артерии на основании данных КТ и КЛКТ. Работа структурирована следующим образом:
-
1. Систематизация известных анатомических вариаций верхнечелюстной артерии и их клинической значимости.
-
2. Анализ современного состояния применения методов глубокого обучения в медицинской визуализации сосудистых структур.
-
3. Формулирование технических требований к архитектуре системы автоматизированного анализа.
-
4. Описание концептуальной модели алгоритма с обоснованием выбора методологических подходов.
-
5. Обсуждение потенциальных преимуществ, ограничений и направлений дальнейших исследований.
Важно подчеркнуть, что настоящая работа носит концептуальный характер и представляет обоснование возможности и целесообразности разработки подобных систем, а не описание готового техни- ческого решения. Мы стремимся определить научно обоснованную траекторию для будущих исследовательских и инженерных усилий в этом направлении.
АНАТОМИЧЕСКАЯ ОСНОВА: ВАРИАБЕЛЬНОСТЬ ВЕРХНЕЧЕЛЮСТНОЙ АРТЕРИИ
Нормальная анатомия и источники вариабельности
Верхнечелюстная артерия отходит от наружной сонной артерии на уровне шейки нижней челюсти, обычно позади ветви нижней челюсти, и направляется кпереди и медиально [1]. Классическое описание её хода разделяет артерию на три сегмента: нижнечелюстной (или мандибулярный), крыловидный (или мышечный) и крылонебный (или верхнечелюстной) [2, 3].
Нижнечелюстной сегмент проходит между шейкой нижней челюсти и клиновиднонижнечелюстной связкой, отдавая глубокую ушную, переднюю барабанную, среднюю менингеальную и нижнюю альвеолярную артерии. Уже на этом уровне возможны значительные вариации: средняя менингеальная артерия может отходить непосредственно от наружной сонной артерии (3–5% случаев), а нижняя альвеолярная артерия иногда берет начало от поверхностной височной артерии [43, 44].
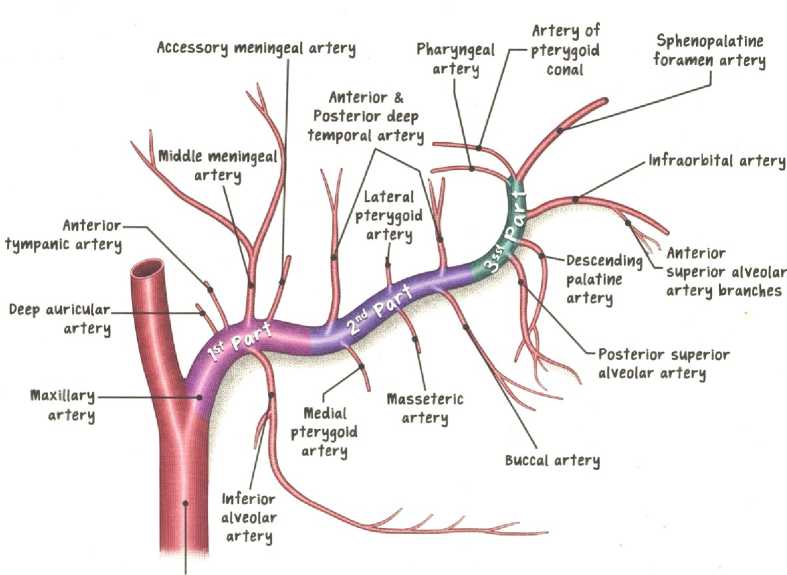
Рисунок 1. Ветви верхнечелюстной артерии (по Netter, с изменениями)
Figure 1. Branches of the maxillary artery
Крыловидный сегмент располагается в подвисочной ямке в непосредственной близости от латеральной крыловидной мышцы. Классически описываются два варианта прохождения: поверхностный (латеральнее нижней головки латеральной крыловидной мышцы) и глубокий (медиальнее или между двумя головками мышцы). Соотношение этих вариантов варьирует в различных популяциях: в европейских выборках поверхностный ход отмечается в 55–65% случаев, глубокий — в 35–45% [45, 46]. В крыловидном сегменте отходят мышечные ветви (жевательная, височные, крыловидные, щечная артерии), конфигурация которых также вариабельна.
Крылонебный сегмент входит в крылонебную ямку через крыловерхнечелюстную щель, где артерия разделяется на свои конечные ветви: заднюю верхнюю альвеолярную, подглазничную, нисходящую нёбную, артерию крыловидного канала и клиновидно-нёбную артерии [3, 47]. Именно в этом сегменте клиническая значимость анатомических вариаций наиболее велика, поскольку крылонебная ямка служит «хирургическими воротами» при эндоскопических вмешательствах на основании черепа и латеральной стенке носа [48].
Систематизация клинически значимых вариантов
Анализ анатомической и клинической литературы позволяет систематизировать основные типы вариаций верхнечелюстной артерии, имеющие хирургическое значение (табл. 1).
Таблица 1. Систематизация анатомических вариаций верхнечелюстной артерии с клиническими импликациями
Table 1. Systematization of anatomical variations of the maxillary artery with clinical implications
|
Тип вариации |
Анатомическая локализация |
Частота встречаемости |
Клиническая значимость |
Источники |
|
Аномальное начало |
Устье артерии |
2–4% |
Может приводить к ошибкам интерпретации ангиографии; требует модификации хирургического доступа |
[43, 44] |
|
Проникновение через височную мышцу |
Крыловидный сегмент |
1–3% (редкий вариант) |
Высокий риск повреждения при операциях на височно-нижнечелюстном суставе; трудности при латеральном доступе к подвисочной ямке |
[49, 50] |
|
Фенестрация |
Любой сегмент |
<1% (казуистика) |
Образование двойного просвета с последующим слиянием; повышенный риск травмы при минимально инвазивных вмешательствах |
[51] |
|
Задняя верхняя альвеолярная артерия в нетипичном положении |
Дно верхнечелюстной пазухи |
8–23% (по данным КЛКТ) |
Критический фактор риска при синус-лифтинге; причина интраоперационного кровотечения в 3–7% случаев |
[7, 8, 52, 53] |
|
Аномальное ветвление в крылонебной ямке |
Крылонебный сегмент |
12–18% |
Нетипичное расположение нисходящей небной артерии может осложнить доступ через большое небное отверстие |
[41, 54] |
|
Измененный ход при патологических процессах |
Любой сегмент |
Вариабельно в зависимости от патологии |
Опухоли, воспаление, травмы вызывают смещение, удлинение или компрессию артерии; затрудняет хирургический доступ |
[55, 56] |
Особого внимания заслуживает положение задней верхней альвеолярной артерии (a. alveolaris superior posterior) относительно дна верхнечелюстной пазухи. Эта ветвь может проходить в толще слизистой оболочки пазухи (интрасинусально), в костной стенке (интрабонально) или под надкостницей (субпериостально) [52]. При синус-лифтинге — процедуре элевации дна верхнечелюстной пазухи для установки дентальных имплантатов — повреждение этого сосуда является одним из наиболее частых осложнений [53].
Современные исследования с использованием КЛКТ показывают, что диаметр задней верхней альвеолярной артерии варьирует от 0,5 до 2,4 мм (среднее значение 1,2 ± 0,4 мм), а расстояние от альвеолярного гребня до сосуда — от 14 до 24 мм [57, 58]. Артерия диаметром более 1,5 мм, расположенная менее чем в 15 мм от альвеолярного гребня, считается значимым фактором риска кровотечения [59].
Гистологические особенности и патофизиологические соображения
Верхнечелюстная артерия является типичным представителем артерий мышечного типа среднего калибра. Её стенка состоит из трёх оболочек — интимы, медии и адвентиции — с хорошо развитой мышечной составляющей, обеспечивающей активную регуляцию кровотока [60].
Интима образована эндотелием, базальной мембраной и тонким подэндотелиальным слоем. Эндотелиальные клетки выполняют не только барьерную функцию, но и играют ключевую роль в регуляции гемостаза, тонуса сосудов и локального воспаления. При атеросклеротическом поражении, которое может развиваться в верхнечелюстной артерии у пожилых пациентов и лиц с метаболическими нарушениями, происходит утолщение интимы с формированием атеросклеротических бляшек [61].
Медия представлена 15–30 слоями циркулярно ориентированных гладкомышечных клеток, между которыми располагаются эластические и коллагеновые волокна. Соотношение мышечных и эластических элементов определяет механические свойства сосуда и его способность к вазодилатации/вазоконстрикции в ответ на метаболические стимулы [62].
Адвентиция образована рыхлой соединительной тканью с продольно ориентированными коллагеновыми волокнами. В этом слое проходят vasa vasorum (сосуды сосудов), обеспечивающие трофику стенки артерии, и нервные волокна, участвующие в вазомоторной регуляции [60].
С точки зрения потенциального применения технологий искусственного интеллекта, важно понимать, что визуализация верхнечелюстной артерии на нативных КТ-изображениях основана на различии рентгеновской плотности крови в просвете сосуда и окружающих мягких тканей. При нативной КТ этот контраст минимален (разница плотности около 5–15 единиц Хаунсфилда), что создаёт технические трудности для автоматической сегментации без контрастного усиления [63]. При КТ-ангиографии контрастированная кровь имеет плотность 200–400 HU, что значительно облегчает задачу идентификации сосуда, но требует инвазивной процедуры [26].
На КЛКТ-изображениях, широко используемых в дентальной практике, мягкотканный контраст ещё более ограничен в силу специфики детекторной системы. Тем не менее, при высоком разрешении и правильно подобранных параметрах сканирования возможна визуализация костных каналов, в которых проходят сосуды, что позволяет косвенно оценить их топографию [64, 65].
Клиническая значимость вариабельности
Неучёт анатомических вариаций верхнечелюстной артерии может приводить к серьёзным интраоперационным осложнениям.
При дентальной имплантации и синус-лифтинге повреждение задней верхней альвеолярной артерии отмечается в 3,2–7,1% случаев [66, 67]. Кровотечение обычно контролируется местными гемостатическими средствами, однако в редких случаях требует прекращения операции и даже формирования гематомы пазухи с необходимостью ревизионного вмешательства [68].
При эндоскопических операциях на околоносовых пазухах повреждение клиновидно-нёбной или нисходящей нёбной артерий в крылонёбной ямке может приводить к массивному кровотечению, требующему эндоваскулярной эмболизации [69, 70]. Частота таких осложнений составляет 0,5–1,5% при эндоскопической хирургии основания черепа [71].
При резекциях верхней челюсти по поводу злокачественных новообразований знание топографии верхнечелюстной артерии критически важно для планирования объёма резекции и сохранения адекватной васкуляризации окружающих тканей [72]. В случаях реконструкции дефектов васкуляризированными лоскутами верхнечелюстная артерия может использоваться как реципиентный сосуд для микрохирургического анастомоза [73].
Неврологические осложнения могут возникать при проникновении эмбола из повреждённой верхнечелюстной артерии в систему внутренней сонной через анастомозы между наружной и внутренней сонными системами (например, через артерию крыловидного канала и офтальмическую артерию). Описаны случаи инфаркта головного мозга после стоматологических процедур, хотя это исключительно редкое осложнение [74, 75].
Таким образом, точная предоперационная оценка анатомии верхнечелюстной артерии имеет непосредственное клиническое значение для минимизации хирургических рисков. Существующие методы визуализации обеспечивают необходимые данные, но их интерпретация остаётся субъективной и трудоёмкой задачей, что создаёт предпосылки для применения технологий автоматизированного анализа.
ИСКУССТВЕННЫЙ ИНТЕЛЛЕКТ
В МЕДИЦИНСКОЙ ВИЗУАЛИЗАЦИИ:
СОВРЕМЕННОЕ СОСТОЯНИЕ
Технологический фундамент:
глубокое обучение для анализа изображений
Современные системы автоматизированного анализа медицинских изображений базируются преимущественно на методологии глубокого обучения — подклассе машинного обучения, использующем многослойные нейронные сети для извлечения иерархических представлений данных [76, 77].
Сверточные нейронные сети (CNN) стали стандартом де-факто для задач компьютерного зрения в медицине. Фундаментальное преимущество CNN заключается в способности автоматически обучаться распознаванию релевантных признаков изображений без необходимости их ручного проектирования [78]. Архитектуры типа ResNet, DenseNet, EfficientNet демонстрируют производительность, превосходящую человека-эксперта, в задачах классификации патологии на рентгенограммах, дерматоскопических изображениях, гистологических препаратах [29, 79, 80].
Для задач семантической сегментации — выделения областей интереса на изображениях с пиксельной точностью — разработаны специализированные архитектуры. U-Net, предложенная
Ronneberger и соавт. (2015), стала каноническим решением в медицинской визуализации благодаря своей способности обучаться на относительно небольших датасетах и обеспечивать высокую точность сегментации [81]. Последующие развития этой архитектуры — 3D U-Net, nnU-Net, U-Net++, Attention U-Net — улучшили производительность и адаптировали методологию для трёхмерных медицинских изображений.
Трансформеры (transformers), изначально разработанные для обработки естественного языка, в последние годы начали применяться и в компьютерном зрении. Vision Transformers (ViT) и их гибриды с CNN показывают впечатляющие результаты, особенно при доступности больших обучающих выборок. В медицинской визуализации трансформеры продемонстрировали эффективность для задач классификации патологии, детекции аномалий и мультиорганной сегментации.
Успехи в анализе сосудистых структур
Автоматизированный анализ сосудов представляет собой зрелую область применения глубокого обучения с многочисленными клинически валидированными решениями.
Коронарные артерии
Системы автоматической сегментации коронарных артерий на КТ-ангиографии достигли уровня зрелости, близкого к клиническому внедрению. Исследование Zreik и соавт. (2018) продемонстрировало способность CNN предсказывать функциональную значимость коронарных стенозов с площадью под ROC-кривой 0,74, что сопоставимо с оценкой опытных радиологов.
Wolterink и соавт. (2019) применили генеративно-состязательные сети (GANs) для синтеза КТ-ангиограмм из нативных КТ-изображений, эффективно «виртуализируя» контрастное усиление и позволяя оценить анатомию коронарных артерий без необходимости введения контрастного препарата. Хотя эта технология остаётся экспериментальной, она иллюстрирует потенциал генеративных моделей для решения проблемы ограниченного контраста на нативных изображениях.
Церебральные сосуды
Автоматическая сегментация интракраниальных артерий и выявление аневризм на КТ- и МР-ангиограммах активно исследуются. Park и соавт. (2019) разработали систему на основе CNN для детекции и классификации церебральных аневризм, достигнув чувствительности 91% и специфичности 95% на валидационной выборке из 611 случаев.
Liu и соавт. (2019) применили методы глубокого обучения для прогнозирования риска разрыва церебральных аневризм на основании морфологиче- ских параметров, автоматически извлекаемых из трёхмерных изображений. Их модель продемонстрировала AUC 0,82 для предсказания разрыва, что существенно превышает производительность традиционных морфологических индексов.
Периферические артерии
В контексте периферических артерий конечностей методы глубокого обучения применяются для автоматической оценки степени стеноза, планирования эндоваскулярных вмешательств и прогнозирования исходов реваскуляризации. Тем не менее, специфические работы по артериям челюстнолицевой области остаются немногочисленными.
Применение ИИ в челюстно-лицевой области: текущее состояние
Технологии искусственного интеллекта активно внедряются в различные аспекты стоматологии и челюстно-лицевой хирургии, преимущественно для анализа зубочелюстных структур, но не сосудистой анатомии.
Детекция кариеса и периапикальной патологии. Несколько коммерческих систем на основе CNN (например, Diagnocat, Overjet, Pearl) обеспечивают автоматическое выявление кариозных поражений, периапикальных очагов, патологии пародонта на внутриротовых рентгенограммах и КЛКТ с чувствительностью 85–92%.
Сегментация зубов и планирование ортодонтического лечения. Алгоритмы глубокого обучения используются для автоматической сегментации отдельных зубов на КЛКТ, построения трёхмерных моделей зубных рядов и прогнозирования результатов ортодонтического лечения.
Выявление переломов и патологии височнонижнечелюстного сустава. CNN демонстрируют высокую точность в детекции переломов костей лицевого скелета на КТ-изображениях и классификации дегенеративных изменений височнонижнечелюстного сустава.
Анализ околоносовых пазух. Системы автоматической сегментации околоносовых пазух и выявления синуситов разрабатываются для КТ и КЛКТ. Chowdhury и соавт. (2022) продемонстрировали точность автоматической классификации типов синуситов на уровне 87%.
Однако специфический анализ сосудистых структур челюстно-лицевой области остаётся малоизученным. Единственное релевантное исследование, которое удалось идентифицировать в процессе подготовки настоящей работы, — это уже упомянутая публикация Aboelmaaty и соавт. (2024), посвящённая автоматической детекции задней верхней альвеолярной артерии. Авторы использовали архитектуру U-Net, обученную на 450 КЛКТ- изображениях с ручной аннотацией положения артерии экспертами. Валидация на независимой выборке из 312 случаев показала:
-
• Чувствительность – 89,4%.
-
• Специфичность – 91,2%.
-
• Dice coefficient – 0,86.
-
• Среднее отклонение автоматически определенного положения от экспертной разметки – 0,74 ± 0,32 мм.
Эти результаты демонстрируют техническую осуществимость применения методов глубокого обучения для локализации сосудистых структур на КЛКТ, но ограниченность исследования одной ветвью артерии и отсутствие анализа всей сосудистой сети верхней челюсти подчеркивают необходимость дальнейших разработок.
Технические требования и ограничения
Разработка систем автоматизированного анализа медицинских изображений на основе глубокого обучения сталкивается с рядом фундаментальных технических вызовов:
-
1. Необходимость больших аннотированных датасетов. Современные архитектуры глубоких нейронных сетей требуют десятков тысяч обучающих примеров для достижения высокой обобщающей способности. В медицине создание таких датасетов затруднено необходимостью экспертной разметки, что трудоёмко и дорогостояще. Методы transfer learning (переноса обучения) и data augmentation (расширения данных) частично решают эту проблему, позволяя обучать модели на меньших выборках.
-
2. Вариабельность протоколов сканирования. Различия в параметрах КТ/КЛКТ между учреждениями (напряжение на трубке, толщина среза, алгоритмы реконструкции) приводят к вариабельности характеристик изображений, что может снижать производительность моделей при применении на данных из новых источников. Robust learning и domain adaptation — активные области исследований, направленные на создание моделей, устойчивых к таким вариациям.
-
3. Проблема «чёрного ящика» и клиническая интерпретируемость. Глубокие нейронные сети часто критикуют за непрозрачность принятия решений, что создаёт барьеры для клинического доверия и регуляторного одобрения. Методы explainable AI (объяснимого ИИ), такие как градиентные карты активации (Grad-CAM), attention mechanisms и layerwise relevance propagation, позволяют визуализировать области изображения, на которые модель «обращает внимание» при принятии решения, повышая интерпретируемость.
-
4. Валидация и регуляторные требования. Для клинического внедрения системы на основе ИИ должны пройти тщательную валидацию в проспективных исследованиях и получить регуляторное одобрение (например, FDA 510(k) в США, маркировку CE в Европе, регистрационное удостоверение Росздравнадзора в России). Это требует демонстрации не только технической точности, но и клинической полезности и безопасности.
Несмотря на эти вызовы, текущее состояние технологий глубокого обучения в медицинской визуализации сосудистых структур демонстрирует зрелость, достаточную для адаптации этих методов к специфической задаче анализа верхнечелюстной артерии. Следующий раздел представляет концептуальную модель такой системы.
АРХИТЕКТУРА СИСТЕМЫ: ОБЩИЙ ОБЗОР
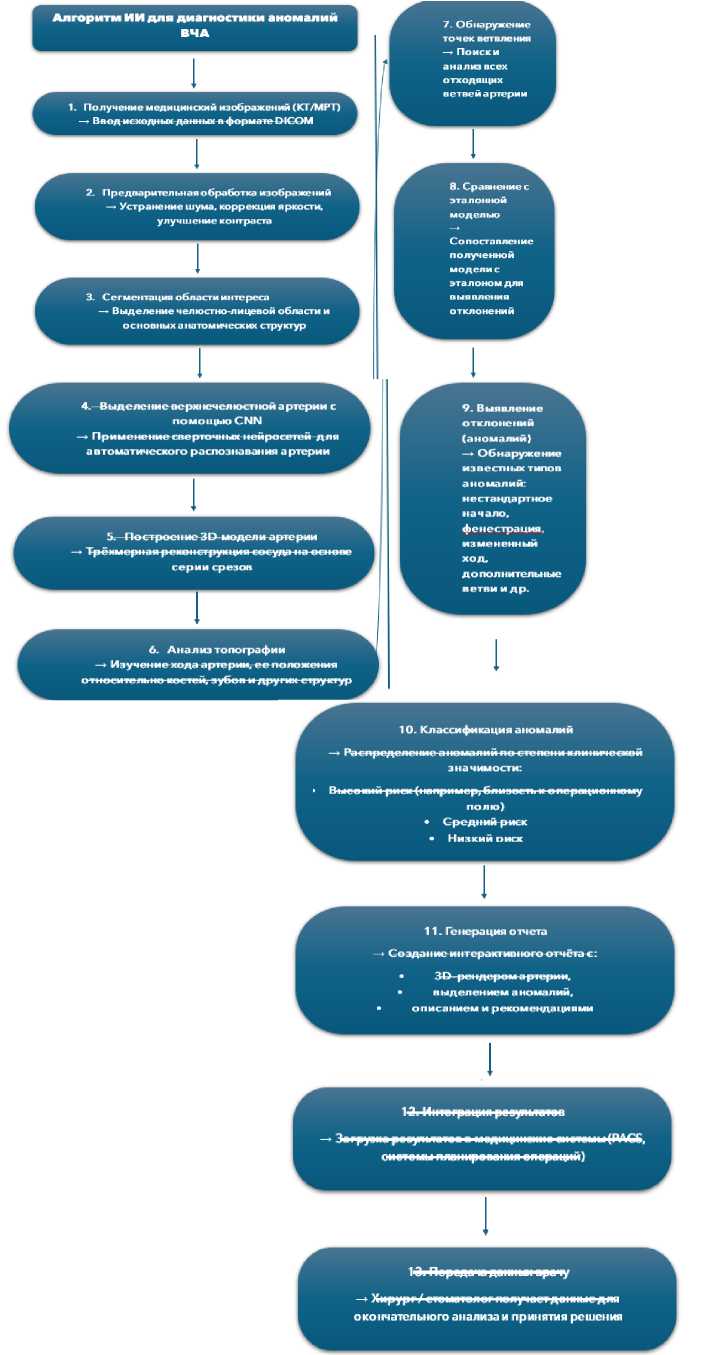
Предлагаемая концептуальная система для автоматизированного анализа анатомии верхнечелюстной артерии построена как последовательность взаимосвязанных модулей обработки данных. Первый модуль выполняет предобработку изображений: загружает DICOM-файлы компьютерной и конусно-лучевой томографии, стандартизирует интенсивности путем нормализации по окну мягких тканей, ориентирует данные в стандартное анатомическое пространство и контролирует качество путём проверки полноты анатомического покрытия.
Второй модуль осуществляет сегментацию анатомических структур. Система автоматически выделяет костные ориентиры, включая верхнюю челюсть, скуловую кость и крыловидные пластинки, сегментирует верхнечелюстную пазуху и идентифицирует крылонебную и подвисочную ямки.
Третий модуль обеспечивает детекцию и сегментацию сосудистой сети: выделяет ствол верхнечелюстной артерии, производит трассировку основных ветвей, к которым относятся задняя верхняя альвеолярная, подглазничная, нисходящая небная и клиновидно-небная артерии, после чего строит трёхмерную модель сосудистого дерева.
Четвёртый модуль выполняет морфометрический анализ и классификацию. Система измеряет диаметр сосудов в ключевых точках, определяет топографические взаимоотношения с костными структурами и верхнечелюстной пазухой, классифицирует выявленные варианты анатомии и оценивает хирургический риск по предопределенным критериям.
Пятый модуль отвечает за визуализацию и клинический отчёт: генерирует трёхмерные реконструкции с цветовым кодированием зон риска, автоматически формирует структурированный отчёт и обеспечивает интеграцию результатов в систему архивирования и передачи изображений и медицинские информационные системы.
Ввод исходных данных в формате DICOM
8. Сравнение с
Устранение шума, коррекция яркости.
Распределение аномалии по степени клиническом
Высоким риск (например.Близость к операционному
Создание интерактивного отчета с:
12. Интеграция результатов
13. Передача данных врачу
9. Выявление отклонении
(аномалии]
3D- рендером а ртерии.
выделением аномалия
Средним риск
Низким писк
Сопоставление полученной отходящих ветвей а ртерии
Хирург/ стоматолог получает да иные для окончательного анализа и принятия решения
5. 11остроение зи модел и артерии
Трехмерная реконструкция сосуда на основе
Изучение хода артерии, ее положения относительно костей, зубов и других структур
Выделение верхнем ел i помощью CNN
Применение сверточных нейросетей для автоматического распознавания артерии
Загрузка результатов в медицинские системы (PACS, системы планирования операции)
Рисунок 2. Алгоритм ИИ для диагностики аномалий верхнечелюстной артерии Figure 2. An AI algorithm for diagnosing maxillary artery abnormalities
МЕТОДОЛОГИЧЕСКИЕ РЕШЕНИЯ
ДЛЯ КЛЮЧЕВЫХ МОДУЛЕЙ
Сегментация сосудистой сети: выбор архитектуры
Для задачи сегментации верхнечелюстной артерии и её ветвей наиболее перспективной представляется архитектура nnU-Net, то есть самоконфигу-рирующаяся вариация U-Net, предложенная Isensee и соавторами в 2021 году. Эта архитектура продемонстрировала результаты уровня state-of-the-art в многочисленных задачах медицинской сегментации, включая сосудистые структуры.
Ключевые преимущества nnU-Net для нашей задачи заслуживают детального рассмотрения. Во-первых, система обеспечивает автоматическую оптимизацию гиперпараметров на основе характеристик датасета, таких как размерность изображений, размер объектов и соотношение классов, что снижает необходимость ручной настройки. Во-вторых, архитектура поддерживает трёхмерные данные с эффективным использованием контекстной информации из смежных срезов, критически важной для точной трассировки сосудов. В-третьих, каскадная архитектура позволяет работать с объектами разного масштаба: ствол верхнечелюстной артерии имеет диаметр от двух до трёх миллиметров, тогда как мелкие ветви достигают лишь половины-полутора миллиметров. В-четвёртых, система демонстрирует устойчивость к вариациям параметров сканирования, достигаемую за счёт интенсивного расширения данных во время обучения.
Впрочем, заслуживают рассмотрения и альтернативные архитектуры. Трёхмерная U-Net с attention gates позволяет сфокусировать сеть на сосудистых структурах при одновременном подавлении фоновых тканей. V-Net представляет собой специализированную архитектуру для трёхмерной сегментации с использованием Dice loss, что может оказаться выгодным для работы с тонкими структурами типа мелких сосудов. Swin-UNETR, являющийся гибридом трансформера и U-Net, показал впечатляющие результаты в мультиорганной сегментации.
Решение проблемы ограниченного контраста
Фундаментальная техническая проблема заключается в том, что на нативных изображениях компьютерной и конусно-лучевой томографии контраст между кровью в просвете артерии и окружающими мягкими тканями минимален. Для её решения мы предлагаем несколько подходов.
Первый подход предполагает использование косвенных признаков. Вместо прямой визуализации просвета сосуда система может опираться на вторичные признаки: костные каналы, в которых проходят артерии (например, подглазничный канал или крылонебная ямка), паттерны мягкотканно- го затенения вдоль предполагаемого хода сосуда и топографические взаимоотношения с хорошо визуализируемыми структурами, к числу которых относятся крыловидные отростки и верхнечелюстная пазуха.
Второй подход основан на трансферном обучении с предобучением на ангиографиях. Нейронную сеть можно сначала обучить на небольшой выборке КТ-ангиограмм, где сосуды визуализируются отчётливо, после чего провести fine-tuning на больших наборах нативных исследований. Это позволяет сети научиться распознавать паттерны сосудистой анатомии даже при ограниченном контрасте.
Третий подход предполагает мультимодальное обучение. Если для части пациентов доступны как нативные исследования, так и КТ-ангиограммы, можно обучить модель предсказывать положение сосудов на нативных изображениях, используя ангиограммы в качестве ground truth.
Четвёртый подход, технически наиболее сложный, заключается в синтетическом контрастном усилении с помощью генеративно-состязательных сетей. Такие сети могут быть обучены трансформировать нативные изображения в виртуальные ангиограммы. Успешное применение этого подхода для коронарных артерий, продемонстрированное Wolterink и соавторами в 2019 году, показывает принципиальную осуществимость метода.
Стратегия создания обучающего датасета
Ключевым препятствием для реализации предлагаемой системы является необходимость большого датасета аннотированных изображений. Рациональная стратегия создания такого датасета включает несколько последовательных этапов.
На первом этапе создаётся пилотный датасет объёмом от ста до ста пятидесяти случаев. Производится ретроспективный отбор изображений компьютерной и конусно-лучевой томографии пациентов, проходивших обследование перед хирургическими вмешательствами. Эксперты — челюстно-лицевой хирург совместно с рентгенологом — выполняют ручную аннотацию с использованием специализированного программного обеспечения, такого как 3D Slicer или ITK-SNAP. Оценка межэкспертного согласия обеспечивает качество разметки. Полученный датасет используется для предварительного обучения модели и оценки технической осуществимости.
На втором этапе формируется основной датасет объёмом от пятисот до тысячи случаев. Расширение датасета осуществляется с привлечением нескольких медицинских центров для обеспечения вариабельности параметров сканирования. Частичная автоматизация аннотации становится возможной: модель, обученная на пилотном датасете, генерирует предварительную разметку, которую эксперт корректирует, что позволяет экономить от 60% до 70% времени. Стратифицированный отбор случаев обеспечивает представленность редких анатомических вариантов.
На третьем этапе собирается валидационный датасет объёмом от двухсот до трёхсот случаев. Формируется независимая когорта для оценки производительности модели. Проспективный сбор данных сопровождается фиксацией клинических исходов, включающих наличие или отсутствие интраоперационных осложнений, что позволяет оценить клиническую полезность системы.
Четвёртый этап представляет собой непрерывное обучение. Создаются механизмы обратной связи для инкорпорации новых случаев и редких вариантов. Модель периодически переобучается на расширенном датасете, что обеспечивает постоянное повышение точности распознавания.
Классификация анатомических вариантов и оценка риска
После сегментации сосудистой сети система должна классифицировать выявленные анатомические паттерны и оценить хирургический риск. Предлагаемая таксономия включает четыре класса.
Первый класс соответствует типичной анатомии. Ствол артерии проходит медиально от латеральной крыловидной мышцы. Задняя верхняя альвеолярная артерия располагается на расстоянии более пятнадцати миллиметров от альвеолярного гребня. Ветвление в крылонебной ямке соответствует стандартному паттерну. Хирургический риск при такой анатомии остается низким.
Второй класс включает малые вариации. Ствол может проходить поверхностно, то есть латераль-но от крыловидной мышцы. Задняя верхняя альвеолярная артерия располагается на расстоянии от десяти до пятнадцати миллиметров от альвеолярного гребня при диаметре менее полутора миллиметров. Наблюдаются незначительные изменения в ветвлении без клинической значимости. Хирургический риск оценивается как умеренный, требующий внимания при синус-лифтинге.
Третий класс характеризуется значительными вариациями. Задняя верхняя альвеолярная артерия располагается менее чем в десяти миллиметрах от альвеолярного гребня при диаметре более полутора миллиметров, что создаёт высокий риск при синус-лифтинге. Ствол может проникать через височную мышцу. Артерия может иметь аномальное начало. Хирургический риск высок и требует модификации хирургической техники или отказа от планируемого вмешательства.
Четвёртый класс объединяет редкие аномалии: фенестрацию, дубликацию ствола, патологическое изменение хода при опухолях или после травмы. Хирургический риск очень высок и требует индивидуального планирования, возможно с выполнением КТ-ангиографии.
Для автоматической классификации можно использовать отдельную нейронную сеть, например ResNet или EfficientNet, обученную на признаках, извлеченных из сегментационных масок и морфометрических параметров.
Интеграция в клинический workflow
Критическим аспектом любой системы медицинского искусственного интеллекта является её бесшовная интеграция в существующий клинический рабочий процесс. Предлагаемая система должна соответствовать нескольким принципиальным требованиям.
Во-первых, система автоматически получает изображения из системы архивирования и передачи изображений при соответствии определенным критериям, например при назначении «предоперационная КТ для дентальной имплантации». Во-вторых, анализ запускается в фоновом режиме без необходимости ручного вмешательства оператора. В-третьих, система генерирует структурированный отчёт в стандартизированном формате с визуализацией зон хирургического риска. В-четвёртых, обеспечивается интеграция с медицинскими информационными системами для автоматической передачи результатов в электронную медицинскую карту пациента. В-пятых, предусматривается интерфейс для коррекции результатов врачом в случае явных ошибок системы. В-шестых, все взаимодействия логируются для целей непрерывного улучшения и регуляторного аудита.
ПОТЕНЦИАЛЬНЫЕ ПРЕИМУЩЕСТВА
И КЛИНИЧЕСКАЯ ЦЕННОСТЬ
Стандартизация диагностических подходов
Одним из фундаментальных преимуществ автоматизированного анализа является устранение межиндивидуальной вариабельности в интерпретации изображений. Исследования документируют значительные различия между специалистами в оценке анатомии верхнечелюстной артерии: коэффициент межэкспертного согласия для определения положения задней верхней альвеолярной артерии колеблется от 0,68 до 0,82 в зависимости от опыта специалистов [22, 23].
Система на основе искусственного интеллекта обеспечивает воспроизводимую, детерминированную оценку, идентичную для одного и того же изображения независимо от времени анализа, загруженности рентгенолога или других субъективных факторов. Это создает основу для единых протоколов предоперационной оценки в различных учреждениях, объективных критериев хирургического риска для принятия клинических решений и сопоставимости результатов в многоцентровых исследованиях и регистрах.
Повышение эффективности предоперационного планирования
Время, затрачиваемое рентгенологом на детальный анализ положения верхнечелюстной артерии с построением трёхмерных реконструкций, составляет от двадцати до сорока пяти минут [24]. Автоматизированная система способна выполнять эквивалентный анализ за одну–пять минут в зависимости от вычислительных ресурсов.
Экономия времени имеет несколько аспектов. Во-первых, снижается нагрузка на рентгенологов, позволяя им сосредоточиться на сложных диагностических случаях, требующих экспертного суждения. Во-вторых, хирурги более быстро получают предоперационную информацию, что ускоряет планирование вмешательств. В-третьих, становится возможным рутинный анализ для всех пациентов, проходящих предоперационную визуализацию, тогда как сейчас детальная оценка сосудистой анатомии часто проводится только при наличии специального запроса.
Минимизация интраоперационных осложнений
Предполагается, что точная предоперационная идентификация анатомических вариантов высокого риска может снизить частоту интраоперационных сосудистых осложнений. Хотя прямые доказательства этого утверждения для верхнечелюстной артерии отсутствуют, аналогии из других областей хирургии подтверждают эту гипотезу.
В нейрохирургии использование систем автоматической сегментации сосудов при планировании резекции артериовенозных мальформаций ассоциировано со снижением частоты послеоперационного неврологического дефицита с 8,2% до 4,7%, что соответствует относительному снижению риска на 43%. В кардиохирургии предоперационное трёхмерное моделирование коронарных артерий коррелирует с сокращением времени операции аортокоронарного шунтирования на 18–22% и снижением частоты ревизий по поводу кровотечения.
Экстраполируя эти данные на контекст челюстно-лицевой хирургии, можно предположить, что система автоматизированного анализа верхнечелюстной артерии потенциально способна снизить частоту значимого интраоперационного кровотечения при синус-лифтинге с текущих 3–7% до 1–2%, уменьшить необходимость конверсии эндоскопических операций на пазухах в открытые вмешательства для контроля кровотечения и улучшить исходы реконструктивных операций за счёт точно- го планирования микрососудистых анастомозов. Однако эти предположения требуют проспективной валидации в клинических исследованиях.
Образовательные применения
Помимо клинического использования, система автоматизированного анализа может служить мощным образовательным инструментом. Студенты медицинских вузов и ординаторы могут использовать систему для интерактивного изучения анатомии, визуализируя различные анатомические варианты верхнечелюстной артерии на реальных клинических случаях, что дополняет традиционное изучение на кадаверном материале.
Трёхмерные модели, генерируемые системой, могут интегрироваться в виртуальные симуляторы для симуляции хирургических сценариев и отработки хирургических навыков в безопасной среде. Автоматизированный анализ больших массивов изображений позволяет создать цифровой атлас вариабельности верхнечелюстной артерии, стратифицированный по демографическим параметрам, полезный для научных и образовательных целей.
Исследовательские применения
Наличие автоматизированного инструмента анализа открывает новые возможности для анатомических исследований. Становятся осуществимыми популяционные исследования частоты различных вариантов строения в больших когортах с стратификацией по возрасту, полу и этнической принадлежности. Возможно изучение корреляций между анатомическими вариантами и клиническими исходами хирургических вмешательств. Система позволяет проводить морфометрические исследования изменений сосудистой анатомии при патологических процессах, таких как опухоли или остеорадионекроз. Открываются перспективы для изучения генетических ассоциаций между определенными вариантами строения и генетическими маркерами.
ОГРАНИЧЕНИЯ, ВЫЗОВЫ И БАРЬЕРЫ
ДЛЯ ВНЕДРЕНИЯ
Технические ограничения
Качество и вариабельность исходных данных. Эффективность систем глубокого обучения критически зависит от качества входных данных. В контексте компьютерной и конусно-лучевой томографии существуют значительные вариации. Различные производители сканеров — Siemens, GE, Philips для компьютерной томографии, Planmeca и Carestream для конусно-лучевой томографии — используют различные алгоритмы реконструкции изображений. Параметры сканирования, включающие напряжение на трубке, толщину среза и поле обзора, варьируют между учреждениями и протоколами. Артефакты от металлических зубных конструкций могут значительно ухудшать качество изображений.
Для обеспечения устойчивости системы к этим вариациям требуется обучение на мультицентровых данных с различным оборудованием, агрессивное расширение данных во время обучения и, возможно, создание отдельных моделей для компьютерной и конусно-лучевой томографии или использование мультимодальной архитектуры.
Редкие анатомические варианты. Обучение модели распознавать редкие варианты с частотой менее одного процента требует их адекватной представленности в обучающей выборке. Для варианта с частотой 0,5% требуется датасет минимум двадцать тысяч случаев, чтобы иметь хотя бы сто примеров этого варианта для обучения.
Стратегии решения включают целенаправленный поиск и включение редких случаев, применение методов few-shot learning для обучения на малых выборках и использование синтетических данных, генерированных на основе известных анатомических принципов.
Ограниченный контраст мягких тканей. Как обсуждалось ранее, визуализация сосудов на нативных изображениях представляет фундаментальную техническую проблему. В случаях с ожирением, обезвоживанием или анемией контраст может быть настолько низким, что даже эксперт испытывает трудности с идентификацией артерии. Система искусственного интеллекта будет сталкиваться с аналогичными ограничениями.
Реалистичное ожидание заключается в том, что система будет высокоточна в 85–90% случаев с хорошим качеством изображений, но может требовать подтверждения экспертом или дополнительной визуализации, такой как КТ-ангиография, в сложных случаях.
Организационные и регуляторные барьеры
Регуляторное одобрение. Системы медицинского искусственного интеллекта, используемые для принятия клинических решений, подлежат регулированию как медицинские изделия. В России это требует получения регистрационного удостоверения Росздравнадзора, проведения клинических испытаний для демонстрации безопасности и эффективности и соответствия государственным стандартам для программного обеспечения медицинского назначения. Процесс регистрации может занимать от двенадцати до двадцати четырёх месяцев и требует значительных финансовых вложений, оценки которых варьируют от пяти до пятнадцати миллионов рублей.
Интеграция в медицинские информационные системы. Большинство российских медицинских учреждений используют различные медицинские информационные системы — МЕДИАЛОГ, Медиалогия, БАРС, Медицина 2.0 и другие, — которые часто не имеют стандартизированных программных интерфейсов для интеграции внешних систем искусственного интеллекта. Это создает технические барьеры для развертывания решений.
Необходимы разработка стандартизированных протоколов обмена данными, участие вендоров медицинских информационных систем в создании экосистемы приложений искусственного интеллекта и, возможно, государственная инициатива по стандартизации интеграционных интерфейсов.
Экономические факторы. Разработка, валидация и внедрение системы автоматизированного анализа требует значительных инвестиций. Создание обучающего датасета обходится в десять-двадцать миллионов рублей, что включает экспертную аннотацию и инфраструктуру хранения данных. Разработка и обучение модели требует пяти–десяти миллионов рублей на вычислительные ресурсы и заработную плату специалистов по машинному обучению. Клинические испытания оцениваются в пятнадцать-тридцать миллионов рублей. Регуляторное одобрение требует пятипятнадцати миллионов рублей. Поддержка и непрерывное обновление составляют три-пять миллионов рублей ежегодно. Таким образом, ориентировочная стоимость вывода продукта на рынок составляет от тридцати пяти до семидесяти пяти миллионов рублей.
Модель монетизации должна обеспечить возврат инвестиций через лицензирование системы клиникам по подписочной модели, плату за анализ каждого исследования или государственное финансирование в рамках программ цифровизации здравоохранения.
Врачебное доверие и приемлемость. Внедрение искусственного интеллекта в клиническую практику часто сталкивается с сопротивлением со стороны медицинских специалистов, обусловленным опасениями относительно точности и надежности автоматизированных систем, восприятием искусственного интеллекта как угрозы профессиональной автономии и неясностью юридической ответственности в случае ошибок системы.
Стратегии повышения приемлемости включают позиционирование системы как инструмента поддержки принятия решений, а не замены врача, обеспечение прозрачности алгоритмов с визуализацией признаков, на которые опирается система, вовлечение клиницистов в процесс разработки и валидации, а также программы обучения для вра- чей по использованию инструментов искусственного интеллекта.
Этические соображения
Конфиденциальность данных. Обучение моделей на медицинских изображениях требует соблюдения законодательства о персональных данных, включая Федеральный закон 152-ФЗ в России и GDPR в Европе. Необходимы деидентификация изображений с удалением метаданных пациентов, получение информированного согласия на использование данных для обучения искусственного интеллекта и защищённые каналы передачи данных.
Предвзятость алгоритмов. Если обучающая выборка не репрезентативна по демографическим параметрам, таким как возраст, пол и этническая принадлежность, обученная модель может демонстрировать различную точность для разных групп пациентов. Это этически неприемлемо.
Стратегия митигации включает обеспечение демографического разнообразия обучающей выборки, стратифицированную валидацию с отдельной оценкой точности для различных подгрупп и непрерывный мониторинг производительности после внедрения с корректировкой при выявлении диспропорций.
Юридическая ответственность. Юридические рамки ответственности при использовании искусственного интеллекта в медицине остаются неясными. Вопросы включают: несёт ли врач полную ответственность за решения, принятые с использованием рекомендаций искусственного интеллекта, может ли разработчик системы нести ответственность в случае ошибки алгоритма, должны ли пациенты быть информированы об использовании искусственного интеллекта в их лечении. Эти вопросы требуют законодательного урегулирования и выработки клинических руководств по использованию искусственного интеллекта в хирургическом планировании.
Заключение
Настоящая работа представила концептуальное обоснование применения искусственного интеллекта для автоматизированного анализа анатомии верхнечелюстной артерии по данным компьютерной и конусно-лучевой томографии.
Мы систематизировали известные анатомические вариации сего сосуда и их клиническую значимость. Точная предоперационная оценка сосудистой топографии критически важна для минимизации интраоперационных осложнений при синус-лифтинге, дентальной имплантации, эндоскопических вмешательствах на околоносовых пазухах и реконструктивных операциях.
Анализ современного состояния методов глубокого обучения в медицинской визуализации сосудов демонстрирует высокий уровень зрелости технологий для смежных анатомических областей — коронарных, церебральных, периферических артерий. Таковое обосновывает техническую осуществимость их адаптации для анализа верхнечелюстной артерии. Ключевые технологические компоненты — сверточные нейронные сети для семантической сегментации, алгоритмы трехмерной реконструкции, методы transfer learning для работы с ограниченными обучающими выборками — доступны и апробированы в клинической практике.
Предложенная архитектура системы включает последовательность модулей: предобработка изображений, сегментация анатомических структур, детекция и трассировка сосудистой сети, морфометрический анализ, классификация вариантов, оценка хирургического риска с генерацией визуальных отчётов. Для модуля сегментации обосновывается выбор архитектуры nnU-Net с её само-конфигурирующимися свойствами и устойчивостью к вариациям параметров сканирования.
Потенциальные преимущества автоматизированного анализа включают стандартизацию диагностических подходов с устранением субъективности интерпретации, повышение эффективности предоперационного планирования через сокращение времени анализа, возможность минимизации интраоперационных осложнений через точную идентификацию анатомических вариантов высокого риска, а также образовательные и исследовательские применения.
Вместе с тем признаются существенные барьеры для реализации концепции. Техническая проблема ограниченного мягкотканного контраста на нативных изображениях требует инновационных методологических решений: использование косвенных анатомических признаков, transfer learning с предобучением на контрастных ангиограммах, возможное применение генеративных моделей для синтетического усиления контраста. Организационные вызовы включают необходимость создания больших мультицентровых датасетов аннотированных изображений, интеграции с разнородными медицинскими информационными системами, обеспечения экономической устойчивости разработки. Регуляторный путь требует проведения клинических испытаний и получения одобрения как медицинского изделия. Этические соображения включают обеспечение конфиденциальности данных пациентов, предотвращение алгоритмической предвзятости, прояснение юридической ответственности при использовании искусственного интеллекта в клинических решениях.
Предложенная фазовая исследовательская траектория — от технико-экономического обоснования через расширение датасета и валидацию к оценке клинической полезности в рандомизированных испытаниях и последующему внедрению — обеспечивает структурированный путь для трансформации концепции в клинически применимое решение.
Важно подчеркнуть: настоящая работа носит концептуальный характер и не описывает готовую технологию либо завершенное исследование. Мы представили научно обоснованную аргументацию возможности и целесообразности разработки систем автоматизированного анализа верхнечелюстной артерии, опираясь на достижения в смежных областях применения искусственного интеллекта в медицинской визуализации. Реализация концепции потребует многолетних коллективных усилий междисциплинарных команд — специалистов по машинному обучению, челюстно-лицевых хирургов, рентгенологов, анатомов, инженеров медицинских систем, — а также значительных финансовых инвестиций и институциональной поддержки.
Тем не менее, учитывая клиническую значимость проблемы, технологическую готовность методов искусственного интеллекта и стратегическое направление развития здравоохранения в сторону цифровизации и персонализированной медицины, мы считаем предложенное направление исследований перспективным и заслуживающим внимания научного и медицинского сообщества.


