Использование 8-diff клинического анализа крови больных для оценки тяжести течения новой коронавирусной инфекции
Автор: Слесарева Т. А., Груздева О. В., Тарасова О. Л., Кузьмина А. А., Алексеенко А. В., Дылева Ю. А., Долинчик Т. Р., Баздырев Е. Д., Гофман Л. С., Барбараш О. Л.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 4 т.37, 2022 года.
Бесплатный доступ
Введение. Новая коронавирусная инфекция вызывает разнообразные изменения в организме инфицированного, что можно мониторировать с помощью клинического анализа крови. Возможности проточной цитофлюориметрии позволяют расширить спектр анализируемых популяций клеток, что дает более полное представление о состоянии пациента и течении инфекционного процесса.Цель: изучение расширенного 8-diff клинического анализа крови пациентов с COVID-19 и выявление параметров, характеризующих тяжелое течение и неблагоприятный исход.Материал и методы. В исследуемую группу вошли 282 пациента с подтвержденным диагнозом новой коронавирусной инфекции. Оценивались следующие параметры расширенного 8-diff клинического анализа крови: общее содержание лейкоцитов и их популяций, количество реактивных и антителсинтезирующих лимфоцитов (RELYMPH, AS-LYMPH), показатели, характеризующие реактивность и гранулярность нейтрофилов (NEUT-RI, NEUT-GI), содержание эритроцитов, гемоглобина, нормобластов, тромбоцитов. Статистическая обработка данных проводилась с использованием пакета STATISTICA 10.0.Результаты. Картина крови пациентов с тяжелым течением новой коронавирусной инфекции, а также пациентов, имеющих неблагоприятный исход заболевания, характеризовалась нейтрофилией, нормобластемией и увеличением количества незрелых гранулоцитов. В то же время отмечалось значительное снижение количества лимфоцитов, моноцитов ниже референсного интервала и уменьшение количества эозинофилов до полного их отсутствия. Проведенный логистический регрессионный анализ позволил определить гематологические параметры, наиболее значимые в прогнозировании исхода COVID-19, которыми являлись: общее количество лейкоцитов (ОШ 1,3), нейтрофилов (ОШ 2,1), реактивные нейтрофилы (ОШ 1,3), эозинофилы (ОШ 0,05), моноциты (ОШ 0,2), лимфоциты (ОШ 0,4), NLR (ОШ 1,4). Также для данных параметров были установлены пороговые значения, так, общее количество лейкоцитов > 7,2 × 109/л, нейтрофилов > 5 × 109/л, реактивных нейтрофилов > 48,6 Fi, эозинофилов 2,9 были ассоциированы с неблагоприятным исходом болезни.Заключение. Полученные данные могут быть использованы в комплексной оценке состояния пациента с COVID-19 вместе с другими лабораторными маркерами тяжелого течения инфекции
Covid-19, гематологические показатели, степень тяжести
Короткий адрес: https://sciup.org/149141447
IDR: 149141447 | УДК: 616.98:578.834.1-036.21]-039.3-07:616.15-07 | DOI: 10.29001/2073-8552-2022-37-4-149-160
Текст научной статьи Использование 8-diff клинического анализа крови больных для оценки тяжести течения новой коронавирусной инфекции
УДК: 616.98:578.834.1-036.21]-039.3-07:616.15-07
Слесарева Т.А., Груздева О.В., Тарасова О.Л., Кузьмина А.А., Алексеенко А.В., Дыле-ва Т.Р., Долинчик Ю.А., Баздырев Е.Д., Гофман Л.С., Барбараш О.Л. Использование 8-diff клинического анализа крови больных для оценки тяжести течения новой коронавирусной инфекции. Сибирский журнал клинической и экспериментальной медицины. 2022;37(4):149–160.
Клиническая картина новой коронавирусной инфекции охватывает множество вариантов течения – от бессимптомного носительства до тяжелых форм с развитием полиорганной недостаточности [1]. На сегодняшний день существует множество лабораторных тестов, с помощью которых оценивается клинический статус пациента, в том числе гемоцитометрия [2]. Исследование гематологических параметров на современных анализаторах позволяет не только определиться с количеством клеток в объеме образца, но и оценить их функцию. Так, на смену 5-diff анализу приходит 8-diff с выделением популяций незрелых гранулоцитов, реактивных и антителсинтезирующих лимфоцитов, нейтрофилов с гипергрануляцией и нейтрофилов с высокой флюоресценцией. Также на сегодняшний день появилась возможность дифференцированного подсчета ядросодержащих эритроцитов в периферической крови, которые дают информацию об эффективности гемопоэза и развитии гипоксиемии. Изучение данных показателей и выявление закономерностей их изменений у больных новой коронавирусной инфекцией может дать возможность диагностировать ухудшение состояния больного и вносить изменения в тактику лечения без дополнительных исследований и финансовых затрат.
Цель: изучить параметры расширенного клинического анализа крови для установления прогностических показателей, характеризующих тяжелое течение и летальный исход новой коронавирусной инфекции.
Материал и методы
В исследование были включены 282 пациента с новой коронавирусной инфекцией разной степени тяжести, госпитализированные в отделение для лечения пациентов с сердечно-сосудистыми заболеваниями (ССЗ) и COVID-19 на базе ГБУЗ ККД имени Л.С. Барбараша (Кемерово), в возрасте от 18 до 95 лет. Диагноз COVID-19 устанавливался на основании временных методических рекомендаций «Профилактика, диагностика и лечение новой коронавирусной инфекции (Сovid-19)», Версия 9 (26.10.2020) и подтверждался с помощью полимеразной цепной реакции (ПЦР) с обратной транскрипцией в режиме реального времени, определяющей наличие вирусной РНК. Для оценки степени тяжести всем пациентам выполнялся стандартный набор физикальных, инструментальных и лабораторных исследований. Клинические проявления варьировали от легкой и среднетяжелой (пневмония без нарушения сатурации О2) до тяжелой (сатурация О2 89–93%) и крайне тяжелой степени (сатурация ≤ 88%, острая дыхательная недостаточность, по-лиорганная недостаточность, шок). Степень дыхательной недостаточности оценивалась по клиническим (одышка, цианоз, пульс в покое) и инструментальным показателям (рО2 артериальной крови, ОФВ1, индекс Генслера). У всех пациентов COVID-19 протекал на фоне хронических коморбидных заболеваний. Ишемической болезнью сердца (ИБС) страдали 244 человека (86,2%), фибрилляцией предсердий – 89 человек (31,5%), артериальной гипертонией (АГ) – 276 человек (97,5%), острым нарушением мозгового кровообращения (ОНМК) – 88 человек (31,1%), хронической сердечной недостаточностью (ХСН) различной степени тяжести – 205 (72,4%), инфарктом миокарда (ИМ) – 71 (25,1%), стенокардией различной степени тяжести – 67 (23,7%), сахарным диабетом – 67 человек (23,7%) в том числе 2-го типа – 65 человек (23%), 1-го типа – 2 человека (0,7%); пороки сердца были у 76 человек. Результаты гематоцитометрии были получены в первый день госпитализации пациентов с помощью исследования образцов крови, взятых в пробирку с ЭДТА на гематологическом анализаторе Sysmex XN-1000 (Япония), в технологии измерения которого используется проточная цитофлюориметрия, что позволяет выделять дополнительные популяции клеток на основе их морфологии и функциональных особенностей. Количественную оценку проводили по следующим показателям: общее количество лейкоцитов, абсолютное количество нейтрофилов, лимфоцитов, моноцитов, базофилов, эозинофилов, незрелых гранулоцитов (промиелоциты, миелоциты, метамиелоциты), количество эритроцитов, концентрация гемоглобина, количество нормобластов, тромбоцитов.
Оценку морфометрии клеток осуществляли на основании параметров, характеризующих величину прямого светорассеивания нейтрофильной (NE-FSC), лимфоцитарной (LY-Z), моноцитарной (MO-Z) областей в WBC скатерограмме. Информацию о внутренней структуре клеток (сегментация ядра, соотношение ядра и цитоплазмы, грануляция, вакуолизация) получали по показателю величины бокового светорассеивания нейтрофильной (NE-SSC), лимфоцитарной (LY-X), моноцитарной (MO-X) областей в WBC скатерограмме. Функциональную активность нейтрофилов, лимфоцитов и моноцитов оценивали по количественным и качественным параметрам, свиде- тельствующим об их активации – реактивности и гранулярности нейтрофилов – NEUT-RI и NEUT-GI, а также NE-SFL – величине флуоресцентного свечения нейтрофильной области в WBC скатерограмме; реактивности и антителсинтезирующей способности лимфоцитов RELYMPH и AS- LYMPH, и LY-Y – по величине флуоресцентного свечения лимфоцитарной области в WBC скатеро-грамме. Об активации моноцитов судили по параметру, характеризующему величину флуоресцентного свечения моноцитарной (MO-Y) области в WBC скатерограмме. Для комплексной оценки, включающей прогнозирование исхода заболевания, были рассчитаны коэффициенты NLR, PLR, LMR. Коэффициент NLR (Ratio of neutrophils to lymphocytes) рассчитывали путем деления абсолютного количества нейтрофилов на абсолютное количество лимфоцитов. Коэффициент PLR (Ratio of platelets to lymphocytes) равен отношению количества тромбоцитов к количеству лимфоцитов. Коэффициентом LMR (Ratio of lymphocytes to monocytes) обозначали отношение значения лимфоцитов к значению моноцитов.
Статистическую обработку данных проводили с использованием пакета STATISTICA 10.0. Для оценки нормальности распределения количественных показателей использовали тест Колмогорова – Смирнова. Возраст пациентов описывали средним значением и стандартным отклонением, остальные количественные показатели представляли медианой ( Ме ) и межквартильным диапазоном ( Q1 – Q3 ). Для оценки статистической значимости различий количественных показателей при сравнении трех и более независимых групп с отличным от нормального распределения использовали критерий Краскела – Уоллиса, при парных сравнениях – U -тест Манна – Уитни. При апостериорных парных сравнениях уровень значимости устанавливался с применением поправки Бонфер-рони.
Для сравнения частот распространенности факторов риска в независимых группах использовали χ2-критерий Пирсона. Статистически значимыми считали различия при достигнутом уровне значимости p ≤ 0,05.
Результаты
Установлено, что из всей выборки больных 9% (27 человек) переносили новую коронавирусную инфекцию в легкой степени, 69% (194 человека) – в средней степени, 22% (61 человек) – в тяжелой степени. Средний возраст исследуемых составил 67,9 ± 11,5 лет. Пациенты с тяжелым течением инфекции были значительно старше тех ( Ме = 71 (65–79)), у кого болезнь протекала легко ( Ме = 61 (56–68)), р = 0,012. Количество мужчин в исследуемой выборке составило 54% (154 человека), женщин – 46% (129 человек). Частота встречаемости мужчин и женщин в группах, выделенных в зависимости от степени тяжести, была практически одинаковой.
Изменение показателей крови в зависимости от степени тяжести течения новой коронавирусной инфекции
В результате оценки гематологических параметров пациентов в зависимости от степени тяжести COVID-19-ас-социированной пневмонии было установлено, что картина крови тяжелых больных характеризуется повышенным уровнем лейкоцитов, нейтрофильных гранулоцитов и незрелых гранулоцитов. Медиана по данному показателю у тяжелых больных была в 6 раз больше, чем у пациентов с легким течением заболевания. Параметры NEUT-GI и NEUT-RI не показали значимых изменений, как и значения показателей, характеризующих их внутреннюю структуру, степень флуоресценции и размер клеток.
В группе с тяжелым течением инфекции отмечалось развитие эозинопении, в отношении базофильных гранулоцитов различий не обнаружено.
У больных с тяжелым течением COVID-19-ассоции-рованной пневмонии медиана количества лимфоцитов была в 1,7 раза меньше, чем у пациентов с легким течением. Общее количество лимфоцитов, обладающих реактивностью, не изменялось между группами пациентов, но доля лимфоцитов, синтезирующих антитела, была больше у пациентов с тяжелым течением болезни, что обусловливает повышенный флуоресцентный сигнал лимфоцитов у таких больных (табл. 1).
Таблица 1. Количественная характеристика лейкоцитов пациентов с новой коронавирусной инфекцией в первый день госпитализации в зависимости от степени тяжести COVID-19
Table 1. Quantitative characterization of leukocytes in patients with novel coronavirus infection on day 1 of hospitalization depending on the severity of COVID-19
|
Показатели × 109/л Parameters × 109/L |
Группа по степени тяжести Severity group |
Уровень значимости p (все группы) Significance level p (all groups) |
Уровень значимости (парные сравнения) Significance level (pairwise comparison) |
||
|
Группа 1 Group 1 ( n = 27) |
Группа 2 Group 2 ( n = 194) |
Группа 3 Group 3 ( n = 39) |
|||
|
Общее количество лейкоцитов Total white blood cell count |
7,1 (6,1–8,6) |
7,9 (4,6–9,7) |
11,6 (7–13,2) |
0,03 |
p 2–3 = 0,004 |
|
Нейтрофилы Neutrophils |
4 (2,6–5,1) |
5,3 (2,5–7) |
9,2 (4,9–12,6) |
0,006 |
p 2–3 = 0,000 p 1–3 = 0,000 |
|
Базофилы Basophils |
0,22 (0,02–0,06) |
0,02 (0,01–0,03) |
0,02 (0,01–0,03) |
0,06 |
p 1–2 = 0,000 p 1–3 = 0,006 |
|
Эозинофилы Eosinophils |
0,18 (0,1–0,25) |
0,08 (0–0,1) |
0,06 (0–0,07) |
0,000 |
p 1–2 = 0,000 p 1–3 = 0,000 |
|
Незрелые гранулоциты Immature granulocytes |
0,02 (0–0) |
0,05 (0–0,1) |
0,12 (0–0,2) |
0,04 |
p 1–3 = 0,009 |
|
Лимфоциты Lymphocytes |
2,2 (1,9–2,6) |
1,6 (0,97–1,9) |
1,3 (0,5–1,8) |
0,000 |
p 1–2 = 0,000 p 1–3 = 0,000 |
|
Лимфоциты, синтезирующие антитела Lymphocytes synthesizing antibodies |
0,006 (0–0) |
0,02 (0–0,04) |
0,01 (0–0,02) |
0,02 |
p 1–2 = 0,01 |
Примечание: при межгрупповом сравнении p ≤ 0,05, при попарном сравнении p ≤ 0,017.
Note: p < 0.05 in case of intergroup comparison, p ≤ 0.017 in case of pairwise comparison.
Изменение количества моноцитов не показало закономерных изменений, характеризующих тяжесть болезни. Морфология популяции моноцитов у всех больных была однородна, не установлено изменений по сложности их внутренней структуры, степени флюоресценции и размеру.
NLR имел максимальные значения у больных в тяжелом состоянии, медиана по этому показателю у данной группы больных была в 5 раз больше, чем у пациентов, легко переносивших инфекцию, MLR показал значимое снижение у тяжелых больных, а PLR имело у таких пациентов наибольшее значение (рис. 1).
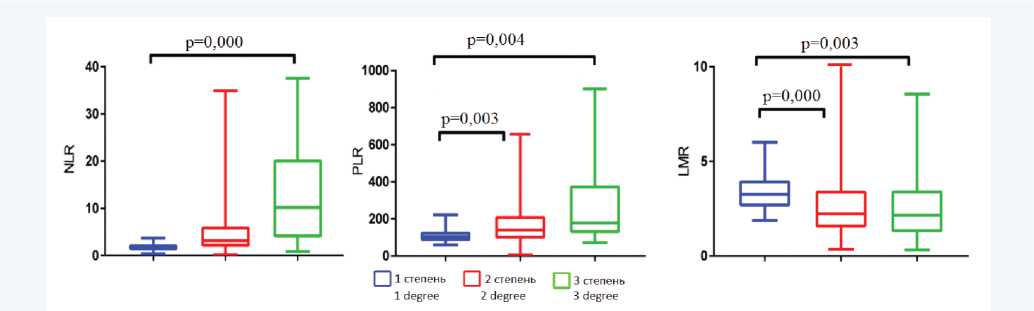
Рис. 1. Значения показателей гематологических коэффициентов у больных COVID-19 в зависимости от степени тяжести инфекции. NLR – отношение нейтрофилов к лимфоцитам, PLR – отношение тромбоцитов к лимфоцитам, LMR – отношение лимфоцитов к моноцитам
Fig. 1. Values of hematological coefficients in patients with COVID-19 depending on the severity of the infection. NLR – neutrophil-to-lymphocyte ratio, PLR – platelet-to-lymphocyte ratio
Количество эритроцитов, тромбоцитов и концентрация гемоглобина у пациентов находились в пределах референсного интервала и не различались между группами. Установлено, что характерным для тяжелого течения COVID-19 является значительное увеличение количества нормобластов по сравнению с легким течением инфекции. Так, у пациентов с тяжелым течением их количество было 0,015 × 109/л, а у больных в легкой форме – 0,003 × 109/л ( р = 0,003).
Изменение показателей крови в зависимости от степени тяжести дыхательной недостаточности у больных новой коронавирусной инфекцией
SARS-CoV-2 чаще, чем другие инфекционные агенты вызывает тяжелое поражение легочной паренхимы, которое приводит к развитию острого респираторного дистресс-синдрома (ОРДС) [3]. В связи с этим мы сочли актуальным проанализировать гематоцитометрические данные больных в зависимости от степени дыхательной недостаточности (ДН). Распределение исследуемой выборки пациентов в зависимости от степени ДН показало, что новая коронавирусная инфекция протекала без развития ДН у 26% пациентов, у 52% развилась ДН 1-й степени, а осложнение в виде ДН 2-й или 3-й степени развилось у 12 и 10% соответственно.
При изучении гематологических показателей пациентов, разделенных в зависимости от степени ДН, были выявлены тенденции, сходные с результатами, полученными при разделении групп по степени тяжести. Исключение составил показатель общего количества лейкоцитов, изменение которого не характеризовало степень ДН у больных с COVID-19-ассоциированной пневмонией. Количество нейтрофилов у пациентов с ДН 3-й степени было максимальным и превышало референсный интервал в 1,6 раза. Параметры, характеризующие функциональную активность нейтрофилов, такие как гранулярность и реактивность, находились практически на одном уровне у всех больных. Количество эозинофильных гранулоцитов имело тенденцию к снижению у пациентов, нуждающихся в искусственном поддержании дыхания, их значение было в 5 раз меньше по сравнению с пациентами с ДН 1-й степени или без признаков ДН. Содержание базофилов статистически значимо различалось между группами пациентов, но не показывало характерных изменений.
Увеличение содержания незрелых гранулоцитов в крови пациентов характеризовало тяжелую степень ДН. Их количество превышало референсный диапазон у пациентов с ДН 2-й и 3-й степени в 1,5 и 2,6 раза соответственно.
При ДН 3-й степени отмечалось значимое снижение количества лимфоцитов, вплоть до лимфопении. Количество реактивных лимфоцитов значимо не изменялось, но у больных с тяжелой ДН оно было наименьшим. Лимфоциты, синтезирующие антитела, присутствовали в крови всех больных с ДН.
По количеству моноцитов клинический анализ крови пациентов значимо различался, наименьшее содержание моноцитов было в группе больных с тяжелой степенью ДН, в 1,8 раза меньше, чем в группе без признаков ДН (табл. 2).
Высокие значения коэффициентов NLR и PLR ассоциировались с тяжелым поражением легочной ткани, а коэффициент MLR не показал значимых изменений в зависимости от степени ДН (рис. 2).
Количество эритроцитов и концентрация гемоглобина в крови в выделенных группах пациентов не различались и находились в пределах референсных интервалов, как и количество тромбоцитов. Для ДН 3-й степени было характерно увеличение содержания нормобластов: их количество у таких пациентов было 0,02 × 109/л, что в 10 раз больше, чем у больных без осложнений в виде ДН ( р = 0,003).
Таблица 2. Количественная характеристика лейкоцитов пациентов с COVID-19 в первый день госпитализации в зависимости от степени дыхательной недостаточности
Table 2. Quantitative characteristics of leukocytes in patients with COVID-19 on the first day of hospitalization, depending on the degree of respiratory failure
|
Показатели × 109/л Indicators × 109/L |
Группа по степени дыхательной недостаточности Group by degree of respiratory failure |
Уровень значимости p (все группы) Significance level p (all groups) |
Уровень значимости (парные сравнения) Significance level (pairwise comparison) |
|||
|
0 ( n = 73) |
1 ( n = 146) |
2 ( n = 33) |
3 ( n = 30) |
|||
|
Нейтрофилы Neutrophils |
4,7 (2,7–5,5) |
5,3 (2,6–7) |
6,7 (2,6–0,1) |
11,2 (4,1–14,3) |
0,04 |
p 0–3 = 0,000 p 1–3 = 0,000 |
|
Базофилы Basophils |
0,1 (0,02–0,05) |
0,02 (0,01–0,03) |
0,01 (0,01–0,02) |
0,02 (0,01–0,03) |
0,007 |
p 0–2 = 0,003 |
|
Эозинофилы Eosinophils |
0,1 (0,02–0,2) |
0,1 (0–0,16) |
0,02 (0–0,04) |
0,02 (0–0,02) |
0,000 |
p 0–2 = 0,000 p 0–3 = 0,000 p 1–2 = 0,01 |
|
Незрелые гранулоциты Immature granulocytes |
0,03 (0–0) |
0,06 (0–0,1) |
0,09 (0–0,1) |
0,16 (0–0,2) |
0,004 |
p 0–3 = 0,000 |
|
Лимфоциты Lymphocytes |
2,3 (1,2–2,4) |
1,5 (0,9–1,9) |
1,2 (0,7–1,7) |
0,9 (0,4–1,3) |
0,002 |
p 0–1 = 0,006 p 0–2 = 0,002 p 0–3 = 0,000 p 1–3 = 0,007 |
|
Моноциты Monocytes |
0,7 (0,5–0,7) |
0,6 (0,5–0,8) |
0,6 (0,3–0,8) |
0,4 (0,25–0,57) |
0,02 |
p 0–3 = 0,000 p 1–3 = 0,004 |
|
Лимфоциты, синтезирующие антитела Lymphocytes synthesizing antibodies |
0,01 (0–0) |
0,02 (0–0,04) |
0,04 (0–0,05) |
0,02 (0–0,05) |
0,005 |
p 0–2 = 0,007 |
Примечание: при межгрупповом сравнении p ≤ 0,05, при попарном сравнении p ≤ 0,012.
Note: p < 0.05 in case of intergroup comparison, p ≤ 0.012 in case of pairwise comparison.
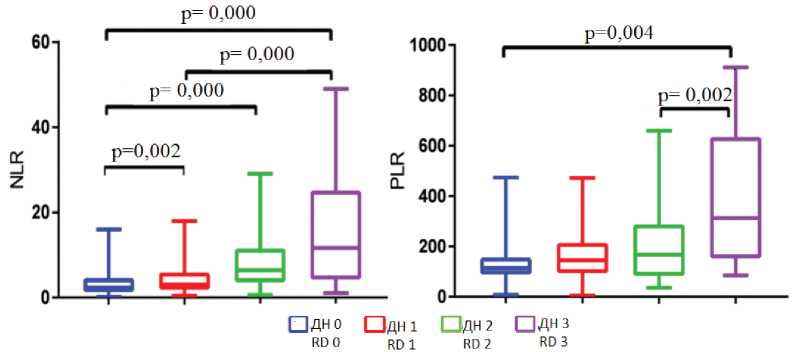
Рис. 2. Значения показателей гематологических коэффициентов у больных COVID-19 в зависимости от степени дыхательной недостаточности: NLR – отношение нейтрофилов к лимфоцитам, PLR – отношение тромбоцитов к лимфоцитам
Fig. 2. Values of hematological coefficients in patients with COVID-19 depending on the degree of respiratory failure: NLR – neutrophil-to-lymphocyte ratio, PLR – platelet-to-lymphocyte ratio
Изменение показателей крови в зависимости от исхода заболевания новой коронавирусной инфекцией
Так как лабораторные исследования, в том числе гемоцитометрия, являются одним из важнейших помощников для врача клинициста в формировании представления о состоянии пациента, важно определить, какие из гематологических показателей ассоциируются с неблагоприятным исходом. Среди обследованных нами пациентов 54 (19%) человека умерли на госпитальном этапе, остальные 228 (81%) завершили курс лечения и были выписаны на амбулаторный этап. Сравнение гематологических показателей в группах, выделенных в зависимости от исхода заболевания, не выявило статистически значимых различий по общему количеству лейкоцитов, но у пациентов с летальным исходом количество нейтрофилов оказалось в 1,7 раза больше, чем у выживших (табл. 3).
Статистических различий между группами по количеству гранулярных нейтрофилов не установлено, а количество реактивных у умерших больных составляло 49,2%, что в 1,1 раза больше, чем у выживших (48%) (p = 0,04). По параметрам, характеризующим морфологию нейтрофилов – сложность внутренней структуры, размер, степень флуоресценции, различий не обнаружено. Для пациентов с летальным исходом было характерно появление в крови в больших количествах незрелых гранулоцитов и эозинопения: содержание незрелых гранулоцитов у умерших пациентов было в 1,6 раза выше, а количество эозинофилов – в 2 раза ниже, чем у выживших. Количество лимфоцитов у больных обеих групп находилось в переделах референсных интервалов, но у больных с неблагоприятным исходом их значение было значительно ниже. Имелись достоверные различия между группами по уровню флуоресценции лимфоцитов, наибольшее ее значение было в группе пациентов с легким и среднетяжелым течением болезни. Показатели, характеризующие реактивность лимфоцитов и их морфологию, не имели значимых различий.
Количество моноцитов у умерших больных также было ниже, чем у выздоровевших, но значения не выходили за пределы референсного диапазона. По показателям внутренней структуры, степени флуоресценции и размера моноцитов группы, выделен- ные в зависимости от исхода болезни, не различались (см. табл. 3).
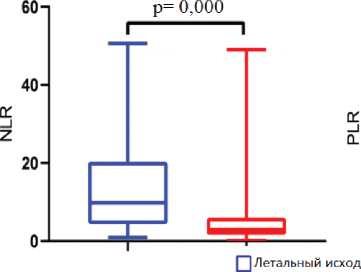
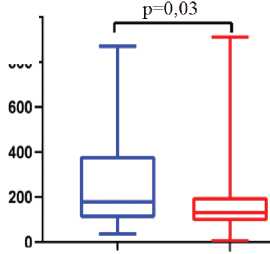
У пациентов с неблагоприятным исходом также отмечались высокие значения коэффициента NLR, тогда как у выживших медиана по данному показателю находилась на низком уровне. PLR был наибольшим у умерших пациентов, несмотря на отсутствие различий между группами по количеству тромбоцитов. По значению коэффициента MLR группы пациентов не различались (рис. 3).
Таблица 3. Количественная характеристика лейкоцитов пациентов с COVID-19 в первый день госпитализации в зависимости от исхода заболевания

Fatal outcome
800-
| I Выздоровление Recovery
Table 3. Quantitative characteristics of leukocytes in patients with COVID-19 on the first day of hospitalization, depending on the outcome of the disease
|
Показатели × 109/л Parameters × 109/L |
Группа по варианту исхода Outcome Option Group |
Уровень значимости р Significance level р |
|
|
Благоприятный исход ( n = 228) Favorable outcome ( n = 228) |
Неблагоприятный исход ( n = 54) Unfavorable outcome ( n = 54) |
||
|
Общее количество лейкоцитов White blood cells |
7,9 (4,8–9,6) |
11,3 (5,7–13) |
0,04 |
|
Нейтрофилы Neutrophils |
5,3 (2,6–6,8) |
9 (4–12) |
0,003 |
|
Эозинофилы Eosinophils |
0,1 (0–0,16) |
0,05 (0–0,05) |
0,02 |
|
Незрелые гранулоциты Immature granulocytes |
0,06 (0–0,1) |
0,1 (0,4–1,4) |
0,02 |
|
Лимфоциты Lymphocytes |
1,7 (1–2,04) |
1,3 (0,4–1,9) |
0,03 |
|
Моноциты Monocytes |
0,6 (0,4–0,7) |
0,5 (0,3-0,6) |
0,018 |
Примечание: показатели принимались значимыми при р ≤ 0,05.
Note: indicators were considered significant at p < 0.05.
Рис. 3. Значения гематологических коэффициентов у больных COVID-19 в зависимости от исхода заболевания. NLR – отношение нейтрофилов к лимфоцитам, PLR – отношение тромбоцитов к лимфоцитам
Fig. 3. Values of hematological coefficients in patients with COVID-19 depending on the outcome of the disease. NLR – neutrophil-to-lymphocyte ratio, PLR – platelet-to-lymphocyte ratio
Количество эритроцитов и концентрация гемоглобина в крови пациентов не изменялись и находились в пределах референсных интервалов, как и количество тромбоцитов. У пациентов с неблагоприятным исходом в крови присутствовали нормобласты в большем количестве (0,02(0–0,01) × 109/л), чем у выздоровевших (0,003(0–0) × 109/л), ( р = 0,000).
Был также проведен анализ частоты несоответствия гематологических параметров референсным интервалам. Установлено, что частота нейтрофилии (количество нейтрофилов > 7 × 109/л) у больных с летальным исходом соста- вила 50%, тогда как среди выживших – 25%, лимфопения (количество лимфоцитов < 1 × 109/л) у умерших пациентов отмечалась в 55% случаев, у выживших – в 25%. Моноцитопения (количество моноцитов < 0,25 × 109/л) встречалась у 24% умерших и 7% выживших. Также у больных с летальным исходом регистрировались: эозинопения (количество эозинофилов = 0 × 109/л) – 66% случаев, нормобластемия (количество нормобластов > 0 × 109/л) – 30%, увеличение количества незрелых гранулоцитов (> 0,06 × 109/л) – 63%, тогда как среди выживших данные изменения встречались в 25,9 и 42% случаев соответственно (рис. 4).
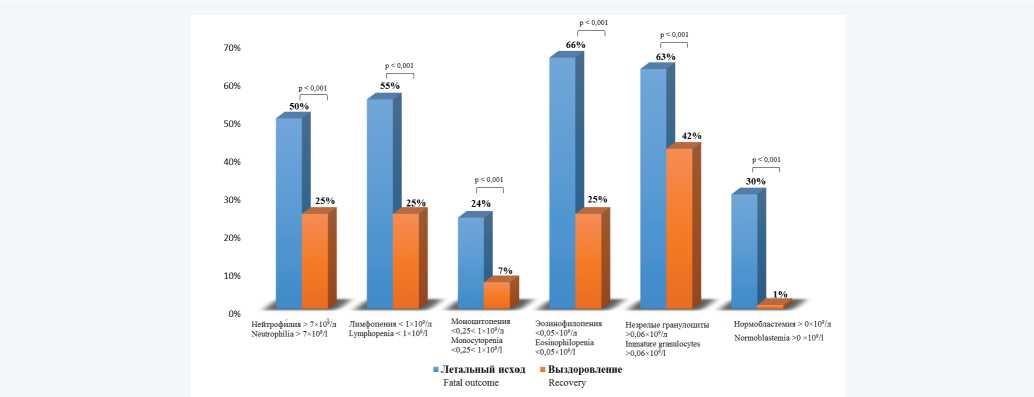
Рис. 4. Частота распространенности изменений параметров гемоцитограммы у выздоровевших и умерших пациентов Fig. 4. Frequency of changes in the hemocytogram parameters in recovered and deceased patients
По результатам исследования картины крови исследования был проведен логистический регрессионный анализ, целью которого было выявление значимых гематологических предикторов неблагоприятного исхода заболевания. Гематологическими параметрами, ассоциированными с неблагоприятным исходом, были количество эозинофилов, моноцитов и лимфоцитов. Так, уменьшение уровня данных клеток сопровождалось увеличением вероятности летального исхода на 99,7; 80; 60% соответственно (табл. 4). Проведенный ROC-анализ позволил определить пороговые значения параметров белой крови, а также гематологических коэффициентов, связанных с риском развития неблагоприятного исхода у пациентов с COVID-19, которые приведены в таблице 5.
Таблица 4. Отношение шансов и 95% доверительный интервал для гематологических параметров при развитии неблагоприятного исхода у пациентов с COVID-19
Table 4. Odds ratio (OR) and 95% confidence interval for hematological parameters in the development of a poor outcome in patients with COVID-19
|
Показатели Parameters |
ОШ OR |
95% ДИ 95% CI |
р |
|
Общее количество лейкоцитов × 109/л Total white blood cell count × 109/L |
1,3 |
[1,2; 1,6] |
0,000 |
|
Нейтрофилы × 109/л Neutrophils × 109/L |
2,1 |
[1,6; 2,7] |
0,000 |
|
Реактивные нейтрофилы, % Reactive neutrophils, % |
1,2 |
[1; 1,3] |
0,001 |
|
Эозинофилы×109/л Eosinophils × 109/L |
0,03 |
[0,01; 0,76] |
0,03 |
|
NLR |
1,4 |
[1,2; 1,5] |
0,000 |
|
PLR |
1 |
[1; 1,01] |
0,1 |
|
Лимфоциты × 109/л Lymphocytes × 109/L |
0,4 |
[0,2; 0,6] |
0,000 |
|
Моноциты × 109/л Monocytes × 109/L |
0,2 |
[0,06; 0,8] |
0,02 |
Примечание: ОШ – отношение шансов, ДИ – доверительный интервал, NLR – отношение нейтрофилов к лимфоцитам, PLR – отношение тромбоцитов к лимфоцитам.
Note: OR – odds ratio, CI – confidence interval, NLR – neutrophil-to-lymphocyte ratio of, PLR – platelet-to-lymphocyte ratio.
Таблица 5. Пороговые значения гематологических параметров, отклонения от которых могут являться факторами риска неблагоприятного исхода у пациентов с COVID-19
Table 5. Threshold values of hematological parameters, deviations from which may be risk factors for poor outcome in patients with COVID-19
|
Показатели Parameters |
Пороговое значение Cut-off value |
Чувствительность % Sensitivity, % |
Специфичность % Specificity, % |
AUC (95% ДИ) Area under curve (95% CI) |
р |
|
Общее количество лейкоцитов, ×109/л White blood cells, ×109/L |
7,2 |
71 |
63 |
0,75 (0,6–0,8) |
0,04 |
|
Нейтрофилы, ×109/л Neutrophils, ×109/L |
5 |
84 |
72 |
0,9 (0,85–0,9) |
0,02 |
Окончание табл. 5
End of table 5
|
Показатели Parameters |
Пороговое значение Cut-off value |
Чувствительность % Sensitivity, % |
Специфичность % Specificity, % |
AUC (95% ДИ) Area under curve (95% CI) |
р |
|
Реактивные нейтрофилы, % Reactive neutrophils, % |
48,6 |
60 |
60 |
0,62 (0,54–0,7) |
0,04 |
|
Эозинофилы, ×109/л Eosinophils, ×109/l |
0,05 |
55 |
55 |
0,6 (0,48–0,6) |
0,04 |
|
NLR |
2,9 |
81 |
71 |
0,8 (0,74–0,9) |
0,03 |
|
PLR |
150 |
70 |
70 |
0,7 (0,6–0,8) |
0,04 |
|
Лимфоциты, ×109/л Lymphocytes, ×109/l |
1,3 |
62 |
63 |
0,7 (0,6–0,8) |
0,04 |
|
Моноциты, ×109/л Monocytes, ×109/l |
0,5 |
60 |
50 |
0,6 (0,5–0,68) |
0,04 |
Примечание: AUC – площадь под кривой, ДИ – доверительный интервал, NLR – отношение нейтрофилов к лимфоцитам, PLR – отношение тромбоцитов к лимфоцитам.
Note: AUC – area under the curve, CI – confidence interval, NLR – neutrophil-to-lymphocyte ratio of, PLR – platelet-to-lymphocyte ratio.
Обсуждение
Пандемия новой коронавирусной инфекции поставила перед здравоохранением всего мира множество новых задач, требующих оперативных решений. Помимо поиска методов эффективного лечения и специфической профилактики COVID-19, немаловажным аспектом остается выбор лабораторных тестов, позволяющих в короткие сроки и с максимальной специфичностью и чувствительностью оценить состояние пациента. Клинический анализ крови является распространенным лабораторным исследованием, который может отражать течение инфекционного процесса, связанного с COVID-19. В данной работе проведен анализ как количественных, так и качественных гематологических параметров клинического анализа крови больных COVID-19. Установлено, что увеличение количества нейтрофильных гранулоцитов на первые сутки госпитализации ассоциировано с тяжелым течением и неблагоприятным прогнозом болезни. Содержание гранулоцитов выше 5 × 109/л можно рассматривать как пороговое (рисковое) в отношении наступления неблагоприятного исхода.
Аналогичные результаты были получены Ю. Чжэн и соавт. в 2020 г., которые установили, что увеличение количества нейтрофилов, выявленное на первые сутки, является одним из значимых показателей прогрессирования вирусной пневмонии, ассоциированной с COVID-19 [4]. Наряду с увеличением количества нейтрофилов, было отмечено повышение их функциональной активности, о чем свидетельствует такой показатель, как Neut-Ri. Более высокое количество реактивных нейтрофилов (Neut-Ri) в крови умерших пациентов по сравнению с выжившими может указывать на чрезмерную, утрачивающую адаптивное значение, активацию врожденного иммунного ответа и механизмов борьбы с инфекцией [5]. Известно, что нейтрофилы способны к образованию нейтрофильных внеклеточных ловушек (Neutrophil extracellular traps-
NET), которые, в свою очередь, вызывают повреждение эпителиальных и эндотелиальных клеток, а также образование клеточных агрегатов, что увеличивает вероятность тромбообразования. Так, М. Леппкес и соавт. установили прямую корреляцию между количеством нейтрофилов, образуемыми ими структурами NET и неблагоприятным исходом болезни [6].
В нашем исследовании установлено, что в крови пациентов с тяжелым течением вирусной пневмонии, ассоциированной с COVID-19, в значительных количествах появлялись незрелые гранулоциты (IG). Данный факт можно объяснить тем, что вирус COVID-19 стимулирует выработку провоспалительных цитокинов, в том числе гранулоцитарно-макрофагального колониестимулирующих факторов (ГМ-КСФ) [7]. Это приводит к активной пролиферации гранулоцитарного ростка и раннему выходу в периферическую кровь незрелых клеток, которые, в свою очередь, обладают повышенной иммуногенностью и способностью к нетозу – образованию нейтрофильных внеклеточных ловушек (NET), что усугубляет течение болезни [8]. Также выявлено, что с тяжелым течением инфекции, тяжелой степенью ДН и неблагоприятным исходом заболевания ассоциировалось сниженное количество эозинофилов, а сниженный уровень базофилов был характерен только для ДН тяжелой степени.
Такие результаты согласуются с данными исследования Т. Фахмина и соавт., где было отмечено, что отсутствие эозинофилов в крови пациентов при поступлении имело значимую связь с тяжелым течением болезни и последующим летальным исходом [9]. Действительно, еще в 70-е гг. проведенный Д. Бассом эксперимент на мышах показал, что эозинопения является реакцией на острое воспаление, включает быстрое снижение количества циркулирующих эозинофилов, связанное с миграцией их к очагу воспаления и нарушением элиминации эозинофилов из костного мозга. Причину замедления выхода эозинофилов в кровеносное русло автор видел в конкуренции со стороны интенсивно мигрирующих в кровь нейтрофилов [10]. С позиций современных представлений о факторах генерации и миграции лейкоцитов одной из причин эозинопении может быть угнетение синтеза хемоаттрактантов – эотаксинов и IL-5, а также ингибирование пролиферации и дифференцировки эозинофилов в красном костном мозге, обусловленное снижением синтеза таких факторов лейкопоэза, как IL-3.
Неблагоприятное течение болезни наиболее ярко характеризовалось снижением количества лимфоцитов. На момент поступления в отделение среди умерших впоследствии пациентов выраженная лимфопения наблюдалась в 55%, тогда как среди выживших – только в 25% случаев. Наши данные соответствуют результатам исследований Ф. Пань и соавт. 2020 г., в котором было установлено, что лимфопения в первые сутки госпитализации является значимым фактором риска смертельного исхода [11]. С. Пермлан и соавт. связывали снижение количества лимфоцитов с цитотоксическим действием провоспалительных интерлейкинов на Т-клетки, а также повреждающим действием вируса на органы гемопоэза, такие как лимфатические узлы и селезенка [12]. Ц. Гу в своем эксперименте с коронавирусами доказал их способность инфицировать лимфоциты и активировать в них гены апоптоза [13].
При помощи проточной цитофлюориметрии мы смогли получить информацию о функциональной активности лимфоцитов у пациентов в момент поступления в стационар. Показатель реактивности лимфоцитов (ReLymph), отражающий их способность синтезировать цитокины, у всех пациентов не выходил за пределы референсных значений, но показатель антителсинтезирующей функции (As-Lymph) был повышен у пациентов со среднетяжелым и тяжелым течением инфекции и ДН. Вероятно, между началом болезни и госпитализацией прошло определенное время, достаточное для перехода индуктивной фазы иммунного ответа, когда происходит презентация антигена T-клеткам, активация и пролиферация специфического клона лимфоцитов, формирование эффекторных клеток и клеток памяти в эффекторную фазу, которая заключается в выработке антител [14].
У пациентов с легким течением COVID-19 и без ДН не выявлена активация антителсинтезирующей функции лимфоцитов в отличие от пациентов со среднетяжелым и тяжелым течением, ДН и неблагоприятным исходом. Наши результаты подтверждаются исследованием Реми Дж.Х. и соавт., где увеличение As-Lymph у пациентов в первый день госпитализации ассоциировалось с тяжелым течением COVID-19 [15], вероятно, имеет место положительная связь между уровнем антител к антигенам вируса SARS-CoV-2 и тяжестью инфекционного процесса [16].
Для больных с тяжелой степенью инфекции было характерно уменьшение количества моноцитов, что обусловлено их миграцией в поврежденные ткани [17]. По параметрам, характеризующим функциональную активацию (MO-Y) и морфологию моноцитов (MO-Z, MO-X), существенных изменений, связанных с тяжестью течения инфекции, выявлено не было, что обусловлено малым количеством в циркулирующей крови. Полученные нами данные частично противоречат результатам исследования Ч. Ли и соавт., которое показало, что у пациентов отделения реанимации и интенсивной терапии (ОРИТ) с COVID-19 отмечалось снижение количества моноцитов, но их повышенная активация по сравнению с пациентами ОРИТ без коронавирусной инфекции [18]. Возможно, это несоответствие обусловлено особенностями включенных в наше исследование пациентов кардиологического профиля, их коморбидной патологией и терапией, что требует дальнейших исследований.
Наряду с количественными характеристиками клеточного состава крови в современных исследованиях большое внимание уделяется исследованию диагностических расчетных коэффициентов. Так, согласно публикации А. Эрдоган и соавт., коэффициенты NLR, PLR, LMR являются информативными показателями системного воспалительного ответа и зарекомендовали себя как полезные прогностические критерии у пациентов с вирусной пневмонией [19]. Нами было установлено, что показатели NLR и PLR были выше у больных с тяжелым течением коронавирусной инфекции, выраженной ДН и неблагоприятным исходом, а значение коэффициента LMR отражало только степень тяжести заболевания. Определено, что увеличение NLR выше 2,3 и PLR выше 150 являются факторами риска развития неблагоприятного исхода.
У всех обследованных нами пациентов, независимо от степени тяжести, ДН или исхода заболевания наблюдался стабильный, в пределах референсного диапазона, уровень эритроцитов и гемоглобина. У пациентов, имеющих тяжелое клиническое течение COVID-19, в периферической крови чаще встречались ядросодержащие эритроциты, чем при легком течении заболевания. Появление незрелых форм эритроцитов обусловлено дыхательной и циркуляторной гипоксией, выраженность которой коррелирует со степенью тяжести коронавирусной инфекции [20]. Ассоциация нормобластемии с неблагоприятным исходом болезни отмечалась и ранее в исследовании, проведенном среди реанимационных больных, нуждающихся в искусственном поддержании дыхания, где смертность пациентов, имеющих нормобласты в периферической крови, была в 14 раз больше, чем у пациентов без данной патологии [21].
Количество тромбоцитов у исследуемых нами пациентов в первый день госпитализации находилось в пределах референсного диапазона, что не противоречит результатам, полученным Й. Линссен и соавт. в 2020 г., которые наблюдали увеличение количества тромбоцитов только на 10-й день госпитализации пациентов [22].
Выявленные нами особенности гематологических показателей у пациентов с различной тяжестью течения коронавирусной инфекции и исходом заболевания подтвердились при построении прогностической модели с использованием метода логистической регрессии. Наиболее высокая прогностическая значимость была установлена для показателей нейтрофилии, эозинопении, NLR и PLR.
Выводы
Таким образом, в нашем исследовании выявлены параметры гематоцитометрии, которые могут быть полезны в определении тяжести состояния пациента с COVID-19 и прогнозировании исхода данного заболевания. Оценка параметров 5-diff анализа установила высокое прогностическое значение лимфопении, нейтрофилии, эози-нопении, высоких показателей нейтрофильно-лимфоцитарного и тромбоцитарно-лимфоцитарного соотношения.
Увеличение таких параметров 8-diff анализа, как количество незрелых гранулоцитов и нормобластов, было связано с тяжелым течением COVID-19, поэтому они могут использоваться в оценке состояния пациента и в сочетании с рутинными 5-diff показателями давать более полное представление о тяжести течения инфекции у больного.
Список литературы Использование 8-diff клинического анализа крови больных для оценки тяжести течения новой коронавирусной инфекции
- Баздырев Е.Д. Коронавирусная инфекция - актуальная проблема XXI века. Комплексные проблемы сердечно-сосудистых заболеваний. 2„2„;9(2):6-16. DOI: 1„.178„2/23„6-1278-2„2„-9-2-6-16. Bazdyrev E.D. Coronavirus disease: A global problem of the 21st century. Complex Problems of Cardiovascular Diseases. 2„2„;9(2):6-16. (In Russ.). DOI: 10.17802/2306-1278-2020-9-2-6-16.
- Santotoribio J.D., Nunez-Jurado D., Lepe-Balsalobre E. Evaluation of routine blood tests for diagnosis of suspected coronavirus disease 2019. Clin. Lab. 2„2„;66(9). DOI: 1„.7754/ain.Lab.3„3„.3„„533.
- Gibson P.G., Qin L., Puah S.H. COVID-19 acute respiratory distress syndrome (ARDS): clinical features and differences from typical pre-COVID-19 ARDS. Med. J. Aust. 2„2„;213(2):54-56.e1. DOI: 10.5694/ mja2.50674.
- Zheng Y., Zhang Y., Chi H., Chen S., Peng M., Luo L. et al. The hemocyte counts as a potential biomarker for predicting disease progression in COVID-19: A retrospective study. Clin. Chem. Lab. Med. 2„2„;58(7):1106-1115. DOI: 1„.1515/cclm-3„3„-„377.
- Kwiecien I., Rutkowska E., Kulik K., Ktos K., Plewka K., Raniszews-ka A. et al. Neutrophil maturation, reactivity and granularity research parameters to characterize and differentiate convalescent patients from active SARS-CoV-2 infection. Cells. 2„21;1„(9):2332. DOI: 10.3390/ cells1„„92332.
- Leppkes M., Knopf J., Nashberger E., Lindemann A., Singh J., Herrmann I. et al. Vascular occlusion with neutrophil extracellular traps in COVID-19. EBioMedicine. 2„2„;58:1„2925. DOI: 10.1016/j.ebi-om.2020.102925.
- Yang L., Liu S., Liu J., Zhang Z., Wan X., Huang B. et al. COVID-19: Im-munopathogenesis and Immunotherapeutics. Signal Transduct. Target. Ther. 2„2„;5(1):128. DOI: 1„.1„38/s41393-„3„-„„343-3.
- Cabrera L.E., Pekkarinen P.T., Alander M., Nowlan K.H.A., Nguyen N.A., Jokiranta S. et al. Characterization of low growth granulocytes in COVID-19. PLoS Pathogens. 2„21;17(7):e1„„9721. DOI: 10.1371/jour-nal.ppat.1009721.
- Tanni F., Akker E., Zaman M.M., Figueroa N., Tharian B., Hupart K.H. Eosinopenia and COVID-19. J. Am. Osteopath. Assoc. 2„2„;12„(8):5„4-508.
- Bass D.A. Behavior of eosinophil leukocytes in acute inflammation. II. Eosinophil dynamics during acute inflammation. J. Clin. Invest. 1975;56(4):870-9. DOI: 1„.7556/jaoa.3„3„.„91.
- Pan F., Yang L., Li Y., Liang B., Li L., Ye T. et al. Factors associated with mortality in patients with severe coronavirus disease-19 (COVID-19): A case-control study. Int. J. Med. Sci. 2020;17(9):1281-1292. DOI: 10.7150/ijms.46614.
- Dandekar A.A., Perlman S. Immunopathogenesis of coronavirus infections: Implications for SARS. Nat. Rev. Immunol. 2005;5(12):917-927. DOI: 10.1038/nri1732.
- Gu J., Gong E., Zhang B., Zheng J., Gao Z., Zhong Y. et al. Multiple organ infection and the pathogenesis of SARS. J. Exp. Med. 2005;202(3):415-424. DOI: 10.1084/jem.20050828.
- Ярилин А.А. Иммунология: учебник. М.: ГЭОТАР-Медиа; 2010:752. Yarilin А.А. Immunology: Textbook. Moscow: GEOTAR-Media; 2010:752. (In Russ.).
- Martens R. J.H., van Adrichem A.J., Mattheij N.J.A., Brouwer C.G., van Twist D.J.L., Broerse J.J.C.R. et al. Hemocytometric characteristics of COVID-19 patients with and without cytokine storm syndrome on the Sysmex XN-10 hematology analyzer. Clin. Chem. Lab. Med. 2021;59(4):783-793. DOI: 10.1515/cclm-2020-1529.
- Bläckberg A., Fernström N., Sarbrant E., Rasmussen M., Sunnerhagen T. Antibody kinetics and clinical course of COVID-19 a prospective observational study. PLoS One. 2021;16(3):e0248918. DOI: 10.1371/journal. pone.0248918.
- Knoll R., Schultze J.L., Schulte-Schlepping J. Monocytes and macrophages in COVID-19. Front. Immunol. 2021;12:720109. DOI: 10.3389/ fimmu.2021.720109.
- Zhou Y., Fu B., Zheng X., Wang D., Zhao C., Qi Y. et al. Pathogenic T-cells and inflammatory monocytes incite inflammatory storms in severe COVID-19 patients. Natl. Sci. Rev. 2020;7(6):998-1002. DOI: 10.1093/nsr/nwaa041.
- Erdogan A., Can F.E., Gönüllü H. Evaluation of the prognostic role of NLR, LMR, PLR, and LCR ratio in COVID-19 patients. J. Med. Virol. 2021;93(9):5555-5559. DOI: 10.1002/jmv.27097.
- Constantino B.T., Kogionis B. Nuclear RBCs-Significance in a peripheral blood film. Laboratory Medicine. 2000;31(4):223-229.
- Kuert S., Holland-Letz T., Friese J., Stachon A. Association of nucleated red blood cells in blood and arterial oxygen partial tension. Clin. Chem. Lab. Med. 2011;49(2):257-263. DOI: 10.1515/CCLM.2011.041.
- Linssen J., Ermens A., Berrevoets M., Seghezzi M., Previtali G., van der Sar-van der Brugge S. et al. A novel haemocytometric COVID-19 prognostic score developed and validated in an observational multicentre European hospital-based study. Elife. 2020;9:e63195. DOI: 10.7554/eLife.63195.


