Использование дополнительных параметров перфузионной сцинтиграфии миокарда в выявлении многососудистого поражения коронарных артерий (клинический случай)
Автор: Шипулин В.В., Мочула А.В., Завадовский К.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 4 т.40, 2025 года.
Бесплатный доступ
Перфузионная сцинтиграфия миокарда (ПСМ) входит в диагностический алгоритм у пациентов со стабильной ишемической болезнью сердца (ИБС). Однако у пациентов с многососудистым поражением коронарных артерий (КА) данный метод может продемонстрировать ложноотрицательный результат, что в случае низкой предтестовой вероятности ИБС и невыраженной симптоматики может привести к ошибкам в диагностической тактике. Представленный клинический случай демонстрирует важность анализа дополнительных параметров ПСМ на примере пациента с многососудистым поражением КА и феноменом сбалансированной ишемии, при котором перфузия левого желудочка (ЛЖ) имеет практически нормальный вид. У пациента 58 лет основные жалобы на одышку и подъемы артериального давления (АД) до 170/100 мм рт. ст. Расчетная предтестовая вероятность ИБС составила 20%. Электрокардиография (ЭКГ) в покое, эхокардиография (ЭхоКГ) не продемонстрировали значимых отклонений от нормы. Согласно рекомендациям по диагностике и лечению пациентов со стабильной ИБС, пациент был направлен на неинвазивное нагрузочное тестирование – ПСМ. По результатам исследования, размер преходящего дефекта перфузии равнялся 3% от площади ЛЖ, что определяется как умеренный риск развития неблагоприятных сердечно-сосудистых событий (НССС). Однако при расширенном анализе данных ПСМ, таких как индекс транзиторной ишемической дилатации, стресс-индуцированная динамика фракции выброса (ФВ) ЛЖ, подвижности стенки и механической диссинхронии ЛЖ, а также наличие коронарного кальция позволили заподозрить у пациента многососудистое поражение КА, что явилось поводом для проведения коронарографии и последующей реваскуляризации.
Перфузионная сцинтиграфия миокарда, многососудистое поражение коронарных артерий, сбалансированная ишемия
Короткий адрес: https://sciup.org/149150156
IDR: 149150156 | УДК: 616.132.2-005:616.127-073.75 | DOI: 10.29001/2073-8552-2025-40-4-210-219
Текст научной статьи Использование дополнительных параметров перфузионной сцинтиграфии миокарда в выявлении многососудистого поражения коронарных артерий (клинический случай)
Термин «многососудистое поражение коронарных артерий» применяется при атерогенном сужении просвета двух или более коронарных артерий (КА) как минимум на 70% либо при сужении одной артерии на 70% в сочетании со стенозом ствола левой КА на 50% и более [1]. Пациенты с многососудистым поражением КА относятся к группе повышенного риска развития неблагоприятных сердечно-сосудистых событий (НССС) [2–4]. Согласно рекомендациям, в диагностике и стратификации риска таких пациентов важную роль играют функциональные методы исследования, в том числе перфузионная сцинтиграфия миокарда (ПСМ) [3, 4]. Однако при многососудистом поражении КА ПСМ может демонстрировать некорректные результаты вследствие феномена «сбалансированной ишемии», при котором можно наблюдать несоответствие выраженности нарушения перфузии и поражения коронарного русла [5, 6]. Данное явление возникает вследствие того, что ПСМ оценивает снижение перфузии относительно участка левого желудочка (ЛЖ) с наибольшим накоплением радиофармпрепарата (РФП). В случаях, когда накопление снижено равномерно по всему ЛЖ, ПСМ может демонстрировать ложноотрицательный результат. Однако на сегодняшний день анализ ПСМ не ограничивается лишь полуколичественной (визуальной) оценкой накопления индикатора в стенках ЛЖ. ЭКГ-синхронизация позволяет анализировать систолическую и диастолическую функцию ЛЖ, его объемы и синхронность сокращения, а сопоставление объемов полости на фоне функционального покоя и при постнагрузочном исследовании дает возможность заподозрить субэндокардиальную ишемию и постишемический стан-нинг [7, 8]. Совместный анализ данных показателей позволяет предположить у пациента наличие трехсосудистого поражения КА.
Описание клинического случая
Пациент П. в возрасте 58 лет обратился с жалобами на одышку смешанного характера при умеренной физической нагрузке, неопределенный дискомфорт в грудной клетке без четкой связи с физической нагрузкой, повышение артериального давления (АД) до 170/100 мм рт. ст. Превалирующими со слов пациента являлись жалобы на одышку, которую он купировал прекращением нагрузки.
Anamnesis morbi
Продолжительность жалоб около 3 лет. К врачу не обращался, амбулаторно не обследовался. В последний год отмечает усиление одышки и учащение болей, неконтролируемое повышение АД. Обратился к кардиологу. После первичного приема было назначено дообследование, рекомендован прием гипотензивных препаратов.
Anamnesis vitae
Без значимых событий. Стаж курения: 40 лет. Алкоголь: до 3 раз в неделю.
Семейный анамнез: отец умер от острого инфаркта миокарда в возрасте 58 лет. Хронические заболевания и операции. Хронический гастрит, ремиссия. Хронический тонзиллит, ремиссия. Микродискэктомия (2015).
Терапия
Аспирин – 75 мг, аторвастатин – 80 мг, бисопролол – 5 мг, периндоприл – 5 мг, эплеренон – 25 мг, эмпоглифозин – 10 мг, ревроксабан – 2,5 мг 2 р/сут, кординик – 20 мг 2 р/сут.
Объективное обследование
Общий осмотр: состояние удовлетворительное, рост – 164 см, масса тела – 90 кг, индекс массы тела – 33,5 (ожирение 1-й степени); подкожно-жировой слой развит избыточно, преимущественно на животе. Органы дыхания: частота дыхательных движений – 17 в мин. Сердечно-сосудистая система: частота сердечных сокращений (ЧСС) – 76 уд/мин. Акцент II тона над аортой. Пульс удовлетворительного наполнения и напряжения, одинаков на обеих руках. АД – 143/95 мм рт. ст. Органы брюшной полости: без особенностей.
Данные лабораторных и инструментальных методов на момент поступления
Общий анализ крови, коагулограмма: без патологических изменений.
Биохимический анализ крови: глюкоза: 5,28 ммоль/л (3,80–6,10); мочевина: 5,70 ммоль/л (2,20–7,20); креатинин: 101,00 мкмоль/л (62,00–106,00); мочевая кислота: 410,0 мкмоль/л (210,0–420,0); билирубин общий: 15,20 мкмоль/л (1,00–21,00); АСТ: 29,00 ед/л (0,00–37,00); АЛТ: 31,00 ед/л (0,00–42,00); креатинкиназа: 132,0 ед/л (24,0– 171,0); креатинкиназа-МВ: 20,0 ед/л (0,0–25,0); ЛПВП: 1,12 ммоль/л (более 1,00); ЛПНП: 1,6 ммоль/л (менее 3,0); холестерин: 3,52 ммоль/л (3,50–5,20); триглицериды: 1,700 ммоль/л (0,150–1,700); кальций общий: 2,49 ммоль/л (2,15–2,57); калий в сыворотке: 4,45 ммоль/л (3,50–5,10); натрий в сыворотке: 144,0 ммоль/л (136,0– 145,0); магний: 0,89 ммоль/л (0,66–1,07); СРБ: 1,7 мг/л (0,0–5,0).
Общий анализ мочи: эритроциты – 7–9 в п/з, эпителий 2–3 в п/з, лейкоциты – 1–2 в п/з, слизь – 1 (+).
Анализ мочи по Нечипоренко: эритроциты – 9050 кл/ мл, лейкоциты – 400 кл/мл, цилиндры – 0 кл/мл.
Биохимический анализ крови: мочевина – 9,4 ммоль/л, креатинин – 124 мкмоль/л (скорость клубочковой фильтрации – 39 мл/мин/1,73 м2 по формуле CKD-EPI).
Исходная электрокардиограмма (ЭКГ) без выраженных изменений: ЧСС – 69 уд/мин, вертикальное положение электрической оси сердца, переходная зона V3–V4, умеренные нарушения процессов реполяризации миокарда нижней, переднебоковой стенок ЛЖ (рис.1А).
Эхокардиография (ЭхоКГ): камеры сердца не расширены (конечно-диастолический объем (КДО) – 114 мл). Гипертрофии нет. Небольшое ремоделирование ЛЖ. Общая сократимость желудочков в норме (фракция выброса (ФВ) 69%). Нарушений локальной сократимости не выявлено. Диастолическая дисфункция (замедление расслабления миокарда). Уплотнение стенки аорты. Клапаны без изменений, функционируют нормально. Систолическое давление в правом желудочке не изменено. В полости перикарда жидкости нет. Гипертрофия ЛЖ.
Предтестовая вероятность ИБС составляет 20%. Согласно рекомендациям Российского кардиологического общества по ведению стабильной ИБС [3], пациент был направлен на проведение ПСМ с нагрузочной пробой. Ввиду невозможности достижения пациентом целевой ЧСС на велоэргометре вследствие мышечной слабости и отсутствия противопоказаний был проведен стресс-тест, включавший введение натрия аденозинтрифосфата (АТФ) в дозе 140 мкг/кг/мин на протяжении 4 мин. Стресс-тест выполняли натощак. Продукты, содержащие кофеин, а также производные метилксантинов, исключали за 24 ч до исследования. Введение АТФ проводили под контролем АД и ЭКГ в 12 стандартных отведениях перед исследованием, во время введения стресс-агента и после окончания стресс-теста до возвращения показателей к исходным цифрам [8]. Инъекцию РФП (99mTc-МИБИ в дозе 370 МБк) осуществляли в конце 2-й мин.
Через 60 мин после введения РФП проводили исследование перфузии миокарда на гамма-камере Discovery NM/CT 570с (GE Healthcare, Milwaukee, WI, USA) в ЭКГ-синхронизированном режиме (16 кадров на сердечный цикл; 40% от R-R интервала – окно принятия цикла). Запись была выполнена с использованием низкоэнергетического мультипинхол-коллиматора (Multi-Pinhole collimator) в 19 проекций в матрицу 32 × 32 пикселя (размер пикселя – 4 мм). Центр энергетического окна устанавливается на фотопик 99mTc – 140 кЭв; ширина энергетического окна была симметричной и составляла 20%.
Для коррекции аттенуации выполняли низкодозную компьютерную томографию органов грудной клетки. Напряжение на трубке составляло 120 кВ, сила тока – 20 мА; время ротации трубки 0,8 с; питч – 0,969 : 1. Изображения реконструировали с толщиной среза 5 мм и меж-срезовым интервалом 5 мм. Исследование выполняли без задержки дыхания и без ЭКГ-синхронизации.
Изображения реконструируировали на специализированной рабочей станции (Xeleris II; GE Healthcare, Haifa, Israel). Компьютерную обработку полученных данных производили при помощи программного обеспечения Corridor4DM (4DM, Invia Medical Imaging Solutions, Ann Arbor, MI, USA). Анализ локальных нарушений перфузии ЛЖ выполняли визуально, а также с применением стандартных индексов. Полуколичественный способ оценки производили с использованием 5-балльной шкалы, где: 0 – нормальное накопление РФП в миокарде; 1 – аккумуляция РФП 50–69% от максимального включения в миокард; 2 – незначительно (умеренно) выраженные дефекты перфузии (30–49%) от максимального включения РФП в миокард; 3 – значительно выраженные дефекты перфузии (10–29% от максимального включения РФП в миокард), 4 – отсутствие или очень незначительное включение индикатора в миокард (< 10%). На основании этого оценивали следующие показатели: SSS – суммарный
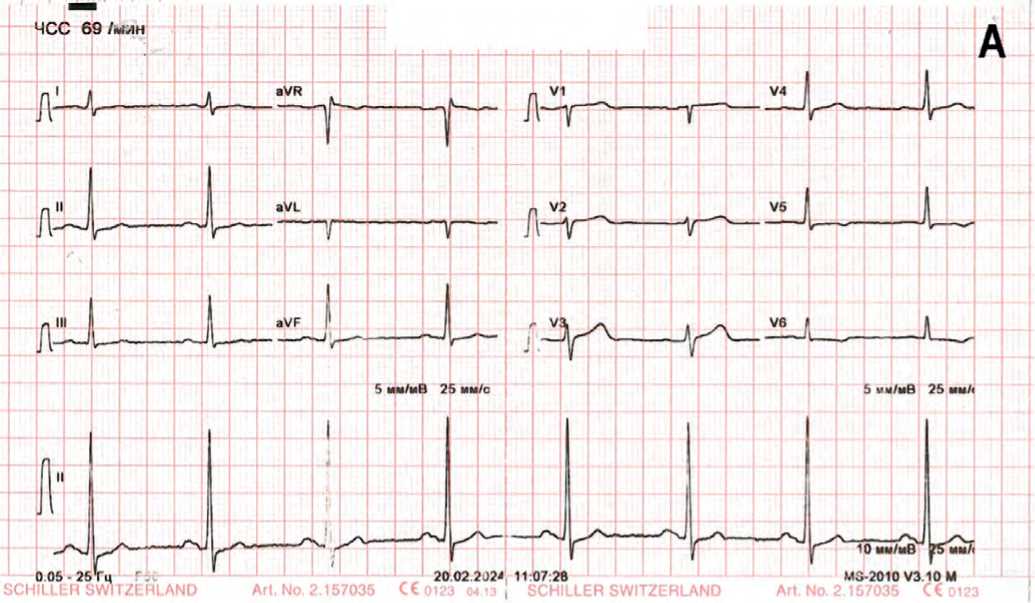
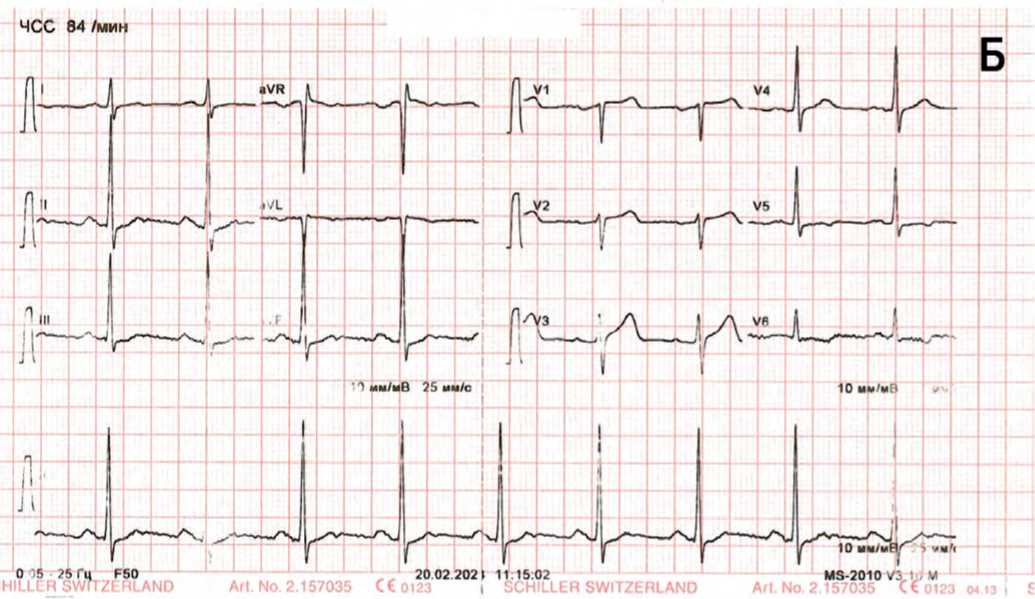
Рис. 1. А – ЭКГ в покое, Б – ЭКГ на пике нагрузочного теста Fig. 1. A – ECG at rest, B – ECG at the peak of the stress test
индекс нарушения перфузии на нагрузке; SRS – суммарный индекс нарушения перфузии в покое; SDS – дефекты перфузии, проходящие в покое [8].
Стресс-тест с АТФ был характеризован как нормальный (рис. 1Б).
По результатам постнагрузочного исследования был выявлен дефект перфузии, составляющий 4 балла, что соответствует 6% от площади миокарда ЛЖ. Все дефекты накопления РФП носили легкий характер (1 балл). Пациент был направлен на исследование в состоянии функционального покоя, которое было выполнено на следующий день с аналогичными параметрами.
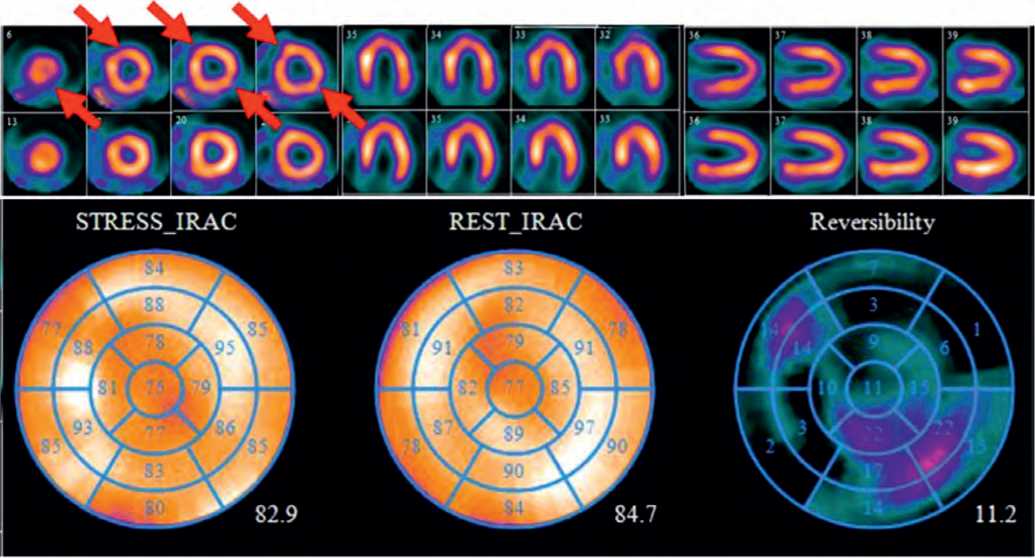
Рис. 2. Результаты перфузионной сцинтиграфии миокарда. На постнагрузочных изображениях отмечается легкая гипоперфузия апикальных отделов передней и задней стенок, средних отделов передне-перегородочной и заднебоковой областей ЛЖ. На изображениях в покое остается дефект накопления РФП в апикальных отделах передней стенки и средних отделах передне-перегородочной области. Стресс-индуцированная ишемия в апикальных отделах задней стенки и средних отделах заднебоковой области ЛЖ (3%)
Fig. 2. Results of myocardial perfusion imaging. Poststress images show mild hypoperfusion of apical segments of the anterior and posterior walls, middle segments of the anteroposterior and posterolateral regions of LV. On resting images, there remains a defect of radiopharmaceutical accumulation in apical segments of the anterior wall and middle segments of the anteroposterior region. Stress-induced ischemia in the apical sections of the posterior wall and middle sections of the posterolateral region of LV (3%)
По результатам двухдневного исследования был определен комбинированный дефект перфузии, включавший приходящий дефект в апикальных отделах задней стенки и заднебоковой области (3%), а также стабильный дефект перфузии в апикальных отделах передней стенки и средних отделах передне-перегородочной области ЛЖ (3%) (рис. 2).
При анализе ЭКГ-синхронизированных серий изображений было выявлено постнагрузочное падение ФВЛЖ на 9% (с 65 до 56%) за счет увеличения конечно-систолического объема (КСО) (с 34 до 44 мл), снижение подвижности в бассейне передней нисходящей артерии (ПНА) (с 6,2 до 5,6 мм), появление зон гипокинеза в бассейне кровоснабжения ПНА и правой коронарной артерии (ПКА), увеличение показателей механической диссинхронии ЛЖ (ширина фазовой гистограммы с 22 до 30%; стандартное отклонение фазовой гистограммы с 5,6 до 7,3%) (рис. 3).
Индекс транзиторной ишемической дилатации (TID) равнялся 1,2. При визуальном анализе бесконтрастных изображений коррекции аттенюации были выявлены протяженные кальцинированные бляшки в проксимальном (пр/с) и среднем сегментах (ср/с) ПНА, в проксимальном сегменте огибающей артерии (ОА), а также локальные бляшки в пр/с, ср/с и дистальном сегменте (дист/с) ПКА, что соответствует CAC-DRS V3N3 (высокий риск развития сердечно-сосудистых событий).
На основании жалоб, заключения ПСМ было принято решение направить пациента на инвазивную коронаро-ангиографию. Согласно результатам коронароангиогра-фии, выявлено многососудистое поражение КА: ствол левой коронарной артерии – 50%, пр/с ПКА – 70%, ср/с ПКА – 50%, пр/с ПНА – 70%, дист/с ПНА – 70%, пр/с ОА – 60%, задняя межжелудочковая ветвь (от ОА) – 95% (рис. 5). Тип кровоснабжения – сбалансированный. SYNTAX Score 34 балла. Пациент был направлен на плановое аортокоронарное шунтирование.
Обсуждение
В данной статье на клиническом примере иллюстрируется важность комплексной оценки данных ЭКГ-син-хронизированной ПСМ в целях корректной стратификации риска пациентов со стабильной ИБС.
ПСМ – широко распространенный метод, позволяющий визуализировать начальные звенья ишемического каскада. Его применение является частью алгоритма первичной диагностики и стратификации риска пациентов со стабильной ИБС. Однако единственным критерием установки уровня риска наступления сердечно-сосудистых событий является размер дефекта перфузии, где наличие ишемии 1–10% от площади миокарда ЛЖ характеризует пациентов умеренного риска, а больше – высокого риска [3, 4]. Так как ПСМ основана на оценке аккумуляции индикатора относительно области с максимальным накоплением, если перфузия снижена равномерно, может быть получен ложноотрицательный результат (практически нормальная перфузия) [5], как и было в нашем случае. Так, R. Nakanishi и соавт. [6] показали, что из 580 пациентов с нормальной перфузией по данным ПСМ (SSS < 4) 7,2% имели многососудистое поражение КА.
Таким образом, очевидной является необходимость использования дополнительных визуальных и количественных критериев, позволяющих стратифицировать риск пациента и заподозрить наличие многососудистого
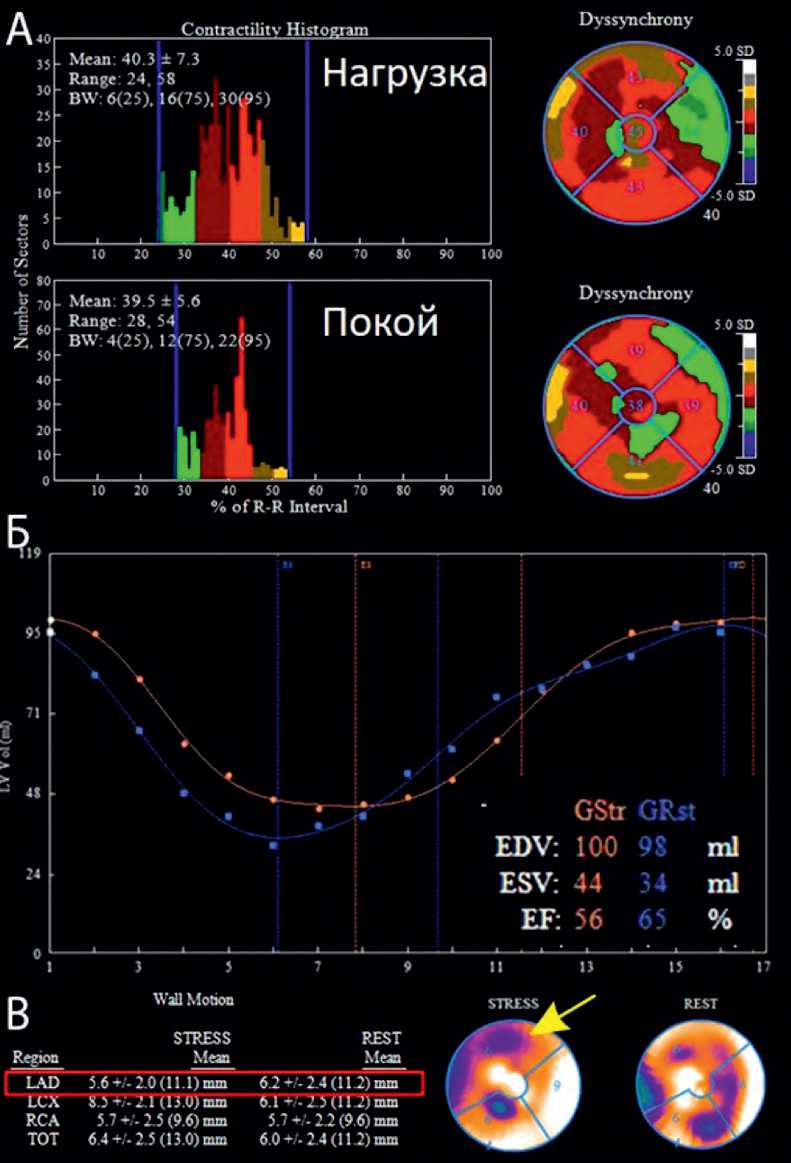
Рис. 3. Показатели ЭКГ-синхронизированной перфузионной сцинтиграфии миокарда. А – показатели механической диссинхронии: отмечаются исходно высокие значения механической диссинхронии, а также стресс-индуцированное увеличение диссинхронии; Б – кривая изгнания наполнения, объемы и фракция выброса ЛЖ: отмечается стресс-индуцированное снижение ФВЛЖ и увеличение КСО ЛЖ; В – показатели подвижности стенки ЛЖ по сосудистым регионам: отмечается стресс-индуцированное снижение подвижности в бассейне кровоснабжения ПНА
Fig. 3. Gated myocardial perfusion images. A – Indices of mechanical dyssynchrony: baseline high values of mechanical dyssynchrony and stress-induced increase of dyssynchrony are noted; B – filling curve, volumes and LV ejection fraction: stress-induced decrease of LV ejection fraction and increase of LV end systolic volume are noted; C – indices of LV wall motion by vascular regions: stress–induced decrease of wall motion in the left anterior descending artery region is noted.
поражения КА при проведении ПСМ. К таким критериям относятся индекс транзиторной ишемической дилатации (TID), данные, полученные при ЭКГ-синхронизации (исходно низкая ФВЛЖ, а также ее снижение при постнагру- зочном исследовании; увеличение объемов ЛЖ; нарушение локальной сократительной функции; увеличение показателей механической диссинхронии), а также данные о наличии кальциноза КА [8].
Рис. 4. Анализ коронарного кальция по изображениям КТ-аттенюации. Кальцинированные бляшки в проксимальном и среднем сегментах ПНА, проксимальном сегменте ОА, а также локальные бляшки в пр/с, ср/с и дист/с ПКА
Fig. 4. Coronary calcium analysis from CT-attenuation images. Calcified plaques in the proximal and middle segments of the LAD, proximal segment of the LCx, as well as plaques in the all RCA segments
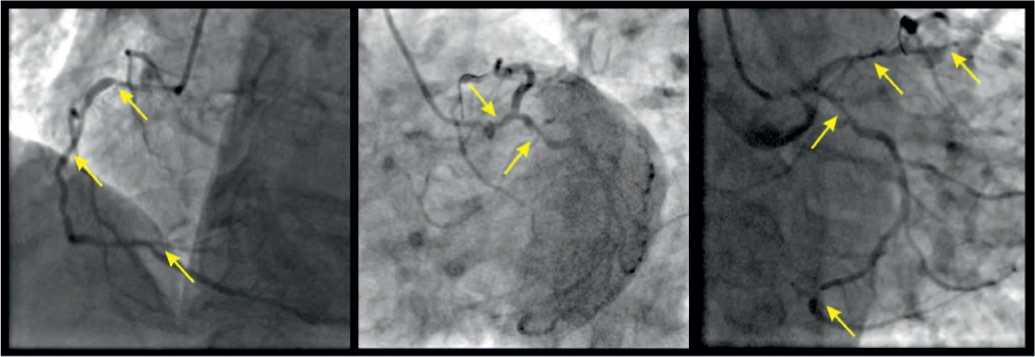
Рис. 5. Результаты коронароангиографии
Fig. 5. Coronary angiography results
Индекс транзиторной ишемической дилатации может быть оценен на изображениях без ЭКГ-синхронизации. Он представляет собой отношение размера полости ЛЖ при постнагрузочном исследовании к размеру полости ЛЖ при исследовании в покое на исследованиях без ЭКГ-синхронизации [9]. Пороговое значение TID, по данным разных исследований, разнится, но в основном не превышает 1,15–1,18 [9, 10]. Увеличение полости ЛЖ, выраженное таким образом, может отражать глобальную субэндокардиальную ишемию или снижение сократительной функции ЛЖ после нагрузки – постстрессовый станнинг. Анализ регистра REFINE SPECT (включающий 16 578 пациентов) продемонстрировал, что у пациентов с ишемией уже на уровне 5–9% от площади ЛЖ и повышением TID, риск наступления неблагоприятных исходов был аналогичен пациентам с нарушениями перфузии больше 10% [10].
Для оценки таких параметров, как ФВ, объем ЛЖ, диастолическая функция и механическая диссинхрония необходимо проведение исследования в ЭКГ-синхрони-зированном режиме. В процессе исследования каждый R-R интервал, фиксируемый электрокардиографом, разделяется на заданное количество равных временных фрагментов (фреймов), каждый из которых соответствует одному кадру сцинтиграммы. Минимальное количество фреймов, необходимое для получения информации о сократительной функции сердца, равняется восьми. Однако для более точного расчета как систолических, так и диастолических показателей необходимо использование как минимум 16-кадровой записи, так как 8-кадровая модель имеет меньшее временное разрешение. Полученные таким образом показатели оказываются заниженными относительно 16-кадровой записи, в то время как использование большего количество кадров ведет либо к существенному снижению счета импульсов на проекцию, либо к значительному увеличению времени исследования. Кроме того, 8-кадровая запись не позволяет получить информацию о скоростных показателях изгнания и наполнения ЛЖ, что может являться вспомогательной диагностической информацией. Тем не менее, с учетом того, что оптимальное время записи одной проекции составляет 25–30 с на проекцию, 8-кадровое исследование позволяет значительно сократить время пребывания пациента на столе и получить минимально необходимую информацию о сократимости. При этом если основные параметры инотропной функции ЛЖ (КДО, КСО, ФВ) допускают снижение времени записи на проекцию до 15 с без статистически значимых изменений [8], то показатели механической диссинхронии начинают значительно меняться при укорочении времени уже на 20–40% [8]. При применении гамма-камер с CZT детекторами время исследования может быть сокращено до 4–8 мин без снижения качества изображения [8, 11]. В процессе сбора информации для каждой проекции формируется усредненный («представительный») сердечный цикл, из которого выделяют конечно-систолические и конечно-диастолические кадры. Конечно-систолический кадр определяется как сцинтиграмма сердечного цикла с максимальным значением плотности сцинтилляционного счета на 1 ячейку матрицы, и, наоборот, на конечно-диастолическом кадре значение этого показателя будет минимальным [8].
Одним из наиболее признанных критериев распространенного поражения КА является отрицательная динамика ФВЛЖ после нагрузки [4, 8]. Снижение ФВЛЖ на 5% и более, а также увеличение КСО после нагрузки могут быть свидетельством постнагрузочного станнинга [8], что является естественной защитой миокарда от ишемии путем снижения потребности в кислороде [12].
Нарушение локальной подвижности стенки также может быть следствием сниженной перфузии. Причем при выраженном поражении коронарного русла нарушения подвижности могут возникать уже в состоянии покоя [13]. В упомянутом выше исследовании данных регистра REFINE SPECT у пациентов с ишемией уже на уровне 5–9% при наличии стресс-индуцированных нарушений подвижности стенки ЛЖ также значительно повышался риск развития НССС [10].
Механическая диссинхрония, оцененная посредствам ПСМ, является наиболее «молодым» дополнительным показателем ПСМ [14]. Она оценивает временную однородность сократительной деятельности ЛЖ посредством фазового анализа. Результаты анализа представляются фазовой гистограммой. Наиболее часто используемые характеристики фазовой гистограммы – ширина (phase histogram bandwidth, HBW), стандартное отклонение (phase standard deviation, PSD) и энтропия (phase entropy, PE) [11, 14, 15]. Увеличение механической диссинхронии при постнагрузочном исследовании позволяло выявить многососудистое поражение КА с чувствительностью до 74% и специфичностью до 91%, тогда как показатели перфузии (SSS ≥ 9) имели чувствительность 84% и специфичность 53%. Другая группа исследователей продемонстрировала взаимосвязь между механической дис-синхронией и постстрессовым станинном [16].
Для ЭКГ-синхронизированных исследований крайне важным условием является качественная ЭКГ-синхронизация. Настройки ЭКГ-триггера для каждого пациента должны быть проверены либо по монитору осциллоскопа, либо по распечатке ЭКГ. При этом врач-радиолог дол- жен убедиться в том, что прибор адекватно фиксирует комплексы QRS с мономорфным зубцом R и свободной от артефактов изолинией.
В большинстве случаев оптимальным расположением электродов, позволяющим получить наиболее четкий сигнал, является следующее: отрицательный электрод (обычно отведение с правой руки) фиксируется непосредственно под правой ключицей по среднеключичной линии; положительный электрод (обычно отведение с левой руки) – выше реберного края, на 2–4 см ниже позиций V4, V5 или V6; заземляющий электрод – в той же позиции, только с правой стороны. Следует проявлять внимательность при подготовке места фиксации электродов.
При затруднениях, связанных с идентификацией зубца R, рекомендуется использовать ЭКГ в 12 стандартных отведениях, что может быть полезно в планировании размещения электродов для синхронизации. Обычно изменение расположения положительного электрода (отведение с левой руки) является единственным требуемым действием для фиксации (определения) ЭКГ-сигнала.
Провода, соединяющие электроды и ЭКГ-триггер, не должны касаться элементов гамма-камеры как при планировании исследования, так и при его проведении. Кроме того, желательно избегать натяжения проводов. Несоблюдение этих условий может привести к потере сигнала во время сбора данных или к появлению артефактов. Неисправность триггера, создающая большую задержку между появлением комплекса QRS и генерацией выходного сигнала к гамма-камере, может неблагоприятно повлиять на построение кривой объема желудочков, привести к снижению статистики (плотности сцинтилляционного счета) и неоправданно удлинить время исследования. В идеале ЭКГ-триггеры должны периодически поверяться и тестироваться при помощи коммерчески доступных динамических фантомов.
Неотъемлемым условием получения качественного ЭКГ-синхронизированного изображения является относительно одинаковая продолжительность зарегистрированных сердечных сокращений. Такая однородность достигается с помощью фильтра, исключающего из записи циклы, продолжительность которых более чем на 20–30% отличается от величины заданного интервала R-R. Окно принятия для RR-интервала обычно устанавливается в рамках ± 10–15%. При этом в случае появления R-R интервала, выходящего за предварительно заданные пределы, все последующие сокращения отбраковываются вплоть до нормализации сердечного ритма.
Определение коронарного кальция является чрезвычайно полезной опцией как самостоятельное исследование, так и как дополнение к ПСМ. В последней версии клинических рекомендаций по диагностике и ведению пациентов со стабильной ИБС определение коронарного кальция выделено в отдельный шаг, который значительно влияет на стратификацию риска [4]. На сайте National Center for Biotechnology Information (Pubmed) найдено 65 результатов по запросу Coronary Artery Calcium Score с фильтром «метаанализ». Уровень доказательности у данного показателя в аспекте влияния на прогноз у пациентов с ИБС 1А [4]. При отсутствии отдельного исследования уровня коронарного кальция и невозможности произвести подсчет индекса Агатстона возможно использование шкалы CAC-DRS, которая позволяет визуально определить степень вовлеченности коронарного русла в атеросклеротический процесс и оценить риск [17].
В данном случае имели место постнагрузочное падение ФВЛЖ на 9%, повышение TID до 1,2, снижение подвижности стенки в бассейне передне-нисходящей артерии и увеличение механической диссинхронии после нагрузки. Кроме того, при анализе уровня коронарного кальция зарегистрирован высокий риск развития НССС у пациента, что также входило в диссонанс с показателями стандартной перфузии, демонстрировавшей минимальные нарушения кровоснабжения с стресс-индуцирован-ную ишемию на уровне 3% от площади ЛЖ.
Заключение
Расширенный анализ данных ЭКГ-синхронизирован-ной перфузионной сцинтиграфии миокарда способствует выявлению пациентов с многососудистым поражением КА. Данный подход незначительно увеличивает время обработки и составления заключения, однако существенно увеличивает потенциальную пользу от исследования и позволяет с большей точностью произвести стратификацию риска пациентов на этапе обследования.


