Использование явления термостимулированной радиационно-обусловленной люминесценции микрокристаллов морской соли для внутриполостной «ин виво» дозиметрии при брахитерапии рака предстательной железы источником 192Ir: оценка потенциала
Автор: Петухов А.Д., Богачева В.В., Степаненко В.Ф., Бирюков В.А., Коротков В.А., Жарова Е.П., Минаева Н.Г., Иванов С.А., Шегай П.В., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 3 т.33, 2024 года.
Бесплатный доступ
Цель исследования - применение явления термостимулированной люминесценции в природных микрокристаллах морской соли (NaCl) в терапевтическом диапазоне доз для разработки метода автономной внутриполостной «ин виво» дозиметрии пациентов при высокодозной брахитерапии рака предстательной железы источником 192Ir. В исследовании использованы аликвоты микрокристаллов морской соли (фракции кристаллов с размерами около 100 мкм). Измерения интенсивности термолюминесценции (ТЛ) проводили на ТЛ-ридере Harshaw. Для построения дозовых калибровочных зависимостей образцы с кристаллами морской соли облучали на стандартном калибровочном источнике 90Sr/90Y с мощностью дозы 2,99 мГр/с. Установлено наличие линейной зависимости дозового отклика микрокристаллов морской соли в диапазоне терапевтических поглощённых доз от 1 до 20 Гр при погрешности измерений интенсивности люминесценции исследуемых образцов микрокристаллов менее 5%. Выявлено, что фединг (спад показаний микродозиметров во времени) не превышает 5% через 5 сут после облучения. Клиническая апробация метода «ин виво» дозиметрии с применением микрокристаллов морской соли при высокомощностной брахитерапии рака предстательной железы показала, что результаты измерений поглощённых доз в органе риска пациентов (прямая кишка) исследуемыми природными кристаллами NaCl согласуются в пределах погрешностей с результатами измерений синтетическими кристаллами LiF:Mg,Ti - при внутриполостном размещении и одновременном облучении сборок этих микрокристаллов в органе риска. Сделан вывод о перспективности применения исследованных микрокристаллов морской соли для «ин виво» дозиметрии при высокомощностной брахитерапии рака предстательной железы источником 192Ir.
Онкология, лучевая терапия, брахитерапия, локальные дозы облучения при радиотерапии, органы риска, рак предстательной железы, радиационно-обусловленная стимулированная люминесценция, люминесцентная дозиметрия,
Короткий адрес: https://sciup.org/170206293
IDR: 170206293 | УДК: 535.376:661.422:616.65-006-085.849.5 | DOI: 10.21870/0131-3878-2024-33-3-46-54
Текст научной статьи Использование явления термостимулированной радиационно-обусловленной люминесценции микрокристаллов морской соли для внутриполостной «ин виво» дозиметрии при брахитерапии рака предстательной железы источником 192Ir: оценка потенциала
«Ин виво» дозиметрия органов риска пациентов необходима для дозиметрического обеспечения качества радиотерапии злокачественных новообразований различных локализаций [1-4]. Это особенно актуально при брахитерапии [5-8], когда терапевтический источник находится вблизи очага и окружающих его нормальных тканей. В этих условиях даже небольшие вариации расстояний между источником, очагом и близлежащими тканями могут привести к существенным отклонениям от первоначального расчётного дозиметрического плана терапии [9-15] из-за подвижности тканей пациентов за период времени после планирования радиотерапии и в процессе сеанса облучения.
Петухов А.Д. – с.н.с., к.б.н.; Богачева В.В. * – в.н.с., к.б.н.; Степаненко В.Ф. – зав. лаб., д.б.н., проф.; Бирюков В.А. – с.н.с., к.м.н.; Коротков В.А. – зав. отд., к.м.н.; Минаева Н.Г. – уч. секр., к.м.н.; Иванов С.А. – директор, чл.-корр. РАН, д.м.н., проф. кафедры РУДН. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Жарова Е.П. – уч. секр.; Шегай П.В. – зам. ген. директора, к.м.н.; Каприн А.Д. – ген. директор, директор МНИОИ им. П.А. Герцена, зав. каф. РУДН, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
Материалы и методы
В качестве объекта исследования использовали образцы аликвот с природными микрокристаллами морской соли со следующим составом: NaCl (99,5%), Ca++ (0,08%), Mg++ (0,05%), SO 4 - (0,31%), К+ (0,025%).
Измерения радиационно-обусловленного люминесцентного свечения проводилось с помощью прибора Harshaw 3500, являющегося ТЛ-ридером. Облучение образцов для построения калибровочной зависимости осуществлялось стандартным источником 90Sr/90Y (поверен на вторичном образцовом гамма-источнике 60Co), обеспечивающим мощность дозы, подводимой к образцам, равной 2,99 мГр/сек.
Исследовали фракции кристаллов с размерами около 100 мкм. Этот размер, как показали исследования (см. раздел «Результаты» ниже), обеспечивает вполне достаточный световыход радиационно-обусловленной термостимулированной люминесценции. В то же время, микрокристаллы такого размера можно рассматривать как «точечные» дозиметры, не обладающие значимым градиентом поглощённой дозы в объёме. При измерениях использовали монослойные аликвоты микрокристаллов массой 10 мг.
Результаты
Дозиметрические характеристики микрокристаллов морской соли
Выявлено, что положение максимума пика интенсивности радиационно-обусловленной термолюминесценции (ТЛ) смещается в диапазоне поглощённых доз от 1 до 20 Гр (рис. 1). Для улучшения точности измерений был выбран интегральный способ оценки интенсивности люминесценции: в качестве меры интенсивности ТЛ вычислялся интеграл по площади кривой высвечивания, соответствующей положению пика ТЛ в области температур нагрева 235-255 °С (в диапазоне ±45 °C от положения максимума этого пика).
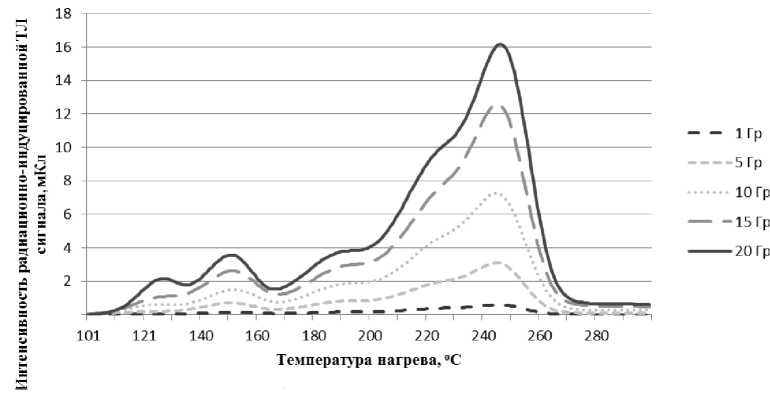
Рис. 1. Зависимость интенсивности радиационно-обусловленной термостимулированной люминесценции от температуры нагрева при разных дозах облучения микрокристаллов NaCl с размерами около 100 мкм.
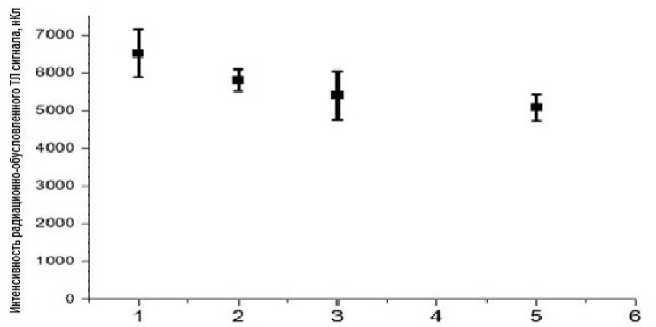
При измерениях была обнаружена зависимость интенсивности радиационно-обусловленной ТЛ от скорости нагрева микрокристаллов (рис. 2). Поэтому для дальнейшей работы была выбрана постоянная скорость нагрева 1 °С/c.
Скорость нагрева микрокристаллов NaCI во время измерения, °С/с
Рис. 2. Интенсивность ТЛ от скорости нагрева. Приведённые погрешности не превышают 10% (2 SD).
Установлено, что имеется вполне приемлемый для измерений фединг (спад показаний микродозиметров во времени): при комнатной температуре фединг не превышает 5% через 5 сут после облучения (рис. 3). Вместе с тем, этот факт требует точного учёта периода времени после окончания облучения и началом измерения.
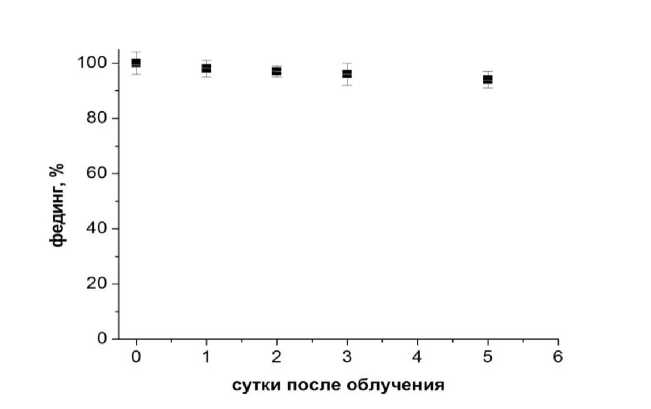
Рис. 3. Фединг термостимулированного сигнала (%) в зависимости от времени после облучения (сутки). Указанные погрешности не превышают 5% (2 SD).
Установлено наличие линейной зависимости дозового отклика микрокристаллов морской соли в диапазоне доз облучения от 1 до 20 Гр при погрешности измерений менее 5%. На рис. 4 приведены примеры дозовых зависимостей для исследуемых кристаллов морской соли и синтетических микрокристаллов LiF:Mg,Ti с размерами около 100 мкм. Установлены следующие параметры линейной корреляции: для NaCl – R=0,9975; N=7; P<0,0001, а для LiF:Mg,Ti – R=0,9955; N=7; P<0,0001.
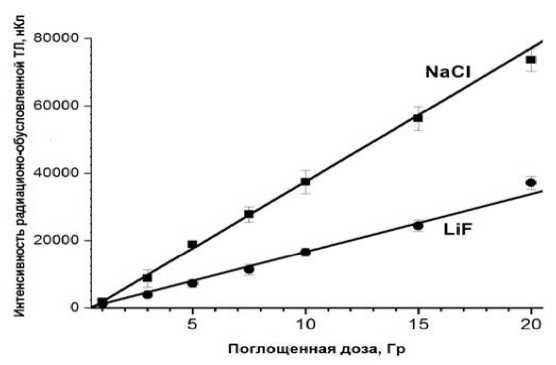
Рис. 4. Дозовая зависимость для исследуемых кристаллов морской соли и (для сравнения) дозовая зависимость для синтетических микрокристаллов LiF:Mg,Ti с размерами около 100 мкм. Приведённые на рисунке погрешности не превышают 5% (1 SD).
Результаты разработки и клинической апробации внутриполостной «ин виво» дозиметрии с применением микрокристаллов NaCl
Сборки микрокристаллов морской соли после их сортировки по размерам герметически запаивали в гибкие тканеэквивалентные трубки с диаметром 1 мм. При брахитерапии рака предстательной железы (РПЖ) органами риска являются уретра и толстый кишечник. Онколог-радиолог перед сеансом брахитерапии, в условиях стерильности, размещал одну из сборок микродозиметров внутри медицинского уретрального катетера, который вводился по медицинским показаниям в уретру. При введении в ректум, две сборки микродозиметров (NaCl и LiF:Mg,Ti) фиксировали в параллельном положении на используемом при брахитерапии ультразвуковом датчике (рис. 5).

Рис. 5. Размещение сборок микродозиметров перед сеансом брахитерапии (фото в центре внизу). При введении в уретру: сборки с NaCl или LiF:Mg,Ti (обозначены как «1» или «2») – фото вверху слева. При введении в ректум сборки фиксировали на УЗИ-датчике: «1» – NaCl и «2» – LiF:Mg,Ti (фото справа вверху).
Клиническая апробация внутриполостной «ин виво» дозиметрии с применением микрокристаллов NaCl при высокомощностной брахитерапии РПЖ показала, что результаты измерений поглощённых доз в органе риска пациентов (прямая кишка) исследуемыми природными кристаллами NaCl согласуются в пределах погрешностей с результатами измерений синтетическими кристаллами LiF:Mg,Ti при внутриполостном размещении и одновременном облучении сборок этих микрокристаллов в органе риска (рис. 6).
18000 -
14000 - to
16000 -
12000 -
юооо -
8000 -
6000 -
4000 -
2000 -
«
о + о
положение в сборке, мм
Рис. 6. Пример: сравнение результатов внутриполостной «ин виво» дозиметрии с применением микрокристаллов NaCl и микрокристаллов LiF:Mg,Ti риска (толстый кишечник) при высокомощностной брахитерапии РПЖ источником 129 Ir. На горизонтальной оси точка «0» соответствует максимальной глубине расположения микродозиметров в прямой кишке. Микрокристаллам NaCl соответствуют треугольные символы. Квадраты соответствуют микрокристаллам LiF:Mg,Ti. Указаны погрешности в 2 SD.
Заключение
В условиях термостимуляции радиационно-обусловленной люминесценции исследуемых микрокристаллов морской соли установлено:
-
^ имеется линейная зависимость дозового отклика в диапазоне терапевтических поглощённых доз от 1 до 20 Гр при погрешности измерений интенсивности люминесценции исследуемых образцов микрокристаллов менее 5%;
-
^ регистрируется вполне приемлемый фединг (спад показаний микродозиметров во времени), который не превышает 5% через 5 сут после облучения;
-
^ клиническая апробация «ин виво» дозиметрии с применением микрокристаллов морской соли при высокомощностной брахитерапии РПЖ показала, что результаты измерений поглощённых доз в органе риска пациентов (прямая кишка) исследуемыми природными кристаллами NaCl согласуются в пределах погрешностей с результатами измерений синтетическими кристаллами LiF:Mg,Ti – при внутриполостном размещении и одновременном облучении сборок этих микрокристаллов в органе риска.
Ранее было предложено использовать кристаллы бытовой соли для целей ретроспективной дозиметрии в диапазоне малых доз облучения (до 0,1 Гр) [16]. Результаты выполненных нами исследований и разработок [17], их клиническая апробация показывают перспективы применения микрокристаллов морской соли при терапевтических дозах для клинической «ин виво» дозиметрии при брахитерапии РПЖ источником 192Ir.
Список литературы Использование явления термостимулированной радиационно-обусловленной люминесценции микрокристаллов морской соли для внутриполостной «ин виво» дозиметрии при брахитерапии рака предстательной железы источником 192Ir: оценка потенциала
- IAEA Human Health Reports No. 8. Development of procedures for in vivo dosimetry in radiotherapy. Vienna: IAEA, 2013. 178 p. [Электронный ресурс]. URL: https://www-pub.iaea.org/MTCD/Publications/PDF/Pub1606_web.pdf (дата обращения 08.04.2024).
- IAEA Human Health Series No. 30. Implementation of high dose rate brachytherapy in limited resource settings. Vienna: IAEA, 2015. 97 p. [Электронный ресурс]. URL: https://www-pub.iaea.org/MTCD/Publications/PDF/Pub1670web-5444797.pdf (дата обращения 08.04.2024).
- ICRP, 2005. Prevention of high-dose-rate brachytherapy accidents. Publication 97 //Ann. ICRP. 2005. V. 35, N 2. P. 1-51.
- Radiotherapy risk profile WHO/IER/PSP/2008.12. Geneva: WHO, 2008. 51 p.
- Каприн А.Д., Бирюков В.А., Карякин О.Б., Галкин В.Н., Иванов С.А., Обухов А.А., Борышева Н.Б., Лепилина О.Г., Гуменецкая Ю.В., Гулидов И.А. Применение высокомощностной брахитерапии 192Ir в лечении рака предстательной железы //Русский медицинский журнал. 2017. № 8. С. 492-495.
- Каприн А.Д., Галкин В.Н., Иванов С.А. Роль брахитерапии в лечении локализованных форм рака предстательной железы //Biomedical Photonics. 2015. Т. 4, № 4. С. 21-26.
- Брахитерапия /под общ. ред. акад. РАН А.Д. Каприна, чл.-корр. РАН Ю.С. Мардынского. Обнинск: МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2017. 245 с.
- Каприн А.Д., Паньшин Г.А., Альбицкий И.А., Миленин К.Н., Цыбульский А.Д., Харченко В.П. Новая медицинская технология: Брахитерапия (локализованного) рака предстательной железы. Разрешение ФС № 2009/218 от 27.07.2009.
- Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Иванников А.И., Борышева Н.Б., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков В.А., Обухов А.А., Анохин Ю.Н. Внутриполостная автономная «ин виво» дозиметрия при высокомощност-ной брахитерапии рака предстательной железы c применением 192Ir: разработка технологии и первые результаты //Радиация и риск. 2017. Т. 26, № 2. С. 72-82.
- Степаненко В.Ф., Бирюков В.А., Карякин О.Б., Каприн А.Д., Галкин В.Н., Иванов С.А., Мардынский Ю.С., Колыженков Т.В., Петухов А.Д., Богачева В.В., Ахмедова У.А., Яськова Е.К., Лепилина О.Г., Санин Д.Б., Скворцов В.Г., Иванников А.И., Хайлов А.М., Анохин Ю.Н. Локальные поглощённые дозы облучения медицинского персонала при брахитерапии рака предстательной железы микроисточниками 125I российского производства //Радиация и риск. 2017. Т. 26, № 1. С. 44-59.
- Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Борышева Н.Б., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Обухов А.А., Иванников А.И., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков В.А., Анохин Ю.Н. «Ин виво» дозиметрия при высокомощностной брахитерапии с примене-нием 192Ir: сравнение распределения планируемых и измеренных доз при внутриполостном размещении автономных люминесцентных микродозиметров //Радиация и риск. 2018. Т. 27, № 1. С. 77-85.
- Коротков В.А., Каприн А.Д., Иванов С.А., Степаненко В.Ф., Бирюков В.А., Борышева Н.Б., Колыженков Т.В., Ахмедова У.А., Богачёва В.В., Петухов А.Д., Жарова Е.П. Проявления позднего лучевого уретрита в сравнении с инструментальными оценками пространственного внутриполостного распределения доз при высокомощностной брахитерапии рака с применением 192Ir: предварительные результаты //Радиация и риск. 2019. Т. 28, № 1. С. 110-123.
- Богачева В.В., Коротков В.А., Бирюков В.А., Каприн А.Д., Иванов С.А., Степаненко В.Ф., Петухов А.Д., Колыженков Т.В., Ахмедова У.А. Технология внутриполостной «ин виво» дозиметрии с использованием автономных люминесцентных микродозиметров для измерения пространственного распределения поглощённой дозы у пациентов при проведении высокомощностной брахитерапии рака предста-тельной железы //Вопросы урологии и андрологии. 2019. Т. 7, № 2. С. 39-40.
- Жарова Е.П., Степаненко В.Ф., Киселёва М.В., Богачёва В.В., Аминов Г.Г., Колыженков Т.В., Петухов А.Д., Жарикова И.А., Демьянович А.В., Борышева Н.Б., Иванов С.А., Каприн А.Д. Ин виво дозиметрия люминесцентными микродозиметрами при брахитерапии рака молочной железы источником 192Ir: разработка технологии и клиническая апробация //Радиация и риск. 2020. Т. 29, № 2. С. 67-77.
- Богачева В.В., Степаненко В.Ф., Крикунова Л.И., Петухов А.Д., Кулиева Г.З., Колыженков Т.В., Жарова Е.П., Коротков В.А., Иванов С.А., Шегай П.В., Каприн А.Д. Внутриполостная «ин виво» дозиметрия при высокомощностной брахитерапии в онкогинекологии //Радиация и риск. 2022. Т. 31, № 4. С. 119-131.
- Christiansson M. Household salt as an emergency radiation dosemeter for retrospective dose assessments using optically stimulated luminescence. Dissertattion. Malmö, Sweden: Lund University, 2014. [Электронный ресурс]. URL: https://portal.research.lu.se/en/publications/household-salt-as-an-emergency-radiation-dose-meter-for-retrospect/ (дата обращения 15.04.2024).
- Петухов А.Д. Люминесцентная дозиметрия локального облучения населения и пациентов с использованием микрокристаллов SiO2 и NaCl: дис. … канд. биол. наук. Обнинск: ФГБУ «НМИЦ радиологии» Минздрава России, 2021. 123 с.


