Использование кноттина как носителя пептида, тропного ПСМА
Автор: Белобородов Е.А., Юрова Е.В., Расторгуева Е.В., Погодина Е.С., Сугак Д.Е., Фомин А.Н., Саенко Ю.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 2, 2022 года.
Бесплатный доступ
Рак предстательной железы является наиболее распространенным типом рака у мужчин. Ежегодно диагностируется около 1,3 млн случаев рака предстательной железы и более 400 тыс. смертей от данного заболевания и ожидается, что к 2040 г. это число удвоится. Классические методы лечения рака предстательной железы имеют множество недостатков, к которым относят также риск рецидива. Недостатки традиционной терапии привели к появлению таргетной радионуклидной терапии с использованием пептидов. Цель. Изучение эффективности связывания меченных Lu177 кноттинов, содержащих тропный ПСМА пептид в разных доменах, in vitro и их биораспределения in vivo. Материалы и методы. В работе использовались культуры клеток рака предстательной железы LNCaP, PC3, а также культура фибробластных клеток яичника CHO-K1. Синтез пептидов осуществлялся на пептидном синтезаторе ResPepSL (Intavis). Изучалась стабильность пептидов, их токсичность и связываемость с клеточными культурами, биораспределение на примере мышей BALB/c с привитыми клетками аденокарциномы молочной железы. Использовались методы хроматографии и радиометрии. Результаты. Синтезированные пептиды, содержащие последовательность GTIQPYPFSWGY, встроенную в узел U5-цитотоксин-Sth1a, более стабильны в плазме крови и физиологическом растворе, чем радиофармацевтический препарат 177Lu-PSMA-617а, но имеют аналогичную с ним степень связывания. Исследования биораспределения у мышей BALB/c демонстрируют более высокий индекс связывания синтезированного пептида по сравнению с 177Lu-PSMA-617. Выводы. Модифицированные пептиды с пептидом, тропным к антигену PSMA, вставленным в структуру токсина U5-Sth1a, демонстрируют высокую стабильность как в физиологическом растворе, так и в плазме крови, хорошее связывание как с клеточными культурами, так и с опухолями в организме.
Рак предстательной железы, кноттин, токсин пауков, радиофармпрепарат, стабильность, лютеций
Короткий адрес: https://sciup.org/14124531
IDR: 14124531 | УДК: 616-006, | DOI: 10.34014/2227-1848-2022-2-117-127
Текст научной статьи Использование кноттина как носителя пептида, тропного ПСМА
Введение. Ежегодно диагностируется около 1,3 млн новых случаев рака предстательной железы. В настоящее время около 10 млн мужчин живут с диагностированным раком предстательной железы и примерно 700 тыс. из них – с метастатическим раком. Метастатический рак является причиной более 400 тыс. смертей ежегодно, и ожидается, что к 2040 г. это число удвоится [1]. По статистике смертность от рака предстательной железы составляет от 3 до 18 %. С возрастом и при наличии хронических заболеваний данный показатель возрастает до 33 % [2].
Методы лечения рака предстательной железы могут различаться в зависимости от стадии, на которой был диагностирован рак, возраста и состояния здоровья пациента, а также зависят от предпочтений самого пациента [3].
К классическим методам лечения относят хирургическое вмешательство (радикальная простатэктомия), гормональную, лучевую терапию и химиотерапию [3–6]. Однако классические методы лечения имеют ряд недостатков, основными из которых являются многочисленные осложнения (недержание мочи, эректильная дисфункция, импотенция), возрастание риска развития рецидива заболевания, при этом некоторые методы неэффективны при метастазирующем раке предстательной железы [7–9].
Именно множественные побочные эффекты и зачастую низкая эффективность лечения способствовали появлению таргетной терапии [10]. Таргетная противораковая терапия представляет собой особый вариант радио- или химиотерапии, когда действующее вещество до- ставляется непосредственно к мишени – раковой клетке [11]. Мишенью для таргетной терапии рака предстательной железы является простатспецифический мембранный антиген (ПСМА, PSMA), экспрессирующийся на мембранах клеток предстательной железы и в тысячи раз сильнее – на клетках рака предстательной железы [12].
Наиболее перспективным средством доставки действующего вещества к раковой клетке считаются пептиды, имеющие ряд преимуществ, в частности высокую проникающую способность из-за их небольшой массы [13].
Однако и у пептидных таргетных препаратов имеются недостатки, такие как низкая стабильность в среде организма, которые решаются применением пептидов с цистеиновым узлом, или кноттинов [14]. Кноттины представляют собой пептиды, обладающие структурой с тремя видами дисульфидных связей [15]. В типичном пептиде с цистеиновым узлом первый и четвертый, второй и пятый остатки цистеина образуют дисульфидные связи; дисульфидная связь, образованная между третьим и шестым остатками цистеина, проходит через эти первые два дисульфида, создавая макроциклический узел [16].
Цель исследования. Изучение эффективности связывания меченных Lu177 кноттинов, содержащих PSMA-тропную вставку в разных доменах, на примере культур клеток рака предстательной железы и их биораспределения.
Материалы и методы. В исследовании использовались следующие линии рака предстательной железы: LNCaP (получена из метастазов в лимфатическом узле), PC3 (получена из метастазов в кости), CHO-K1 (фибробластоподобные клетки яичника). Раковые линии культивировались в среде RPMI-1640 с 10 % фетальной бычьей сывороткой и 100 ед./мл пенициллина/стрептомицина во влажном инкубаторе при 37 °C и 5 % CO 2 .
Для исследования синтезировались пептиды, спроектированные на основе токсина U5-Sth1a паука семейства Scytodes thoracica, в который встраивался PSMA с последовательностью GTIQPYPFSWGY [17]. PSMA внедрялся в начале (DOTA-Knot/C0-C1), после первого цистеинового узла (DOTA-Knot/C1-C2) и после второго цистеинового узла (DOTA-Knot/C2-C3) (рис. 1).
Пептиды были получены на пептидном синтезаторе ResPep SL (Intavis) методом твердофазного синтеза по стандартному протоколу с использованием защитной F-moc (fluo-renylmethyloxycarbonyl chloride)-АА-группы на смоле TentaGel, где ангидрид уксусной кислоты применялся в качестве capping mixing, 0,5M HBTU (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate) – в качестве активатора, NMM (N-Methylmorpho-line) – катализатора, DMF (Dimethylformamide), NMP (N-Methyl-2-pyrrolidone) – растворителей, 20 % пиперидин – депротектора. После синтеза пептиды отщеплялись от смолы коктейлем, содержащим TFA (Trifluoroacetic acid) (92,5 %), TIPS (Triisopropylsilane) (5 %) и деионизированную воду (2,5 %). Далее отщепленные пептиды осаждались холодным MTBE (Methyltert-butylether) и сушивались.
Синтезированные пептиды анализировались методами хроматографии и масс-спектрометрии.
Хроматографический анализ пептидов проводился с использованием хроматографической системы Shimadzu LC-20AD XR, оснащенной спектрофотометрическим детектором SPD-20A. Анализ осуществлялся методом обращенно-фазовой хроматографии с использованием колонки Dr. Maisch Luna C18(2) по стандартному протоколу градиентного элюирования от 95 % A, 5 % В до 0 % A, 100 % B в течение 40 мин, где элюент A – деионизированная вода, элюент B – ацетонитрил. Объем образца составлял 20 мкл, детектирование осуществлялось на длине волны 215 нм.
Масс-спектрометрический анализ производился на программно-аппаратном комплексе MALDI-TOF MS серии FLEX (Bruker Dal-tonics, Germany).
Для дальнейшей работы пептиды метились активным лютецием в форме 177LuCl3 в соляной кислоте 0,05 N. Реакционная смесь состояла из хлорида лютеция с активностью 3,5 MBq, растворенного пептида (конечная концентрация 0,05 мг/мл) и 0,2 М натрий-ацетатного буфера с pH 4. Мечение проводилось с использованием модуля для синтеза Gaia (Raytest, Германия) при температуре 80 °С в течение 10 мин для кноттинов и 95 °С в течение 20 мин для фармацевтического препарата PSMA-617, используемого для сравнения.
Анализ и очистка пептида до и после синтеза проводились по указанному протоколу хроматографии. Активность измерялась с помощью радиодетектора Gabi (Raytest, Германия).
Использовались пептиды с радиохимической чистотой >95 %.
Исследование стабильности пептидов проводилось в течение 168 ч в физрастворе (pH 7,4) и плазме человека. Для определения стабильности в физрастворе к растворам пеп- тидов 177Lu-DOTA-Knot/C0-C1, 177Lu-DOTA-Knot/C1-C2, 177Lu-DOTA-Knot/C2-C3 (100 мкл, 4,25 MBq) и 177Lu-PSMA-617 (100 мкл, 10 MBq) добавлялся NaCl (0,9 %) в объеме 900 мкл. Каждая смесь инкубировалась при 4 °С и 21 °С в трех повторах и анализировалась методом хроматографии с детектором радиоактивности Gabi (Raytest, Германия) (рис. 1, 2) через 24, 48, 96 и 168 ч [18].
Для исследования стабильности в плазме пептиды в объеме 100 мкл (10 MBq) добавлялись к плазме крови человека и инкубировались при 37 °С в течение 168 ч [19].
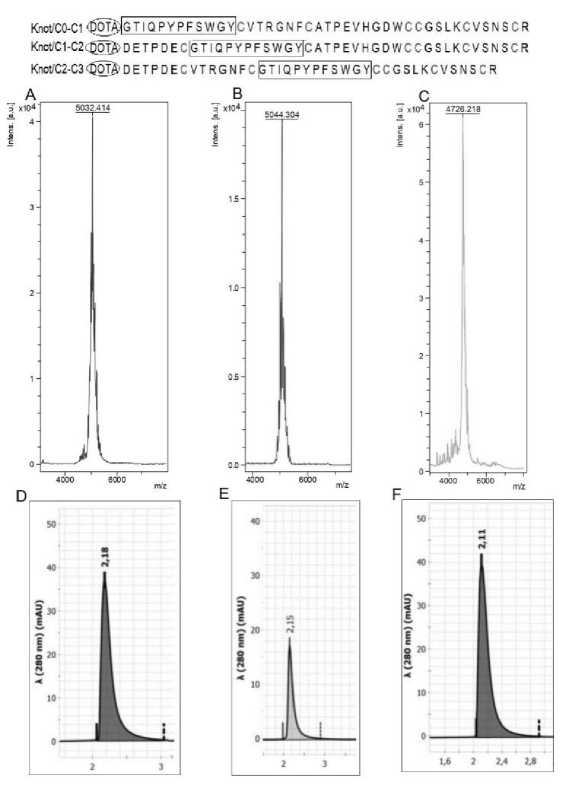
Рис. 1. Результаты синтеза PSMA-тропного пептида с последовательностью GTIQPYPFSWGY, встроенного в разные участки токсина U5-Sth1a
Fig. 1. Synthesis of PSMA-tropic peptide with GTIQPYPFSWGY sequence; the peptide is inserted into different sites of U5-Sth1a toxin
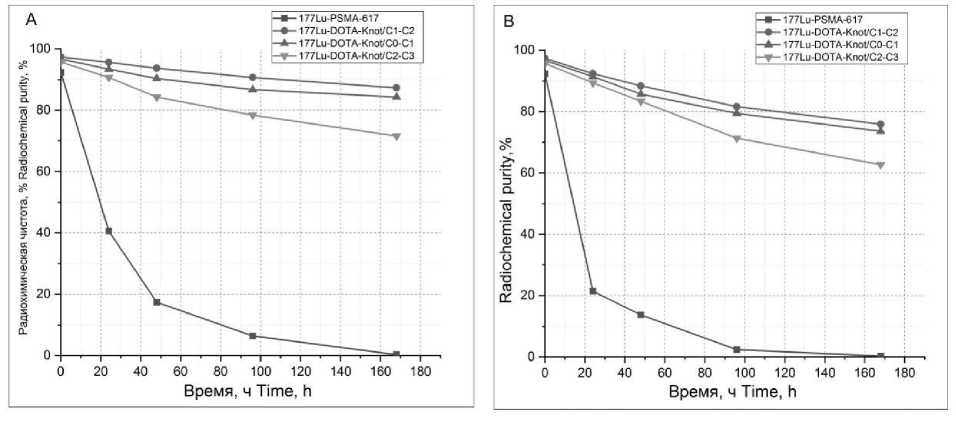
Рис. 2. Стабильность меченых пептидов 177Lu-PSMA-617, 177Lu-DOTA-Knot/C0-C1, 177Lu-DOTA-Knot/C1-C2, 177Lu-DOTA-Knot/C2-C3 в физрастворе (A) и в плазме крови (B)
Fig. 2. Stability of labeled peptides (177Lu-PSMA-617, 177Lu-DOTA-Knot / C0-C1, 177Lu-DOTA-Knot / C1-C2 and 177Lu-DOTA-Knot / C2-C3) in saline (A) and in blood plasma (B)
Для исследования связывания с культурой клетки высеивались в планшеты в количестве 100 тыс. клеток на одну лунку планшета. После добавления меченого пептида (50 КБк) культуры инкубировались в PBS при температуре 37 °С в атмосфере с 5 % CO 2 в течение 3 ч. В качестве сравнения использовался пептид 177Lu-PSMA-617 [20]. Измерялась активность исходного раствора пептида, раствора PBS после инкубации и раствора со смытыми клетками с помощью сцинцилляторного радиометра Triathler (Hidex Oy, Финляндия) с использованием кристалла йодистого натрия (NaITI). Результаты обрабатывались с помощью Excel.
Для анализа токсичности клетки линии CHO-K1 обрабатывались пептидом без метки в концентрации 0,5 мкМ через 24 ч после посева и в режиме реального времени контролировалась кинетика цитостатического ответа с помощью системы 16-луночного планшета RTCA S 16 xCELLigence (ACEA Biosciences, США). В качестве контрольного токсического препарата использовался менадион.
Распределение пептидов определялось через 4 и 24 ч после инъекции у мышей BALB/c с привитыми клетками аденокарциномы молоч- ной железы по пять в каждой группе. Каждой особи вводилось 100 мкл (3,9 МБк) раствора меченого пептида через хвостовую вену. Животные умерщвлялись с использованием протоколов ухода за животными. Ткани взвешивались, их удельная активность в процентах от введенной дозы на грамм определялась с помощью сцинцилляторного радиометра Triath-ler (Hidex Oy, Финляндия) [21].
Каждое исследование проводилось в трех повторах для каждой подопытной группы. Результаты представлялись как среднее значение и стандартное отклонение (М±SD). Для оценки статистической значимости различий применялся t-критерий Стьюдента для парных переменных. Различия между группами считались достоверными при р<0,05.
Результаты и обсуждение. Синтезированные пептиды, очищенные хроматографическим методом до чистоты >95 %, исследовались на стабильность (рис. 2). По результатам данного исследования можно сделать вывод, что пептиды 177Lu-DOTA-Knot/C0-C1, 177Lu-DOTA-Knot/C1-C2, 177Lu-DOTA-Knot/C2-C3 обладают большей стабильностью по сравнению с 177Lu-PSMA-617 как в физрастворе, так и в плазме крови. Радиохимическая чистота пеп- тидов 177Lu-DOTA-Knot/C0-C1, 177Lu-DOTA-Knot/C1-C2, 177Lu-DOTA-Knot/C2-C3 сохраняется на уровне >70 % в течение 168 ч в физрастворе и в течение 96 ч в плазме крови. Наибольшей стабильностью обладает пептид 177Lu-DOTA-Knot/C1-C2, он сохраняет радиохимическую чистоту >90 % в физрастворе и >80 % в плазме в течение 96 ч. Полученные данные являются подтверждением гипотезы об увеличении стабильности препарата за счет встраивания в молекулу аминокислотной последовательности с дисульфидными связями.Исследование токсичности пептидов DOTA-Knot/C0-C1, DOTA-Knot/C1-C2,
DOTA-Knot/C2-C3 и менадиона по отношению к культуре CHO-K1 через 24 ч инкубации показало минимальные различия между группами, обработанными пептидами, и контрольной (рис. 3). Показатели положительного контроля клеточного индекса при обработке менадионом имеют отрицательные значения (-0,8), что свидетельствует о клеточной смерти. Статистически значимые различия были получены при сравнении с контрольной группой. Полученные данные свидетельствуют об отсутствии токсичности исследуемых пептидов в концентрации 0,5 мкМ для клеток линии CHO-K1.
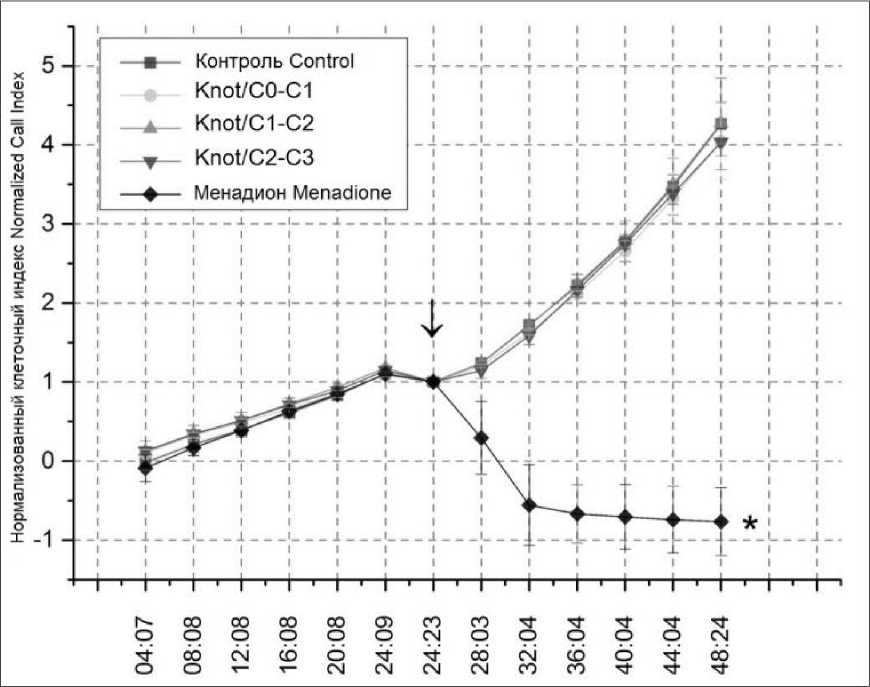
Рис. 3. Цитотоксические ответы клеток CHO-K1 после добавления пептидов (() DOTA-Knot/C0-C1, DOTA-Knot/C1-C2, DOTA-Knot/C2-C3 и менадиона через 24 ч инкубации (* - статистически значимое отличие (p<0,05) при сравнении c контролем)
Fig. 3. Cytotoxic responses of CHO-K1 cells after addition of DOTA-Knot / C0-C1, DOTA-Knot / C1-C2 and DOTA-Knot / C2-C3 peptides (|) and menadione, 24-hour incubation (* p<0.05 - the difference is significant when compared with the control)
На рис. 4 показана степень связывания пептидов 177Lu-PSMA-617, 177Lu-DOTA-Knot/C0-C1, 177Lu-DOTA-Knot/C1-C2, 177Lu-DOTA-Knot/C2-C3 с клеточными линиями LNCaP, PC3 и CHO-K1 через 3 ч инкубации. Наибольшее связывание происходит с клетками культуры LNCaP, наименьшее – с CHO-K1.
Полученные результаты свидетельствуют о прикреплении пептидов к простатспецифиче-скому мембранному антигену на поверхности клеток культуры LNCaP, поскольку концентрация PSMA на мембране клеток данной культуры максимальна.
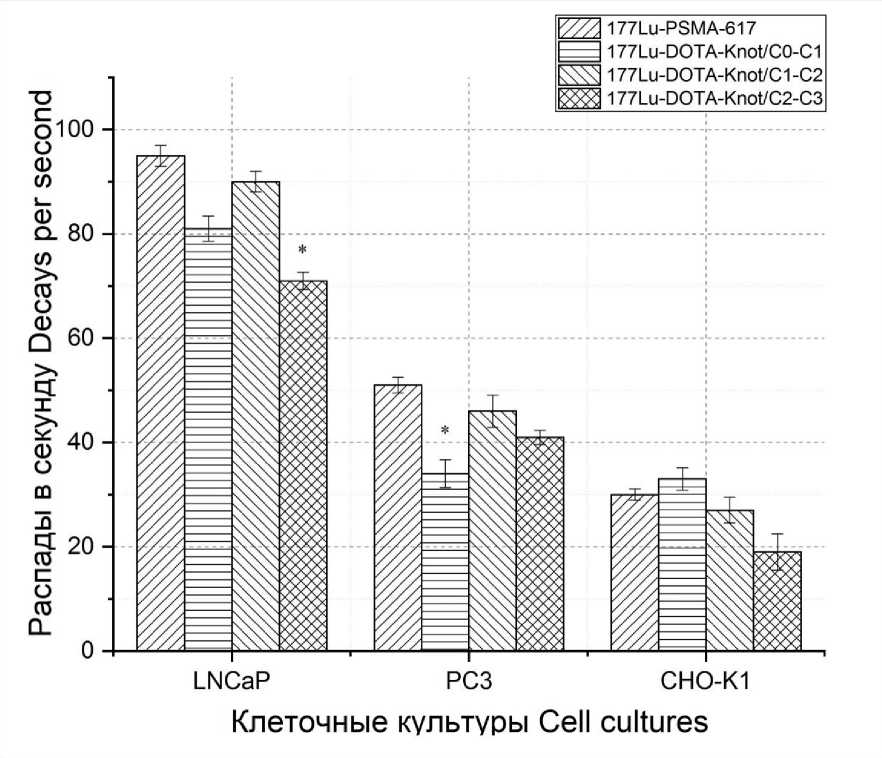
Рис. 4. Связывание меченых пептидов 177Lu-PSMA-617, 177Lu-DOTA-Knot/C0-C1, 177Lu-DOTA-Knot/C1-C2, 177Lu-DOTA-Knot/C2-C3 с мембраной опухолевых клеток линий LNCaP, PC3 и CHO-K1 через 3 ч инкубации (* – статистически значимое отличие (p<0,05) при сравнении с 177Lu-PSMA-617)
Fig. 4. Binding of labeled peptides (177Lu-PSMA-617, 177Lu-DOTA-Knot / C0-C1, 177Lu-DOTA-Knot / C1-C2 and 177Lu-DOTA-Knot / C2-C3) with the membrane of tumor cells lines (LNCaP, PC3 and CHO-K1), 3-hour incubation
(*p<0.05 – the difference is significant when compared with 177Lu-PSMA-617)
177LU-PSMA-617
177Lu-DOTA-Knot/CO-C 1
177Lu-DOTA-Knot/C1-C2
177Lu-DOTA-Knot/C2-C3
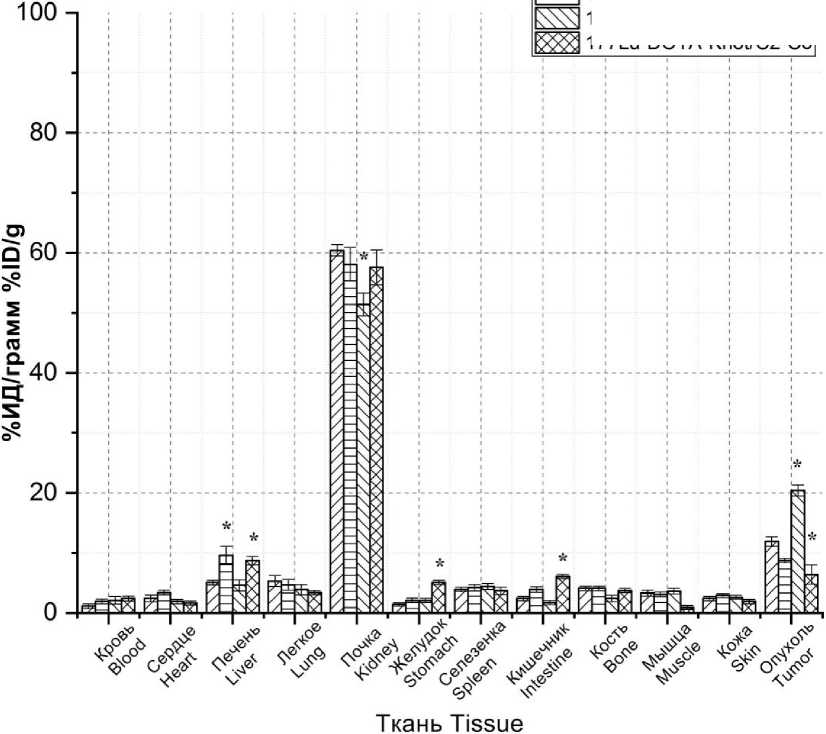
Рис. 5. Биораспределение 177Lu-PSMA-617, 177Lu-DOTA-Knot/C0-C1, 177Lu-DOTA-Knot/C1-C2 и 177Lu-DOTA-Knot/C2-C3 у мышей линии BALB/c с аденокарциномой молочной железы через 24 ч после инъекции (* – статистически значимые отличия (р<0,05) по сравнению с 177Lu-PSMA-617)
Fig. 5. Biodistribution of peptides (177Lu-PSMA-617, 177Lu-DOTA-Knot / C0-C1, 177Lu-DOTA-Knot/C1-C2 and 177Lu-DOTA-Knot/C2-C3) in breast adenocarcinoma-bearing BALB/c mice, 24-hour intubation (* p<0.05 – the difference is significant when compared with 177Lu-PSMA-617)
Заключение. Исследование показало, что синтезированные пептиды 177Lu-DOTA-Knot/C0-C1, 177Lu-DOTA-Knot/C1-C2 и 177Lu-DOTA-Knot/C2-C3, содержащие последовательность GTIQPYPFSWGY, вставленную в токсин U5-Sth1a, более стабильны в плазме крови и физиологическом растворе, а также проявляет большую степень связывания по сравнению с 177Lu-PSMA-617. Исследования биораспределения 177Lu-PSMA-617, 177Lu-DOTA-Knot/C0-C1, 177Lu-DOTA-Knot/C1-C2, 177Lu-DOTA-Knot/C2-C3 у мышей линии
BALB/c с аденокарциномой молочной железы показали, что пептид 177Lu-DOTA-Knot/C1-C2 имеет связывание с опухолью, аналогичное с 177Lu-PSMA-617.
Таким образом, модифицированные пептиды с пептидом, тропным к антигену PSMA, встроенные в структуру токсина U5-Sth1a, демонстрируют высокую стабильность как в физиологическом растворе, так и в плазме крови, а также хорошее связывание как с клеточными культурами, так и с опухолями в организме.
Исследование выполнено при поддержке Российского фонда фундаментальных исследований, проект № 18-44-732004 р_мк.
Список литературы Использование кноттина как носителя пептида, тропного ПСМА
- Sandhu S., Moore C.M., ChiongE., Beltran, H., Bristow R.G., WilliamsS.G. Prostate cancer. The Lancet. 2021; 398 (10305): 1075-1090.
- Litwin M.S., Tan H.-J. The Diagnosis and Treatment of Prostate Cancer. JAMA. 2017; 317 (24): 2532.
- Moris L. Benefits and Risks of Primary Treatments for High-risk Localized and Locally Advanced Prostate Cancer: An International Multidisciplinary Systematic Review. European Urology. 2020; 77 (5): 614-627.
- Lawrentschuk N., Trottier G., Kuk C., Zlotta A.R. Role of surgery in high-risk localized prostate cancer. Curr. Oncol. 2010; 17 (Suppl. 2): S25-S32.
- Picard J.C., Golshayan A.R., Marshall D.T., Opfermann K.J., Keane T.E. The multi-disciplinary management of high-risk prostate cancer. Urol. Oncol. 2012; 30 (1): 3-15.
- MahmoudM., Honood A.R., Mothafr Y., KhaleelH., Yazan E. Primary metastatic prostate cancer between prognosis or adequate/proper medical therapy. World J. Surg. Oncol. 2021; 19 (1): 5.
- Koupparis A., Gleave M.E. Multimodal approaches to high-risk prostate cancer. Curr. Oncol. 2010; 17 (Suppl. 2): S33-S37.
- Bill-Axelson A. Radical Prostatectomy or Watchful Waiting in Prostate Cancer - 29-Year Follow-up. N. Engl. J. Med. 2018; 379 (24): 2319-2329.
- Law A.B., McLaren D.B. Non-surgical treatment for early prostate cancer. J.R. Coll. Physicians Edinb. 2010; 40 (4): 340-342.
- Wüstemann T., Haberkorn U., Babich J., Mier W. Targeting prostate cancer: Prostate-specific membrane antigen based diagnosis and therapy. Medicinal Research Reviews. 2019; 39 (1): 40-69.
- Baudino T.A. Targeted Cancer Therapy: The Next Generation of Cancer Treatment. Curr. Drug Discov. Technol. 2015; 12 (1): 3-20.
- KawakamiM., Nakayama J. Enhanced expression of prostate-specific membrane antigen gene in prostate cancer as revealed by in situ hybridization. Cancer Res. 1997; 57 (12): 2321-2324.
- Dmitrieva M.D., Voitova A.A., Dymova M.A., Richter V.A., Kuligina E.V. Tumor-Targeting Peptides Search Strategy for the Delivery of Therapeutic and Diagnostic Molecules to Tumor Cells. International journal of molecular sciences. 2020; 22 (1): 314.
- Moore S.J., Leung C.L., Norton H.K., Cochran J.R. Engineering agatoxin, a cystine-knot peptide from spider venom, as a molecular probe for in vivo tumor imaging. PloS One. 2013; 8 (4): e60498.
- Kolmar H. Natural and Engineered Cystine Knot Miniproteins for Diagnostic and Therapeutic Applications. Current Pharmaceutical Design. 2011; 17 (38): 4329-4336.
- Ackerman S.E., Currier N.V., Bergen J.M., Cochran J.R. Cystine-knot peptides: emerging tools for cancer imaging and therapy. Expert Review of Proteomics. 2014; 11 (5): 561-572.
- Kun C, Wei J. Патент US № US20170240596A1; 2019.
- Liu F., Zhu H., Yu J, Han X, Xie Q, Liu T., Xia C., Li N., Yang Z. 68Ga/177Lu-labeled DOTA-TATE shows similar imaging and biodistribution in neuroendocrine tumor model. Tumor Biology. 2017; 39 (6).
- Pujatti P.B. Development of a novel bombesin analog radiolabeled with Lutetium-177: in vivo evaluation of the biological properties in Balb-C mice. Cellular and molecular biology. 2010; 56 (2): 18-24.
- Cui C., Hanyu M., Hatori A., Zhang Y., Xie L., Ohya T., Fukada M., Suzuki H., Nagatsu K., Jiang C., Luo R., Shao G., Zhang M., Wang F. Synthesis and evaluation of [64Cu] PSMA-617 targeted for prostate-specific membrane antigen in prostate cancer. Am. J. Nucl. Med. Mol. Imaging. 2017; 7 (2): 40-52.
- Sharifi M., Jalilian A., Yousefnia H., Alirezapour B., Bahrami-Samani A., Zolghadri S. Production, quality control, biodistribution and imaging studies of 177Lu-PSMA-617 in breast adenocarcinoma model. Radiochimica Acta. 2018; 106 (6): 507-513.


